このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
慢性ニコチン投与によるマウスノックインで蛍光標識ニコチン性受容体のスペクトル共焦点イメージング
要約
私たちはより良いアプローチノックインおよびスペクトルを用いた受容体の蛍光タンパク質タグを含むアプローチの組み合わせを使用して、ニコチン中毒のメカニズムを理解するCNSニューロンの特定のサブタイプの細胞内領域内のニコチン性アセチルコリン受容体の変化を定量化する新しい技術を開発しました共焦点イメージング。
要約
中枢神経系(CNS)のリガンド依存性イオンチャネルは、深刻な医学的および社会的影響を持つ多数の条件に関与している。例えば、喫煙を介してニコチンへの中毒は、早死に世界的に(世界保健機構)の主要な原因である可能性が高いと脳1のイオンチャネルの分布の変化によって引き起こされます。 1月3日脳組織内のニコチン性アセチルコリン受容体(nAChRs)数の増加の両方のげっ歯類およびヒトの結果の慢性ニコチン曝露。同様に、グルタミン酸作動性GluN1またはGluA1チャネルの変化は、そのようなコカイン、アンフェタミンとアヘン4月6日のような他の依存性薬物に感作を誘発に関与している。
したがって、特定のイオンチャネルの分布と発現パターンをマッピングし、定量化する能力は、中毒のメカニズムを理解する上で非常に重要です。脳領域特異的EFの研究個々の薬剤のfectsこのような放射性リガンドとしての技術の出現によって進められた。しかし、放射性リガンド結合の低空間分解能は、ニューロンの特定のサブタイプのリガンド依存性イオンチャネルを定量化する能力を防ぎます。
そのような緑色蛍光タンパク質(GFP)とその多くの色の変種とし て遺伝的にエンコードされた蛍光レポーターは、生物学の7分野に革命をもたらしました。遺伝的にタギングすることで蛍光レポーターは1つがin vivoで 7-10 のタンパク質を可視化することができます内因性蛋白質に。プローブを用いた蛍光タグタンパク質の一つの利点は、標的タンパク質に非特異性とアクセシビリティの問題を抱えている抗体の使用の排除です。我々は、トランスフェクションした培養細胞11にフェルスター共鳴エネルギー移動(FRET)を用いた受容体アセンブリーの研究を有効にして蛍光ラベルnAChRs、この戦略を使用しています。最近では、我々は石油公社を使用しているK-のスペクトル共焦点顕微鏡12を介して中枢神経系ニューロンのサブミクロンの解像度で受容体を ex vivoでの正確な定量を可能にする、α4のnAChRサブユニット(α4YFP)をタグ付け黄色蛍光タンパク質を持つエンジニアのマウスへのアプローチ。対象と蛍光ノックイン変異は野生型マウスのタグの付いていない受容体に比較した場合の発現と受容体の調節の正常なレベルを生産する、内因性遺伝子座にその天然のプロモーターの制御下に組み込まれています。このノックインアプローチは蛍光他のイオンチャネルをタグ付けしCNS内の受容体の可視化と定量化の強力なアプローチを提供していますように拡張することができます。
本稿では、慢性的なニコチンへの曝露後、特定のCNSニューロンでのnAChR発現の変化を定量化する方法を説明します。私たちの方法は、ミニ浸透圧ポンプ注入、心臓内灌流固定、蛍光標識ニコチンRECのイメージングと解析が含まれていからeptorサブユニットα4YFPノックインマウス(図1)。我々は、固定脳tissue.We詳細に正確にα4YFP蛍光シグナルを得るためにautofluoresent信号を減算する線形スペクトルアンミキシングアルゴリズムと組み合わせてスペクトル共焦点顕微鏡を使用して、私たちのイメージング手法を説明しますから、蛍光最小限に抑えるために固定技術を最適化しました。最後に、我々は、海馬の内側perforantパス内のα4YFP受容体の慢性的なニコチン誘発性の亢進の結果を示しています。
プロトコル
1。ポンプの注入
- ポンプの注入前に、Alzetミニ浸透圧ポンプ(Alzet、モデル2002、クパチーノ、米国)は気泡を導入しないように注意して記入して準備します。ミニ浸透圧ポンプのこのモデルは、14日間で0.5μL/ hrの速度でソリューションを提供します。無菌状態を確認します。空と充填ポンプの重量を量る。実験(10日移植後)の終了時に、ポンプ内の残りの液体を注射器と注射針を除去し、ポンプ容積を計算するために計量することができます。
- 制御ソリューションのポンプは(0.9%W / V、Teknova、S5819、ホリスター、アメリカ)生理食塩水が含まれています。 ( - ) - ニコチン酒石酸水素塩(シグマ社、カタログ番号N5260)生理食塩水で希釈する(0.9%w / v)と0.22μmのシリンジエンドフィルターを通して濾過することにより滅菌ニコチン溶液、1 Mのストック溶液を調製した。我々はこれまでに10日間の0.4および2 mg / kg体重/時(ニコチンの遊離塩基として計算)で、ニコチンを投与しています。
- 3生理食塩水浴場(3つの準備10cmの生理食塩水)は、ペトリ皿を埋め尽くした。ポンプは充填し、キャップをした後、外殻に、薬物の痕跡を削除するそれぞれの連続した生理食塩水お風呂で十分にポンプを洗う。浸しは別の生理食塩水コンテナ内のコントロールとニコチンポンプを維持し、手術まで、ストレージ用の生理食塩水でポンプを満たした。
- 健康回復を促進し、術後感染のリスクを軽減するために、長期的な回復のために準備きれいなケージを持っています。
- すぐに手術後の短期的な回復のために、加熱パッドと熱ランプを含むケージを準備します。
- 慢性的なニコチンの効果を調べるために、我々は5から6ホモ接合α4YFPノックインマウス(2-3ヶ月齢)各グループ内の(コントロールまたはニコチン)を持っています。 α4YFPノックインマウスラインがC57BL/6Jマウス系統10世代に戻し交配されています。我々は、すべてのマウスの年齢や性別は、研究のために同じであり、すべての手術は、ばらつきを最小限に抑えるために同じ日に行われていることを確認してください。 HYを防ぐために手術中と後のマウスにpothermiaは、滅菌外科用ドレープで覆われ、加熱パッドで手術台を装備。
- 3 L / minの酸素および3%イソフルランでα4YFPノックインマウスを誘導し、2.5 L / minの酸素で麻酔し、1%イソフルランを維持しています。イソフルラン手術の完了時に迅速にシステムをクリアするため我々は、イソフルラン麻酔を好むとマウスは〜2分以内に意識して、携帯があります。角膜損傷を避けるために(涙 - ゲル、ノバルティス)すぐに点眼を適用します。
- ポンプは、首の後ろの皮膚を切開して皮下に注入されるとポンプが背面の背側面の下尾プッシュされます。マットに95%エタノール毛皮の前肢の間に戻って上の領域を拭きます。 0.8ミリメートルグレーフェ鉗子(ファイン科学ツール、11050から10)で皮膚をつまむと虹彩鋏(ファイン科学ツール、14060から10)を使用して、1センチメートル中央横カットを行います。
- 標準パターンのシザーを挿入し、ポンプの皮下スペースを作成するには切開にS(ファイン科学ツール、14101から14)と、動物の尾の端に向かって慎重に押し込みます。
- 1.0ミリメートルグレーフェ鉗子(ファイン科学ツール、11650から10)を使用して、生理食塩水からポンプを取り外します。切開のオープンを使用して鉗子を保持し、動物の尾の端に直面して浸透圧ポンプキャップを切開中にポンプを挿入し、尾方端にポンプを押してください。
- ピンチは0.8mm鉗子を使用してシャットダウン巻きとVetbond十分な量の(3M、猫#1469SB)接着剤を適用します。傷が封印されるまで押し続けます。
- イソフルランマスクから動物を削除するには、意識やモバイルまで、短期的な回復ケージに鎮痛薬、メロキシカム(0.1 mg / kgを皮下)、および場所に注入します。その後、食料と水利用可能な広告を自由に長期的な回復ケージ内に置きます。
2。 α4YFPは、ノックインマウスの心臓内灌流により固定
- 手続きの前にソリューション一日を作り、すべてのマウスのばらつきを最小限に抑えるために4℃のままに同じ日に、ソリューションの同じバッチで灌流されます。
- 換気の良い場所で灌流固定した実行します。のddH 2 Oで、peristaticポンプ(Masterflexポンプコントローラ、60648 Masterflexイージーロード、7518から00)のフラッシュライン
- 20ミリリットルのPBSのpH 7.6(Invitrogen社製、カタログ番号70011)にヘパリンの〜0.0015グラム(シグマ社、カタログ番号H4784)、抗凝固剤を追加します。
- 麻酔α4YFP後肢筋に筋肉内ケタミンの混合物(25 mg / kgで、ワイス·アニマルヘルス)とmedatomidine塩酸塩(0.25 mg / kgで、ファイザー社)を注入することにより、ノックインマウスとすぐにそのホームケージに戻って動物を配置します。
- 金属製のトレイに挿入された発泡スチロールの蓋に動物を固定する。 95%エタノールで胸部を拭いてください。アドソン鉗子(ファイン科学ツール、91106から12)と略とピンチ皮膚はアイリスはさみで胸腔を開きます。超微細止血剤(ファイン科学ツール、13021から12)を使用して、胸郭を固定し、心臓を公開します。
- 4ミリリットル/分でPBSを揚水開始およびi動物の左心室に23G翼状針(Becton Dickinson社、367253)をnsert。すぐに血を許可し、脱出する潅流液に右心房を切り取る。
- PBS(pH7.6)で20mlを灌流、4%パラホルムアルデヒド(16%PFA在庫からPBSで希釈してpHを7.6、、電子顕微鏡学、猫#15710)の後、30 mlの5%スクロースのその後20ミリリットル液(pH7.6) 。我々は上の固定は、蛍光増加することがわかった。 5%スクロースの灌流は自家蛍光が低下、脳から残留PFAをすすぐ。
- 3日間、30%ショ糖の脳とストアを削除します。
- 冠状切片のための脳を凍結するには、OCTの取り付け化合物(ティッシュテック、猫#4583)で(VWR、猫#18986から1)プラスチック製の埋め込み型で吻側サイドアップと水没をかみそりの刃と場所を脳と小脳を切断。スライスする前に、-20℃ドライアイスの店でフリーズします。
- クライオスタットにして、セクションの脳(厚さ30μm)をコートしたスライドに転送されます。 ·-20℃の脳切片を保存する度、一方、無水硫酸カルシウム石を含むスライドボックスにC。 -20℃で保存したときのスライドボックスには、水分とその後のフリーザー火傷を避けるために、ジップロック密封袋に入れなければなりません
3。スペクトル共焦点顕微鏡を用いたイメージング蛍光nAChRs
- スライドが退色最小限に抑えるために、任意の光源への最小限の露出があることを確認してください。
- 蛍光タンパク質の蛍光を阻害しない取り付け培地で脳切片スライドをカバースリップ。我々は、数時間後に硬化Mowiol 4から88(トリス-HClとグリセロールのpH 8.5、EMD-Calbiochem社、カタログ番号475904)との良好な成功を持っています。 Mowiolは空気の泡を避けるために、スリップカバーを前に室温に均衡を確認してください。それはYFPの蛍光を消光するのでスリップカバーするとき、マニキュアを使用しないでください。
- 画像は、ニコンC1siスペクトル共焦点顕微鏡システムを用いて取得されます。スペクトル共焦点イメージングと線形アンミキシングの方法についての詳細は提供されている他のD 13-15スペクトル共焦点顕微鏡を使用する根拠は、固定脳組織が固有の蛍光を持っているということです。ニコンC1siのスペクトル共焦点イメージングは、単に色の虹に白色光を屈折させるプリズムのような格子の分散素子を介してその異なる波長に空間的に屈折し、そのサンプルの蛍光放出される光の波長の範囲を指定した32光電子増倍管検出器のアレイを使用しています16。発光スペクトルは、画像のラムダスタックの各ピクセルのために収集されるように、異なる波長の光で収集された画像 - どのように集められる画像のラムダスタックです。 YFPと組織の自家蛍光は、それぞれの特性スペクトルシグネチャを持っているので、ラムダスタックは独立したYFPと自家蛍光信号(図2)に線形アンミキシング代数的アルゴリズムを用いてデコンボリューションすることができます。したがって、YFP蛍光の非常に正確な定量は、auの有意なレベルでも組織で決定することができますtofluorescence。
- 各種設定は、画像の品質と蛍光収集効率を最適化するように調整することができます。我々は一般的に使用する設定を報告しますが、これらの設定は、サンプルと共焦点顕微鏡に応じて調整することができます。正確にα4YFPサブユニット発現の変化を定量化するために慢性的なニコチンと我々はすべての画素の信号のグレースケールレベルの強度(12ビットグレースケールの<4095)の飽和値以下であることを確認してください。さらに、ピクセルが飽和値の3分の1(〜1300年から1400年)以下のまわりにあるように、焦点の設定を調整することによって受容体のアップレギュレーションに起因する信号の潜在的な増加に対応します。設定が最適化されていたら、設定はすべてイメージングセッションおよびサンプルの同一に維持されます。
- 40 mWのアルゴンレーザーの15%、最大伝送時の488 nmのレーザーライン:我々は、60X油CFIプランアポVC目標(1.40 NA、0.13ミリメートル作動距離)を用いた撮像α4YFPは、以下の設定を使用、220スペクトル検出器のゲインは、5 nmの分解能で496.5 nmから656.5 nmからイメージングスペクトル範囲は50μm×50μmの領域の上に512×512ピクセル、メディアピンホールの大きさ(60μmの直径)、4.08ピクセルは、滞留時間2スキャンとグレースケールの12ビット以上の平均。
4。スペクトル共焦点画像と画像解析の線形アンミキシング
- スペクトル共焦点顕微鏡で撮影したサンプル画像の線形スペクトルアンミキシングを実行するには、最初にYFPおよび組織の自家蛍光の基準スペクトルを参照スペクトルを取得する必要があります。
- 任意の基準スペクトルの重要な前提条件は、あなたのサンプルのイメージングに使用するのと同じレーザーラインで撮像ノイズ蛍光スペクトルに高信号を取得することです。アルゴンの514 nmレーザーラインは、優れたYFPの発光ピークから分離し、488 nmのラインは以下のlであるがあるため、我々は488 nmのレーザーラインでのイメージYFPを好むYFPを励起するため、より高い励起効率を持っていますがikelyピークを歪ませると1つのピークに上昇を含む全体のYFPの発光スペクトルを得ることができます。我々は、画像、可溶性YFP強いYFP信号が得られるようにセルラインにトランスフェクトし、得られたYFPのスペクトルは、参照スペクトルの我々のライブラリに格納されています。それはまた、バックグラウンドスペクトルに高信号を提供するため、細胞株で発現上のトランスフェα4YFPを使用することもできます。
- 我々はα4YFPマウスからイメージするつもりとそれに対応するスペクトルを得ることが様々な脳領域からの野生型マウスの脳切片から蛍光我々のイメージ蛍光の参照スペクトルを取得します。我々は、レーザー強度を検出器のゲインを変更したり、ノイズに信号を最大化するために平均的なイメージングを行うことができるが、私たちは、同じレーザーライン、488 nmであり、ほぼ同一のパラメータを使用してイメージを使用します。
- α4YFPマウスの脳領域からスペクトル共焦点画像を取得した後、画像は、そのYFPとautofluorにデコンボリューションされたYFPの参照スペクトルと同じ脳の領域から、野生型マウスの自家蛍光の参照スペクトルを用いた線形スペクトルアンミキシングアルゴリズムを適用することにより、escence信号。
- 非混合α4YFPイメージは、そのようなImageJの(ような画像解析ソフトウェアで開くことができますhttp://rsbweb.nih.gov/ij/ )、そして平均ピクセル強度関心領域ごとに計算されます。 ImageJのためのプラグインは"loci_tools.jar"(と呼ばれるhttp://www.loci.wisc.edu/bio-formats/imagej )ニコンICS / IDS焦点ファイルをインポートするために使用することができます。
- 我々は背景の残留値を取得するために、同じ脳の領域でマウスを野生型に同じ線形スペクトルアンミキシングと分析を繰り返します。
- その後1から背景残存価額(4.6)を差し引くことにより補正した平均α4YFP強度を取得する補正α4YFP値(4.5)を意味します。
5。代表的な結果
我々は、スペクトル共焦点顕微鏡で撮影したホモ接合α4YFPマウス(図3A)から内側手綱の画像のラムダスタックの代表的な真の色の投影を示しています。また、同じラムダスタック画像(図3B)からα4YFP陽性ニューロンを含む関心領域からの発光スペクトルを示しています。異なる発光ピークはYFPの蛍光発光ピークです〜527 nmで明らかである。内側手綱を近隣の地域はα4YFPのnAChRサブユニットの有無を示す、527 nmのスペクトルピークを欠いた発光スペクトルを示しています。大幅な排出量の重なり(図4)、YFPの分離と自家蛍光信号とYFPの参照スペクトルとマウスの脳autofluoresenceを用いた線形スペクトルアンミキシングに続いて、降伏α4YFP最新リリース情報を受信画像、自家蛍光画像最新リリース情報を受信し、残りのチャンネルが可能です。 α4YFPインフルエンザの明確な局在クマリンは、内側手綱(図4)の密集した相馬に識別することができます。
海馬α4YFP主に内側perforantパス、tempero-アンモニアのパスとalveus 12にローカライズされています。これらは、海馬のグルタミン酸作動性神経支配のすべてです。我々は、海馬perforantパス(図5)α4YFP式に慢性的なニコチンの影響を調べた。ニコチンの慢性投与(10日2 mg / kg体重/ HR)は、慢性ニコチン投与したマウス(P = 0.001、Wilcoxonの順位和検定)への制御生理食塩水処置したマウスからのα4YFP蛍光が大幅に増加(69±14%)の結果(図5)。
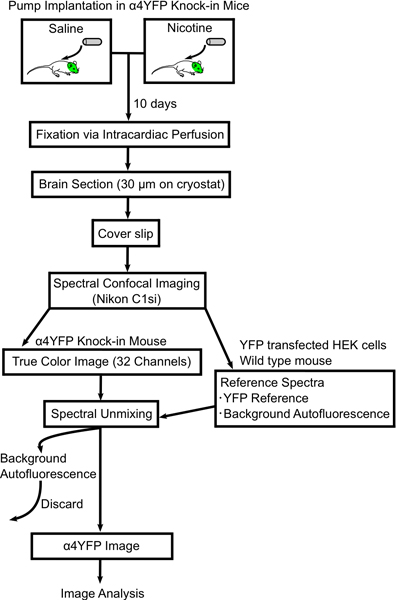
慢性ニコチンα4YFPのnAChRサブユニット内のイメージの変化に手順を示す1。フローチャート図 。ミニ浸透圧ポンプは、生理食塩水またはニコチンのどちらかで満たされたと&ALPの皮下に注入されるヘクタール。4YFPホモ接合体マウス。 10日マウスを4%パラホルムアルデヒドとマウスの脳を灌流して固定された後、スライド上(厚さ30μm)区画されている。脳切片は、スペクトル共焦点顕微鏡(ニコンC1si)上に結像とスペクトルYFPおよび自家蛍光画像に純粋されています。その後α4YFP画像がImageJのソフトウェアを使用してさらに分析されています。
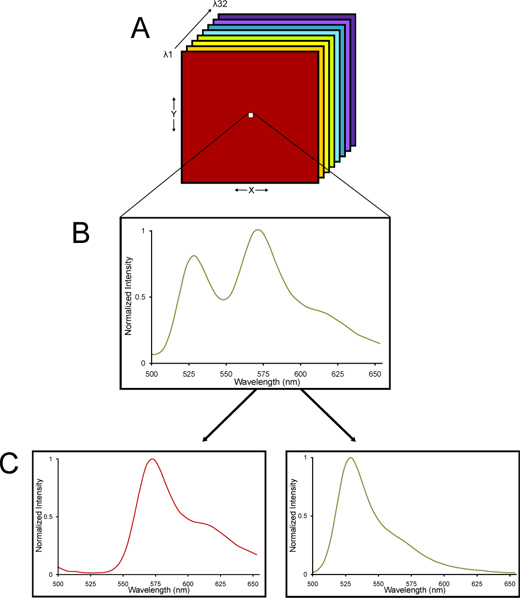
図2スペクトル共焦点顕微鏡からイメージと直線的にそのスペクトル成分に純粋なラムダスタックの概略図。 (A)画像のラムダスタックが収集されます。 (B)ラムダ·スタックは、発光スペクトルは、スタック全体の各ピクセルのために収集されるように、異なる波長の光で集めた画像で構成されています。 YFPと組織の自家蛍光は、それぞれの特性スペクトルシグネチャを持っているので(C)、ラムダ·スタックは、sに線形アンミキシング代数的アルゴリズムを用いてデコンボリューションすることができますeparate YFPと自家蛍光の信号。したがって、YFP蛍光の非常に正確な定量はあっても蛍光のレベルが高い組織で決定することができます。

図3。α4YFPのnAChRsを表現する脳の領域のスペクトル共焦点画像。ニコンC1siスペクトル共焦点顕微鏡で撮影したα4YFPマウスから内側手綱の画像のラムダスタックの(A)トゥルーカラー投影。 (B)α4YFP含むニューロン(緑)、内側手綱(赤)の外に興味のある領域を含む関心領域からのスペクトルのプロット。
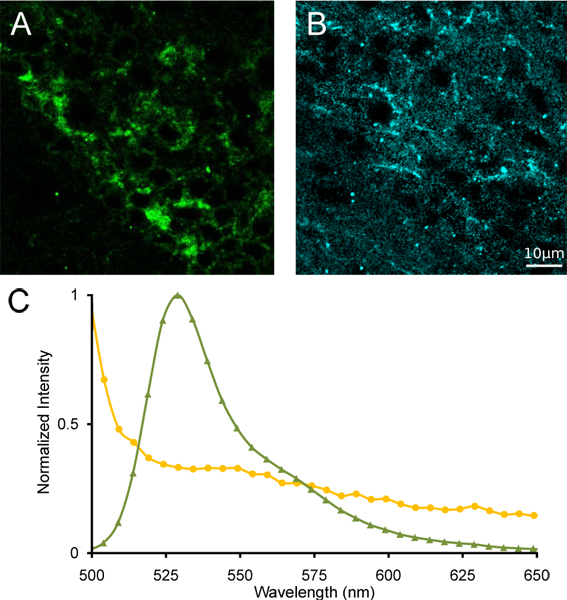
図4。内側手綱の線形スペクトルアンミキシング。最新リリース情報を受信α4YFPの(A)画像、(B)の蛍光スペクトルは、次の線形アンミキシング。 YFP(緑色のトリ(C)リファレンススペクトルスペクトルアンミキシングに使用される角度)と蛍光(黄丸)。

図5の海馬におけるα4nAChRsの亢進α4YFPノックの慢性的なニコチンに曝露したマウス。 (A)海馬からα4YFP蛍光のタイル張りのモンタージュ。 2の破線の選択領域は、分析は各マウスに対して行われた海馬のperforantパスの下肢のおおよその場所です。 (B)α4YFP蛍光は、慢性的な生理食塩水(*、P = 0.001、Wilcoxonの順位和検定)より慢性的なニコチンに曝露したマウスのperforantパスに有意に高かった。結果は平均値±生理食塩水および慢性の両方のニコチン投与したマウスのnからSEM = 20測定(各治療群の5匹)を表します。

図6 Dファイン抗体の標識に比べてα4YFPのepth式。 α4YFP蛍光()とセカンダリラベル(B)としてCy5でVGlut2抗体のXZ直交ビュー。 (C)α4YFP(白丸)と比較して抗体染色(黒四角)の深さ以上の大きな蛍光信号強度の低下を示すプロット。
ディスカッション
量と特定のイオンチャネルの局在を決定するためのノックインマウスモデルにおける蛍光体の使用は多くの利点を提供しています。そのような普遍的にすべての細胞に発現しているアクチン、などのタンパク質とは対照的に、イオンチャネルは、はるかに少ない数で存在し、それらの発現は困難で、従来の免疫組織化学的手法を介して正確な分析を行うニューロンのサブタイプ間で異なり?...
開示事項
我々は、開示することは何もありません。
謝辞
アンソニーRendaは、ビクトリア研究フェローシップ賞の大学によってサポートされていました。 MyreとWinifredのシム·ファンド、イノベーション助成金、ブリティッシュコロンビア州の知識開発基金のためのカナダの財団 - この研究は自然科学とカナダのディスカバリーグラント工学研究評議会、NARSAD若手研究者賞(RNまで)、ビクトリア財団によってサポートされていました自然科学とカナダのリサーチ·ツールと計測グラント工学研究評議会。我々は優れたマウスの飼育のためにジリアン·マッケイ、クリスティーナ·バーンズ、アリエル·サリバン、ジェニファーマクドナルド、ダニエルMorgadoに感謝します。
資料
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ミニ浸透圧ポンプ | Alzet | モデル2002 | |
| 生理食塩水 | Teknova | S5819 | |
| ( - ) - ニコチン酒石酸水素塩 | シグマ | N5260 | |
| 目薬 | ノバルティス | 涙ジェル | |
| Vetbondグルー | 3M | 1469SB | |
| ヘパリンナトリウム塩 | シグマ | H4784 | |
| 10倍PBS | インビトロジェン | 70011 | |
| ケタミン | WyetHアニマルヘルス | 0856-4403-01 | |
| medatomidine塩酸塩 | ファイザー | 1950673 | |
| 23G翼状針 | ベクトン·ディッキンソン | 367253 | |
| パラホルムアルデヒド | 電子顕微鏡学 | 15710 | |
| プラスチック製の埋め込み型 | VWR | 18986から1 | |
| 10月取付物 | 組織 - Tek社 | 4583 | |
| Mowiol 4から88 | EMD-カルビオケム | 475904 | pH 8.5の |
参考文献
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved