Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imagen confocal espectral de marcado con fluorescencia receptores nicotínicos en Knock-en ratones con administración crónica de nicotina
En este artículo
Resumen
Hemos desarrollado una nueva técnica para cuantificar los cambios de los receptores nicotínicos de acetilcolina en las regiones subcelulares de los subtipos específicos de neuronas del sistema nervioso central para comprender mejor los mecanismos de la adicción a la nicotina mediante el uso de una combinación de enfoques que incluyen el etiquetado proteína fluorescente del receptor con el golpe-en el enfoque y espectral imagen confocal.
Resumen
Ligando los canales iónicos en el sistema nervioso central (SNC) están implicados en numerosas enfermedades con graves consecuencias médicas y sociales. Por ejemplo, la adicción a la nicotina a través de consumo de tabaco es la principal causa de muerte prematura en todo el mundo (Organización Mundial de la Salud) y es probablemente causado por una alteración de la distribución de canales de iones en el cerebro 1. La exposición crónica de nicotina en roedores y en los resultados de los seres humanos en un mayor número de receptores nicotínicos de acetilcolina (nAChR) en el tejido cerebral 1-3. Del mismo modo, las alteraciones en los glutamatérgicos GluN1 o GluA1 canales han sido implicados en el desencadenamiento de la sensibilización a otras drogas adictivas como la cocaína, las anfetaminas y los opiáceos 4-6.
En consecuencia, la capacidad de asignar y cuantificar los patrones de distribución y expresión de canales iónicos específicos es de vital importancia para la comprensión de los mecanismos de la adicción. El estudio de la región del cerebro específica de EFpermiten descomponer los medicamentos individuales fue promovido por el advenimiento de técnicas tales como ligandos radiactivos. Sin embargo, la baja resolución espacial de la unión del ligando radiactivo impide la capacidad de cuantificar ligando los canales iónicos en los subtipos específicos de neuronas.
Codificados genéticamente reporteros fluorescentes, como la proteína verde fluorescente (GFP) y sus variantes de color muchas, han revolucionado el campo de la biología 7. Mediante el etiquetado de un reportero genéticamente fluorescente a una proteína endógena se puede visualizar las proteínas in vivo 10.7. Una de las ventajas de las proteínas de marcado con fluorescencia con una sonda es la eliminación del uso de anticuerpos, que tienen problemas de falta de especificidad y la accesibilidad a la proteína diana. Hemos utilizado esta estrategia para nAChRs etiqueta fluorescente, lo que permitió el estudio de conjunto de los receptores con transferencia de energía Förster resonancia (FRET) transfectadas en células cultivadas 11. Más recientemente, se ha utilizado el Knock-en el enfoque de los ratones de ingeniería con proteína amarilla fluorescente etiquetado a4 subunidades de nAChR (α4YFP), lo que permite la cuantificación precisa de la ex vivo del receptor a una resolución de submicrométrico en las neuronas del SNC a través de la microscopía confocal espectral 12. El selectivo fluorescente en cadena en la mutación se incorpora en el locus endógeno y bajo el control de su promotor nativo, produciendo niveles normales de expresión y regulación del receptor cuando se compara a los receptores no marcados en ratones normales. Este enfoque knock-in puede ser extendido para marcar con fluorescencia de otros canales de iones y ofrece un enfoque de gran alcance de la visualización y cuantificación de los receptores en el SNC.
En este trabajo se describe una metodología para cuantificar los cambios en la expresión de nAChR en las neuronas del SNC específicos después de la exposición crónica a la nicotina. Nuestros métodos incluyen mini-osmótica implantación de la bomba, la fijación de perfusión intracardíaca, las imágenes y el análisis de fluorescencia rec etiquetado nicotínicosubunidades eptor de α4YFP en cadena en ratones (fig. 1). Hemos optimizado la técnica de fijación para minimizar autofluorescencia de tissue.We cerebro fijo describir en detalle nuestra metodología de imágenes utilizando un microscopio confocal espectral en conjunción con un algoritmo de desmezcla espectral lineal para restar la señal autofluoresent con el fin de obtener con precisión la señal de fluorescencia α4YFP. Finalmente, se muestran los resultados de la crónica inducida por la nicotina regulación al alza de los receptores de α4YFP en la vía perforante medial del hipocampo.
Protocolo
1. Bomba de la implantación
- Antes de la implantación de la bomba, rellenar y preparar a los Alzet bombas mini-osmóticas (Alzet, modelo 2002, de Cupertino, EE.UU.), teniendo cuidado de no introducir burbujas de aire. Este modelo de mini-osmótica bomba suministra solución a una velocidad de 0,5 l / h durante 14 días. Asegúrese de que las condiciones de esterilidad. Pesar las bombas vacías y llenas. A la conclusión del experimento (10 días después de la implantación), el líquido residual en la bomba se puede quitar con una jeringa y la aguja y se pesa para calcular el volumen bombeado.
- Las bombas con solución de control contienen solución salina (0,9% w / v, Teknova, S5819, Hollister, EE.UU.). Para preparar la solución de nicotina, una solución 1 M de stock de (-)-nicotina sal tartrato de hidrógeno (Sigma, Cat. # N5260) se diluye en solución salina (0,9% w / v) y se esteriliza por filtración a través de una jeringa 0,22 micras de filtro de extremo. Anteriormente hemos administrado nicotina a 0,4 y 2 mg / kg / h (calculado como base libre de nicotina) durante 10 días.
- Prepare tres baños de solución salina (tres10 cm llena de solución salina platos petri). Una vez que la bomba se ha llenado y tapado, la bomba de lavado a fondo en cada baño sucesiva de solución salina para eliminar cualquier rastro de la droga en la capa exterior. Sumergir llena bombas en solución salina para su almacenamiento hasta la cirugía, manteniendo el control y bombas de nicotina en recipientes separados de solución salina.
- Para alentar una recuperación saludable y reducir el riesgo de infección post-quirúrgica, tienen jaulas limpias preparadas para recuperación a largo plazo.
- Para corto plazo de recuperación inmediatamente después de la cirugía, preparar una jaula que contiene una almohadilla eléctrica y una lámpara de calor.
- Para examinar los efectos crónicos de nicotina que tienen 5 a 6 α4YFP homocigotos knock-en ratones (2-3 meses de edad) en cada grupo (control o la nicotina). El knock-in α4YFP línea de ratones se han backcrossed durante 10 generaciones a la cepa de ratón C57BL/6J. Hacemos que la edad y sexo de todos los ratones son los mismos para el estudio y que todas las cirugías se realizan en el mismo día para minimizar la variabilidad. Para evitar Hyhipotermia a los ratones durante y después de la cirugía, dotar a la mesa de operaciones con una almohadilla térmica cubierta de paño quirúrgico estéril.
- Inducir la α4YFP knock-in ratón con 3 l / min de oxígeno e isoflurano 3% y luego mantener la anestesia en el 2,5 L / min de oxígeno e isoflurano al 1%. Nosotros preferimos anestesia isoflurano porque el cierre de la cirugía isoflurano despeja el sistema rápidamente y los ratones son conscientes y móvil dentro de ~ 2 min. Aplique gotas para los ojos inmediatamente (Tear-Gel, de Novartis) para evitar daños en la córnea.
- Las bombas se implantaron subcutáneamente a través de una incisión en la piel en la parte posterior del cuello y la bomba es empujado hacia abajo caudalmente la cara dorsal de la espalda. Limpie el área en la parte posterior entre las patas delanteras con etanol al 95% de mate de la piel. Pellizque la piel con pinzas de 0,8 mm Graefe (Herramientas de Bellas ciencia, 11050-10) y hacer una central de 1 cm de corte lateral con unas tijeras iris (Herramientas de Bellas ciencia, 14060-10).
- Para crear un espacio subcutáneo para la bomba, insertar tijera patrón estándars (Herramientas de Bellas ciencia, 14101-14) en la incisión y empuje con cuidado hacia el extremo caudal del animal.
- Uso de 1,0 mm pinza de Graefe (Herramientas Bellas ciencia, 11650-10), retire la bomba de solución salina. Mantenga la incisión abierta fórceps e introducir la bomba en la incisión con la tapa de la bomba osmótica hacia el extremo caudal del animal y empuje de la bomba al extremo caudal.
- Una pizca de herida cerrada con fórceps 0.8mm y aplicar una cantidad adecuada de Vetbond (3M, cat # 1469SB) pegamento. Mantener hasta la herida se cierra herméticamente.
- Retire el animal de la máscara de isoflurano, inyectar con el analgésico, el meloxicam (0,1 mg / kg sc), y el lugar en una jaula de recuperación a corto plazo hasta que consciente y móvil. A continuación, coloque en una jaula de recuperación a largo plazo con alimento y agua disponibles ad.
2. α4YFP knock-en la fijación del ratón por perfusión intracardíaca
- Que las soluciones de un día antes del procedimiento y dejar a 4 ° C. Para minimizar la variabilidad todos los ratonesse perfundió en el mismo día y con el mismo lote de soluciones.
- Realizar las fijaciones de perfusión en un área bien ventilada. La tubería de descarga de la bomba peristáltica (Masterflex Carga Fácil, 7518-00; Masterflex Controlador de Bombas, 60648) con ddH 2 O.
- Añadir ~ 0.0015g de la heparina (Sigma, cat # H4784), un anticoagulante, a 20 ml de PBS pH 7.6 (Invitrogen, cat # 70011).
- Anestesie α4YFP knock-en el ratón mediante la inyección intramuscular de una mezcla de ketamina (25 mg / kg, de sanidad animal Wyeth) e hidrocloruro de medatomidine (0,25 mg / kg, de Pfizer) en el músculo de la pierna trasera e inmediatamente colocar el animal de nuevo en su jaula.
- Pin animal a una tapa de espuma de poliestireno se inserta en una bandeja de metal. Limpie el tórax con un 95% de etanol. Una pizca de la piel con pinzas de Adson (Herramientas de Bellas ciencia, 91106-12) y recortar abrir la cavidad torácica con una tijera de iris. Sujete la caja torácica con una pinza hemostática ultra fino (Herramientas de Bellas ciencia, 13.021-12) y exponer el corazón.
- Comienza bombeo PBS a 4 ml / min y insert una aguja tipo mariposa de 23G (Becton Dickinson, 367,253) en el ventrículo izquierdo del animal. Inmediatamente cortar la aurícula derecha para que la sangre y el líquido de perfusión para escapar.
- Perfundir 20 ml de PBS (pH 7,6), a continuación 30 ml de paraformaldehído al 4% (pH 7,6, se diluyó con PBS a partir de un 16% de stock de PFA, Microscopía Electrónica de Ciencias, Cat # 15710), a continuación 20 ml de sacarosa al 5% (pH 7,6) . Hemos encontrado que la fijación sobre los aumentos de autofluorescencia. La perfusión con 5% de sacarosa residual enjuaga PFA desde el cerebro, lo que disminuye la autofluorescencia.
- Retire el cerebro y la tienda en el 30% de sacarosa durante 3 días.
- Para congelar el cerebro para la sección coronal, cortar el cerebelo con una cuchilla de afeitar y el cerebro a cabo en un molde de plástico de empotrar (VWR, Cat # 18986-1) hacia rostral y sumergirse en Compuesto octubre de montaje (Tissue-Tek, cat # 4583) . Congelar en hielo seco y almacenar a -20 ° C antes de rebanar.
- Los cerebros de la Sección (30 m de espesor) en un criostato y luego se transfieren a portaobjetos recubiertos. Almacene las secciones del cerebro a -20 ygrados; C en cajas de diapositivas que contienen una piedra sulfato de calcio anhidro. El cuadro de la diapositiva debe estar en una bolsa zip lock sellada para evitar la humedad y la quemadura de congelador, posteriormente, cuando se almacenó a -20 ° C.
3. Proyección de imagen fluorescente nAChRs mediante microscopía confocal espectral
- Asegúrese de que las diapositivas tienen una exposición mínima a cualquier fuente de luz para minimizar photobleaching.
- Cubreobjetos las diapositivas sección cerebrales con un medio de montaje que no inhibe la fluorescencia de la proteína fluorescente. Tenemos mucho éxito con Mowiol 4-88 (pH 8,5 en Tris-HCl y glicerol, EMD-Calbiochem, cat # 475904), que se endurece después de unas horas. Hacer que el Mowiol equilibra a temperatura ambiente antes de la cubierta deslizamiento con el fin de evitar burbujas de aire. No use esmalte de uñas cuando la cubierta del deslizamiento, ya que apagar la fluorescencia YFP.
- Las imágenes se adquieren utilizando una Nikon C1si espectral sistema de microscopía confocal. Los detalles sobre el método de imagen confocal espectral y desmezcla lineal son proporcionard otras partes 13-15. La justificación del uso de un microscopio confocal espectral es que el tejido cerebral fija tiene autofluorescencia inherente. Imagen confocal espectral en el C1si Nikon utiliza una matriz de 32 detectores fotomultiplicadores del tubo que la muestra de un determinado rango de longitudes de onda de la luz fluorescente emitida, refractada espacialmente en sus diferentes longitudes de onda a través de un elemento dispersivo rejilla al igual que un prisma refracta la luz blanca en un arco iris de colores 16. Lo que se recoge es una pila de lambda de imágenes - imágenes recogidas en diferentes longitudes de onda de la luz para que un espectro de emisión se recoge para cada píxel de una pila de imágenes lambda. Desde YFP y autofluorescencia tejido cada uno tiene características firmas espectrales, la pila de lambda se puede deconvolved utilizando un algoritmo de desmezcla algebraica lineal en YFP separado y señales autofluorescentes (Fig. 2). Así, la cuantificación muy precisa de YFP fluorescencia se puede determinar incluso en el tejido con niveles significativos de Autofluorescence.
- Varios ajustes se pueden ajustar para optimizar la calidad de imagen y la eficiencia de captura de fluorescencia. Les mantendremos informados de la configuración que utiliza habitualmente, pero esta configuración se puede ajustar dependiendo de la muestra y el microscopio confocal. Para cuantificar con exactitud los cambios en la expresión de la subunidad α4YFP con la crónica de nicotina nos aseguramos de que la intensidad de la escala de nivel de gris de las señales de todos los píxeles son inferiores al valor de saturación (<4095 para 12 bits en escala de grises). Por otra parte, nos acomodamos para un aumento potencial en la señal debido a la regulación positiva del receptor mediante el ajuste de la configuración confocal para que los píxeles son alrededor de un tercio del valor de saturación (~ 1300-1400) o menos. Una vez que los ajustes están optimizados, los ajustes se mantienen idénticos para todas las sesiones de formación de imágenes y muestras.
- Utilizamos los siguientes ajustes para imágenes α4YFP utilizando un aceite de 60X CFI Plan Apo VC objetivo (1,40 NA, 0,13 mm de distancia de trabajo): 488 nm láser de línea en un 15% de transmisión máxima de 40 mW láser de argón, Ganancia del detector espectral a 220, la gama espectral fotografiada desde 496,5 nm a 656,5 nm a 5 nm de resolución, 512 x 512 pixeles más de un 50 micras x 50 micras, área, un tamaño de orificio medio (60 diámetro micras), un píxel 4,08 tiempo de permanencia, promedio de más de dos exploraciones y 12 bits de escala de grises.
4. Desmezcla lineal de imágenes espectrales confocal y análisis de imágenes
- Para realizar desmezcla espectral lineal en una imagen de muestra tomada con un microscopio confocal espectral, una primera debe adquirir un espectro de referencia para YFP y un espectro de referencia para autofluorescencia tejido.
- Un requisito importante para cualquier espectro de referencia es el de obtener una señal alta al espectro de ruido de fluorescencia con imágenes de la línea de láser mismo utilizado para las imágenes de las muestras. Aunque la línea de láser 514 nm de argón tiene una eficiencia superior de excitación para excitar YFP preferimos YFP imagen con la línea de 488 nm láser porque hay una mejor separación del pico de emisión de YFP y la línea de 488 nm es menos likely a distorsionar el pico y se puede obtener el espectro de emisión YFP completo, incluyendo la subida al pico. Nos YFP imagen soluble transfectadas en una línea celular de modo que una señal YFP fuerte se obtiene y el espectro YFP resultante se almacena en la biblioteca de espectros de referencia. Α4YFP transfectadas sobreexpresado en líneas celulares también pueden ser utilizados, ya que también proporcionará una señal alta al espectro de fondo.
- Para obtener un espectro de referencia de la autofluorescencia autofluorescencia imagen que a partir de una sección de cerebro de ratón de tipo salvaje de las diversas regiones del cerebro que tenemos la intención de la imagen del ratón α4YFP y obtener su espectro correspondiente. Nuestro método de la línea láser mismo, 488 nm, y la imagen utilizando los parámetros casi idénticos, a pesar de que puede alterar la ganancia del detector, la intensidad del láser o de realizar las imágenes de medio para maximizar la relación señal a ruido.
- Después de obtener una imagen confocal espectral de una región del cerebro del ratón α4YFP, la imagen es deconvolved en su YFP y autofluorseñales de escencia de la aplicación de un algoritmo lineal desmezcla espectral, utilizando el espectro de referencia de YFP y el espectro de referencia de la autofluorescencia del ratón tipo salvaje de la misma región del cerebro.
- La imagen α4YFP sin mezclar a continuación, se puede abrir en un software de análisis de imagen, tales como ImageJ ( http://rsbweb.nih.gov/ij/ ) y luego la intensidad de los píxeles media se calcula para la región de interés. Un plug-in para ImageJ llamado "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) se puede utilizar para importar Nikon ics / identificadores de archivos confocal.
- Se repite el mismo desmezcla lineal espectral y análisis para wildtype ratones en la misma región del cerebro para obtener un valor de fondo residual.
- Luego se obtiene la media de intensidad de α4YFP corregido restando el valor de fondo residual (4,6) de la media corregida α4YFP valor (4,5).
5. Los resultados representativos
Se muestra una proyección de color representativo de una pila lambda de imágenes de la habénula media de un ratón homocigoto α4YFP (Fig. 3) tomadas con un microscopio confocal espectral. También muestran el espectro de emisión de una región de interés que contiene α4YFP neuronas positivas a partir de la imagen misma pila lambda (Fig. 3B). Un pico de emisión distinto es evidente a ~ 527 nm, que es el pico de emisión de fluorescencia de YFP. La región vecina a la habénula medial muestra un espectro de emisión carece de un pico espectral a 527 nm, lo que indica la ausencia de subunidades de nAChR α4YFP. Después de desmezcla lineal espectral, utilizando espectros de referencia de YFP y autofluoresence cerebro de ratón con una coincidencia significativa de las emisiones (Fig. 4), la separación de YFP y la señal de autofluorescente es posible ceder una imagen α4YFP sin mezclar, una imagen pura y un canal de autofluorescente resto. La localización clara de la gripe α4YFPorescence pueden ser identificados en el soma apretada de la medial habénula (fig. 4).
En el α4YFP hipocampo se localiza principalmente en la vía perforante medial, la ruta de acceso temporal-amónico y el alveus 12. Estos son todos inervación glutamatérgica del hipocampo. Se examinaron los efectos de la nicotina sobre la expresión crónica α4YFP en la vía perforante del hipocampo (fig. 5). La administración crónica de nicotina (2 mg / kg / h durante 10 días) resultó en un aumento significativo (69 ± 14%) en α4YFP fluorescencia de control de los ratones tratados con solución salina a la crónica en ratones tratados con nicotina (p = 0,001, test de Wilcoxon) ( fig. 5).
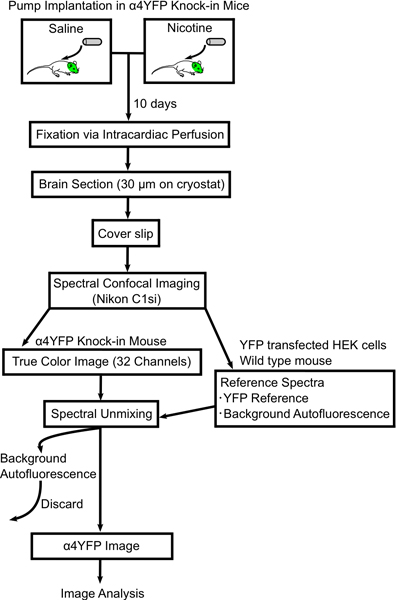
Figura 1. Diagrama de flujo que muestra el procedimiento a los cambios de imagen en las subunidades de nAChR α4YFP con crónica de nicotina. Mini-osmóticas bombas están llenas de solución salina o la nicotina y se implantaron subcutáneamente en y ALPha; 4YFP ratones homocigotos. Después de 10 días los ratones son perfundidos y fijados con paraformaldehído al 4% y los cerebros de los ratones se seccionan (30 m de espesor) en las diapositivas. La sección del cerebro se forma la imagen en un microscopio confocal espectral (Nikon C1si) y espectralmente puro en imágenes YFP y autofluorescente. Entonces las imágenes α4YFP se analizaron posteriormente con el software ImageJ.
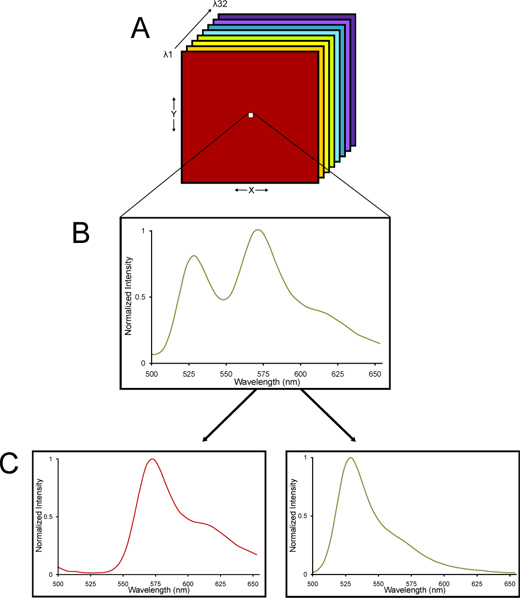
Figura 2. Un diagrama esquemático de una pila de lambda fotografiada desde un microscopio confocal espectral y linealmente sin mezcla en sus componentes espectrales. (A) Una pila de lambda de imágenes se recoge. (B) Una pila de lambda se compone de imágenes recogidas en diferentes longitudes de onda de la luz para que un espectro de emisión se recoge para cada píxel de todo el grupo. (C) Desde YFP y la autofluorescencia del tejido cada uno tiene características firmas espectrales, la pila de lambda se puede deconvolved utilizando un algoritmo lineal algebraica desmezcla en sYFP eparate y las señales de autofluorescentes. Así, la cuantificación muy precisa de YFP fluorescencia se puede determinar incluso en el tejido con altos niveles de autofluorescencia.

Figura 3. La imagen confocal espectral de una región del cerebro que expresan nAChRs α4YFP. (A) Una proyección en color real de una pila de lambda de imágenes de la habénula medial de un ratón α4YFP tomada con un microscopio Nikon C1si confocal espectral. (B) Las representaciones de los espectros de una región de interés, que incluye α4YFP las neuronas que contienen (verde), y una región de interés fuera de la habénula medial (rojo).
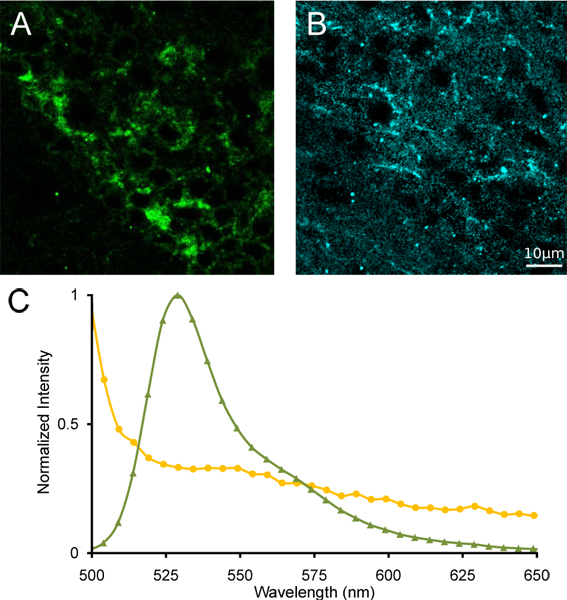
Figura 4. Desmezcla lineal espectral de la habénula medial. (A) Imágenes de α4YFP pura y (B) después de autofluorescencia unmixing espectral lineal. (C) Referencia espectros de YFP (verde triángulos) y autofluorescencia (círculos amarillos) que se utiliza para la desmezcla espectral.

Figura 5. Aumento del a4 nAChR en el hipocampo de α4YFP knock-en ratones expuestos a la nicotina crónica. (A) Un montaje de azulejos α4YFP fluorescencia del hipocampo. Los dos trazos áreas de selección son los lugares aproximados en la extremidad inferior de la vía perforante del hipocampo donde los análisis se realizaron para cada ratón. (B) α4YFP fluorescencia fue significativamente mayor en la vía perforante de los ratones expuestos a la nicotina que la solución salina crónica crónica (*, p = 0,001, test de Wilcoxon). Los resultados representan la media ± error estándar de n = 20 mediciones de nicotina para los ratones, tanto de solución salina y crónica tratados (5 ratones de cada grupo de tratamiento).

Figura 6. Mejor depth expresión de α4YFP en comparación con el etiquetado de anticuerpos. XZ ortogonales puntos de vista de α4YFP fluorescencia (A) y anticuerpo VGlut2 con Cy5 como una etiqueta secundaria (B). (C) Las representaciones que muestran una mayor degradación de fluorescencia intensidad de la señal sobre la profundidad de la tinción de anticuerpos (cuadrados negros) en comparación con α4YFP (círculos abiertos).
Discusión
El uso de un receptor fluorescente en un modelo de ratón knock-in para determinar la cantidad y localización de un canal iónico específico proporciona una serie de ventajas. En contraste a las proteínas como la actina, que se expresa de forma ubicua en todas las células, los canales iónicos están presentes en un número mucho menor y su expresión varía entre los subtipos neuronales que hacen un análisis preciso a través de tradicionales técnicas de inmunohistoquímica difíciles. El producto del gen α4Y...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Anthony Renda fue apoyada por la Universidad de Victoria Beca de Postgrado. Esta investigación fue apoyada por una de Ciencias Naturales e Ingeniería de Investigación de Canadá Descubrimiento Grant, un premio NARSAD joven investigador (a RN), la Fundación Victoria - Myre y Winifred Sim Fondo, una Fundación Canadiense para la Innovación de subvención, un conocimiento de Columbia Británica Fondo de Desarrollo y Ciencias Naturales e Ingeniería de Investigación de Canadá Herramientas para la Investigación y de la subvención de instrumentación. Damos las gracias a Jillian McKay, Christina Barnes, Ariel Suarez, Jennifer MacDonald y Daniel Morgado para la cría de ratón excelente.
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| bombas mini-osmóticas | Alzet | modelo 2002 | |
| salina | Teknova | S5819 | |
| (-)-Nicotina hidrógeno sal tartrato | Sigma | N5260 | |
| gotas para los ojos | Novartis | Tear-Gel | |
| Vetbond pegamento | 3M | 1469SB | |
| sal de sodio de heparina | Sigma | H4784 | |
| 10x PBS | Invitrogen | 70011 | |
| la ketamina | Wyeth de Sanidad Animal | 0856-4403-01 | |
| medatomidine clorhidrato de | Pfizer | 1950673 | |
| 23G aguja de mariposa | Becton Dickinson | 367253 | |
| paraformaldehído | Microscopía Electrónica de Ciencias | 15710 | |
| molde de plástico de empotrar | VWR | 18986-1 | |
| Octubre de montaje compuesto | Tissue-Tek | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | pH 8,5 |
Referencias
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados