É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem Confocal Espectral de fluorescência com a tag receptores nicotínicos na Knock-em camundongos com a administração de nicotina crônica
Neste Artigo
Resumo
Nós desenvolvemos uma nova técnica de quantificar as alterações de receptores de acetilcolina nicotínicos no interior das regiões subcelulares de subtipos específicos de neurónios no SNC a compreender melhor os mecanismos da dependência da nicotina, usando uma combinação de abordagens, incluindo a marcação da proteína fluorescente do receptor usando o arrastamento na abordagem e espectral imagiologia confocal.
Resumo
Canais ligando-iônicos no sistema nervoso central (CNS) estão implicados em numerosas condições com sérias consequências médicas e sociais. Por exemplo, dependência de nicotina através de fumo de tabaco é a principal causa de morte prematura em todo o mundo (Organização Mundial de Saúde) e é provavelmente causada por uma alteração de ião canal de distribuição no cérebro 1. Exposição crónica de nicotina em ambos os roedores e os resultados seres humanos em aumento do número de receptores de acetilcolina nicotínicos (nAChRs) no tecido cerebral 1-3. Da mesma forma, alterações nas glutamatérgicos GluN1 ou GluA1 canais têm sido implicados no desencadeamento de sensibilização a outras drogas como a cocaína, as anfetaminas e opiáceos 4-6.
Consequentemente, a capacidade de mapear e quantificar a distribuição e os padrões de expressão de canais iónicos específicos é criticamente importante para a compreensão dos mecanismos de dependência. O estudo do cérebro específico de região efciais de drogas individuais foi avançada pelo advento de técnicas como ligantes radioativos. No entanto, a baixa resolução espacial de ligação do ligando radioactivo evita a possibilidade de quantificar canais ligando-iônicos em subtipos específicos de neurónios.
Codificados geneticamente repórteres fluorescentes, tais como a proteína verde fluorescente (GFP) e suas variantes de cor muitos, têm revolucionou o campo da biologia 7. Por marcação geneticamente um repórter fluorescente para uma proteína endógena se pode visualizar as proteínas in vivo 7-10. Uma vantagem das proteínas fluorescentes de marcação com uma sonda é a eliminação do uso de anticorpos, que têm problemas de inespecificidade e acessibilidade à proteína alvo. Nós temos usado essa estratégia para nAChRs fluorescente rótulo, o que permitiu o estudo do conjunto receptor usando Förster Resonance Energy Transfer (FRET) em cultura de células transfectadas 11. Mais recentemente, temos utilizado a Knock-na abordagem aos ratos engenheiro com proteína fluorescente amarela marcado α4 subunidades (nAChR α4YFP), permitindo a quantificação exacta do ex vivo receptor em resolução submicrométricas em neurônios do sistema nervoso central através de microscopia confocal espectral 12. O alvo fluorescente knock-in mutação é incorporado no locus endógeno e sob o controlo do seu promotor nativo, produzindo níveis normais de expressão e regulação do receptor, quando comparado aos receptores não marcados em ratinhos de tipo selvagem. Esta abordagem knock-in pode ser estendido para marcar fluorescentemente canais iónicos outros e oferece uma abordagem poderoso de visualizar e quantificar os receptores do SNC.
Neste artigo descrevemos uma metodologia para quantificar as mudanças na expressão nAChR em neurônios específicos do SNC após exposição crônica à nicotina. Nossos métodos incluem mini-implante de bomba osmótica, a fixação de perfusão intracardíaca, imagem e análise de fluorescência marcado rec nicotínicosubunidades eptor de α4YFP knock-em ratinhos (Fig. 1). Temos optimizada a técnica de fixação para minimizar a partir de autofluorescência tissue.We cérebro fixo descrever em detalhe a nossa metodologia de imagem utilizando um microscópio confocal espectral em conjunto com um algoritmo de desmistura linear espectral para subtrair o sinal autofluoresent, a fim de obter com precisão o sinal de fluorescência α4YFP. Finalmente, mostra resultados de upregulation nicotina induzida crónica de receptores α4YFP no caminho perfurante medial do hipocampo.
Protocolo
1. Implantação da bomba
- Antes da implantação da bomba, preencher e preparar os Alzet mini-bombas osmóticas (Alzet, Modelo 2002, Cupertino, EUA), tomando cuidado para não introduzir bolhas de ar. Este modelo de mini-osmótica bomba fornece solução a uma taxa de 0,5 ul / h durante 14 dias. Garantir condições estéreis. Pesar bombas vazias e cheias. Na conclusão da experiência (10 dias após o implante), o líquido remanescente na bomba pode ser removido com uma seringa e agulha e pesados para calcular o volume bombeado.
- Bombas com a solução de controlo contêm salina (0,9% w / v, Teknova, S5819, Hollister, EUA). Para preparar as soluções de nicotina, uma solução de reserva 1 M de (-)-nicotina sal tartarato de hidrogénio (Sigma, Cat # N5260) é diluído em solução salina (0,9% w / v) e esterilizado por filtração através de um filtro de seringa de 0,22 iM-end. Nós previamente administrada nicotina a 0,4 e 2 mg / kg / hr (calculado como base livre de nicotina), durante 10 dias.
- Prepare três banhos salinos (três10 centímetros salina cheio placas de Petri). Uma vez que a bomba foi preenchido e limitado, lavar bombear exaustivamente em cada banho sucessiva de solução salina para remover quaisquer vestígios de droga no invólucro exterior. Imergir preenchido bombas em solução salina para armazenamento até a cirurgia, mantendo o controlo e as bombas de nicotina em recipientes separados salinos.
- Para estimular uma recuperação saudável e reduzir o risco de infecção pós-cirúrgica, têm gaiolas limpas preparados para a longo prazo de recuperação.
- Para a curto prazo de recuperação imediatamente após a cirurgia, preparar uma gaiola contendo uma almofada de aquecimento e uma lâmpada de aquecimento.
- Para examinar os efeitos da nicotina crónicas temos 5-6 α4YFP homozigótica knock-em ratinhos (2-3 meses de idade) em cada grupo (controlo ou de nicotina). O knock-in α4YFP linhagem de camundongos foram retrocruzadas por 10 gerações para a estirpe de ratinhos C57BL/6J. Tornamos se a idade eo sexo do todos os ratinhos são os mesmos para o estudo e que todas as cirurgias são realizadas no mesmo dia para minimizar a variabilidade. Para evitar que hyhipotermia aos ratos durante e após a cirurgia, equipar mesa cirúrgica com uma almofada de aquecimento coberta de panos cirúrgicos estéreis.
- Induzir o rato knock-in α4YFP com 3 L / min de oxigénio e 3% de isoflurano e, em seguida, manter a anestesia em 2,5 L / min de oxigénio e 1% de isoflurano. Nós preferimos a anestesia isoflurano, porque no final da cirurgia isoflurano limpa o sistema rapidamente e os ratos são conscientes e móvel dentro de ~ 2 min. Aplicar colírio imediatamente (rasgo Gel, Novartis) para evitar lesões na córnea.
- As bombas são implantados subcutaneamente por meio de uma incisão na pele na parte de trás do pescoço e da bomba é empurrado para baixo caudal do aspecto dorsal das costas. Limpe a área na parte de trás entre as patas dianteiras com etanol 95% para a pele fosca. Aperte a pele com uma pinça 0.8mm Graefe (Ferramentas Ciência Belas, 11050-10) e fazer um corte de 1 centímetro central lateral com uma tesoura de íris (Ferramentas Ciência Belas, 14060-10).
- Para criar um espaço subcutâneo para a bomba, inserir tesoura padrão padrãos (Ferramentas Ciência finas, 14101-14) na incisão e empurrá-los cuidadosamente para a extremidade caudal do animal.
- Usando uma pinça 1,0 mm Graefe (Ferramentas Ciência Belas, 11.650-10), remover a bomba de solução salina. Segurar os incisão aberta fórceps e inserir usando a bomba na incisão, com a tampa da bomba osmótica de frente para a extremidade caudal do animal e empurre a bomba na extremidade caudal.
- Pitada ferida fechou com pinça 0,8 mm e aplicar uma quantidade adequada de Vetbond (3M, cat # 1469SB) cola. Segure até ferida está selado.
- Remover o animal de máscara isoflurano, injectar com o analgésico, o meloxicam (0,1 mg / kg sc), e em lugar de uma gaiola de recuperação de curto prazo até consciente e móvel. Em seguida, coloque em uma gaiola de recuperação a longo prazo com comida e água disponível ad libitum.
2. α4YFP bater-na fixação do rato por perfusão intracardíaca
- Fazer soluções um dia antes do procedimento e deixar a 4 ° C. Para minimizar a variabilidade todos os ratinhosserá perfundidos no mesmo dia e com o mesmo lote de soluções.
- Execute fixações de perfusão em uma área bem ventilada. Linha de onda de bomba peristatic (Masterflex fácil de carga, 7518-00; bomba Masterflex Controller, 60648), com DDH 2 O.
- Adicionar ~ 0.0015g de heparina (Sigma, Cat # H4784), um anticoagulante, para 20 ml de PBS de pH 7,6 (Invitrogen, cat # 70011).
- Anestesiar α4YFP knock-em rato por injecção intramuscular de uma mistura de cetamina (25 mg / kg, Saúde Animal Wyeth) e cloridrato de medatomidine (0,25 mg / kg, Pfizer) no músculo da perna posterior direita e colocar imediatamente o animal de volta para a sua gaiola de origem.
- Pino animal para uma tampa de isopor inserido um tabuleiro de metal. Wipe tórax com etanol a 95%. Pitada pele com uma pinça Adson (Ferramentas Ciência Belas, 91106-12) e recorte abrir a cavidade torácica, com tesoura de íris. Grampo da caixa torácica com uma pinça hemostática ultra fino (Ferramentas Ciência Belas, 13021-12) e expor o coração.
- Começar a bombear PBS a 4 ml / min e iINSERI uma agulha de borboleta 23G (Becton Dickinson, 367,253) para o ventrículo esquerdo do animal. Imediatamente cortar o átrio direito para permitir que o sangue e perfusato para escapar.
- Perfundir 20 ml de PBS (pH 7,6), em seguida, 30 ml de paraformaldeído a 4% (pH 7,6, diluído com PBS a partir de um 16% PFA banco de Ciências Microscopia de electrões, cat # 15710), em seguida, 20 ml de sacarose a 5% (pH 7,6) . Descobrimos que aumenta a fixação sobre autofluorescência. Perfusão com sacarose a 5% lavagens PFA residual a partir do cérebro, o que reduz autofluorescência.
- Remover cérebro e armazenar em sacarose a 30% durante 3 dias.
- Para congelar o cérebro para corte coronal, cortar o cerebelo, com uma lâmina de barbear eo cérebro realizada em um molde de encaixe de plástico (VWR, cat # 18986-1) rostral lateral-se e mergulhe em outubro Composto de montagem (Tissue-Tek, cat # 4583) . Congelar em gelo seco e armazenar a -20 ° C antes de cortar.
- Cérebros seção (30 mm de espessura) em um criostato e depois transferir para lâminas revestidas. Guarde as seções do cérebro a -20 &°; C em caixas de lâmina contendo uma pedra de sulfato de cálcio anidro. A caixa de lâminas deve estar em um saco zip lock selado para evitar a umidade e freezer subseqüente queimar quando armazenadas a -20 ° C.
3. NAChRs imagem fluorescentes usando microscopia confocal espectral
- Certifique-se de slides tem uma exposição mínima a qualquer fonte de luz para minimizar a fotodegradação.
- Lamela as lâminas secção cerebrais com um meio de montagem que não inibe a fluorescência da proteína fluorescente. Nós temos um bom sucesso com Mowiol 4-88 (pH 8,5 em tampão Tris-HCl e glicerol, EMD-Calbiochem, cat # 475,904), que endurece após algumas horas. Assegure-se o Mowiol equilibra a temperatura ambiente antes de tampa deslizar de forma a evitar bolhas de ar. Não usar unhas polonês quando a tampa deslizar como ele vai saciar a fluorescência YFP.
- As imagens são adquiridas usando uma Nikon C1si sistema de microscópio confocal espectral. Detalhes sobre o método de imagem confocal espectral e desmistura linear são fornecerd em outro lugar 13-15. A lógica para a utilização de um microscópio confocal espectral é que o tecido cerebral fixa tem autofluorescência inerente. Imagiologia confocal espectral na C1si Nikon usa uma matriz de 32 detectores de tubos fotomultiplicadores que a amostra de uma determinada gama de comprimentos de onda da luz emitida fluorescente, refratada espacialmente em seus diferentes comprimentos de onda através de um elemento dispersivo ralar como um prisma refratando a luz branca em um arco-íris de cores 16. O que é recolhida é uma pilha de lambda de imagens - imagens recolhidas em diferentes comprimentos de onda da luz de modo a que um espectro de emissão são recolhidos para cada pixel de uma pilha de lambda de imagens. Uma vez que YFP e autofluorescência tecido têm cada característicos espectrais assinaturas, a pilha de lambda pode ser deconvolved usando um algoritmo de desmistura linear algébrica em YFP separada e sinais autofluorescente (Fig. 2). Assim, a quantificação precisa de muito YFP fluorescência pode ser determinado, mesmo em tecido com níveis significativos de autofluorescence.
- Várias configurações podem ser ajustadas para otimizar a qualidade de imagem e eficiência de coleta de fluorescência. Vamos relatar as configurações que normalmente usam, mas essas configurações podem ser ajustadas, dependendo da amostra e do microscópio confocal. Para quantificar com precisão as alterações na expressão da subunidade α4YFP com nicotina crônica garantir que o nível de intensidade em escala de cinza dos sinais de todos os pixels estão abaixo do valor de saturação (<4095 para 12 em escala de cinza bit). Além disso, acomodar o potencial aumento de sinal devido a regulação positiva do receptor, ajustando as configurações confocal de modo que os pixels são cerca de um terço do valor de saturação (~ 1300-1400) ou menos. Uma vez que as configurações são otimizados, as configurações são mantidos de forma idêntica para todas as sessões de imagens e amostras.
- Usamos as seguintes configurações para imagens α4YFP usando um óleo de 60X Plano TPI Apo VC objetivo (1,40 NA, 0,13 mm de distância de trabalho): 488 nm do laser de linha em 15% transmissão máxima de um 40 mW laser de argônio, O ganho de detector espectral a 220, a partir de faixa espectral imaged 496,5 nm a 656,5 nm a 5 resolução nm, 512 x 512 pixels mais de uma área de 50 um x 50 um, um tamanho médio furo (60 diam mm), um pixel 4,08 tempo de permanência, uma média de dois exames e 12 bits de escala de cinza.
4. Desmistura linear de imagens espectrais confocal e análise de imagem
- Para executar desmistura espectral linear sobre uma imagem de amostra tirada com um microscópio confocal espectral, deve-se primeiro adquirir um espectro de referência para YFP e um espectro de referência para autofluorescência tecido.
- Um requisito importante para qualquer espectro de referência é a obtenção de um sinal de alta para espectro de ruído de fluorescência fotografada com a linha de laser mesmo utilizado para geração de imagens das suas amostras. Embora a linha de laser 514 nm de árgon tem uma maior eficiência de excitação para excitar YFP nós preferimos YFP imagem com a linha de laser 488 nm, porque há uma melhor separação da emissão de pico de YFP ea linha 488 nm é menos likely para distorcer a pico e pode-se obter o espectro de emissão inteiro YFP incluindo o aumento de pico. Nós YFP imagem solúvel transfectados em uma linha de células de modo a que um sinal forte YFP é obtido e do espectro YFP resultante é armazenado na nossa biblioteca de espectros de referência. Α4YFP transfectadas sobre expressa em linhas de células podem também ser utilizados desde que também irá proporcionar um sinal de alta ao espectro de fundo.
- Para obter um espectro de referência do autofluorescência autofluorescência imagem que a partir de uma seção do tipo selvagem de cérebro de camundongos a partir das várias regiões do cérebro que pretendemos para a imagem do mouse α4YFP e obter seus espectros correspondentes. Usamos a linha de laser mesmo, 488 nm, e de imagem utilizando parâmetros de quase idênticas, embora se possa alterar o ganho do detector, a intensidade do laser ou realizar imagem média para maximizar sinal para ruído.
- Após a obtenção de uma imagem confocal espectral a partir de uma região do cérebro do rato α4YFP, a imagem é, então, na sua deconvolved YFP e autofluorsinais escence mediante a aplicação de um algoritmo de desmistura linear espectral usando o espectro de referência do YFP eo espectro de referência do tipo selvagem autofluorescência rato a partir de a mesma região do cérebro.
- A imagem α4YFP puro pode então ser aberto em um software de análise de imagem, tal como ImageJ ( http://rsbweb.nih.gov/ij/ ) e, em seguida, a intensidade de pixel média é calculada para a região de interesse. Um plugin para o ImageJ chamado "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) pode ser usado para importar Nikon ics / ids arquivos confocal.
- Vamos repetir o mesmo desmistura linear espectral e análise à estirpe selvagem ratos na mesma região do cérebro para obter um valor de fundo residual.
- Em seguida, obtém-se a intensidade média corrigida α4YFP subtraindo o valor de fundo residual (4,6) a partir do valor médio α4YFP não corrigido (4,5).
5. Os resultados representativos
Nós mostramos uma projecção de cor verdadeiro representante de uma pilha de lambda de imagens do habenula medial a partir de um rato α4YFP homozigótica (Fig. 3A) tomado com um microscópio confocal espectral. Nós também mostram o espectro de emissão a partir de uma região de interesse contendo α4YFP neurónios positivos a partir da mesma imagem pilha lambda (Fig. 3B). Um pico de emissão distinta é evidente a ~ 527 nm, que é a emissão de pico de fluorescência de YFP. A região limítrofe da habenula medial mostra um espectro de emissão falta um pico espectral em 527 nm, indicando a ausência de subunidades α4YFP nAChR. Após desmistura espectral linear usando os espectros de referência de YFP e autofluoresence cérebro do rato com a sobreposição de emissão (Fig. 4), a separação de YFP e sinal autofluorescente é possível imagem um rendimento α4YFP não misturados, uma imagem autofluorescente puro e um canal restante. Localização clara de gripe α4YFPorescence podem ser identificados no soma embaladas apertadamente do habenula medial (Fig. 4).
No hipocampo α4YFP está localizada principalmente no caminho perfurante medial, o caminho Tempero-amônio eo alveus 12. Estes são todos inervação glutamatérgica do hipocampo. Foram examinados os efeitos da nicotina crónica na expressão α4YFP no caminho perfurante do hipocampo (Fig. 5). A administração crónica de nicotina (2 mg / kg / h durante 10 dias), resultou num aumento significativo (69 ± 14%) em α4YFP fluorescência a partir de ratinhos de controlo tratados com solução salina crónicas de nicotina ratinhos tratados (p = 0,001, teste de Wilcoxon Rank Sum) ( Fig. 5).
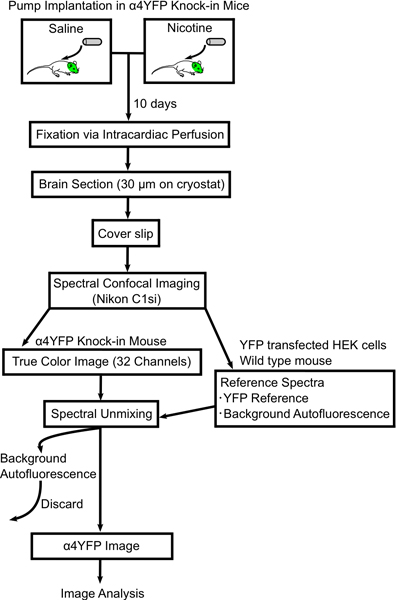
Figura Fluxograma 1. Mostrando procedimento para alterações de imagem em subunidades nAChR α4YFP com nicotina crônica. Mini-bombas osmóticas são preenchidos com solução salina ou nicotina e implantado por via subcutânea em e ALPha; 4YFP camundongos homozigotos. Após 10 dias os ratos são perfundidos e fixados com paraformaldeído a 4% e os cérebros de rato são seccionados (30 mm de espessura) em lâminas. A seção do cérebro é fotografada em um microscópio confocal espectral (Nikon C1si) e sem mistura espectral em imagens YFP e autofluorescente. Em seguida, as imagens são analisadas mais α4YFP com o software ImageJ.
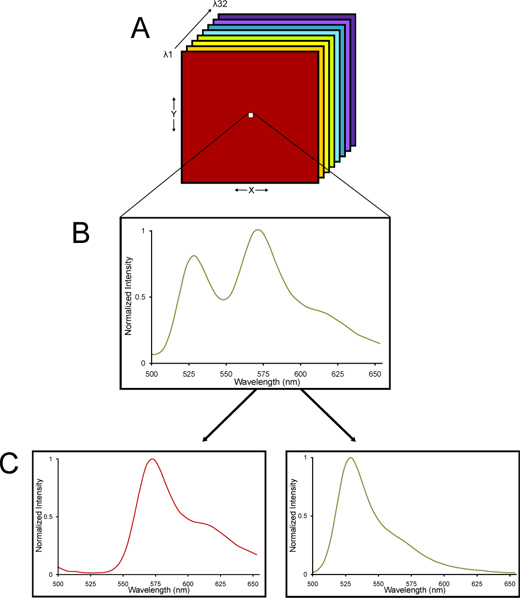
Figura 2. Um diagrama esquemático de uma pilha de lambda visualizado usando um microscópio confocal espectral e linearmente não misturados em seus componentes espectrais. (A) Uma pilha lambda de imagens é coletada. (B) Uma pilha lambda consiste de imagens recolhidas em diferentes comprimentos de onda da luz de modo a que um espectro de emissão é recolhido para cada pixel do outro lado da pilha inteira. (C) Uma vez que YFP e autofluorescência tecido têm cada característicos espectrais assinaturas, a pilha de lambda pode ser deconvolved usando um algoritmo de desmistura linear algébrica em sYFP eparate e os sinais de autofluorescente. Assim, a quantificação precisa de muito YFP fluorescência pode ser determinado, mesmo em tecido com elevados níveis de autofluorescência.

Figura 3. Imagem confocal espectral de uma região do cérebro expressar nAChRs α4YFP. (A) Uma projecção de cor verdadeira de uma pilha de lambda de imagens do habenula medial de um rato α4YFP tomado com um microscópio Nikon C1si espectral confocal. (B) A parcela de espectros a partir de uma região de interesse, que inclui α4YFP neurónios contendo (verde), e uma região de interesse fora do habenula medial (vermelho).
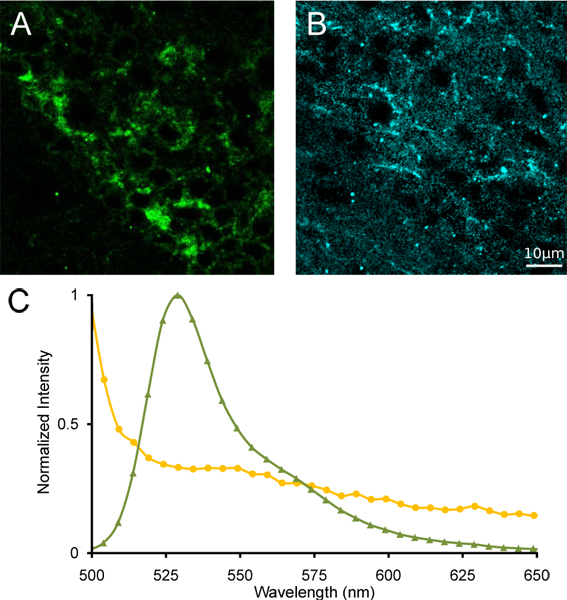
Figura 4. Desmistura espectral linear do habenula medial. (A) Imagens de α4YFP pura e (B) seguindo autofluorescência desmistura linear espectral. (C) espectros de referência do YFP (verde triângulos) e autofluorescência (círculos amarelos) utilizado para desmistura espectral.

Figura 5. Upregulation de α4 nAChRs no hipocampo de α4YFP knock-nos ratinhos expostos a nicotina crónica. (A) Uma montagem de azulejos de α4YFP fluorescência a partir do hipocampo. As duas áreas de selecção tracejadas são os locais aproximados no membro inferior do caminho perfurante do hipocampo, onde as análises foram realizadas para cada rato. (B) α4YFP fluorescência foi significativamente maior no caminho perfurante de ratinhos expostos a nicotina crónica do que salina crónica (*, p = 0,001, teste de Wilcoxon Rank Sum). Os resultados representam a média ± SEM de n = 20 medições para ratinhos nicotina tanto salinos e crónica tratado (5 ratinhos para cada grupo de tratamento).

Figura 6. D Melhorexpressão epth de α4YFP como comparado com a rotulagem do anticorpo. Exibições XZ ortogonais de α4YFP de fluorescência (A) e VGlut2 anticorpo com Cy5 como um rótulo secundário (B). (C) As parcelas que mostram uma maior intensidade de fluorescência a degradação do sinal sobre a profundidade para a coloração de anticorpo (quadrados pretos) em comparação com α4YFP (círculos abertos).
Discussão
O uso de um receptor de fluorescente num modelo de rato knock-se para determinar a quantidade e localização de um canal de ião específico fornece um número de vantagens. Em contraste com as proteínas, tais como actina, que é ubíqua expressa em todas as células, os canais de iões estão presentes em números muito menos ea sua expressão varia entre os subtipos neuronais tornando a análise exacta através tradicionais técnicas imuno-histoquímicas desafio. O produto do gene α4YFP é expresso em níveis de...
Divulgações
Não temos nada a divulgar.
Agradecimentos
Anthony Renda foi apoiado por uma Universidade de Victoria Prêmio Bolsa de Pós-Graduação. Esta pesquisa foi suportada por uma Ciências Naturais e Engenharia Council of Canada Discovery Grant, um investigador NARSAD Prêmio Jovem (para RN), a Fundação Victoria - Myre e Winifred Sim Fund, a Fundação Canadense para Inovação de subvenção, a British Columbia Fundo de Desenvolvimento do Conhecimento e Ciências Naturais e Engenharia do Conselho de Pesquisa de Ferramentas de Pesquisa do Canadá e Grant Instrumentação. Agradecemos Jillian McKay, Christina Barnes, Ariel Sullivan, Jennifer MacDonald e Daniel Morgado para criação excelente mouse.
Materiais
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| mini-bombas osmóticas | Alzet | modelo 2002 | |
| salina | Teknova | S5819 | |
| (-)-Nicotina sal tartarato de hidrogénio | Sigma | N5260 | |
| colírio | Novartis | Lágrima-Gel | |
| Vetbond cola | 3M | 1469SB | |
| sal heparina sódica | Sigma | H4784 | |
| PBS 10x | Invitrogen | 70011 | |
| ketamina | Wyeth Saúde Animal | 0856-4403-01 | |
| cloridrato medatomidine | Pfizer | 1950673 | |
| 23G agulha borboleta | Becton Dickinson | 367253 | |
| paraformaldeído | Electron Microscopy Sciences | 15710 | |
| molde plástico de encaixe | VWR | 18986-1 | |
| Composto outubro de montagem | Tissue-Tek | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | pH 8,5 |
Referências
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados