A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استنساخه سحق الفأر العصب الوركي وتقييم لاحق للتجديد من قبل الجامعة جبل تحليل العضلات
In This Article
Summary
نحن في هذا التقرير وصفا لطريقة لسحق العصب الوركي الماوس. هذا الأسلوب يستخدم الملقط مرقئ متاحة بسهولة ويسر، وبتكاثر تنتج كاملة سحق العصب الوركي. وبالإضافة إلى ذلك، ونحن تصف طريقة لإعداد يتصاعد العضلات كلها مناسبة للتحليل من تجديد العصب بعد سحق العصب الوركي.
Abstract
تدرس على نطاق واسع في تجديد النظام العصبي الطرفي (المحيطي) على حد سواء لأهميتها بالنسبة لمرض الإنسان وفهم ردا قويا على التجدد التي تنفذها الخلايا العصبية الجهاز العصبي المحيطي وبالتالي إلقاء الضوء ربما فشل تجديد الجهاز العصبي المركزي 1. الوركي سحق العصبية (انهتاك المحوار) هو واحد من النماذج الأكثر شيوعا لإصابة الأعصاب الطرفية في القوارض 2. سحق المقاطعات هي الحفاظ على جميع المحاور لكن شوان الصفائح الخلايا القاعدية بحيث التجديد هو الأمثل 3،4. هذا يسمح للمحقق على وجه التحديد لدراسة قدرة محور عصبي متزايد للتفاعل مع كل من خلايا شوان والصفيحة القاعدية 4. وكانت الفئران عموما على نماذج حيوانية المفضل لسحق العصب التجريبية. وهي متاحة على نطاق واسع وأعصابهم الوركي lesioned يوفر تقريب معقول من الآفات العصبية الإنسان 5،4. على الرغم من أصغر في الحجم من العصب الفئران، العصب الماوس لديه صفات كثيرة مماثلة. إلا أن الأهم، مذكرات تفاهمالنماذج الإلكترونية هي ذات قيمة متزايدة بسبب توافر واسعة من خطوط المعدلة وراثيا يسمح الآن لتشريح مفصل للجزيئات الفردية حاسمة لتجديد العصبية 6 و 7. وقد استخدم المحققون قبل أساليب متعددة لإنتاج سحق العصب أو إصابة بما في ذلك ملقط الزاوية بسيط، ملقط المبردة، ملقط مرقئ، والمشابك الأوعية الدموية، والمشابك محقق المصممة 8،9،10،11،12. وقد استخدم الباحثون أيضا أساليب مختلفة لوضع العلامات على موقع الإصابة بما في ذلك خياطة الجروح، وجزيئات الكربون والخرز فلوري 13،14،1. نحن لدينا وصف طريقة للحصول على كامل بتكاثر سحق العصب الوركي مع دقيق ومستمر من وضع علامات للموقع سحق باستخدام ملقط غرامة مرقئ والكربون لاحق سحق الموقع وسم. كجزء من الوصف الذي نعيش فيه من إجراء العصب الوركي سحق ادرجنا أيضا طريقة بسيطة نسبيا من كل عضلة جبل نستخدمها لتحديد وقت لاحق تجديد.
Protocol
1. حيوان المواضيع
1.1. علاج
- يجب أن يتم تنفيذ جميع الإجراءات الحيوان بموافقة رعاية الحيوان ومؤسسة محلية والأخلاق واللجنة وفقا للاستخدام واللجنة، والمعاهد الوطنية للصحة المبادئ التوجيهية، مع التدابير المتخذة للحد من الألم والانزعاج.
- وتم إيواء الفئران لدينا تحت درجة الحرارة التي تسيطر عليها الظروف على عكس الضوء لمدة 12 ساعة، ودورة الظلام، في حين تشاو فأرة بنك الاحتياطي الفيدرالي والمياه libitum الإعلانية.
- للدراسات من تجديد الكبار، وينبغي أن تكون الفئران لا يقل عن 6 أسابيع من العمر عندما يتم تنفيذ سحق العصب الوركي. هذا العصر هو أبعد من الوقت الذي تشذيب من الوصلات العصبية والعضلية متعدد الأعصاب تحدث.
- في هذه التجارب، وكنا 6-8 الاسبوع C57BL القديمة / 6 الفئران تم الحصول عليها من نهر تشارلز. عند مقارنة تجديد بعد سحق العصب الوركي (أي: معدل النمو محور عصبي) ينبغي أن سلالات الفئران أن تكون هي نفسها، والاختلافات في تجدد المحاور وكانت لاإد بين السلالات الفطرية مختلف 15،16. إذا الفئران التلاعب وراثيا هي لاستخدامها، والضوابط littermate هي الأنسب.
1.2. تحضير جراحي
- الحيوانات هي تخدير عميق لعملية جراحية باستخدام مزيج من الكيتامين (100 ملغ / كلغ)، وزيلازين (10 ملغ / كلغ) عن طريق الحقن داخل الصفاق. كل حيوان يتلقى أيضا حقن تحت الجلد من meloxicam (10 ملغ / كلغ) لتقليل الألم بعد الجراحة.
- وحلق ذقنه بعناية كل من الخلف باستخدام كليبرز الجراحية (Roboz، RC-5903)، والانتهاء من إزالة الشعر مع الشعر نير كريم إزالة (وجدت في الصيدلية المحلية).
- الجلد هو تطهير باستخدام أدوات تطبيقها قطن معقم الرؤوس وفرك betadine الجراحية (فيشر العلمية، 19066452).
- ويطبق مرهم عيني (فيشر العلمية، 19082795) للعيون باستخدام أدوات تطبيقها قطن معقم الرؤوس.
- يتم وضع الماوس على طبق من الفولاذ المقاوم للصدأ نظيفة، والتي تم بموجبها وضع homeot قبل ساخنةhermic نظام بطانية (هارفارد جهاز، 507222F). يتم الحفاظ على الحيوانات في درجة الحرارة 37 درجة مئوية.
- وسجلت جميع الأطراف إلى أسفل، مع الحرص على وضع الأرجل الخلفية بشكل متناظر بحيث أن مفصل الركبة يجعل زاوية قائمة مع الجسم (الشكل 1، لوحة أ).
- ويغطي مجال العمليات الجراحية مع ثنى العقيمة. يتم تعقيم كل الأدوات التي الأوتوكلاف أو حار حبة تعقيم (أدوات العلوم الجميلة، 18000-45) والجراح يرتدي قناع، ثوب، والقفازات المعقمة.
2. استنساخه سحق العصب الوركي
- بعد إعداد، يتم إجراء شق نصف دائرية عبر خط الوسط (الشكل 1) في الجلد. يتم تشريح بلطف الجلد من عضلات الكامنة، ومطوية على أن يبقى للخروج من الطريق أثناء العملية. ومن ابقى رطبة باستخدام تطبيقات من ملحي معقم 0.1 مل (هوسبيرا، 0409-4888-20) أثناء العملية.
- فتح الطائرة لفافي بين الألوية الكبيرة ورئيس الأمامي من femori العضلة ذات الرأسينق يكشف عن العصب الوركي (الشكل 1، لوحة أ). لمراقبة العمليات الجراحية، ينبغي أن يتعرض العصب الوركي، وحشدت المقابل، لكنها تركت على حالها. ومن ثم الجهاز العضلي الألوية إعادة تعارض وخياطة باستخدام الحرير مضفر 6-0، غير قابل للامتصاص الغرز (Roboz، SUT-1073-11).
- ثم يتعرض العصب الوركي التجريبية بنفس الطريقة، مع الكامشات في مكان للتخفيف من التصور (الشكل 1، لوحة B). يتم تعقيم الكامشات قبل استخدامها.
ملاحظة: على الرغم من أن أنظمة ضام متاحة تجاريا، فإنها غالبا ما تكون باهظة التكاليف. كنا قادرين على جعل نظام ضام مرضية باستخدام الأجهزة غير مكلفة لوازم ودبابيس للحشرات (انظر المواد المقطع). - ومن ثم العصب الوركي سراح بلطف من النسيج الضام المحيطة باستخدام مقص قطع القزحية.
- باستخدام ملقط 5/45 (أدوات العلوم الجميلة، 11251-35) غرامة، يتم وضع العصب في الفك السفلي من ملقط فائقة غرامة مرقئ (العلوم الجميلة جداليرة سورية، 13020-12). تتماشى بشكل متتابع في كراسات ثلاثة، وليس على رأس كل منهما الآخر (الشكل 1، B أقحم). وقد نقشت على ملقط مرقئ مع علامة في 1.5 ملم من طرف بهم. يتم وضع جزء أبعد من فقرات الظهر وفقا لهذه العلامة قبل التدافع. هذا يضمن وجود عرض من سحق موحدة، وهذا العصب لا تتجاوز بين فكي الملقط مرقئ عندما دكت نظرا لقوة ساحقة. وإذا كان العصب يمتد إلى أبعد من طرف الملقط فقط العصب سيتم سحق جزئيا.
- يرصد الزحام عمودي على العصب في 45 ملم من اصبع القدم الثالث، كما تم قياسه من قبل مؤشر ترابط أن يقترب من مسار العصب الوركي. وسحق العصب مرة لمدة 15 ثانية في 3 نقرات من ملقط مرقئ. والحرص على عدم امتداد العصب. عندما تكون في المرقأة اعادة فتح، يجب أن تكون شفافة بالكامل العصب في موقع التدافع.
- والزوج الثاني من ملقط مرقئ (مطابق للأول) التي كانت قبل انخفض فيويستخدم الكربون المجفف (فيشر العلمية، C272-500) للاحتفال موقع التدافع. وسحق العصب في موقع سحق نفسه لمدة 15 ثانية في 3 نقرات. لا ينبغي أن الكربون وسم تتجاوز حدود لسحق الأولي. وهذا أمر مهم خاصة إذا كان مطلوبا دقيق وسم من موقع التدافع. قبل استعمالها، وتعقيم مسحوق الكربون عن التعرض للأشعة فوق البنفسجية لمدة ساعتين، وبعد ذلك تتم معالجة باستخدام تقنية معقمة.
- إلى ما قبل تراجع الملقط في الكربون ولكن يستبعد الكربون على نطاق واسع في موقع الجراحية، ويتم فتح ملقط في مسحوق الكربون، ثم أغلقت بلطف (ولكن ليس النقر) أغلقت، ويتم محو الكربون على السطح الخارجي للالمرقأة قبالة باستخدام شاش معقم . ويتم التحقق من تحت ملقط على الأقل تكبير 3X للتحقق من أن تكون مغلفة بشكل متساو على السطوح في سحق الكربون المجفف. إذا لزم الأمر، وأنها إعادة معالجتها والقضاء.
- وعضلات الألوية إعادة تعارض وخياطة بالطريقة نفسها كما في الجانب المقابل.
- أخيرا، يتم إغلاق شق الجلد باستخدام 9 مقاطع منعكس ملم (أدوات دقيقة العالم، 500346، مطبق: 500345). ويمكن إذا تم العثور على 9 مقاطع لا ارادي مم لتقييد حركة، ومقاطع صغيرة لا ارادي أو الغرز 6-0 (Roboz، SUT-1073-11) أن تستخدم بدلا من ذلك.
3. الرعاية بعد العملية
- بعد هذا الإجراء، وتوضع الحيوانات في وسادة التدفئة على 37 درجة مئوية حتى تظهر علامات على الحركة.
- يتم نقل بعد ذلك إلى قفص وطنهم، حيث الماء والطعام يمكن الوصول إليها بسهولة على الأرض في شكل هيدروجيل والغذاء المبللة.
4. شبه رقيقة التحضير
- بعد جرعة زائدة من بنتوباربيتال (300 ملغ / كلغ) يتم إزالة الجهاز العضلي في الساق لفضح * العصب الوركي. مع العصب المتبقية في الموقع، وتغمر في العجيزة بارافورمالدهيد 2٪ و 2٪ في gluteraldehyde 0.1 العازلة الفوسفات M على الجليد لمدة 30 دقيقة.
* إذا استكمال إعداد كل عضلة جبل، العضلات هي موسم الحصادإد قبل الكشف عن العصب الوركي. - تتم إزالة بعناية العصب، مع الحرص على التعامل فقط مع نهاية القريبة. ثم العصب هو في مرحلة ما بعد ثابت في مثبت نفسه لمدة ثلاث ساعات إضافية.
- بعد تثبيت تشطف العصب ثلاث مرات في 0.1 العازلة الفوسفات M.
- غارق في العصب في رباعي أكسيد الأوزميوم 2٪ في 0.1 العازلة الفوسفات م لمدة ساعة.
- العصب ومن ثم المجففة عن طريق الغمر متتابعة في الإيثانول أكثر تركيزا (50٪، 70٪، 80٪، 95٪، 100٪، 100٪، 100٪). كل غمر 15 دقيقة.
- وحضنت العصب المجففة مرتين في أكسيد البروبيلين لمدة ثلاث دقائق لكل منهما.
- ثم يتم غمر العصب في خليط 01:01 من أكسيد البروبيلين و 812 أنقل ما لا يقل عن 6 ساعات (بين عشية وضحاها عادة).
- ثم يتم غمر العصب في خليط 02:01 من أكسيد البروبيلين و 812 تضمين بين عشية وضحاها.
- أخيرا، ومنغمسين في العصب في تضمين نقي 812 لمدة ست ساعات، جزءا لا يتجزأ من ثم في القالب المناسب وعلى درجة البكالوريوسرطة في 60 درجة مئوية لمدة 48 ساعة.
- يتم قطع 1،0 ميكرون من أقسام الجذع العصبية البعيدة على مسافة مجموعة من موقع سحق باستخدام UCT Ultracut مشراح مستدق (لايكا) بسكين الزجاج الملون، واللون الأزرق مع طولويدين. ويمكن أيضا أن تنتج الشرائح الرقيقة لدراسة التركيب الدقيق بواسطة المجهر الإلكتروني.
5. كامل تحضير جبل العضلات
- وضحى الفئران الأول مع جرعة زائدة من بنتوباربيتال (300 ملغ / كلغ)، وتتم إزالة الأرجل الخلفية في الركبتين.
- تتم إزالة أربعة العضلات في الطرف هند للتحليل: الأمامي الظنبوبي (TA)، الباسطة للأصابع الطويلة (EDL)، النعلية، والشظوية الطويلة.
- تتم إزالة جميع العضلات عن طريق تشريح دقيق ويعلق من خلال أنسجتهم الضام إلى sylgard الأسود (فيشر العلمية، NC9492579) صحن مطلي. وتشطف هم في برنامج تلفزيوني، وثابتة ثم في بارافورمالدهيد 4٪ لمدة 30 دقيقة.
- ومن ثم تشطف المساعدة الفنية في برنامج تلفزيوني، جزءا لا يتجزأ من أكتوبر (فيشر العلمية، 14-373-65)، وتجمد بسرعة في حمام من الثلج الأسيتون وجاف.
- يتم تخزينها في -80 درجة مئوية لمدة باجتزاء رقيقة في القضية برمتها جبل إعداد فشل. بشكل عام، وTA سميكة جدا ليتصاعد كل مناسبة.
- وتشطف في مؤسسة كهرباء لبنان، النعلية، والشظوية الطويلة لمدة 3 دقائق × 10 في برنامج تلفزيوني، وضعت في جليكاين 0.1 M * (فيشر العلمية، AC12007-0010، مخففة في PBS) لمدة 30 دقيقة، وتشطف 3 × 10 دقائق في برنامج تلفزيوني جديد. وتطفأ بعد ذلك في الميثانول الباردة الجليد 100٪ لمدة 5 دقائق بالضبط عند -20 درجة مئوية، تشطف 3 × 10 دقائق في برنامج تلفزيوني، واستحم في مترافق fluorescently ألفا بنغاروتوكسين (1:200 المخفف في PBS) لمدة 30 دقيقة. وتشطف العضلات لمدة 3 دقائق × 10 في برنامج تلفزيوني، تليها كتلة 1-ساعة في جيش صرب البوسنة 2٪ (KPL، 50-61-00) وتريتون 0.2٪ X-100 (نقطة العلمية للإعلام، 9002-93-1) في برنامج تلفزيوني *، وحضنت بين عشية وضحاها في حين تعصف في 4 درجات مئوية في مزيج من الأجسام المضادة الأولية مخففة في نفس 2٪ كتلة تريتون BSA/0.2٪.
* جليليمصنوعة ycine والحلول عرقلة في نفس اليوم كما حصد العضلات ويحرك لمدة 30-60 دقيقة في درجة حرارة الغرفة قبل استخدامها.- بمناسبة المحاور والمشابك العصبية والعضلية، ونحن نستخدم مزيج من neurofilament علامة الفأر وحيدة النسيلة (كوفانس، SMI-312R، المخفف 1:1000)، والفأر وحيدة النسيلة علامة حويصلة متشابك (SV2 DSHB، تضعف 1:1000)، وألفا رودامين مترافق -بنغاروتوكسين (سيغما الدريخ، تضعف 1:200). بمناسبة رد الفعل خلايا شوان التي نستخدمها أرنب المضادة لل(GAP) 43 (نوفوس البيولوجية، NB300-143، المخفف 1/500). الأجسام المضادة الأولية وتصور مع IgG1 سلالة فلوريسئين مترافق محددة الأجسام المضادة لمكافحة فأر عنزة الثانوية وDyLight 649 مترافق حمار المضادة للأرنب (جاكسون ImmunoResearch، تضعف 1:200).
- في اليوم التالي، وتشطف العضلات في برنامج تلفزيوني لمدة 3 دقائق × 10، وحضنت في الأجسام المضادة الثانوية المخفف 1:200 (في 2٪ حل تريتون BSA/0.2٪ تسد). وشطفها بعد ذلك 2 × 10 دقيقة في برنامج تلفزيوني، FOllowed من قبل غمر 5 دقائق في دابي (إينفيتروجن، D3571، تضعف إلى 300 نيوتن متر في الماء منزوع الأيونات)، وآخر 10 دقيقة شطف في برنامج تلفزيوني.
- ثم يتم تشريح كل عضلة على sylgard الأسود (فيشر العلمية، NC9492579) المغلفة طبق بيتري. في البداية يتم إزالة الأوتار في نقطة الإدراج الخاصة بهم في العضلات، ومن ثم يتم ضعفت العضلات بواسطة تقشير بعيدا ألياف العضلات الداخلية (الشكل 3، والألواح AC). والحرص على الحفاظ على الخارج سطح العضلات، بما في ذلك العصابات endplate (الشكل 3، والألواح DF). هي التي شنت على العضلات الناتجة عن الشرائح الجمع (فيشر العلمية، 12-550-15) مع vectashield (ناقلات مختبرات، H-1000) و 22 × 40 ملم الزجاج coverslips (فيشر العلمية، 12-548-5C) مختومة من قبل طلاء الأظافر واضح على الجانبين. عندما شنت بشكل صحيح على الشريحة الاتصالات الفرقة endplate وساترة.
6. قياس التجديد
- ويمكن تقدير التجدد في كل عضلات الثلاث (الشظوية، مؤسسة كهرباء لبنان، والنعلية). نحن السابقين في كثير من الأحيانأمين تجديد 14 يوما بعد سحق العصب، وهو الوقت الذي تشكل نسبة كبيرة من NMJs إعادة معصب. كلا نقطة في وقت سابق والوقت لاحقا هي أيضا مناسبة، وهذا يتوقف على السؤال الذي طرح العلمية. في كل العضلات، ويتم فحص إعادة تعصيب من الفرقة endplate كامل. ويسجل سوى سطح NMJs وجه خاص. في هذا الشكل، قد يكون لا يقل عن 200 NMJs في عضلة فحص بسرعة.
- ليسجل عضلة إعادة تعصيب نحن تحديد "إعادة نسبة التعصيب". القاسم هو عدد الوصلات العصبية والعضلية المزالة التعصيب كما وصفت من قبل α-بنغاروتوكسين GAP-43 خلية ملزمة وشوان تفاعلية مناعية. البسط هو عدد إعادة معصب NMJs وصفت بأنها من قبل neurofilament/SV2 تفاعلية مناعية. إذا لزم الأمر، يمكن تصنيفها على النحو NMJs جزئيا إما (تغطية كاملة من بنغاروتوكسين-α بواسطة SV2) أو بالكامل (تغطية كاملة لبنغاروتوكسين-α بواسطة SV2) إعادة معصب. للحصول على أمثلة من NMJs إعادة معصب والمزالة التعصيب انظر الشكل 3، والألواح G و H.
7. ممثل النتائج
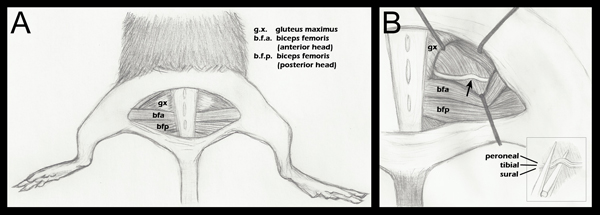
الشكل 1. تخطيطي التشريح أطرافهم هند مهم لسحق العصبية. A. تم إجراء شق الجلد نصف دائري الكشف عن الجهاز العضلي الكامنة. B. وقد تم فصل الجهاز العضلي الألوية، وكشفت عن العصب الوركي (الخطوة 2.4 أعلاه). سهم يدل على موقع سحق تقريبي. ويظهر وضع ضام كمرشد عام، ويتم ضبط خلال كل عملية جراحية لتخفيف تصور من الوركي ونهج ملقط مرقئ لسحق B (الشكل): التنسيب للالوركي في الفك السفلي للملقط مرقئ قبل سحق (الخطوة 2.5 أعلاه). وصفت كراسات منفصلة لتثبت أنها ليست متجاورة أفقيا، ولكن ليس عموديا، وخلال التدافع. رغم مضي ثلاثة fascوصفت icles في هذا المخطط، يمكن للمرء أيضا أن نرى ملزمة الرابع، وفرع مفصلي من الشظوية. لرسم تشريحي أكثر تفصيلا لأنماط متفرعة من العصب الوركي ملزمات البعيدة إلى حد التدافع، يرجى الرجوع إلى تشريح غرين من الجرذ، الشكل 188 17.
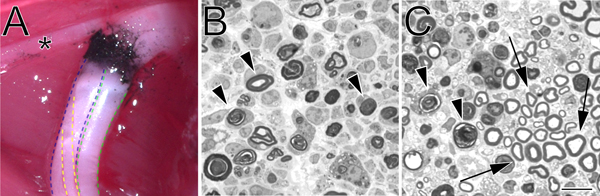
الشكل 2. موقع سحق الكربون ملحوظ في الوضع الطبيعي وزرقة الطولويدين الملطخة أقسام شبه رقيقة، من العصب الوركي المسحوقة. ألف مثال على موقع التدافع في الموقع (أطرافهم هند اليسار). أسود الكربون يدل على موقع التدافع. النجمة يمثل فرع من العصب قصبي أن يعصب عضلات الفخذ، وتقوم بدور مفيد معلما أثناء الجراحة سحق. ويرد تقسيم عظام الساق من العصب الوركي في الزرقاء، والشظوية في الخضراء، وربلي في. أقسام الصفراء شبه رقيقة باء يدل على سحق الكامل مع قوة أداء مرقئPS. جيم شبه رقيقة المقاطع مما يدل على سحق ناقصة يؤديها مع ملقط الزاوية. في كل من صور وتتميز ملامح التحول المايلين مع رؤوس سهام. في لوحة سهام C بمناسبة أمثلة لمحات المايلين الحفاظ عليها ومجموعة من المحاور يدخر. شريط المقياس 10 ميكرومتر.
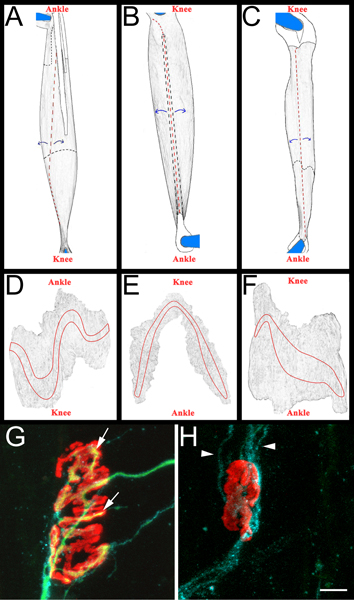
الشكل 3 الجامع التخطيطي جبل العضلات وNMJs ممثل AC:. الصور المقدمة من مؤسسة كهرباء لبنان (A)، الشظوية الطويلة (B)، والنعلية (C) بعد إزالة العضلات من طرف هند. عضلات المعروضة هي من حق الطرف الخلفيتين. وترد أيضا في الركبة والكاحل التوجه التشريحية للرجوع اليها. يتم تلوين البيض والأوتار المبينة في خط أسود متين عند وضعه على الجزء العلوي من عضلة. وترد هم في خط أسود تبددت عندما يمتد تحت العضلات. وترد التخفيضات في الحمراء الخطوط المتقطعة.ومقشر العضلات بعيدا عن مواقع المعالم، كما يتضح من الأسهم الزرقاء، وضعفت في وقت لاحق. بعد التخفيف، يتم فصل العضلات من المسامير من خلال خفض حول ما تبقى من الأوتار دبس DF:. الصور المقدمة من العضلات جبل كامل بعد إزالة النسيج الضام واللاحقة رقيق. وترد الفرق endplate على كل عضلة GH: العضلة النعلية جبل كامل 14 يوما بعد سحق العصب الوركي مما يدل إعادة معصب (G) والمزالة التعصيب (H) تقاطعات العصبية والعضلية. في هذه اللوحات، NMJs، محاور عصبية، وخلايا شوان وتصور على النحو الموصوف أعلاه في القسم 5.5.1. مستقبلات أستيل هي الأحمر، الأخضر محاور عصبية، وشوان خلية العمليات الزرقاء. في لوحة G، وتبين الأسهم مناطق NMJ التي تم إعادة معصب من محور عصبي. في لوحة النصال H تشير إلى GAP-43 خلية شوان إيجابي العمليات. لاحظ عدم وجود محاور عصبية. شريط المقياس 10 ميكرومتر.
Access restricted. Please log in or start a trial to view this content.
Discussion
قدمنا وسيلة للحصول على كامل موثوق سحق العصب الوركي مع الدقيق وسم من موقع التدافع. كما ذكر سابقا، الوركي سحق العصب هو نموذج شائع للإصابة الأعصاب الطرفية في الفئران والجرذان. على الرغم من أن كل طريقة من سحق له مزاياه وعيوبه، وجدنا هذه الطريقة تنتج سحق الكاملة التي ت?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح K08NS065157 (إلى TAF) وبالإضافة إلى ذلك، فإن مركز جامعة بنسلفانيا لاضطرابات العظام والعضلات، جائزة P30AR050950 عدد من المعهد الوطني لالتهاب المفاصل، أمراض العضلات والعظام ودعمت الجلد، وهذا العمل (TAF وستيفن شيرر S.). وفي الختام، أيد Shriners الأطفال البذور مركز تمويل البحوث (TAF) هذا العمل. نود أن نعترف الدكتور يونغ جين الابن لتظاهرهم في البداية كل إجراء جبل ايمي وكيم ألف لتقديم المساعدة لها في انتاج الرسومات من الشكل رقم 1.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم (وصف / كمية) | المزود | فهرس العدد | |
| مصغرة مع المقص رقم 0000 بليد | Roboz | RC-5903 | |
| نير مزيل الشعر (9 أونصة.) | الكنيسة وشركاه دوايت، المؤتمر الوطني العراقي. | N / A | |
| فرك Betadine الجراحية (1 جالون) | فيشر العلمية | 19066452 | |
| مرهم للعين (1 أوقية). | فيشر العلمية | 19082795 |
أدوات جراحية:
| اسم (وصف / كمية) | المزود | فهرس العدد |
| FST 250 حار حبة معقم | أدوات العلم غرامة | 18000-45 |
| قزحية مقص (11 سنتيمترا) | الآلات الدقيقة العالم | 500216 |
| بوتس سميث الملقط (مستقيم؛ 18cm؛ 1X2 الأسنان) | أدوات العلم غرامة | 11024-18 |
| مكفرسون، Vannas مقص (ريش ملم 5) | الآلات الدقيقة العالم | 14124-G |
| دومون # 5 الملقط - Dumoxel ستاندرد تلميح | أدوات العلم غرامة | 11252-30 |
| دومون # 5/45 الملقط - Dumoxel ستاندرد تلميح | أدوات العلم غرامة | 11251-35 |
| المرقأة الجميلة جدا (مستقيم؛ السطوح الملساء في الداخل) | أدوات العلم غرامة | 13020-12 |
| مسحوق الكربون المنشط (500 غرام) | فيشر العلمية | C272-500 |
| حجم 6-0 خيوط مع C-1 الإبرة (العقيمة، الحرير، أسود، مزين،غير قابل للامتصاص، 18 "طول؛ صندوق من 36) | Roboz | SUT، 1073-1011 |
| منعكس مطبق كليب (لمدة 9 مقاطع مم) | الآلات الدقيقة العالم | 500345 |
| 9MM الفولاذ المقاوم للصدأ لقطات رد الفعل (100/box) | الآلات الدقيقة العالم | 500346 |
رعاية الحيوان:
| اسم (وصف / كمية) | المزود | فهرس العدد |
| 0.9٪ كلوريد الصوديوم حقن (مجاني الحافظة، 20 مل) | هوسبيرا | 0409-4888-20 |
| نظام كامل مع التحقيق غطاء Homeothermic مرنة (متوسطة، و 115 فولت، 60 هرتز) | هارفارد جهاز | 507222F |
الجراحية المنهاجم والكامشات:
(تم شراؤها في متجر لاجهزة الكمبيوتر المحلي)
| اسم (وصف /) | كمية |
| الفولاذ المقاوم للصدأ منهاج (ناعم، ~ 12 "X12" X1 / 8 ") | 1 |
| مغناطيسات زر (مثال: الكسوف E825) | 3 |
| مسامير الصلب غير القابل للصدأ (3 "لونغ، القطر وتصميما من قبل مغناطيسات زر) | 3 |
| غير القابل للصدأ البندق الصلب (الحجم لاحتواء مسامير) | 9 |
| الأربطة المطاطية (التوتر الخفيفة) | 3 |
| حشرة الدبابيس (كلاهما ينتهي بينت إلى نموذج خطاف) | 3 |
شبه يخفف:
| اسم (وصف / كمية) | المورد </ قوي> | فهرس العدد |
| لامتصاص العرق (1 كلغ) | سيغما الدريخ | P6148-1KG |
| ثنائي القاعدة فوسفات الصوديوم اللامائية (500 غرام، وتستخدم لإعداد العازلة الفوسفات) | فيشر العلمية | S375-500 |
| صوديوم فوسفات أحادى اللامائى (1 كغم؛ تستخدم لإعداد العازلة الفوسفات) | فيشر العلمية | AC38987-0010 |
| غلوتارالدهيد (50٪، 10 × 10 مل) | تيد بيلا، شركة | 18431 |
| رباعي أكسيد الأوزميوم (مائي 4٪، 10 × 10 مل) | تيد بيلا، شركة | 18465 |
| أكسيد البروبيلين (450 مل) | تيد بيلا، شركة | 18601 |
| تضمين 812 (كيت، لكتل الصلب / عالية التباين صورة) | علوم المجهر الإلكتروني | 14120 |
| Toluidiشمال شرق الزرقاء (25 ز) | تيد بيلا، شركة | 19451 |
كامل تحضير العضلات وجبل المناعية:
| اسم (وصف / كمية) | المزود | فهرس العدد |
| لامتصاص العرق (1 كلغ) | سيغما الدريخ | P6148-1KG |
| ثنائي القاعدة فوسفات الصوديوم اللامائية (500 غرام، وتستخدم لإعداد العازلة الفوسفات) | فيشر العلمية | S375-500 |
| صوديوم فوسفات أحادى اللامائى (1 كغم؛ تستخدم لإعداد العازلة الفوسفات) | فيشر العلمية | AC38987-0010 |
| جيش صرب البوسنة 10٪ مخفف / الحل حجب (200 مل) | Kirkegaard بيري والمختبرات، وشركة | 50-61-00 |
| تريتون X-100 (100 مل) | نقطة العلمية للإعلام | 9002-93-1 |
| جليكاين، 98٪ (1 كلغ) | فيشر العلمية | AC12007-0010 |
| الأنسجة تيك البرد أكتوبر مجمع (حالة من 12، 4 زجاجات أونصة) | فيشر العلمية | 14-373-65 |
| Sylgard DOW 170 (2 كيت بالرطل) | فيشر العلمية | NC9492579 |
| غير القابل للصدأ الدبابيس الحشرات الصلب، حجم 1 (100/pkg) | أدوات العلم غرامة | 26001-40 |
| Tetramethylrhodamine-A-بنغاروتوكسين (0.5 ملغ) | سيغما الدريخ | T0195-.5MG |
| جسم الفأر وحيدة النسيلة ضد SMI-312 (0.1 مل) | كوفانس | SMI-312R |
| جسم الفأر وحيدة النسيلة ضد SV2 (0.1 مل) | الدراسات التنموية ورم هجين بنك (DSHB) | SV2 |
| أرنب بولينسيلي الأجسام المضادة ضد 43-GAP | نوفوس البيولوجية | NB300-143 |
| Flourescein مترافق عنزة المضادة للماوس مفتش الحكومة، Fcγ الفئة الفرعية 1 محددة | جاكسون ImmunoResearch | 11 5-095-205 |
| DyLight 649 مترافق حمار المضادة للأرنب مفتش | جاكسون ImmunoResearch | 711-495-152 |
| 4 '،6-diamidino-2-phenylindole (دابي، dilactate، و 10 ملغ) | إينفيتروجن | D3571 |
| Vectashield التركيب متوسطة (10 مل) | ناقلات مختبرات | H-1000 |
| Superfrost زائد شرائح المجهر (الأبيض، الحجم: 75 × 25 مم، حزمة من 144) | فيشر العلمية | 12-550-15 |
| Fisherfinest النظارات غطاء بريميوم (الحجم: 40 × 22 مم؛ حزمة من 1 أوقية.) | فيشر العلمية | 12-548-5C |
References
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved