JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
전체 마운트 근육 분석에 의한 재현성 마우스 좌골 신경 크러시와 중생의 후속 평가
요약
이 보고서에서는 마우스 좌골 신경을 파멸시키는 방법을 설명합니다. 이 방법은 쉽게 사용할 수 hemostatic 집게를 사용하여 쉽고 reproducibly 전체 좌골 신경 호감을 생산하고 있습니다. 또한 좌골 신경 호감 후 신경 재생의 분석에 적합한 근육 전체가 마운트를 준비하는 방법을 설명합니다.
초록
말초 신경계 (PNS)의 중생은 널리 인간의 질병에 그것의 관련성을함으로써 가능한 CNS 재생 1의 실패를 계몽 PNS의 뉴런에 의해 탑재된 강력한 재생 반응을 이해하는 모두 공부하고 있습니다. 좌골 신경 호감 (axonotmesis)는 설치류 2 말초 신경 손상의 가장 일반적인 모델 중 하나입니다. 그 중생은 3,4 최적 수 있도록 인터럽트에게 반해 모든 axons하지만 Schwann 세포 기저 laminae는 보존됩니다. 이 조사가 정확하게 Schwann 세포 및 기저 laminae 사 모두와 상호 작용하는 성장 축삭의 능력을 공부하실 수 있습니다. 쥐 실험은 일반적으로 신경 호감을 위해 선호하는 동물 모델되었습니다. 그들은 널리 사용할 수 있으며 자신의 lesioned 좌골 신경은 인간의 신경 병변 5,4의 합리적인 근사치를 제공합니다. 쥐의 신경보다 크기가 작은 있지만, 마우스 신경은 많은 유사한 자질을 가지고 있습니다. 가장 중요한 것은 그래도 mous전자 모델 때문에 유전자 변형 라인의 넓은 가용성을 증가 가치는 이제 신경 재생 6, 7에 대한 중요한 개별 분자의 상세한 해부을 허용합니다. 이전 수사관은 단순 직각 포셉, 냉장 포셉, hemostatic 포셉, 혈관 클램프, 그리고 탐정 설계 클램프 8,9,10,11,12 포함한 신경 호감이나 부상을 생산하기 위해 여러 방법을 동원했습니다. 수사관은 또한 봉합, 탄소 입자와 형광 구슬 13,14,1 포함한 부상 사이트를 표시하는 다양한 방법을 동원했습니다. 우리는 정확하고 영구가 좋은 hemostatic 포셉 및 마킹 이후 탄소 호감이 사이트를 방문하여 호감이 사이트의 마킹으로 reproducibly 전체 좌골 신경 호감을 얻는 우리의 방법을 설명합니다. 좌골 신경 호감 절차의 설명의 일환으로 우리는 또한 근육 전체의 비교적 간단한 방법을 포함하는 것은 우리가 이후에 재생을 계량하는 데 사용할 탑재합니다.
프로토콜
1. 동물 과목
1.1. 치료
- 모든 동물의 절차는 고통과 불편을 최소화하기 위해 취한 조치로, 지방 기관의 동물 관리 및 윤리위원회의 승인을 보건 가이드라인의 사용 및위원회와 국립 연구소에 따라서 수행되어야한다.
- 우리 쥐들이 12 시간 역방향 빛과 어둠의 사이클에 대한 온도 제어 조건에서 지내게, 수사관 마우스 차우와 물 광고 libitum 동안 시작했다.
- 좌골 신경 호감이 수행될 때 성인 중생의 연구 내용은 마우스 연령 적어도 6 주가 걸릴한다. 이 나이 polyneural 신경근육학 분기점의 가지치기가 자리를 차지할되는 시간을 넘어선 것이다.
- 이 실험에서 우리는 6-8주 오래된 C57BL / 찰스 리버로부터 얻은 6 생쥐를 사용했습니다. 좌골 신경 호감 (예 : 축삭의 성장 속도) 이후에 재생을 비교하면 axonal 중생의 차이가되지 않은 것처럼 마우스 변종이 동일해야합니다다른 근친 변종 15,16 사이 에드. 유전자 조작 생쥐가 사용될 경우 littermate 컨트롤이 가장 적합합니다.
1.2. 외과 준비
- 동물 intraperitoneal 주사를 통해 케타민 (100 밀리그램 / kg)과 xylazine (10 밀리그램 / ㎏)의 칵테일을 사용하여 수술에 대한 깊은 anesthetized 있습니다. 각 동물은 또한 수술의 고통을 최소화하기 meloxicam의 피하 주사 (10 밀리그램 / ㎏)받습니다.
- 두 엉덩이쪽에 신중하게 수술 가위 (Roboz, RC-5903) 및 왁스는 나이르 머리 제거 크림 (현지 약국에서 발견)와 함께 완료를 사용하는 면도있다.
- 피부 소독면 스쳐 applicators 및 betadine 수술 스크럽 (피셔 과학, 19066452)를 사용 정화입니다.
- 안과 연고 (피셔 과학, 19082795)은 소독면 스쳐 applicators를 사용하여 눈에 적용됩니다.
- 마우스는 미리 온수 homeot를 보관되었습니다 그 밑에, 깨끗한 스테인레스 강판에 배치됩니다hermic 담요 시스템 (하버드 장치, 507222F). 동물 온도는 37에서 관리하고 있습니다 ° C.
- 모든 사지는 무릎 관절이 신체 (그림 1, 패널)과 직각을 만드는 것이 대칭 때문에 두 다리 위치를 위해 총감독과 함께 아래로 녹화됩니다.
- 수술 부위가 무균 드레이프로 덮혀 있습니다. 모든 악기는 압력솥이나 고온 비드 살균 (파인 과학 도구, 18000-45)와 외과 의사들이 마스크, 가운 및 멸균 장갑을 끼고 소독을하고 있습니다.
2. 재현성 좌골 신경 호감
- 준비 후, 중간선 (그림 1)에 걸쳐 반 원형 절개는 피부에서 만들어졌다. 피부는 부드럽게 기본 근육의 해부하고, 절차를 수행하는 동안 밖에 나가 있으여 접혀있다. 그것은 절차를 수행하는 동안 0.1 ML 멸균 식염수 (Hospira, 0409-4888-20)의 애플 리케이션을 사용하여 촉촉한 보관됩니다.
- 대둔근에와 팔뚝 femori의 앞부분은 머리 사이 fascial 비행기 열기S는 좌골 신경 (그림 1, 패널)을 보여준다. 수술 컨트롤은 contralateral 좌골 신경이 노출되어 동원했지만 그대로 남아 있어야합니다. gluteal 근육 그런 다음 다시 반대와 6-0 꼰 실크, 비 흡수성 봉합을 (Roboz, SUT-1073년에서 1011년까지)를 사용하여 봉합합니다.
- 실험적 좌골 신경은 다음 시각화 (그림 1, 패널 B)을 완화하기 위해 자리에 견인기와 같은 방식으로 노출됩니다. 견인기는 사용하기 전에 소독을하고 있습니다.
참고 : 견인기 시스템은 상용 있지만, 그들은 종종 매우 비쌉니다. 우리는 저렴한 하드웨어 용품 및 곤충 핀을 (자료 섹션을 참조)을 사용하여 만족스러운 리트 렉터 시스템을 만들 수있었습니다. - 좌골 신경은 부드럽게 iridectomy 가위를 사용하여 주위 결합 조직에서 해방됩니다.
- 좋은 45분의 5 (파인 과학 도구, 11251-35) 포셉 사용하여 신경이 슈퍼 벌금 hemostatic 포셉의 아래쪽 턱 (파인 과학이 너무에 배치됩니다혹시, 13020-12). 세 fascicles는 순차적 아니라 서로의 꼭대기 (그림 1, 삽입된 페이지 B)에 정렬됩니다. hemostatic 포셉들은 일각에서 1.5 mm에서 마르크와 함께 새겨져있다. 좌골의 바깥쪽 부분은 호감 전에이 표시가있는 라인에 배치됩니다. 이것은 균일 너비 호감을 보장하고, 분쇄 력으로 인해 평평 때 신경이 hemostatic 포셉의 문턱 넘어 연장되지 않습니다. 신경이 포셉 팁 초월해 경우 신경이 부분적으로만 짓눌린됩니다.
- 호감은 좌골 신경의 경로를 대략 스레드에 의해 측정된대로, 세 번째 발가락부터 45mm에서 신경에 수직 이루어집니다. 신경은 hemostatic 포셉 3 클릭에 15 초간 한번 짓눌린있다. 치료는 신경을 운동하지 가져옵니다. hemostats가 다시 오픈하면, 전체 신경이 호감이가는 사이트에서 반투명이어야합니다.
- 에서 미리 빠져있다 hemostatic 포셉의 두 번째 쌍 (첫번째와 동일)분말 탄소 (피셔 과학, C272-500)은 호감 사이트를 표시하는 데 사용됩니다. 신경은 3 클릭에 15 초간 같은 호감이 사이트에 짓눌린있다. 마킹 없음 탄소는 초기 호감의 경계 넘어 확대해서는 안됩니다. 호감이 사이트의 정확한 마킹이 필요한 경우에 특히 중요합니다. 사용하기 전에 탄소 분말은 두 시간 동안 자외선에 노출 소독을하고 있으며, 이후 무균 기술을 사용하여 처리됩니다.
- 면 탄소의 포셉을 미리 찍어하지만 외과 사이트에서 널리 탄소를 배제, 포셉은 분말 탄소에 오픈하고 나서 부드럽게 (그러나 클릭하지 않음) 폐쇄 다물고, 그리고 hemostats의 외부에있는 탄소는 멸균 거즈를 사용하여 소멸된다 . 포셉는 분쇄 표면이 균일하게 가루 탄소로 코팅되어 있는지 확인하기 위해 적어도 3 배 배율 하에서 선택되어 있는지 확인하십시오. 필요하다면, 그들은 다시 감소하고 피곤합니다.
- gluteal 근육은 다시 반대와 contralateral 측면과 같은 방식으로 봉합된다.
- 마지막으로, 피부 절개는 9mm 반사 클립 (; : 500,345 Applier 세계 정밀 계측기, 500,346)를 사용하여 닫힙니다. 9mm 반사 클립 운동, 작은 반사 클립 또는 6-0 봉합 (Roboz, SUT-1073년부터 1011년까지)을 제한하려면 판단될 경우 대신 사용할 수 있습니다.
3. 수술 케어
- 그들은 운동의 흔적을 보여주 ° C까지 절차에 따라 동물 37 손난로에 표시됩니다.
- 그들은 다음 물과 음식 히드로겔 및 침수 식품의 형태로 바닥에 쉽게 액세스할 수있는 그들의 집을 케이지로 다시 이동됩니다.
4. 세미 씬 준비
- pentobarbital의 과다 복용 (300 밀리그램 / ㎏)에 이어 다리 근육은 좌골 신경 *을 폭로 제거됩니다. 현장에 남아있는 신경으로, 뒷다리 및 엉덩이 부분은 30 분 동안 얼음에 0.1 M 인산 완충액의 2 % paraformaldehyde와 2 % 글루 테르 알데히드에 열중하고 있습니다.
* 전체 마운트 근육 준비를 완료하면 근육이 수확입니다좌골 신경을 노출하기 전에 에드. - 신경 신중 근위 끝에만을 처리하기 위해 총감독으로 제거됩니다. 그렇다면 신경이 세 개의 추가 시간 동안 동일한 정착액에 사후 고정입니다.
- 고정 후 신경이 0.1 M 인산 완충액으로 세 번 씻어서있다.
- 신경은 1 시간 0.1 M 인산 완충액으로 2 % 오스뮴의 tetroxide에 열중하고 있습니다.
- 신경 그러면 점차 농축 에탄올의 연속 침지 (50 %, 70 %, 80 %, 95 %, 100 %, 100 %, 100 %)에 의해 탈수있다. 각 침지은 15 분입니다.
- 탈수 신경은 세 분마다 프로필렌 산화물에 두번 incubated있다.
- 그러면 신경이 프로필렌 옥사이드의 1:1 혼합물에 열중하고 (보통 하룻밤) 적어도 6 시간 동안 812 어젯 서비스하고 있습니다.
- 그러면 신경이 프로필렌 옥사이드의 2시 1분 혼합물에 잠겨과 하룻밤 812 어젯.
- 마지막으로, 신경이 6 시간 동안 순수 퍼가기 812에 잠겨 후 적절한 금형 및 바에 포함된48 시간 동안 60 ° C에서 ked.
- 1.0 μm의 섹션은 toluidine과 청색 유리 나이프와 스테인드 함께 Ultracut UCT ultramicrotome (Leica)를 사용 호감 사이트에서 설정된 거리에서 말초 신경 유세에서 해고된다. 얇은 부분은 또한 전자 현미경에 의한 ultrastructure의 시험 생산 수 있습니다.
5. 전체 마운트 근육 준비
- 첫 번째 생쥐는 pentobarbital의 과다 복용 (300 밀리그램 / ㎏)로 희생되고 두 다리는 무릎에서 제거됩니다.
- 뒷다리에있는 네 개의 근육이 분석을 위해 제거됩니다 : tibialis 앞부분 (TA), 신근 digitorum longus의 (편집 판단리스트), soleus 및 peroneus longus.
- 모든 근육은주의 절개를 통해 제거하고 검은 sylgard (피셔 과학, NC9492579) 코팅 접시 자신의 결합 조직을 통해 박혀있다. 그들은 30 분간 4 % paraformaldehyde에 PBS에서 씻어서 다음 해결됩니다.
- TA는 다음 10월 (피셔 과학, 14-3에 박혀 PBS에서 씻어서 있습니다73-65), 그리고 신속하게 아세톤과 드라이 아이스 목욕에 얼어 붙 어서.
- 그것은 -80 ° C에서 전체 마운트 준비가 실패할 경우에 얇은 sectioning 위해 저장됩니다. 일반적으로 조교가 적절한 온 마운트에 비해 너무 두께입니다.
- 편집 판단리스트, soleus 및 peroneus longus은 0.1 M 글리신 * (피셔 과학, AC12007-0010, PBS에 희석)에 배치 PBS에서 3 × 10 분 동안 씻어서하고 30 분 후, 다시 PBS에서 3 × 10 분 씻어서. 그들은 다음, -20에서 정확히 5 분간 얼음 차가운 100 % 메탄올 ° C에서 침묵 PBS에서 3 × 10 분 씻어서, 그리고 알파 - bungarotoxin (PBS에 1:200 희석) 30 분 fluorescently 복합 목욕을하고 있습니다. 근육은 2 % BSA에 1 시간 블록 (KPL, 50-61-00)와 0.2 % 트리톤 X-100 (도트 과학 법인, 9002-93-1) 다음 PBS에서 3 × 10 분 동안 씻어서있다 같은 2% BSA/0.2 %의 트리톤 블록에 희석 일차 항체의 칵테일에서 4 ° C에서 출렁 이는 동안 PBS에서 *와 하룻밤 incubated.
* 미군 병사ycine 및 차단 솔루션은 근육 수확과 같은 날에 만들어 사용하기 전에 실온에서 30~60분 동안 흔들 수 있습니다.- , 마우스 단클론 시냅스 소포 마커 (SV2 DSHB, 1:1000 희석)와 rhodamine 복합 알파, axons과 신경근육학 시냅스를 기념하기 위해, 마우스 단클론 neurofilament 마커의 조합 (1:1000 희석 Covance, SMI-312R)를 사용 - bungarotoxin (시그마 - 올드 리치, 1:200 희석). 반응 Schwann 세포를 표시하기 위해 우리는 토끼 반 GAP-43 (Novus 체액, NB300-143, 1 / 500 희석)을 사용합니다. 일차 항체는 IgG1 나눠 봤는데요 특정 플루오레신 복합 염소 항 마우스 이차 항체와 DyLight 649 복합 당나귀 안티 - 토끼 (1:200 희석 잭슨 ImmunoResearch)과 시각입니다.
- 그 다음날은 근육은 3 × 10 분 동안 PBS에서 씻어서 및 이차 항체에 incubated (2 % BSA/0.2 %의 트리톤 차단 솔루션)를 1:200 희석된다. 그들은 다음 PBS, 구경에 2 × 10 분 씻어서있다그리고 또 10 분 동안 PBS에서 헹굼, 5 분 DAPI에 침지 (탈이온수 300 NM로 희석 Invitrogen, D3571)에 의해 llowed.
- 각 근육 그러면 검은색 sylgard (피셔 과학, NC9492579) 코팅된 배양 접시에서 해부한다. 인테리어 근육 섬유 (그림 3, 패널 AC)를 물러나고하여 처음에는 힘줄 근육 속으로 삽입 지점에서 제거하고 근육 thinned있다. 케어는 endplate 밴드 (그림 3, 패널 DF)를 포함하여 근육의 외부 표면을 유지하기 위해 가져옵니다. 그 결과 근육이 vectashield (벡터 연구소, H-1000) 및 22 플러스 슬라이드 (피셔 과학, 12-550-15)에 탑재되어 투명 매니큐어 날인 X 40mm 유리 coverslips (피셔 과학, 12-548-5C) 양면에. 제대로 endplate 밴드 연락처 coverslip 슬라이드에 장착합니다.
6. 중생을 측정
- 중생이 세 근육 (peroneus, 편집 판단리스트 및 soleus)에 추정 수 있습니다. 우리는 종종 예십사일 신경 호감 후 아민 재생, NMJs의 상당한 비율이 다시 innervated되는 한 번에. 둘 다 이전하고 나중 포인트는 요청을 받고 과학적 질문에 따라도 적합합니다. 각 근육에서 전체 endplate 밴드의 재 innervation을 면밀히 검토합니다. 전용 욕실 얼굴 표면 NMJs가 채점됩니다. 이러한 방식으로, 근육 당 최소한 200 NMJs 신속하게 검사 수 있습니다.
- 근육을 입증하려면 다시 innervation 우리는 '다시 innervation 비율 "을 결정합니다. 분모는 α-bungarotoxin 구속력과 Schwann 세포 GAP-43 immunoreactivity에 의해 표시된대로 denervated 신경근육학 분기점의 번호입니다. 분자는 neurofilament/SV2 immunoreactivity로 표시된 재 innervated NMJs의 번호입니다. 필요한 경우 NMJs는 두 부분 (SV2에 의한 α-bungarotoxin의 불완전 커버 리지) 또는 완전 (SV2에 의한 α-bungarotoxin의 완전한 범위) 다시 innervated으로 분류됩니다. 다시 innervated 및 denervated NMJs의 예를 들어 그림 3, 패널 G와 H는보고.
7. 대표 결과
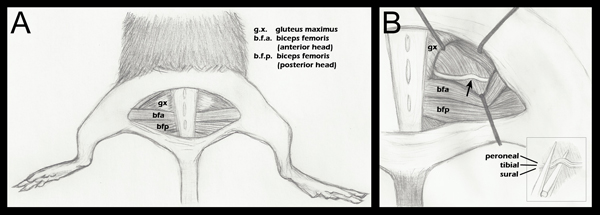
그림 1. 신경 호감 중요한 뒷다리의 해부학 도식. A.이 반 원형의 피부 절개가 근본적인 근육을 공개하였습니다. B. gluteal 근육은 (위의 단계 2.4)로 구분하고, 좌골 신경이 발표되었습니다. 화살표는 대략적인 호감이 사이트를 나타냅니다. 견인기 게재 위치는 일반적인 가이드로 표시되며, 호감이가는 사람을위한 hemostatic 포셉의 좌골과 접근 시각을 완화하기 위해 각각의 수술 중에 조정됩니다 B는 (삽입된 페이지). 막 호감 전에 hemostatic 포셉의 아래턱에있는 좌골 배치 (단계 위의 2.5). 별도 fascicles는 호감을하는 동안이 아닌 수직으로 그들이 수평으로 인접해있다는 것을 입증하는 라벨이 있지만됩니다. 비록 세 fascicles이 다이어그램에 표시된하고, 하나도 사분의 일 분책, peroneal의 관절 지점을 볼 수 있습니다. 좌골 신경의 분기 패턴의 상세한 해부 그림은 호감 지점 말초 fascicles 들어, 쥐, 그림 188 17 그린의 해부학을 참조하십시오.
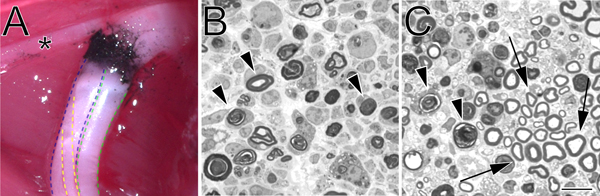
그림 2. 조각 좌골 신경의 현장과 toluidine 푸른 스테인드, 세미 얇은 부분의 탄소 표시된 호감 사이트. A. 원래의 장소에 호감 사이트 (왼쪽 뒷다리)의 예. 블랙 카본은 호감이가는 사이트를 나타냅니다. 별표는 허벅지의 근육을 innervates 및 호감 수술시 유용한 랜드마크 역할을 tibial 신경의 지점을 표시합니다. 좌골 신경의 tibial 부문은 청색, 녹색의 peroneal에 명시된 바와 같이, 노랑. B. 세미 얇은 섹션 sural은 hemostatic 강제로 수행 완전한 호감을 입증하고 있습니다PS. 직각 포셉 수행할 불완전한 호감을 보여주 C. 세미 얇은 부분. 두 이미지에서 degenerating myelin 분석 자료가 화살촉으로 표시됩니다. 패널에서 C의 화살표가 보존 myelin 프로필의 예를와 겪었던 axons의 클러스터를 표시합니다. 스케일 바는 10 μm의입니다.
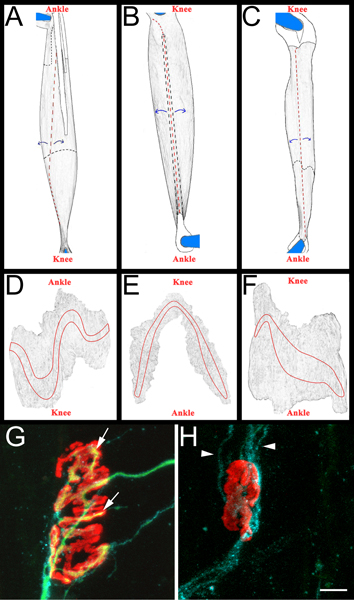
그림 3 전체 마운트 근육의 약도와 대표 NMJs AC :.. 편집 판단리스트 (A) peroneus의 longus (B), 그리고 뒷다리의 탈퇴 이후 soleus (C) 근육의 거라구 이미지. 표시된 근육이 오른쪽 뒷다리부터입니다. 무릎 및 발목의 해부 학적 방향도 참조용으로 제공됩니다. 힘줄 흰색 물들고과 근육 위에 위치했을 때 단단한 검은 라인에 요약되어 있습니다. 그들은 근육 아래에 연장 때 그들은 검은 점선에 요약되어 있습니다. 베인은 빨간색 점선 라인에 표시됩니다.근육은 같은 파란색 화살표로 표시 컷 사이트에서 떨어져 벗겨하고, 이후 thinned있다. 숱이 후, 근육은 고정된 힘줄 중에 남아 주위를 절단하여 핀에에서 분리된 DF가 :. 거라구 이미지는 전체 마운트 근육의 결합 조직 및 숱이 이후의 제거 후. endplate 밴드는 각 근육에 설명되어 있습니다 GH :. 십사일 다시 innervated (G)와 denervated (H) 신경근육학의 분기점을 보여주는 좌골 신경 호감 후 Soleus 전체 마운트 근육. 위의 섹션 5.5.1에서 설명한 것처럼이 패널에서는 NMJs, axons 및 Schwann 세포는 시각입니다. 아세틸콜린 수용체는 axons 녹색 빨간색이며, Schwann 세포는 파란색으로 처리합니다. 패널 G에서 화살표가 축삭으로 다시 innervated되었습니다 NMJ의 영역을 나타냅니다. 패널에서 H의 화살촉은 GAP-43 양성 Schwann 세포 프로세스를 나타냅니다. axons의 부재를 적어 둡니다. 스케일 바는 10 μm의입니다.
Access restricted. Please log in or start a trial to view this content.
토론
우리는 호감이 사이트의 정확한 마킹과 함께 안정적으로 완전한 좌골 신경 호감을 얻을 수있는 방법을 제시했습니다. 이전에 언급했듯이, 좌골 신경 호감은 마우스 및 쥐의 말초 신경 손상의 일반적인 모델입니다. 호감의 각 방법의 장점과 단점을 가지고 있지만, 우리는이 방법을 쉽게 특수 장비 (예 : 특수 클램프 등)을 최소로 표시되었다 완전한 호감을 생산 발견.
호감 방법 ...
Access restricted. Please log in or start a trial to view this content.
공개
우리는 공개 할게 없다.
감사의 말
이 작품은 또한 NIH 교부금 K08NS065157 (TAF까지)에 의해 지원되었다 Musculoskeletal 장애에 대한 펜은 센터, 관절염의 국립 연구소에서 보너스 번호 P30AR050950는 Musculoskeletal와 피부 질환이 작품을 (TAF와 스티븐 S. Scherer) 지원. 마지막으로, Shriners 소아 연구 센터 종자 기금 (TAF)이 작업을 지원합니다. 우리는 처음에는 그림 1의 스케치를 생산하는 그녀의 도움을 전체 장착 절차와 에이미 A. 김 시연을 위해 박사 영 진의 아들을 인정하고 싶습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 이름 (설명 / 수량) | 공급 | 카탈로그 번호 | |
| 번호 0000 블레이드와 미니 클리퍼 | Roboz | RC-5903 | |
| 나이르 헤어 리무버 (9온스) | 교회 드와이트 유한 주식 회사 | N / A | |
| Betadine 외과 스크럽 (1갤런) | 피셔 과학 | 19066452 | |
| 안과 연고 (일온스) | 피셔 과학 | 19082795 |
외과 도구 :
| 이름 (설명 / 수량) | 공급 | 카탈로그 번호 |
| FST 250 핫 비드 살균기 | 파인 과학 도구 | 18000-45 |
| 아이리스 가위 (11cm 길이) | 세계 정밀 계측기 | 500,216 |
| 포츠 - 스미스 포셉 (직선, 18cm, 1x2 치아) | 파인 과학 도구 | 11024-18 |
| 맥퍼슨 - Vannas 가위 (5 밀리미터 블레이드) | 세계 정밀 계측기 | 14124-G |
| 뒤몽 # 5 집게 - Dumoxel 표준 팁 | 파인 과학 도구 | 11252-30 |
| 뒤몽 # 45분의 5 집게 - Dumoxel 표준 팁 | 파인 과학 도구 | 11251-35 |
| 울트라 파인 Hemostats (직선, 부드러운 내부 표면) | 파인 과학 도구 | 13020-12 |
| 분말 활성 탄소 (500 G) | 피셔 과학 | C272-500 |
| C-1 니들 (무균, 실크, 블랙, 꼰와 크기 6-0 봉합비 흡수성, 18 "길이; 36 박스) | Roboz | SUT-1073년부터 1011년까지 |
| 목표 클립 Applier (9mm 클립의 경우) | 세계 정밀 계측기 | 500,345 |
| 9mm 스테인레스 목표 클립 (100/box) | 세계 정밀 계측기 | 500,346 |
동물 케어 :
| 이름 (설명 / 수량) | 공급 | 카탈로그 번호 |
| 0.9 %의 나트륨 염화물 주입 (방부제 무료, 20 ML) | Hospira | 0409-4888-20 |
| 유연한 프로브를 갖춘 Homeothermic 담요 시스템 (매체, 115 VAC, 60 Hz에서) | 하버드 장치 | 507222F |
외과 PlatforM 및 견인기 :
(지역 철물점에서 구입)
| 이름 (설명 /) | 양 |
| 스테인레스 스틸 플랫폼 (가공된; ~ 12 "x12"1 개 / 8 ") | 일 |
| 버튼 자석 (예 : 이클립스 E825) | 3 |
| 스테인레스 볼트 (3 "긴, 단추 자석에 의해 결정 직경) | 3 |
| 스테인레스 스틸 너트 (볼트 들어갈 크기) | 9 |
| 고무 밴드 (라이트 장력) | 3 |
| 곤충 핀 (끝 모두가 후크를 형성 구부 러) | 3 |
세미 된 것 같아 :
| 이름 (설명 / 수량) | 공급 </ strong>을 | 카탈로그 번호 |
| Paraformaldehyde (1 ㎏) | 시그마 - 올드 리치 | P6148-1KG |
| 나트륨 인산 이염 무수 (500g, 인산 버퍼를 준비하는 데 사용됩니다) | 피셔 과학 | S375-500 |
| 나트륨 인산 일염기의 무수 (1kg, 인산 버퍼를 준비하는 데 사용됩니다) | 피셔 과학 | AC38987-0010 |
| 글루 타 알데히드 (50 %, 10 × 10 ML) | 테드 펠라 주식 회사 | 18,431 |
| 오스뮴의 Tetroxide (4 % 수용액, 10 × 10 ML) | 테드 펠라 주식 회사 | 18,465 |
| 프로필렌 산화물 (450 ML) | 테드 펠라 주식 회사 | 18,601 |
| 퍼가기 812 (키트, 하드 블록 / 높은 이미지 대비를위한) | 전자 현미경 과학 | 14,120 |
| ToluidiNE 블루 (25 G) | 테드 펠라 주식 회사 | 19,451 |
전체 마운트 근육 준비 및 Immunohistochemistry :
| 이름 (설명 / 수량) | 공급 | 카탈로그 번호 |
| Paraformaldehyde (1 ㎏) | 시그마 - 올드 리치 | P6148-1KG |
| 나트륨 인산 이염 무수 (500g, 인산 버퍼를 준비하는 데 사용됩니다) | 피셔 과학 | S375-500 |
| 나트륨 인산 일염기의 무수 (1kg, 인산 버퍼를 준비하는 데 사용됩니다) | 피셔 과학 | AC38987-0010 |
| 10% BSA의 희석제 / 차단 솔루션 (200 ML) | Kirkegaard & 페리 연구소 주식 회사 | 50-61-00 |
| 트리톤 X-100 (100 ML) | 다트 과학 법인 | 9002-93-1 |
| 글리신, 98 % (1kg) | 피셔 과학 | AC12007-0010 |
| 조직 - 테크 Cryo 10 월 컴파 운드 (12시, 4 오즈의 마법사 '병) | 피셔 과학 | 14-373-65 |
| Sylgard DOW 170 (2파운드 키트) | 피셔 과학 | NC9492579 |
| 스테인레스 스틸 곤충 핀, 사이즈 1 (100/pkg) | 파인 과학 도구 | 26001-40 |
| Tetramethylrhodamine-A-Bungarotoxin (0.5 밀리그램) | 시그마 - 올드 리치 | T0195-.5MG |
| SMI-312 (0.1 ML)에 대해 마우스 단클론 항체 | Covance | SMI-312R |
| SV2 (0.1 ML)에 대해 마우스 단클론 항체 | 발달 연구 하이 브리 도마 은행 (DSHB) | SV2 |
| 토끼 폴리GAP-43 반대 clonal 항체 | Novus 체액 | NB300-143 |
| Flourescein 복합 염소 안티 - 마우스 IgG, 특정 Fcγ 서브 클래스 1 | 잭슨 ImmunoResearch | 11 5-095-205 |
| DyLight 649 복합 돈키 안티 - 토끼 IgG | 잭슨 ImmunoResearch | 711-495-152 |
| 4 ', 6 diamidino-2-phenylindole (DAPI, dilactate, 10 밀리그램) | Invitrogen | D3571 |
| Vectashield 장착 중형 (10 ML) | 벡터 연구소 | H-1000 |
| Superfrost 플러스 현미경 슬라이드 (화이트, 사이즈 : 75 X 25mm, 144 팩) | 피셔 과학 | 12-550-15 |
| Fisherfinest 프리미엄 커버 안경 (크기 : 40 X 22mm, 1 온스 팩.) | 피셔 과학 | 12-548-5C |
참고문헌
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유