Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Reproductible écrasement du nerf sciatique de souris et l'évaluation subséquente de la régénération par l'analyse du Mont muscle entier
Dans cet article
Résumé
Dans ce rapport, nous décrivons une méthode pour écraser la souris nerf sciatique. Cette méthode utilise facilement disponibles pinces hémostatiques et facilement et de façon reproductible produit complet écrasement du nerf sciatique. En outre, nous décrivons une méthode pour préparer montures de muscles entiers appropriés pour l'analyse de la régénération nerveuse après écrasement du nerf sciatique.
Résumé
La régénération dans le système nerveux périphérique (SNP) est largement étudié à la fois pour sa pertinence à la maladie humaine et de comprendre la réponse robuste régénérative montée par les neurones du SNP ce qui pourrait éclairant les échecs de la régénération du SNC 1. Écrasement du nerf sciatique (axonotmésis) est l'un des modèles les plus courants de lésion du nerf périphérique chez les rongeurs 2. Broyage interrompt tous les axones, mais lames de cellules de Schwann basale sont conservés afin que la régénération est optimal 3,4. Cela permet à l'enquêteur d'étudier précisément la capacité d'un axone en croissance pour interagir avec la cellule de Schwann et lames basales 4. Les rats ont généralement été les modèles animaux préférés pour écrasement du nerf expérimentale. Ils sont largement disponibles et leur sang-froid lésé sciatique fournit une approximation raisonnable de lésions nerveuses humaines 5,4. Bien que plus petit en taille que chez le rat nerf, le nerf de la souris a de nombreuses qualités similaires. Mais surtout, énormemodèles électroniques sont de plus en plus précieux en raison de la grande disponibilité de lignées transgéniques permet maintenant une dissection détaillée des molécules individuelles critiques pour la régénération du nerf 6, 7. Enquêteurs antérieures ont utilisé de multiples méthodes pour produire un écrasement du nerf ou d'une blessure, y compris de simples pinces angulaires, pinces, pinces hémostatiques réfrigérés, pinces vasculaires, et les colliers enquêteur conçus 8,9,10,11,12. Les enquêteurs ont également utilisé diverses méthodes de marquage du site, y compris des blessures de suture, des particules de carbone et de billes fluorescentes 13,14,1. Nous décrivons notre méthode pour obtenir un écrasement du nerf sciatique reproductible complète des informations exactes et persistante de marquage de l'écrasement site à l'aide d'une pince fine hémostatiques et de carbone suite à l'écrasement du site de marquage. Dans le cadre de notre description de la procédure écrasement du nerf sciatique, nous avons également inclus une méthode relativement simple de l'ensemble des muscles que nous utilisons pour monter ensuite de quantifier la régénération.
Protocole
1. Expérimentation animale
1,1. Traitement
- Toutes les procédures d'animaux doit être effectué avec l'approbation de protection des animaux de l'institution locale et Comité d'éthique et conformément à l'utilisation et du Comité et les National Institutes of Health des lignes directrices, avec les mesures prises pour minimiser la douleur et l'inconfort.
- Nos souris ont été logés dans des conditions contrôlées de température sur un feu de recul de 12 heures et le cycle de sombre, alors que la souris nourries chow et l'eau ad libitum.
- Pour les études de régénération des adultes, les souris doivent être d'au moins 6 semaines d'âge lorsque l'écrasement du nerf sciatique est effectué. Cet âge est au-delà de la date à laquelle la taille des jonctions neuromusculaires polyneural lieu.
- Dans ces expériences, nous avons utilisé 6-8 semaines C57BL vieille / 6 souris acquises auprès de Charles River. Lorsque l'on compare la régénération après écrasement du nerf sciatique (ex: taux de croissance des axones) des souches de souris devraient être les mêmes, que les différences dans la régénération axonale ont été de ne pased entre les différentes souches consanguines 15,16. Si les souris génétiquement manipulées doivent être utilisés, les contrôles sont même portée la plus appropriée.
1,2. Préparation chirurgicale
- Les animaux sont profondément anesthésié pour une chirurgie à l'aide d'un cocktail de kétamine (100 mg / kg) et de xylazine (10 mg / kg) par injection intrapéritonéale. Chaque animal reçoit également une injection sous-cutanée de meloxicam (10 mg / kg) afin de minimiser la douleur postopératoire.
- Les deux membres postérieurs sont soigneusement rasé à l'aide d'un coupe-chirurgicales (Roboz, RC-5903) et l'épilation est terminée avec de la crème Nair épilation (qui se trouve à la pharmacie locale).
- La peau est nettoyée à l'aide des applicateurs de coton stérile à embout et Betadine scrub chirurgicale (Fisher Scientific, 19066452).
- Pommade ophtalmique (Fisher Scientific, 19082795) est appliqué sur les yeux en utilisant des applicateurs de coton stérile à embout.
- La souris est placée sur une plaque d'acier inoxydable propre, dans lesquelles a été placé un homeot préchauffésystème de couverture hermic (Harvard Apparatus, 507222F). La température des animaux est maintenue à 37 ° C.
- Tous les membres sont enregistrés vers le bas, en prenant soin de positionner les membres postérieurs symétriquement de telle sorte que l'articulation du genou forme un angle droit avec le corps (Figure 1, partie A).
- Le champ opératoire est recouverte d'un champ stérile. Tous les instruments sont stérilisés à l'autoclave ou à chaud de stérilisation talon (Outils belle science, 18000-45) et le chirurgien porte un masque, une blouse et des gants stériles.
2. Reproductible écrasement du nerf sciatique
- Après la préparation, d'une incision en demi-cercle dans la ligne médiane (figure 1) est faite dans la peau. La peau est légèrement disséqué de la musculature sous-jacente, et replié pour rester hors de la voie pendant la procédure. Il est maintenu humide en utilisant des applications de 0,1 mL de solution saline stérile (Hospira, 0409-4888-20) au cours de la procédure.
- Ouverture le plan aponévrotique entre le muscle grand fessier et la tête antérieure du biceps femoris révèle le nerf sciatique (figure 1, tableau A). Pour un contrôle chirurgical, le nerf sciatique controlatéral doit être exposé et a mobilisé, mais a laissé intacte. La musculature fessière est ensuite ré-opposition et suturé à l'aide d'une soie tressée 6-0, non résorbables (Roboz, SUT-1073-1011).
- Le nerf sciatique expérimentale est ensuite exposée de la même façon, avec écarteurs en place pour faciliter la visualisation (Figure 1, partie B). Les écarteurs sont stérilisés avant leur utilisation.
Remarque: bien que les systèmes rétracteurs sont disponibles dans le commerce, ils sont souvent très coûteux. Nous étions en mesure de faire un système enrouleur satisfaisante en utilisant des fournitures de matériel peu coûteux et épingles insectes (voir la section Matériaux). - Le nerf sciatique est ensuite délicatement libéré de tissu conjonctif qui entoure l'aide de ciseaux iridectomie.
- Utilisation d'une amende de 5/45 (Science Tools Beaux-11251-35) forceps, le nerf est placé sur la mâchoire inférieure d'une pince ultra-fines hémostatiques (Sciences bien aussils, 13020-12). Les trois fascicules sont séquentiellement alignée, non sur le dessus les uns des autres (Figure 1, encart B). Les pinces hémostatiques ont été gravés avec une marque à 1,5 mm de leur extrémité. La partie la plus externe de la sciatique est placé en ligne avec cette marque avant l'écrasement. Ceci assure un écrasement de largeur uniforme, et que le nerf ne s'étend pas au-delà des mâchoires des pinces hémostatiques lors aplati en raison de la force d'écrasement. Si le nerf s'étend au-delà de la pointe pince le nerf ne sera que partiellement écrasée.
- L'écrasement se fait perpendiculairement au nerf à 45 mm de la troisième orteil, telle que mesurée par un fil qui se rapproche de la trajectoire du nerf sciatique. Le nerf est écrasé une fois pendant 15 secondes à 3 clics des pinces hémostatiques. On prend soin de ne pas étirer le nerf. Lorsque les pinces hémostatiques sont rouvertes, le nerf entier devrait être translucide sur le site d'écrasement.
- Une deuxième paire de pinces hémostatiques (identique à la première) qui a été pré-croisement danspoudre de carbone (Fisher Scientific, C272-500) est utilisé pour marquer le site d'écrasement. Le nerf est écrasé sur le site d'écrasement de même pour 15 secondes à 3 clics. Pas de carbone marquage doit s'étendre au-delà de la limite de l'écrasement initiale. Ceci est particulièrement important si un marquage précis du site d'écrasement est nécessaire. Avant d'utiliser, de poudre de carbone est stérilisé par exposition à la lumière UV pendant deux heures, et est ensuite traitée en utilisant une technique stérile.
- Pour pré-tremper la pince en carbone, mais s'oppose carbone généralisée au site chirurgical, les pinces sont ouvertes en carbone en poudre, puis referma doucement (mais pas cliqué) fermées, et le carbone à l'extérieur des pinces hémostatiques est essuyée à l'aide de gaze stérile . Les pinces sont vérifiés au moins sous un grossissement de 3x pour vérifier que les surfaces de broyage sont uniformément recouvert de poudre de carbone. Si nécessaire, ils sont re-plongé et effacé.
- La musculature fessière est re-opposition et suturé de la même manière que le côté opposé.
- Enfin, l'incision de la peau est fermée à l'aide de 9 mm clips réflexes (instruments de précision du monde, 500346; applicateur: 500345). Si 9 mm clips réflexes se trouvent à limiter le mouvement, les petits clips réflexes ou 6-0 points de suture (Roboz, SUT-1073-1011) peut être utilisé à la place.
3. Soins postopératoires
- Après la procédure, les animaux sont placés sur un coussin chauffant à 37 ° C jusqu'à ce qu'ils montrent des signes de mouvement.
- Ils sont ensuite ramenés à leur cage, où l'eau et la nourriture sont facilement accessibles sur le sol sous la forme d'hydrogel et de la nourriture mouillée.
4. Semi-fines Préparation
- Suite à une surdose de pentobarbital (300 mg / kg) la musculature jambe est enlevée pour exposer le nerf sciatique *. Avec le nerf reste in situ, l'arrière-train est immergé dans du paraformaldéhyde et le glutaraldéhyde à 2% 2% en tampon phosphate 0,1 M sur la glace pendant 30 minutes.
* Si vous remplissez l'ensemble la préparation musculaire de montage, les muscles sont la récolteed avant d'exposer le nerf sciatique. - Le nerf est soigneusement enlevé, en prenant soin à ne manipuler l'extrémité proximale. Puis le nerf est post-fixe dans le fixateur de même pour trois heures supplémentaires.
- Après fixation du nerf est rincé trois fois dans un tampon phosphate 0,1 M.
- Le nerf est immergé dans du tétroxyde d'osmium 2% dans un tampon phosphate 0,1 M pendant une heure.
- Le nerf est ensuite déshydraté par immersion dans de l'éthanol séquentielle de plus en plus concentré (50%, 70%, 80%, 95%, 100%, 100%, 100%). Chaque immersion est de 15 minutes.
- Le nerf déshydratée est incubée à deux reprises en l'oxyde de propylène pendant trois minutes chacun.
- Puis le nerf est plongé dans un mélange 1:1 de l'oxyde de propylène et 812 pour Intégrer au moins 6 heures (généralement pendant la nuit).
- Puis le nerf est plongé dans un mélange 2:1 de l'oxyde de propylène et 812 Intégrer la nuit.
- Enfin, le nerf est plongé dans le plus pur Embed 812 pour six heures, puis incorporé dans le moule approprié et baked à 60 ° C pendant 48 heures.
- 1.0 um sections sont coupés de la souche nerveuse distale à une distance à partir du site d'écrasement en utilisant un Ultracut UCT ultramicrotome (Leica) avec un couteau de verre et teinté au bleu de toluidine. Les lames minces peuvent également être produits pour examen de l'ultrastructure en microscopie électronique.
5. Whole Préparation musculaire Mont
- Premières souris sont sacrifiées par une overdose de pentobarbital (300 mg / kg) et les membres postérieurs sont enlevés au niveau des genoux.
- Quatre muscles de la patte postérieure, sont prélevés pour l'analyse: le muscle tibial antérieur (TA), extenseur commun des orteils (EDL), soléaire et long péronier latéral.
- Tous les muscles sont prélevés par l'intermédiaire d'une dissection minutieuse et épinglé par le biais de leur tissu conjonctif à un Sylgard noir (Fisher Scientific, NC9492579) plat couché. Ils sont rincés dans du PBS, puis fixées dans du paraformaldéhyde à 4% pendant 30 minutes.
- Le TA est ensuite rincé dans du PBS, qui est intégré dans l'OCT (Fisher Scientific, 14-373-65), et rapidement congelées dans un bain de glace et d'acétone à sec.
- Il est conservé à -80 ° C pour la coupe mince affaire dans son ensemble la préparation de montage échoue. En général, la TA est trop épais pour supports adéquats entiers.
- Le permis de conduire, soléaire et long péronier latéral sont rincés pendant 3 x 10 minutes dans du PBS, placés dans 0,1 M de glycine * (Fisher Scientific, AC12007-0010; dilués dans du PBS) pendant 30 minutes, et rincées 3 x 10 minutes dans du PBS à nouveau. Ils sont ensuite trempés dans de la glace du méthanol à 100% à froid pendant exactement 5 minutes à -20 ° C, rincés 3 x 10 minutes dans du PBS, et baigné dans fluorescence conjugué alpha-bungarotoxine (dilué à 1:200 dans du PBS) pendant 30 minutes. Les muscles sont rincés pendant 3 x 10 minutes dans du PBS, suivi par un bloc de 1 heure à 2% de BSA (KPL, 50-61-00) et Triton de 0,2% X-100 (Dot scientifique Incorporated, 9002-93-1) dans du PBS *, et incubées pendant la nuit tout en balançant à 4 ° C dans un cocktail d'anticorps primaires dilués dans le même bloc de 2% Triton BSA/0.2%.
* Glycine et des solutions de blocage sont faites le même jour que la récolte du muscle et on agite pendant 30-60 minutes à température ambiante avant de l'utiliser.- Pour marquer les axones et les synapses neuromusculaires, nous utilisons une combinaison d'un marqueur des neurofilaments monoclonal de souris (Covance, SMI-312R; dilué 1:1000), une souris marqueur monoclonal vésicule synaptique (SV2 DSHB, dilué 1:1000), et l'alpha rhodamine conjuguée -bungarotoxine (Sigma-Aldrich, dilué 1:200). Pour marquer les cellules de Schwann réactifs que nous utilisons de lapin anti-GAP-43 (Novus Biologicals, NB300-143, dilué au 1/500). Les anticorps primaires sont visualisées avec une IgG1 sous-type spécifique de fluorescéine de chèvre anti-anticorps de souris conjugué secondaire et DyLight 649 âne anti-lapin conjugué (ImmunoResearch Jackson, dilué 1:200).
- Le lendemain, les muscles sont rincées dans du PBS pendant 3 x 10 minutes, et incubés dans Anticorps secondaires dilués à 1:200 (dans une solution de 2% de Triton BSA/0.2% de blocage). Ils sont ensuite rincés 2 x 10 minutes dans du PBS, followed par une immersion de 5 minutes en DAPI (Invitrogen, D3571; dilué à 300 nM dans l'eau déminéralisée), et un autre de 10 minutes de rinçage dans du PBS.
- Chaque muscle est ensuite disséqué sur une Sylgard noir (Fisher Scientific, NC9492579) revêtu une boîte de Pétri. Initialement, les tendons sont enlevées à leurs points d'insertion dans le muscle, puis les muscles sont amincis par arrachement des fibres musculaires intérieures (figure 3, les panneaux AC). On prend soin de préserver la surface extérieure du muscle, y compris les bandes des plateaux vertébraux (Figure 3, panneaux DF). Les muscles qui en résultent sont montées sur des lames plus (Fisher Scientific, 12-550-15) avec Vectashield (Vector Laboratories, H-1000) et 22 x 40 mm (lamelles de verre Fisher Scientific, 12-548-5C) scellés par vernis à ongles sur deux côtés. Lorsqu'il est correctement monté sur la glissière les contacts de la bande des plateaux vertébraux de la lamelle.
6. Mesure de régénération
- La régénération peut être estimée dans les trois muscles (péronier latéral, EDL, et le soléaire). Nous avons souvent examine régénération quatorze jours après écrasement du nerf, un moment où un pourcentage substantiel de NMJs sont ré-innervés. Les deux points précédents et plus tard du temps sont également appropriés, en fonction de la question scientifique posée. Dans chaque muscle, ré-innervation de la bande flasque ensemble est examiné. Seuls NMJs fr surface de la face sont notés. De cette façon, au moins 200 NMJs par muscle peut être rapidement examinées.
- Pour marquer ré-innervation musculaire, nous déterminons un «ré-innervation ratio". Le dénominateur est le nombre de jonctions neuromusculaires dénervées comme marquées par α-bungarotoxine GAP-43 de liaison cellulaire et Schwann immunoréactivité. Le numérateur est le nombre de re-innervés NMJs comme marquées par neurofilament/SV2 immunoréactivité. Si nécessaire, NMJs peuvent être classés comme étant soit partiellement (couverture incomplète des α-bungarotoxine par SV2) ou totalement (une couverture complète de α-bungarotoxine par SV2) re-innervés. Pour des exemples de NMJs re-innervés et dénervés voir la figure 3, les panneaux G et H.
7. Les résultats représentatifs
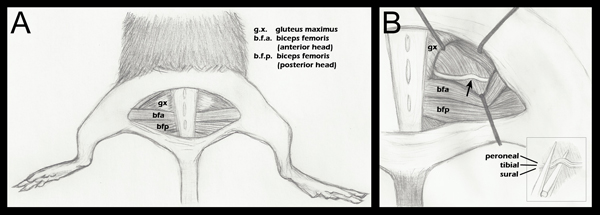
Figure 1. Schéma de l'anatomie des membres postérieurs importante à l'écrasement du nerf. A. Une incision de la peau semi-circulaire a été faite révélant la musculature sous-jacente. B. La musculature fessière a été séparé, et le nerf sciatique a révélé (étape 2.4 ci-dessus). Une flèche indique le site d'écrasement approximative. Placement rétracteur est montré comme un guide général, et est ajustée au cours de chaque opération afin de faciliter la visualisation de la sciatique et l'approche des pinces hémostatiques pour écraser B (en médaillon):. Placement du sciatique sur la mâchoire inférieure des pinces hémostatiques, juste avant l'écrasement (étape 2.5 ci-dessus). Fascicules distincts sont étiquetés de manière à démontrer qu'ils sont adjacents horizontalement, pas verticalement, mais, au cours de la cohue. Bien que trois fascicles sont étiquetés dans ce schéma, on peut aussi voir un fascicule quatrième, la branche articulaire du sciatique poplité externe. Pour un dessin anatomique plus détaillée des patrons de ramification du nerf sciatique fascicules distale au point écraser, s'il vous plaît se référer à l'anatomie Greene du Rat, la figure 188 17.
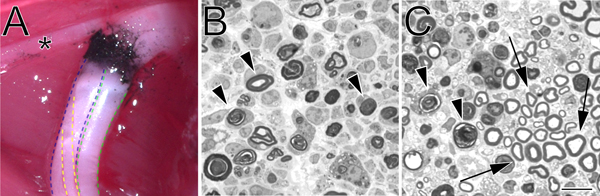
Figure 2. Un site d'écrasement marqué au carbone in situ et de bleu de toluidine-tachés, coupes semi-fines de nerf sciatique écrasé. A. Un exemple d'un site d'écrasement in situ (à gauche du membre postérieur). Le noir de carbone désigne le site d'écrasement. L'astérisque marque une branche du nerf tibial qui innerve la musculature de cuisse et sert de point de repère utile lors de la chirurgie à l'écrasement. La division tibiale du nerf sciatique est entouré de bleu, de la sciatique poplité externe en vert, et le sural en jaune. B. coupes semi-fines démonstration d'un écrasement complet effectué avec une force hémostatiqueps. C. coupes semi-fines qui démontrent un écrasement incomplète réalisée avec une pince à angle. Dans les deux images dégénérescence profils de myéline sont marquées avec des flèches. Dans le panneau flèches C marquer des exemples de profils de myéline conservés et une grappe d'axones épargnés. La barre d'échelle est de 10 um.
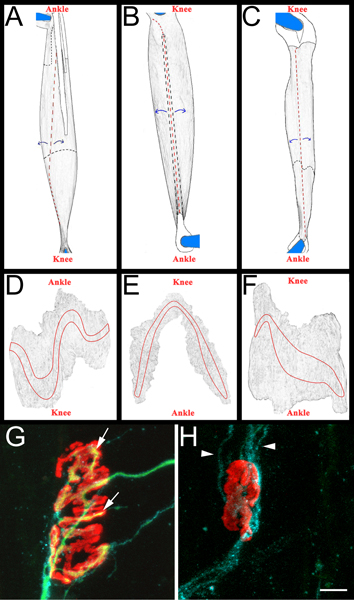
Figure 3 Tout schéma de montage et musculaire NMJs représentatives AC:.. Images fondues de EDL (A), long péronier latéral (B), et soléaire (C) des muscles après l'enlèvement de membres postérieurs. Muscles qui sont montrés proviennent du membre postérieur droit. Du genou et la cheville orientation anatomique sont également inclus pour référence. Les tendons sont de couleur blanche et décrites dans une ligne noire continue lorsqu'il est positionné sur le dessus du muscle. Elles sont présentées dans une ligne noire en pointillés quand ils s'étendent au-dessous du muscle. Les coupures sont indiquées en rouge pointillé.Le muscle est décollé à partir de sites de coupe, comme indiqué par des flèches bleues, et par la suite dilué. Après l'éclaircie, le muscle est séparé des broches en coupant autour de ce qui reste des tendons épinglés DF:. Images rendues à partir de muscles entiers de montage après l'enlèvement du tissu conjonctif et la suite d'amincissement. Les bandes des plateaux vertébraux sont indiquées sur chaque muscle GH:. Soleus muscle entier montage quatorze jours après écrasement du nerf sciatique démontrant ré-innervés (G) et dénervé (H) des jonctions neuromusculaires. Dans ces panneaux, NMJs, les axones et les cellules de Schwann sont visualisés comme décrit ci-dessus à la section 5.5.1. Récepteurs de l'acétylcholine sont rouges, les axones vert, et la cellule de Schwann traite bleu. Dans le panneau G, les flèches indiquent les zones de la jonction neuromusculaire qui ont été ré-innervés par un axone. Dans le panneau des pointes de flèche H indiquent GAP-43 positifs processus de cellules de Schwann. Notez l'absence des axones. La barre d'échelle est de 10 um.
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous avons présenté une méthode pour obtenir un écrasement du nerf sciatique avec fiabilité complète marquage précis du site d'écrasement. Tel que mentionné précédemment, écrasement du nerf sciatique est un modèle commun de lésion du nerf périphérique chez la souris et les rats. Bien que chaque méthode d'écrasement a ses avantages et ses inconvénients, nous avons trouvé cette méthode produit un écrasement complet qui a été facile de marquer avec un minimum d'équipements spéciaux (p....
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail a été soutenu par le NIH subventions K08NS065157 (à TAF) En outre, le Centre de Penn pour les troubles musculo-squelettiques, P30AR050950 Nombre Prix de l'Institut national de l'arthrite, les maladies musculo-squelettiques et la peau ont soutenu ce travail (TAF et Steven S. Scherer). Enfin, les Shriners de financement pédiatrique semences Research Center (TAF) a soutenu ce travail. Nous tenons à remercier le Dr Young-Jin Fils pour démontrer d'abord toute la montagne procédure et Amy A. Kim pour son aide dans la production des croquis de la figure 1.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom (description / quantité) | Fournisseur | Numéro de catalogue | |
| Clipper Mini n ° 0000 de la lame | Roboz | RC-5903 | |
| Hair Remover Nair (9 onces) | Eglise et Dwight Co., Inc | N / A | |
| Betadine scrub chirurgical (1 gallon) | Fisher Scientific | 19066452 | |
| Pommade ophtalmique (1 oz) | Fisher Scientific | 19082795 |
Outils chirurgicaux:
| Nom (description / quantité) | Fournisseur | Numéro de catalogue |
| FST 250 Hot stérilisateur à billes | Outils belle science | 18000-45 |
| Ciseaux Iris (11 cm de long) | Instruments de précision du monde | 500216 |
| Potts-Smith forceps (droite; 18cm; 1x2 dents) | Outils belle science | 11024-18 |
| McPherson Vannas Ciseaux (5 lames mm) | Instruments de précision du monde | 14124-G |
| Dumont # 5 - Pince Dumoxel standard Tip | Outils belle science | 11252-30 |
| Dumont # 5/45 - Pince Dumoxel standard Tip | Outils belle science | 11251-35 |
| Ultra fin (cylindrique hémostatiques; surfaces intérieures lisses) | Outils belle science | 13020-12 |
| Charbon actif en poudre (500 g) | Fisher Scientific | C272-500 |
| Taille 6-0 sutures avec C-1 aiguille (stérile, de la soie, noir, tressé,Non-absorbable; 18 "Longueur; Boîte de 36) | Roboz | SUT-1073-1011 |
| Applicateur de clips Reflex (pour 9 clips mm) | Instruments de précision du monde | 500345 |
| 9mm en acier inoxydable Clips Reflex (100/boîte) | Instruments de précision du monde | 500346 |
Protection des animaux:
| Nom (description / quantité) | Fournisseur | Numéro de catalogue |
| Injectable à 0,9% de chlorure de sodium (agent de conservation; 20 ml) | Hospira | 0409-4888-20 |
| Système complet de couverture homéothermes avec sonde flexible (moyenne, 115 VAC, 60 Hz) | Harvard Apparatus | 507222F |
Platfor chirurgicalem et écarteurs:
(Acheté chez votre quincaillerie locale)
| Nom (description /) | Quantité |
| Plate-forme en acier inoxydable (usiné; ~ 12 "x12" x1 / 8 ") | 1 |
| Aimants bouton (Exemple: Eclipse E825) | 3 |
| Boulons en acier inoxydable (3 "long; diamètre déterminé par aimants bouton) | 3 |
| Écrous en acier inoxydable (dimensionnée pour s'adapter à Boulons) | 9 |
| Elastiques (légère tension) | 3 |
| Pins d'insectes (les deux extrémités pour former des crochets Bent) | 3 |
Semi-Minces:
| Nom (description / quantité) | Fournisseur </ Strong> | Numéro de catalogue |
| Paraformaldéhyde (1 kg) | Sigma-Aldrich | P6148-1KG |
| Phosphate de sodium dibasique anhydre (500 g; Utilisé pour Préparer un tampon phosphate) | Fisher Scientific | S375-500 |
| Phosphate de sodium monobasique anhydre (1 kg; Utilisé pour Préparer un tampon phosphate) | Fisher Scientific | AC38987-0010 |
| Glutaraldéhyde (50%; 10 x 10 ml) | Ted Pella, Inc | 18431 |
| Tétroxyde d'osmium (aqueuse à 4%, 10 x 10 ml) | Ted Pella, Inc | 18465 |
| Oxyde de Propylène (450 ml) | Ted Pella, Inc | 18601 |
| Embed 812 (Kit, pour les blocs durs ou de contraste d'image élevée) | Sciences Electron Microscopy | 14120 |
| Toluidine Bleu (25 g) | Ted Pella, Inc | 19451 |
Whole Préparation musculaire mont et immunohistochimie:
| Nom (description / quantité) | Fournisseur | Numéro de catalogue |
| Paraformaldéhyde (1 kg) | Sigma-Aldrich | P6148-1KG |
| Phosphate de sodium dibasique anhydre (500 g; Utilisé pour Préparer un tampon phosphate) | Fisher Scientific | S375-500 |
| Phosphate de sodium monobasique anhydre (1 kg; Utilisé pour Préparer un tampon phosphate) | Fisher Scientific | AC38987-0010 |
| 10% de diluant BSA / solution de blocage (200 ml) | Kirkegaard & Perry Laboratories, Inc | 50-61-00 |
| Triton X-100 (100 mL) | Dot scientifique Incorporated | 9002-93-1 |
| Glycine, 98% (1 kg) | Fisher Scientific | AC12007-0010 |
| Tissue-Tek Cryo-OCT composé (Caisse de 12, 4 bouteilles oz) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (2 Kit lb) | Fisher Scientific | NC9492579 |
| Inoxydable Pins insectes en acier, taille 1 (100/PKG) | Outils belle science | 26001-40 |
| Tétraméthylrhodamine-A-bungarotoxine (0,5 mg) | Sigma-Aldrich | T0195-.5MG |
| Anticorps monoclonal de souris contre SMI-312 (0,1 mL) | Covance | SMI-312R |
| Anticorps monoclonal de souris contre SV2 (0,1 ml) | Des études de développement de la Banque d'hybridome (DSHB) | SV2 |
| Lapin PolyAnticorps contre clonale GAP-43 | Novus Biologicals | NB300-143 |
| Flourescein conjugué de chèvre anti-IgG de souris, sous-classe 1 Fcy spécifique | Jackson ImmunoResearch | 11 5-095-205 |
| DyLight 649 conjugué d'âne anti-IgG de lapin | Jackson ImmunoResearch | 711-495-152 |
| 4 ',6-diamidino-2-phénylindole (DAPI, dilactate; 10 mg) | Invitrogen | D3571 |
| Vectashield Milieu de montage (10 ml) | Vector Laboratories | H-1000 |
| Superfrost Plus Lames de microscope (blanc; Taille: 75 x 25 mm, paquet de 144) | Fisher Scientific | 12-550-15 |
| Fisherfinest Lunettes de couverture Premium (Taille: 40 x 22 mm; Pack de 1 oz.) | Fisher Scientific | 12-548-5C |
Références
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon