Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Воспроизводимые мыши седалищного нерва и Давка Последующие оценки регенерации полного анализа горы мышц
В этой статье
Резюме
В этом докладе мы описываем способ раздавить мышь седалищного нерва. Этот метод использует доступны гемостаза щипцы и легко воспроизводимым и производит полный седалищный нерв давка. Кроме того, мы опишем способ подготовить мышцы все крепления подходят для анализа регенерации нерва после седалищный нерв давка.
Аннотация
Регенерация в периферической нервной системы (ПНС) широко изучается как для его отношение к болезни человека и понять, надежная регенеративный ответ монтируется нейронов ПНС что, возможно, освещение неудач ЦНС регенерации 1. Седалищный нерв давке (axonotmesis) является одним из наиболее распространенных моделей повреждения периферического нерва у грызунов 2. Дробление прерывания все аксоны, но Шванн клетки базальной пластинки сохраняются, так что восстановление оптимального 3,4. Это позволяет исследователю изучать именно способность растущих аксонов взаимодействовать как с клетки Шванн и базальной пластинки 4. Крысы в целом были предпочтительным животных моделей для экспериментальных давке нерва. Они широко доступны и их пораженном седалищного нерва дает разумное приближение человека поражения нерва 5,4. Несмотря на меньший размер, чем нерва крысы, мыши нерв имеет много схожих качеств. Самое главное, хотя, меморандумы о взаимопониманииэлектронной модели становятся все более ценными из-за широкой доступности трансгенных линий теперь позволяет для детального расчленения отдельных молекул важны для регенерации нерва 6, 7. До исследователи использовали несколько методов для получения давке нерва или травмы, включая простой угловой пинцет, охлажденные щипцы, пинцеты гемостаза, сосудистые зажимы, и следователь-зажимы предназначены 8,9,10,11,12. Исследователи также использовали различные методы маркировки в месте повреждения, включая шовный материал, частицы углерода и люминесцентные бусины 13,14,1. Мы описываем наш метод получения полного воспроизводимо седалищного нерва с поклонников точных и постоянных маркировки краш-сайт с помощью тонкой гемостаза щипцы и последующих углерода краш-сайт маркировки. В рамках нашего описания седалищного нерва процедура давки мы также включили относительно простой метод мышечного все смонтировать мы используем, чтобы в дальнейшем количественно регенерации.
протокол
1. Животное субъектов
1.1. Лечение
- Все животные процедуры должны выполняться с одобрения местных животных Учреждения по уходу и Комитет по этике и в соответствии с использованием и Комитета и Национального института здоровья принципы, меры, принимаемые для минимизации боли и дискомфорта.
- Наши мыши содержались при температуре контролируемых условиях на 12-часовой световой обратный и темно цикла, в то время кормили мышей чау и воды вволю.
- Для изучения регенерации взрослых, мышей должна быть не менее 6-недельного возраста, когда седалищный нерв давки не производится. Это возраст за время, обрезка polyneural нервно-мышечных узлов происходит.
- В этих экспериментах мы использовали 6-8 недельных C57BL / 6, приобретенных из реки Чарльз. При сравнении регенерации после седалищный нерв давка (например: скорость роста аксонов) мышей должна быть такой же, как различия в регенерацию аксонов были неред различных инбредных 15,16. Если генетически модифицированных мышей, которые будут использоваться, однопометница управления являются наиболее подходящими.
1.2. Хирургическая подготовка
- Животные глубоко под наркозом для операции с использованием коктейля кетамина (100 мг / кг) и ксилазина (10 мг / кг) через внутрибрюшинного введения. Каждое животное получает также подкожные инъекции мелоксикама (10 мг / кг), чтобы свести к минимуму послеоперационные боли.
- Оба задних тщательно побрился использовать хирургические ножницы (Roboz, RC-5903) и депиляция комплектуется Наир эпиляции кремом (находится в местной аптеке).
- Кожа очищается стерильным хлопок наконечником аппликаторы и бетадин хирургических скраб (Fisher Scientific, 19066452).
- Офтальмологическая мазь (Fisher Scientific, 19082795) наносится на глаза стерильным хлопок наконечником аппликаторы.
- Мышь находится на чистую нержавеющей стали, в рамках которого была помещена предварительно нагретой homeothermic системы одеяло (Harvard аппарата, 507222F). Животное температура поддерживается на уровне 37 ° C.
- Все конечностей выявляются вниз, тщательность в положение задних конечностей симметрично, так что в коленном суставе составляет прямой угол с телом (рис. 1, панель).
- Операционное поле покрывается стерильной драпировки. Все инструменты стерилизуются в автоклаве или горячей стерилизации шарик (Fine инструментов науки, 18000-45) и хирург надевает маску, халат и стерильные перчатки.
2. Воспроизводимые седалищного Давка Нервные
- После подготовки, полукруглый разрез по средней линии (рис. 1) выполнен в коже. Кожа нежно расчлененный от основной мускулатуры, и сложил за остаться в стороне во время процедуры. Он влажной использованием приложений 0,1 мл стерильного физиологического раствора (Hospira, 0409-4888-20) во время процедуры.
- Открытие фасциальных плоскости между ягодичной мышцы и передние головки двуглавой мышцы femoriс раскрывает седалищного нерва (рис. 1, панель). Для хирургического контроля, противоположной седалищного нерва должны подвергаться и мобилизовали, но остается неизменным. Ягодичные мышцы затем повторно отличие и подшивается помощью 6-0 плетеные шелковые, не рассасывающиеся нити (Roboz, SUT-1073-11).
- Экспериментальные седалищного нерва затем подвергаются таким же образом, с преднатяжителями на место, чтобы облегчить визуализацию (рис. 1, группа В). Втягивающих стерилизовать перед использованием.
Примечание: хотя втягивающим системы являются коммерчески доступными, они часто являются весьма дорогостоящими. Мы смогли сделать удовлетворительную систему втягивающим с помощью недорогих поставок оборудования и насекомых контактов (см. материалы раздела). - Седалищный нерв затем аккуратно освободить от окружающей соединительной ткани с помощью ножниц иридэктомия.
- Использование штраф 5/45 (Fine инструментов науки, 11251-35), щипцы, нерв располагается на нижней челюсти супер-тонкий пинцет гемостаза (Fine науки слишкомLS, 13020-12). Три пучки последовательно согласованы, а не друг на друга (рис. 1, вставка B). Гемостатическим пинцетом были выгравированы отметки в 1,5 мм от кончика. Внешняя часть седалищного находится в соответствии с этой отметки до давки. Это гарантирует, давка одинаковой ширины, и что нервы не выходит за пределы челюсти гемостаза, когда плоские щипцы из-за дробления сил. Если нерв выходит за кончик пинцетом нервы будут только частично разгромлены.
- Давка производится перпендикулярно к нерву в 45 мм от третьей ноги, если судить по потоку, который приближается к пути седалищного нерва. Нерв сминается раз в течение 15 секунд на 3 клика гемостатической щипцами. Особое внимание уделяется тому, чтобы не растянуть нерв. Когда hemostats повторно открыт, все нервы должны быть полупрозрачными в давке сайта.
- Вторая пара щипцов гемостаза (идентичный первому), который был предварительно смоченной впорошкообразный углерод (Fisher Scientific, C272-500) используется для обозначения поклонников сайта. Нервные дробится на том же месте давки в течение 15 секунд в 3 клика. Нет углерода маркировка должна выходить за границы начальной давка. Это особенно важно, если точная маркировка давке сайт обязательна. Перед использованием углеродного порошка стерилизуется под воздействием ультрафиолетового излучения в течение двух часов, а затем обрабатываются с использованием стерильной техники.
- Чтобы предварительно окунуть в щипцы углерода, но исключает широкое углерода в месте операции, щипцы открыты в порошке углерода, затем аккуратно закрыты (но не нажата) закрыты, и углерода за пределами hemostats будет стерт с использованием стерильной марли . Щипцы проверяются по крайней мере, 3-кратным увеличением, чтобы убедиться, что дробление поверхности равномерно покрыты порошкового угля. При необходимости они вновь погружать и уничтожили.
- Ягодичные мышцы повторно отличие и подшивается в том же, как и в противоположную сторону.
- Наконец, разрез кожи закрывают 9 мм рефлекс клипов (World Precision Instruments, 500346, объект применения: 500345). Если 9 мм рефлекс клипы находятся ограничить движение, меньше рефлекс клипы или 6-0 швов (Roboz, SUT-1073-11) может быть использован вместо.
3. Послеоперационный уход
- В соответствии с процедурой, животные размещаются на грелку на 37 ° С, пока они не показывают признаков движения.
- Затем они вернулись в свои дома клетку, где вода и пища легко доступны на полу в виде гидрогеля и контактирующие пищи.
4. Полу-тонкий подготовка
- После передозировки фенобарбитала (300 мг / кг) мускулатура ног удаляются, чтобы разоблачить седалищный нерв *. С нервов, оставшихся в местах, заднюю погружается в 2% параформальдегида и 2% gluteraldehyde в 0,1 М фосфатного буфера на льду в течение 30 минут.
* Если после целом подготовка мышц гору мышц урожаяред, прежде чем подвергать седалищного нерва. - Нерв тщательно удалены, с осторожностью принимать на обработку только проксимального конца. Тогда нерва после фиксированного же фиксатора на три дополнительных часа.
- После фиксации нерв промыть три раза, в 0,1 М фосфатного буфера.
- Нерв погружается в 2% осмия в 0,1 М фосфатного буфера в течение одного часа.
- Нерва, то обезвоженный путем последовательного погружения в более концентрированный этиловый спирт (50%, 70%, 80%, 95%, 100%, 100%, 100%). Каждое погружение на 15 минут.
- Обезвоженный нерва инкубировали дважды в окись пропилена в течение трех минут.
- Затем нерв погружается в смеси 1:1 окиси пропилена и Вставить 812, по крайней мере 6 часов (обычно на ночь).
- Затем нерв погружается в 2:1 смесь окиси пропилена и 812 Вставить в одночасье.
- Наконец, нервы погружается в чистом Embed 812 в течение шести часов, то встроенный в соответствующей форме и баоттаптывали при 60 ° С в течение 48 часов.
- 1,0 мкм секций вырезать из дистальной культи нерва на заданное расстояние от давки сайта с помощью Ultracut UCT ультрамикротомом (Leica) с ножом стекло и окрашенных толуидиновым синим. Тонкие разделы могут быть также получены для исследования ультраструктуры с помощью электронного микроскопа.
5. Всего горы мышц подготовка
- Первая мышь приносятся в жертву при передозировке фенобарбитала (300 мг / кг) и задние конечности удаляются в коленях.
- Четыре мышцы задних конечностей удаляются для анализа: передней большеберцовой (TA), разгибатель пальцев мышцы (EDL), камбаловидной и малоберцовой мышцы.
- Все мышцы удаляются через рассечение осторожны и возлагали через соединительную ткань в черно sylgard (Fisher Scientific, NC9492579) покрытием блюдо. Они промывали в PBS, а затем фиксировали в 4% параформальдегида в течение 30 минут.
- TA затем промывают в PBS, встроенные в октябре (Fisher Scientific, 14-373-65), и быстро заморожен в ванне ацетона и сухого льда.
- Он хранится при температуре -80 ° C для тонких срезов в случае целом подготовка гору не получается. В целом, TA является слишком толстым для адекватного все крепления.
- EDL, камбаловидной и малоберцовой мышцы промываются в течение 3 х 10 минут в PBS, расположенных в 0,1 М глицин * (Fisher Scientific, AC12007-0010, разводят в PBS) в течение 30 минут и промыть 3 х 10 минут в PBS снова. Они гасят в ледяную 100% метанола ровно 5 минут при температуре -20 ° С, промыть 3 х 10 минут в PBS, и купались в флуоресцентно сопряженных альфа-бунгаротоксина (разбавленный 1:200 в PBS) в течение 30 минут. Мышцы промыть в течение 3 х 10 минут в PBS, а затем 1 час блока в 2% BSA (КПЛ, 50-61-00) и 0,2% Тритон Х-100 (Dot научно Incorporated, 9002-93-1) в PBS *, и инкубировали в течение ночи в то время как раскачивание при 4 ° С в коктейль из первичных антител разводят в те же 2% BSA/0.2% Тритон блока.
* Glycine и блокирование решения принимаются в тот же день, как мышцы уборки и перемешивали в течение 30-60 минут при комнатной температуре перед использованием.- Чтобы отметить аксонов и нервно-мышечных синапсов, мы используем комбинацию мышиных моноклональных маркер нейрофиламентов (Covance SMI-312R, разбавленный 1:1000), мышиные моноклональные синаптических везикул маркер (SV2 DSHB, разбавленный 1:1000) и родамина сопряженных альфа -бунгаротоксина (Sigma-Aldrich, разбавленный 1:200). Чтобы отметить реактивных клеток Шванн мы используем кроличьих анти-GAP-43 (Novus биологические, NB300-143, разбавленного 1/500). В качестве первичных антител визуализируются с IgG1 подтип конкретного флуоресцеина сопряженных антимышиного вторичными антителами и DyLight 649 сопряженных осла анти-кролик (Jackson ImmunoResearch, разбавленный 1:200).
- На следующий день мышцы промывают в PBS в течение 3 х 10 минут, и инкубировали в вторичными антителами разбавленное 1:200 (в 2% BSA/0.2% Тритон блокирующий раствор). Затем их промывают 2 х 10 минут в PBS, лllowed по 5 минут погружения в DAPI (Invitrogen, D3571, разбавляют до 300 нМ в дистиллированной воде), и еще 10 минут промыть в PBS.
- Каждая мышца затем расчлененный на черном sylgard (Fisher Scientific, NC9492579) покрытием чашке Петри. Сначала удаляют сухожилия в точках их введения в мышцу, а затем мышцы разбавленной на отслаивания интерьера мышечные волокна (рис. 3, панель переменного тока). Особое внимание уделяется тому, чтобы сохранить внешнюю поверхность мышцы, в том числе концевой пластинки группы (рис. 3, панель DF). В результате мышцы крепятся на плюс слайды (Fisher Scientific, 12-550-15) с vectashield (Vector Laboratories, H-1000) и 22 х 40 мм стекло покровные (Fisher Scientific, 12-548-5C) печатью ясный лак для ногтей с двух сторон. При правильной установке на слайде контакты концевой пластинки группы покровным.
6. Измерение регенерации
- Восстановление может быть оценено во всех трех мышц (малоберцовой, EDL, и камбаловидной). Мы часто бывшиеамин регенерации четырнадцати дней после нерв давка, время, за которое значительная часть NMJs повторно иннервируется. И ранние и поздние моменты времени пригодны также, в зависимости от научных вопрос, который задают. В каждой мышце, повторно иннервации всей зоне концевой пластинки рассматривается. Только ан NMJs лицевой поверхности забил. В этом моде, по крайней мере 200 NMJs в мышцах может быть быстро рассмотрены.
- Чтобы забить мышцы повторного иннервации мы определяем «ре-иннервации отношения". Знаменатель числа денервированного нервно-мышечных узлов, помеченных как α-бунгаротоксина обязательным и Шванн клетки GAP-43 иммунореактивности. В числителе число повторно иннервируемых NMJs как помечены neurofilament/SV2 иммунореактивности. Если необходимо, NMJs могут быть классифицированы как частично (неполный охват α-бунгаротоксина по SV2) или полностью (полный охват α-бунгаротоксина по SV2) вновь иннервируется. Для примера повторного иннервируемых и денервированного NMJs см. Рисунок 3, панели G и H.
7. Представитель Результаты
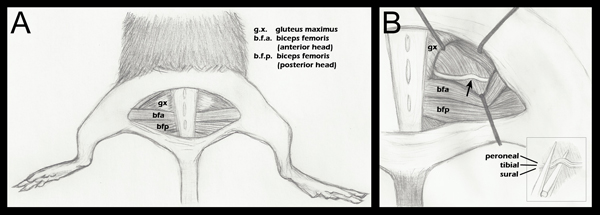
Рисунок 1. Схема задних конечностей анатомии важно нервы давка. А. полукруглый разрез кожи был сделан выявление основных мускулатуры. В. ягодичных мышц была отделена, и седалищного нерва выявлено (шаг 2.4 выше). Стрелка обозначает примерное местоположение давка. Ретрактор размещение показано в качестве общего руководства, и корректируется при каждом операцию, чтобы облегчить визуализацию седалищного и подход гемостаза щипцы для давки B (вставка). Размещение седалищного на нижней челюсти гемостаза щипцы перед давка (шаг 2.5 выше). Отдельные пучки помечены, чтобы продемонстрировать, что они являются смежными по горизонтали, но не по вертикали, во время давки. Хотя три fascicles обозначены в этой схеме, можно также увидеть 1/4 пучка, суставные ветви малоберцового. Для более подробного анатомического рисования ветвления закономерности седалищного нерва брошюрам дистальнее точки давка, пожалуйста, обратитесь к анатомии Грина из крыс, рис. 188 17.
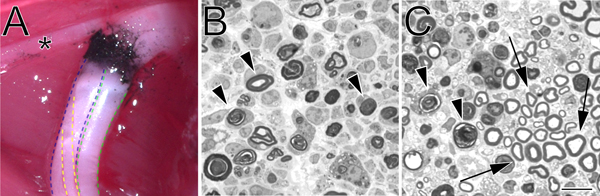
Рисунок 2. Углерода заметно давка сайт на месте и толуидиновым синим окрашенных, полу-шлифов дробленого седалищного нерва. А. пример давки сайт на месте (левой задней конечности). Черный углерод обозначает давка сайта. Звездочка отмечает филиал большеберцового нерва, который иннервирует мускулатуру бедра и служит полезным вехой в давке операции. Большеберцовой разделения седалищного нерва, изложенные в синий, зеленый малоберцового и икроножных в желтый цвет. В. Полу-шлифов демонстрируя полное давка осуществляется с гемостатической силупс. С. Полу-шлифов демонстрирует неполную давка осуществляется с угловым пинцетом. В обоих изображений вырождается миелина профили, отмеченные стрелками. В панели C Стрелками отмечены примеры сохранились профили миелина и кластер пощадил аксонов. Шкала бар 10 мкм.
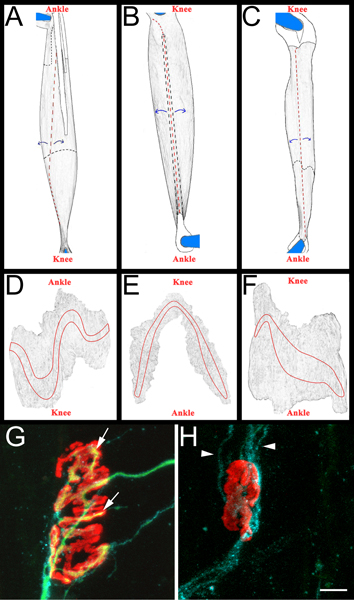
Рисунок 3 Схема полного мышц гора и представитель NMJs AC:.. Предоставляемые изображения EDL (А), малоберцовой мышцы (B), и камбаловидной (C) мышцы после удаления из задних конечностей. Мышцы указаны с правой задней конечности. Коленного сустава и лодыжки анатомической ориентации также для справки. Сухожилия окрашены в белый цвет и изложенные в сплошной черной линией, когда они расположены в верхней части мышцы. Они изложены в черный пунктир, когда они распространяются под мышцу. Сокращения показаны красным пунктиром.Мышцы отслаивается от сокращения сайтов, как указано синими стрелками, а затем разбавляется. После прореживания, мышцы отделена от контактов за счет сокращения вокруг того, что осталось от возлагали сухожилия DF. Предоставляемые изображения из цельного мышцы гору после удаления соединительной ткани и последующего ухода. Концевой пластинки группы изложены на каждую мышцу GH. Камбаловидной все мышцы горы четырнадцать дней после того, как седалищный нерв давка демонстрации повторно иннервируемых (G) и денервированного (H), нервно-мышечных контактов. В этих панелях, NMJs, аксоны, и Шванн клетки визуализировать, как описано выше в разделе 5.5.1. Рецепторы ацетилхолина являются красный, зеленый аксонов, и Шванн клеточных процессов синий. В панели G, стрелки указывают области NMJ, которые были повторно иннервируются аксона. В панели H стрелки указывают на GAP-43 позитивных процессов клетки Шванн. Обратите внимание на отсутствие аксонов. Шкала бар 10 мкм.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Мы представили метод получения полного надежно седалищный нерв давка с точной маркировки давке сайта. Как упоминалось ранее, седалищный нерв давка общую модель повреждения периферического нерва у мышей и крыс. Хотя каждый метод имеет давка свои преимущества и недостатки, мы нашли это?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа была поддержана грантами NIH K08NS065157 (для TAF) Кроме того, Пенн центра опорно-двигательного аппарата, премии Количество P30AR050950 из Национального института артрита, костно-мышечной и кожных заболеваний поддержала эту работу (TAF и Стивен С. Шерер). Наконец, Shriners Детская научно-исследовательский центр Начальное финансирование (TAF) поддержал эту работу. Мы хотели бы поблагодарить д-р Ен Джина Сына сначала демонстрируют все горе процедуры и Эми А. Кима за помощь в создании эскизов на рисунке 1.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Наименование (описание / кол-во) | Поставщик | Номер по каталогу | |
| Мини Clipper с № 0000 Лезвие | Roboz | RC-5903 | |
| Наир для удаления волос (9 гр.) | Церковь и Дуайт завод, ОАО | N / A | |
| Бетадин хирургических скраб (1 галлон) | Fisher Scientific | 19066452 | |
| Офтальмологическая мазь (1 унция). | Fisher Scientific | 19082795 |
Хирургические инструменты:
| Наименование (описание / кол-во) | Поставщик | Номер по каталогу |
| FST 250 Горячий шарик стерилизатор | Изобразительных средств наук | 18000-45 |
| Iris Ножницы (11 см) | Инструменты Всемирной Precision | 500216 |
| Поттс-Смит Пинцет (прямой, 18 см, 1x2 зубы) | Изобразительных средств наук | 11024-18 |
| Макферсон-Vannas Ножницы (5 лезвий мм) | Инструменты Всемирной Precision | 14124-G |
| Дюмон # 5 щипцы - Dumoxel Стандартный совет | Изобразительных средств наук | 11252-30 |
| Дюмон # 5/45 Пинцет - Dumoxel Стандартный совет | Изобразительных средств наук | 11251-35 |
| Ultra Fine Hemostats (прямые, гладкие поверхности внутри) | Изобразительных средств наук | 13020-12 |
| Угольный порошок (500 г) | Fisher Scientific | C272-500 |
| Размер 6-0 Швы с C-1 иглы (стерильный, шелк, черный, плетеные,Невсасываемые, 18 "Length; коробка из 36) | Roboz | SUT-1073-11 |
| Reflex клип объекта применения (для 9 мм клипов) | Инструменты Всемирной Precision | 500345 |
| 9-мм нержавеющей стали Reflex клипы (100/box) | Инструменты Всемирной Precision | 500346 |
Animal Care:
| Наименование (описание / кол-во) | Поставщик | Номер по каталогу |
| 0,9% раствор хлорида натрия инъекций (без консервантов, 20 мл) | Hospira | 0409-4888-20 |
| Полное Homeothermic системы одеяло с гибкий зонд (средний, 115 В переменного тока, 60 Гц) | Гарвардский аппарата | 507222F |
Хирургическое Platforм и ретракторы:
(Куплены в местном хозяйственном магазине)
| Имя (описание /) | Количество |
| Платформа из нержавеющей стали (молотый; ~ 12 "x12" x1 / 8 ") | 1 |
| Кнопка магниты (Пример: Eclipse E825) | 3 |
| Болты из нержавеющей стали (3: "Да, Диаметр Определяется магнитов Button) | 3 |
| Гайки из нержавеющей стали (размер подходит для болтов) | 9 |
| Резинки (Light напряжения) | 3 |
| Насекомые выводов (с обеих сторон Бент к форме крючки) | 3 |
Полу-Thins:
| Наименование (описание / кол-во) | Поставщик </ STRONG> | Номер по каталогу |
| Параформальдегид (1 кг) | Sigma-Aldrich | P6148-1 кг |
| Диаммоний фосфат натрия безводный (500 г, для приготовления фосфатный буфер) | Fisher Scientific | S375-500 |
| Одноосновного фосфата натрия безводный (1 кг, используются для подготовки фосфатный буфер) | Fisher Scientific | AC38987-0010 |
| Глутаральдегид (50%, 10 х 10 мл) | Тед Пелла, Inc | 18431 |
| Осмия (4% водный, 10 х 10 мл) | Тед Пелла, Inc | 18465 |
| Окиси пропилена (450 мл) | Тед Пелла, Inc | 18601 |
| Код для вставки 812 (комплект для жестких блоков / высокой контрастностью изображения) | Электронная микроскопия наук | 14120 |
| Toluidiпе Blue (25 г) | Тед Пелла, Inc | 19451 |
Всего горы мышц Подготовка и иммуногистохимического:
| Наименование (описание / кол-во) | Поставщик | Номер по каталогу |
| Параформальдегид (1 кг) | Sigma-Aldrich | P6148-1 кг |
| Диаммоний фосфат натрия безводный (500 г, для приготовления фосфатный буфер) | Fisher Scientific | S375-500 |
| Одноосновного фосфата натрия безводный (1 кг, используются для подготовки фосфатный буфер) | Fisher Scientific | AC38987-0010 |
| 10% BSA Разбавитель / Блокирование решения (200 мл) | Киркегор & Perry Laboratories, Inc | 50-61-00 |
| Тритон Х-100 (100 мл) | Dot Научно инкорпорейтед | 9002-93-1 |
| Глицин, 98% (1 кг) | Fisher Scientific | AC12007-0010 |
| Ткань-Tek Cryo-OCT соединений (на примере 12, 4 унции бутылки) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (2 фунта Kit) | Fisher Scientific | NC9492579 |
| Нержавеющая сталь насекомых пальцы, размер 1 (100/pkg) | Изобразительных средств наук | 26001-40 |
| Tetramethylrhodamine-A-бунгаротоксина (0,5 мг) | Sigma-Aldrich | T0195-.5MG |
| Мышь моноклональных антител против SMI-312 (0,1 мл) | Covance | SMI-312R |
| Мышь моноклональных антител против SV2 (0,1 мл) | Развития исследований Hybridoma банка (DSHB) | SV2 |
| Кролик Polyклонального антитела против GAP-43 | Novus биологические | NB300-143 |
| Flourescein сопряженных антимышиного IgG, Fcγ Подкласс 1 Удельный | Джексон ImmunoResearch | 11 5-095-205 |
| DyLight 649 Сопряженные Donkey Anti-IgG кролика | Джексон ImmunoResearch | 711-495-152 |
| 4 ',6-диамидино-2-фенилиндола (DAPI, dilactate, 10 мг) | Invitrogen | D3571 |
| Vectashield Монтаж среднего (10 мл) | Vector Laboratories | H-1000 |
| SuperFrost Plus микроскопа (белый, Размеры: 75 х 25 мм, в упаковке 144) | Fisher Scientific | 12-550-15 |
| Fisherfinest Премиум покровные стекла (размер: 40 х 22 мм, в упаковке 1 гр.) | Fisher Scientific | 12-548-5C |
Ссылки
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены