A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكمي للاستعمار الفطرية، تولد الأبواغ، وإنتاج السموم الفطرية عن طريق اختبارات بيولوجية على النواة
* These authors contributed equally
In This Article
Summary
ودفع الدمار الذي محاصيل الحبوب من قبل الفطريات بذرة اصابة العديد من الجهود البحثية من أجل فهم أفضل النباتات الممرض التفاعلات. لدراسة بذور للفطريات التفاعلات في إعداد مختبر، طورنا طريقة قوية لالكمي للاستنساخ الفطرية، والكتلة الحيوية، وتلوث بالسموم الفطرية باستخدام اختبارات بيولوجية على نواة.
Abstract
وتعفن الحبوب بواسطة البذور تصيب الفطريات يشكل واحدا من أكبر التحديات الاقتصادية في جميع أنحاء العالم لإنتاج الحبوب، ناهيك عن مخاطر جسيمة على صحة الإنسان والحيوان. بين إنتاج الحبوب، الذرة يمكن القول إن أكثر المحاصيل تضررا، وذلك بسبب العوامل المسببة للأمراض التي يسببها خسائر في سلامة الحبوب والبذور تلوث بالسموم الفطرية. والسموم الفطرية وهما الأكثر انتشارا ومشكلة لمزارعي الذرة والأغذية والأعلاف والمعالجات الأفلاتوكسين و fumonisin، التي تنتجها النكهات الرشاشيات وverticillioides فيوزاريوم، على التوالي.
وقد أثبتت الدراسات التي أجريت مؤخرا في التفاعلات الجزيئية النباتية الممرض وعد في فهم آليات محددة مرتبطة ردود مصنع للعدوى الفطرية وتلوث بالسموم الفطرية 1،2،3،4،5،6. لأن العديد من المعامل تستخدم المقايسات نواة لدراسة النباتات والممرض التفاعلات، وهناك حاجة لطريقة موحدة لقياس العوامل البيولوجية المختلفة، لذلكويمكن النتائج من المختبرات المختلفة العابرة للتفسير. عن وسيلة قوية وقابلة للتكرار لتحاليل الكمية على البذور، وضعنا نواة المقايسات في المختبر، وطرق لاحق لتحديد نمو الفطريات، والكتلة الحيوية، وتلوث بالسموم الفطرية. يتم تلقيح أربع حبات الذرة معقمة في قوارير الزجاج مع تعليق الفطرية (10 6)، وحضنت لمدة محددة سلفا. ثم يتم اختيار عينة قوارير للتعداد من غبيرات بواسطة تحليل الكتلة الحيوية عدادة الكريات، إرغوستيرول المستندة إلى الأداء العالي اللوني السائل (HPLC)، تقدير الأفلاتوكسين باستخدام أسلوب AflaTest مقياس التألق، وتقدير fumonisin بواسطة HPLC.
Protocol
1. نواة الذرة الأحيائي
- قبل أسبوعين، والثقافة ومسببات الأمراض الفطرية على أجار البطاطس سكر العنب (PDA) في 28 درجة مئوية.
- حدد حبات مع حجم وشكل مماثل، يفضل أن يكون بالارض حتى وضع مستوى مع الجزء السفلي من قنينة الأحيائي، والمكان في 50 مل من أنابيب صقر. يجب ان يكون قد تم تحديد إنتاج الحبوب في وقت واحد في نفس البيئة لضمان سن مماثل البذور وتكوين الأيض.
- السطح تعقيم الحبوب عن طريق هز أنابيب في درجة حرارة الغرفة لمدة 5 دقائق مع الايثانول 70٪، 1 دقيقة مع الماء المعقم، و 10 دقائق مع هيبوكلوريت الصوديوم 6٪. شطف، ثلاث مرات، لمدة 5 دقائق في كل مرة، مع الماء المعقم في حين يهز استمرار. حبات اتركها حتى تجف على مناشف ومشبع.
- لتسهيل عدوى من النكهات الرشاشيات، إنشاء جرح صغير على جانبي الجنين بإبرة G 18 إلى عمق 0.5 سم. ومع ذلك، في تجربتنا وهناك حاجة أكبر للعدوى الجرح verticillioides فيوزاريوم. الerefore، واستخدام شفرة حلاقة لقطع في جانب جنين على عمق 0.5 مم.
- إعداد تعليق اللقاح عن طريق كشط لوحات مثقف في حوالي 5 مل من محلول مشبع توين-20 0.01٪ لتحرير الجراثيم وإزالة المشيجة عن طريق الجاذبية من خلال تصفية ما لا يقل عن 4 طبقات من القماش القطني مشبع. حساب تركيز بوغ مع عدادة الكريات والتكيف مع جراثيم 6 10 / مل لأ. النكهات أو F. verticillioides. إذا كان استخدام الأنواع الأخرى من العوامل المسببة للأمراض أو المضيف، فمن المهم لتقييم تركيز اللقاح للعدوى المناسبة.
- إنشاء غرفة الرطوبة في وعاء من البلاستيك (29.2 سم X 18.7 سم X 8.3 سم) واصطف مع خمسة ورقة من المناشف الورقية و 100 مل من الماء المعقم. وينبغي أن الغرفة لا يمكن إضافة ماء أو الهواء وضيق والماء طوال تجربة إضافية للحفاظ على مناشف ورقية رطبة.
- 4 حبات مكان الى مشبع قارورة 20 مل التلألؤ والزجاج، وتسجيل كتلة كل منها. تطعيم مع 200 تعليق بوغ ميكرولتر،وكأب، ودوامة لحبات معطف بالتساوي مع تعليق. ترخي مباراة دولية للسماح بحرية تبادل الهواء والمكان إلى غرفة الرطوبة.
ملاحظة: للحصول على البذور أو الفطريات أخرى غير تلك المذكورة في هذه الأساليب، وكمية اللقاح المطلوبة قد تكون مختلفة، وينبغي أن تستمد تجريبيا.
- احتضان حبات تحت الضوئية 12-h-light/12-h-dark عند 28 درجة مئوية لمدة 7 أيام أو حتى المطلوب.
2. غبيرات التعداد
- بعد فترة العدوى، وإضافة 5 مل من مشبع 0.01٪ توين-20 إلى قارورة تحتوي على حبات التلألؤ المصابة ودوامة تماما لمدة 1 دقيقة.
- باستخدام طرف ماصة واسعة الجوف، تمييع فورا عن طريق تحويل منفصلين 200 aliquots ميكرولتر من تعليق بوغ في أنابيب 2.0 مل تحتوي على إيبندورف 1.8 مل من 0.01٪ توين-20 (أو تمييع حسب الحاجة تبعا لعدوى).
- تعداد كل قسامة 200 ميكروليتر مرتين مع عدادة الكريات 4ومقارنة مستويات غبيرات بين المعالجات.
3. الأفلاتوكسين الكمي
- إضافة حبات من 1 إلى 50 عينة كأس خلاط مل مع 20 مل من الميثانول من 80٪ و 0.05 جم كلوريد الصوديوم، والغطاء، ومزيج بسرعة عالية لمدة 1 دقيقة.
- وضع ورقة مرشح مخدد أكثر من وعاء جمع نظيفة وتصب في استخراج مرشح.
- نقل 10 مل من الراشح إلى وعاء نظيف، إضافة 20 مل المقطر H 2 O، وتخلط جيدا.
- مرشح عينة من خلال مرشح ميكرون 1.5 مجهرية زجاج في كوب نظيف.
- تطبق 1 مل من المستخلص المرشح لاختبار منظمة المعونة القانونية وعمود، وذلك باستخدام الهواء المضغوط، وإجبار استخراج تصفيتها من خلال العمود بمعدل 1-2 قطرات / 2 حتى تفرغ.
- غسل العمود مرتين مع 1 مل من O 2 H المقطر وتمر عبر العمود في 1-2 قطرة / الثانية، حتى الهواء يأتي من خلال.
- أزل عمود مع 1ml من 100٪ HPLC الميثانول في الصف 1-2 قطرة / من الدرجة الثانية التي تم جمعها في كوفيت الزجاج.
- إضافة1 مل من المطور اختبار منظمة المعونة القانونية إلى شطافة وتخلط جيدا. كفيت مكان إلى معايرة مقياس التألق وقرأت في 60 ثانية.
ملاحظة: عند استخدام بروتوكول Aflatest FGIS، يتم حساب قياس من مقياس التألق يستند الى 50 غراما الأولي للعينة المستخرجة في 100 مل. إذا كنت تنظر في التخفيف من العينة مع الماء، وتطبيق 1 مل إلى عمود يمثل 0.166 غرام من العينة. لذلك، عند تعديل البروتوكول، تحتاج إلى أن تأخذ في الاعتبار الاختلافات في حجم العينة، والحل استخراج الأولي. على سبيل المثال، يتم استخراج 2 غرام من الحبوب في الميثانول مل 20 80٪. هذا هو 0.1 غرام / مل. عندما يخلط 1 مل من هذه العينة مع مل من الماء 2، نسبة العينة في السائل هو الآن 0.033 غرام / مليلتر. إذا كان هذا النموذج يعطي قراءة مقياس التألق من 100 جزء من البليون، ويستند تركيز الفعلي على نسبة من العينة إلى 0،166، وهذا هو، جزء من البليون = (0.166 غرام X 100 جزء من البليون) / جرام 0.1)، أو جزء من البليون 166. لquantifi الأفلاتوكسين البديلالأساليب الموجبة، أنظر المرجع 7.
4. Fumonisin B1 (FB1) تحليل
- عندما يزرع فطر على حبات الذرة، واستخراج عينات بين عشية وضحاها مع 10 مل من الأسيتونيتريل / المياه (50/50، V / V) في درجة حرارة الغرفة دون تحريض. بعد ذلك، مزيج من خلاصة (2 مل) مع ماء منزوع الأيونات (6 مل)، وتطبيق هذا المزيج (8 مل) مباشرة إلى مرحلة الاستخراج C-18 الصلبة.
- قبل تحميل عينة، شرط مسبق استخراج مرحلة C-18 صلب عمود بواسطة الشطف مع 2 مل من الأسيتونيتريل تليها 2 مل من الماء.
- بعد تحميل العينة، يتم غسلها العمود مع 2 مل من الماء تليها 2 مل من الأسيتونيتريل / المياه (15/85، V / V). ومزال عينة للتحليل HPLC (التي تحتوي على FB1) مع 2 مل من الأسيتونيتريل / المياه (70/30، V / V).
- Derivatize FB1 مع O-phthaldehyde (OPA) عن طريق تحويل 0.1 مل من شطافة عمود إلى قارورة تحتوي على 0،1 العازلة بورات مل (0.05 متر بوريك الصوديوم M acid/0.05 بورات [50/50، V / V]، ودرجة الحموضة 8.5) و 0.1 مل OPA (0.1 ملغ / مل في acetonitrile مع 0.5٪ - المركابتويثانول).
- وقف رد فعل بعد 10 دقيقة عن طريق إضافة 0.5 مل من حمض البوريك acetonitrile/0.01 M (40/60، V / V).
- تحليل FB1 على نظام شيمادزو LC-20AT HPLC مجهزة عمود التحليلية المواد المستنفدة للأوزون Zorbax (4.6 150 مم) وطول موجي متغير Shimatzu RF-10Axl كاشف مضان (إثارة 335 نيوتن متر / انبعاث 440 نيوتن متر).
- ويتم استخدام الانحدار الخطي (مذيب ج: acetonitrile/0.1 فوسفات الصوديوم M (40/60)، ودرجة الحموضة 3.3؛ ب المذيب: الأسيتونيتريل / 0،1 فوسفات الصوديوم M (60/40)، ودرجة الحموضة 3.3) وبرنامج التدرج هو كما يلي: 100٪ A. إلى ب 100٪ في 10 B، دقيقة 100٪ لمدة 5 دقائق
- تحليل FB1 المعايير HPLC، وتستخدم القياسات منطقة ذروة لتوليد منحنى القياسية. بعد ذلك، تحديد مستوى FB1 في عينة من خلال مقارنة مع مناطق ذروة FB1 منحنى القياسية.
5. إرغوستيرول التحليل
- ثقافة الفطر على حبات الذرة لمدة 7-14 يوما.
- بعد فترة الحضانة، إضافة 10 مل من الكلوروفورم: ميثأنول (2:1، V / V) في كل قارورة. وأضاف مرة واحدة، هز العينات جيدا واحتضان ثم قوارير في الظلام في درجة حرارة الغرفة لمدة 24 ساعة.
- بعد 24 ساعة، منبذة العينات، وجمع طاف وتصفيتها من خلال 0،45 غشاء نايلون أم.
- حقن العينة مباشرة إلى نظام شيمادزو LC-20AT HPLC مجهزة عمود 4،6 المواد المستنفدة للأوزون C18 يو (200، 250 ± 4.6 ملم)، والحزب الديمقراطي الاشتراكي شيمادزو-20A UV / VIS للكشف عن مجموعة لمراقبة بمبلغ 282 نانومتر.
- استخدام الميثانول (100٪) في معدل تدفق 1.5 مل / دقيقة كما في الطور المتحرك. تحديد الكمي للإرغوستيرول في عينات من خلال مقارنة عينات من مناطق الذروة إلى منحنى معيار المتولدة من HPLC الصف إرغوستيرول.
6. ممثل النتائج
بعد التلقيح والحضانة في غرفة الرطوبة لمدة يومين أو ثلاثة أيام، وينبغي أن نمو الفطريات تبدأ في الظهور على الألباب. وينبغي أن سبعة ايام بعد العلاج، والنمو الخضري على النباتات المعالجة تكون واضحة للعيان، whilيجب أن تكون الضوابط ه وهمية غير مصاب (الشكل 1B، أعلى). فترات أطول حضانة تفضي إلى النمو الخضري أكثر غزير (الشكل 1B، أسفل). وفقا للشروط الواردة في هذا التقرير، الشكل (2G)، أ. النكهات من النوع البري اتفية 3357 الحد الأقصى للقيم المعروضة من الاستعمار، وتراكم الأفلاتوكسين، والإنتاج غبيرات في 8 و 6 و 8 أيام، على التوالي (الشكل 2، AC). ومع ذلك، عندما تمت مقارنة تلوث بالسموم الفطرية و conidiation لكل وحدة من إرغوستيرول، لاحظ أعلى مستويات في 4 و 6 أيام، على التوالي (الشكل 2، DE). الشكل 2F يلخص هذه الفطرية الكتلة الحيوية التي تعتمد على أقصى قدر من الملاحظات القيمة. ومن المثير للاهتمام، ما بين 4-6 أيام بعد التلقيح، وحبات تمر النووي تدهور حامض، كما رأينا من قبل الجيش الملكي النيبالي مجموع من عينات على المسار في الوقت (الشكل 2H، أسفل).
العديد من الدراسات، بما في ذلك منطقتنا، لديها examinإد F. verticilliodies عدوى في حبات الذرة 2،8،9،10،11،12 واستخدمت بنجاح 7-13 أيام من الوقت نقاط عن الملاحظات. باستخدام الأساليب المذكورة في هذه الوثيقة، fumonisin مستويات تتراوح ما بين 3،500-8،000 نانوغرام / غرام من نواة 4،13 ومستويات إرغوستيرول مجموعة من 5،000-10،000 نانوغرام / غرام من نواة 14،13. ويبين الشكل 3 قمم ممثل عن fumonisin (أعلى) وإرغوستيرول (القاع ) من HPLC المخططات الاستشرابية. ويمكن أيضا قياس إرغوستيرول تنفذ عبر الأطياف الامتصاصية 15.
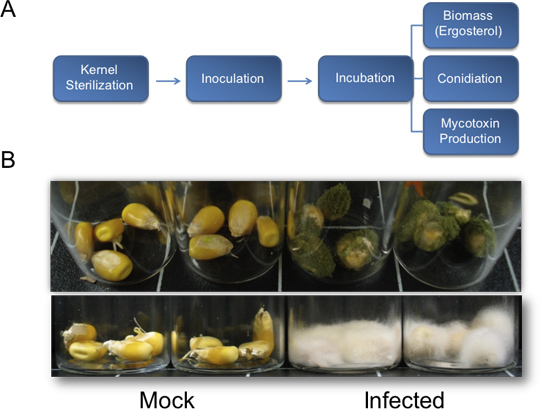
الشكل 1. الرسم البياني لتقدير حجم الكتلة الحيوية الفطرية، تولد الأبواغ، وإنتاج السموم والنتائج ممثل عن النمو الخضري من اختبارات بيولوجية على نواة. أ) الرسم البياني تحدد طريقة وصفها لتقدير حجم العوامل البيولوجية الأساسية المستخدمة لتقييم المرضية الفطرية على حبات الذرة. ب) الممثلنتائج اختبارات بيولوجية على نواة. أعلى، أ. النكهات (NRRL3357) النمو الخضري على حبات الذرة في الخلفية B73 الوراثية. تم تلقيح البذور مع 200 ميكرولتر من 10 مل / 6 جراثيم والصور أخذت 7 تلقيح آخر أيام. أسفل، F. verticillioides تلقيح الألباب في B73 خلفية إصابة 13 يوما آخر. تم تلقيح الحبوب مع 200 ميكرولتر من الجراثيم 6 10 / مل.
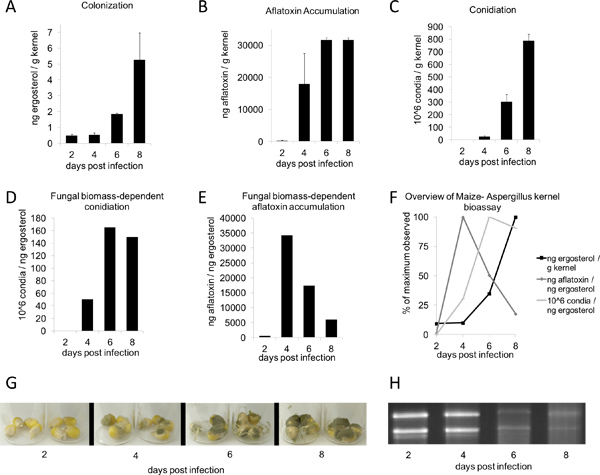
الشكل 2. نواة النكهات الرشاشيات الأحيائي وقتا بالطبع. تم تلقيح B73 حبات مع 200 ميكرولتر من الجراثيم 6 10 / مل تعليق النكهات الرشاشيات غبيري والمحتضنة ل2-8 أيام (G). تم تحديد جميع القيم من متوسط الوزن الجاف من 4 حبات (ن = 3-4؛ متوسط ± SE). A) وتم قياس كمية الاستعمار (على أساس إرغوستيرول) والأفلاتوكسين (B)، و conidiation (ج) استخدام الأساليب المذكورة أعلاه. E) يتم عرض الافلاتوكسين و conidiation (F)بوصفها وظيفة من الكتلة الحيوية الفطرية التي تقاس من خلال إرغوستيرول ح. F) القيم القصوى لإرغوستيرول، تراكم الأفلاتوكسين، و conidiation بوصفها وظيفة من الكتلة الحيوية الفطرية - لاحظ القيم أقصى لكل كمية تم تعيين إلى 100٪. (H) 1 ميكروغرام لكل حارة من الحمض النووي الريبي من مجموع بالطبع الوقت.
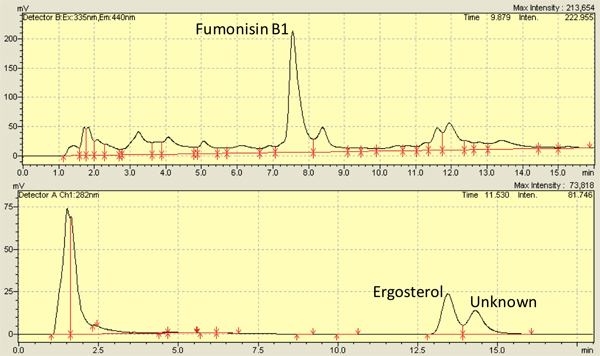
الشكل 3. الممثل السائل عالية الأداء اللوني (HPLC) المخططات الاستشرابية عن B1 fumonisin (أعلى) وإرغوستيرول (القاع) معزولة عن حبات المصابين verticillioides فيوزاريوم (M3125).
Discussion
لقد تم اختبار الطرق الموضحة هنا على نطاق واسع وثبت أن تكون قوية في توليد نتائج قابلة للقياس الكمي للاستعمار الفطرية، تولد الأبواغ، وإنتاج السموم الفطرية. وعلاوة على ذلك، ينبغي أن تكون قابلة للتطبيق هذه الأساليب على البذور من الأنواع النباتية الأخرى التي هي عرضة للتلوث مع الفطريات mycotoxig...
Disclosures
ليس لدي ما يكشف.
Acknowledgements
نود أن نشكر براندون هاسيت وكارلوس اورتيز لمساعدتها التقنية. وأيد هذا العمل من قبل جبهة الخلاص الوطني منح المعهد المصرفي، 0544428، 0951272، IOS، ودائرة الرقابة الداخلية 0925561 إلى Kolomiets الدكتور مايكل، والمعهد الوطني وزارة الزراعة الأميركية للأغذية والزراعة (NIFA)، م ع تربية النبات ومنحة التعليم # 2010-85117 -20539 إلى الدكاترة. سيث موراي، Isakeit توماس، وKolomiets مايكل.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج # | |
| البطاطس سكر العنب آجار | فيشر العلمية دورة | S71659A | |
| توين-20 | فيشر العلمية دورة | BP337-100 | |
| البلاستيك حضانة حاوية | Sterilite | 1713LAB06 | |
| خلاط | Vicam | 20200 | |
| 24 سم مزمر تصفية ورقات | Vicam | 31240 | |
| 1.5 ميكرون مجهرية زجاج | Vicam | 31955 | |
| منظمة المعونة القانونية اختبار عمود | Vicam | G1024 | |
| Afrla اختبار المطور | Vicam | 32010 | |
| الميثانول | Vicam | 35016 | |
| الأسيتونيتريل | فيشر العلمية دورة | AC14952-0025 | |
| الإيثانول | فيشر Scientifc | AC39769-0025 | |
| C-18 استخلاص الطور الصلب العمود (الإعدادية عمود SPE سبتمبر C18) | فيشر العلمية دورة | 60108-304 | |
| O-phthalaldehyde (OPA) | سيغما كميكال | 79760-5G | |
| حمض البوريك | فيشر العلمية دورة | BP168-500 | |
| بورات الصوديوم | فيشر العلمية دورة | RDCS0330500 | |
| المركابتويثانول | فيشر العلمية دورة | 45-000-231 | |
| شيمادزو HPLC LC-20AT (مضخة) | شيمادزو أجهزة علمية، وشركة | LC-20AT | |
| Zorbax المواد المستنفدة للأوزون العمود (4.6x150mm) | اجيلنت تكنولوجيز | 443905-902 | |
| Shimatzu RF-10Axl كاشف مضان | شيمادزو أجهزة علمية، وشركة | RF-10AXL | |
| فوسفات الصوديوم | فيشر العلمية دورة | AC38987-0010 | |
| FB1 المعايير | سيغما شركة الكيميائية | F1147-1mg | |
| الكلوروفورم | VWR | MK444410 | |
| 13 مرشح حقنة ملم مع 0.45 غشاء نايلون أم (HPLC) | بظلالها علوم الحياة | 4426 | |
| إرغوستيرول | سيغما الدريخ | 45480-50G-F | |
| التلألؤ قوارير | VWR | 66021-602 | |
| كلوريد الصوديوم | Vicam | G1124 |
References
- Tsitsigiannis, D. I., Keller, N. P. Oxylipins as developmental and host-fungal communication signals. Trends Microbiol. 15, 109-118 (2007).
- Gao, X., Shim, W. -. B., Göbel, C., Kunze, S., Feussner, I., Meeley, R., Balint-Kurti, P., Kolomiets, M. Disruption of a maize 9-lipoxygenase results in increased resistance to fungal pathogens and reduced levels of contamination with mycotoxin fumonisin. Mol. Plant-Microbe Interact. 20, 922-933 (2007).
- Brodhagen, M., Tsitsigiannis, D. I., Hornung, E., Goebel, C., Feussner, I., Keller, N. P. Reciprocal oxylipin-mediated cross-talk in the Aspergillus - seed pathosystem. Mol. Microbiol. 67, 378-391 (2008).
- Gao, X., Brodhagen, M., Isakeit, T., Brown, S. H., Göbel, C., Betran, J., Feussner, I., Keller, N. P., Kolomiets, M. V. Inactivation of the lipoxygenase ZmLOX3 increases susceptibility of maize to Aspergillus spp. Mol. Plant-Microbe Interact. 22, 222-231 (2009).
- Gao, X. Q., Kolomiets, M. V. Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28, 79-88 (2009).
- Mukherjee, M., Kim, J. -. E., Park, Y. -. S., Kolomiets, M. V., Shim, W. -. B. Regulators of G protein signaling in F. verticillioides mediate differential host-pathogen responses on non-viable versus viable maize kernels. Mol. Plant Pathol. 12, 479-491 (2011).
- Zheng, M. Z., Richard, J. L., Binder, J. A review of rapid methods for the analysis of mycotoxins. Mycopathologia. 161, 261-273 (2006).
- Bacon, C. W., Bennett, R. M., Hinton, D. M., Voss, K. A. Scanning electron microscopy of Fusarium moniliforme within asymptomatic maize kernels and kernels associated with equine leukoencephalomalacia. Plant Dis. 76, 144-148 (1992).
- Munkvold, G. P., Hellmich, R. L., Rice, L. G. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and nontransgenic hybrids. Plant Dis. 83, 130-138 (1999).
- Sagaram, U. S., Shaw, B. D., Shim, W. -. B. Fusarium verticillioides GAP!, a gene encoding a putative glycolipid-anchored surface protein, participates in conidiation and cell wall structure but not virulence. Microbiol. 153, 2850-2861 (2007).
- Shim, W. -. B., Flaherty, J. E., Woloshuk, C. P. Comparison of Fumonisin B1 biosynthesis in maize germ and degermed kernels by Fusarium verticillioides. J. Food Protect. 66, 2116-2122 (2003).
- Shim, W. -. B., Woloshuk, C. P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1. Appl. Environ. Micrbiol. 67, 1607-1612 (2001).
- Christensen, S. A. . Conversation with: Won-Bo Shim. , (2011).
- Shin, J. -. H., Shim, W. -. B. Characterization of PPR1 and PPR2, genes encoding regulatory subunits of protein phosphatase 2A in Fusarium verticillioides. Phytopathol. 99, S119 (2009).
- Breivik, O. N., Owades, J. L. Spectrophotometric Semimicrodetermination of Ergosterol in Yeast. Yeast. Agric. and Food Chem. 5, 360-363 (1957).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved