Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная грибковой колонизации, спорогенеза, и производство микотоксинов Использование ядра Биопробы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Опустошение зерновых культур на семенные заражения грибками вызвало многочисленные исследовательские усилия, чтобы лучше понять растение-патоген взаимодействия. Для изучения семенного грибковых взаимодействия в лабораторных условиях, мы разработали надежный метод для количественного грибковых воспроизводства биомассы и микотоксинами с ядром биопробы.
Аннотация
Гниение зерна на семенные заражения грибками представляет собой одну из величайших экономических проблем во всем мире производство зерновых, не говоря уже о серьезных рисков для здоровья человека и животных. Среди производство зерновых, кукурузы, вероятно, наиболее пострадавших сельскохозяйственных культур, в связи с возбудителем вызванного потерями в целостности зерна и загрязнения микотоксинами зерна. Две самые распространенные и проблемные микотоксинов на кукурузу производители пищевых продуктов и кормов процессоров афлатоксин и фумонизин, выпускаемых Aspergillus flavus и Fusarium verticillioides соответственно.
Недавние исследования в области молекулярной растительного взаимодействия возбудителя продемонстрировал перспективы в понимании конкретных механизмов, связанных с завода ответ на грибковую инфекцию и микотоксинами 1,2,3,4,5,6. Поскольку многие лаборатории используют ядро тесты для изучения растительного взаимодействия возбудителя, есть необходимость в стандартизированный метод для количественного различных биологических параметров, поэтомуРезультаты разных лабораториях могут быть перекрестно интерпретировать. Для надежной и воспроизводимой средствами для количественного анализа на семена, мы разработали в лаборатории анализов ядра и последующее методов количественного роста грибов, биомасса, и микотоксинами. Четыре ядра кукурузы стерилизовать засевают в стеклянных флаконах с грибковыми подвески (10 6) и выдерживают в течение определенного периода. Пример флаконов, то выбранный для перечисления конидий на гемоцитометра, эргостерола на основе биомассы анализа высокоэффективной жидкостной хроматографии (ВЭЖХ), афлатоксин количественного использования AflaTest флуорометр метод и фумонизин количественного ВЭЖХ.
протокол
1. Кукуруза биопроб ядра
- За две недели до, культуры грибным патогенам картофеля на Декстроза агар (PDA) при 28 ° C.
- Выбор ядра с аналогичным размером и формой, желательно плоский, чтобы они лежали на одном уровне с нижней биопроб флаконы, и место в 50 мл пробирки сокола. Ядра выбраны, должны быть произведены одновременно в той же среде для обеспечения того же возраста семян и метаболитов состава.
- Поверхностные стерилизовать ядра путем встряхивания пробирки при комнатной температуре в течение 5 минут с 70% этанола, 1 минута стерильной водой и 10 минут с 6% гипохлорита натрия. Промыть, три раза в течение 5 минут каждый раз, стерильной водой, продолжая дрожать. Пэт ядра на сухой автоклавного полотенца.
- Для облегчения заражения Aspergillus flavus, создать небольшую рану на эмбрион о бок с 18 G иглой на глубину 0,5 см. Однако, по нашему опыту большого рану необходимо для инфекции Fusarium verticillioides. Therefore, используйте лезвие, чтобы разрезать на эмбрионов стороны на глубине 0,5 мм.
- Подготовка посевной подвески, очищая культурных плит примерно в 5 мл автоклавного 0,01% Твин-20 решение освободить споры и мицелий удалить самотеком фильтрации по крайней мере 4 слоя марли автоклавного. Вычислить концентрацию спор с гемоцитометра и приспособиться к 10 6 спор / мл для А. flavus или F. verticillioides. При использовании других видов патогенов или хозяин, важно оценить концентрацию инокулята для соответствующих инфекций.
- Создать камере влажности в пластиковый контейнер (29,2 см х 18,7 см х 8,3 см) выложены пять листов бумажных полотенец и 100 мл стерильной воды. Палата не водой или герметичные и дополнительной воды должны быть добавлены по всему эксперимент держать влажным бумажным полотенцем.
- Место четыре ядра в автоклаве 20 мл флакон сцинтилляционных стекло и записывать их массы. Инокулировать 200 мкл суспензии спор,шапка, и вихрь, чтобы равномерно слой ядра с подвеской. Открутите крышки свободно позволить обмен воздуха и места в камере влажности.
Примечание: для семян или других грибов, не указанных в этих методах, количество посевного необходимые может быть различным и должен быть получен экспериментально.
- Инкубируйте ядра под 12-h-light/12-h-dark фотопериода при 28 ° С в течение 7 дней до желаемой.
2. Конидии Перечисление
- После того, как инфекция период, добавляют 5 мл из автоклавного 0,01% Твин-20 сцинтилляционных флаконах, содержащих инфицированные ядра и вихрь полностью в течение 1 минуты.
- Использование широкого диаметра кончика пипетки, сразу разводить путем передачи двух отдельных 200 мкл аликвоты суспензии спор в 2,0 мл пробирок Эппендорф содержащие 1,8 мл 0,01% Твин-20 (или разбавлять по мере необходимости в зависимости от инфекции).
- Перечислять каждые 200 мкл дважды гемоцитометра 4и сравнить уровни конидий между процедурами.
3. Афлатоксин количественного
- Добавить ядер от 1 образца 50 мл блендере чашку с 20 мл 80% метанола и 0,05 г NaCl, крышки и смесь на высокой скорости в течение 1 мин.
- Положите бумагу складчатый фильтр на чистом сосуде сбора и залить экстракт в фильтр.
- Трансфер 10 мл фильтрата чистый сосуд, добавить 20 мл дистиллированной H 2 O, и хорошо перемешать.
- Фильтры образца через 1,5 мкм стекло микрофибры фильтр в чистую чашку.
- Применяют по 1 мл фильтрованного экстракт колонке испытаний ФППА и с помощью сжатого воздуха, заставить экстракт фильтруют через колонку со скоростью 1-2 капли / сек до опустели.
- Промойте колонку в два раза с 1 мл дистиллированной H 2 O и проходят через колонку 1-2 капли / сек, пока воздух проникает.
- Элюции колонку с 1 мл на 100% ВЭЖХ метанолом на 1-2 капли / секунду собраны в стеклянную кювету.
- Добавлять1 мл ФППА испытаний разработчика для элюата и хорошо перемешать. Место в кювет калиброванный флуорометр и читать на 60 сек.
Примечание: При использовании Aflatest Федеральной инспекции зерна протокол измерений от флуорометр рассчитывается на первоначальный 50 г образца добывается в 100 мл. Если вы считаете, разведение образца воды, 1 мл наносили на колонку представляют 0,166 грамм образца. Таким образом, при изменении протокола, необходимо принимать во внимание различия в размере выборки и исходного раствора извлечения. Например, 2 г ядер извлекается в 20 мл 80% метанола. Это 0,1 г / мл. Когда 1 мл этого образца смешивают с 2 мл воды, доля образцов в жидком сейчас 0,033 г / мл. Если этот пример дает флуорометр чтения 100 частей на миллиард, фактическая концентрация основана на долю образца 0,166, то есть частей на миллиард = (0.166 грамм X 100 частей на миллиард) / 0,1 грамма), или 166 частей на миллиард. Для альтернативных афлатоксин quantifiкатион методы, см. ссылку 7.
4. Фумонизин B1 (FB1) анализ
- Когда грибы выращивают на кукурузных зерен, извлечение образцов ночь с 10 мл ацетонитрил / вода (50/50 об / об) при комнатной температуре без перемешивания. Затем смешать экстракт (2 мл) с дистиллированной водой (6 мл), и применять эту смесь (8 мл) непосредственно в C-18 твердофазной экстракции.
- Перед загрузкой образца, условие C-18 колонке твердых фаз добычи промывка 2 мл ацетонитрила, затем 2 мл воды.
- После загрузки образца колонку промывали 2 мл воды, затем 2 мл ацетонитрил / вода (15/85 о / о). Пример для ВЭЖХ (содержащий FB1) элюировали 2 мл ацетонитрил / вода (70/30 о / о).
- Derivatize FB1 с о-phthaldehyde (OPA), передав 0,1 мл колонки элюата на флакон, содержащий 0,1 мл боратного буфера (0,05 М борной acid/0.05 М борат натрия [50/50 об /], рН 8,5) и 0,1 OPA мл (0,1 мг / мл ацетонаitrile 0,5% - меркаптоэтанол).
- Остановить реакцию через 10 минут, добавляя 0,5 мл acetonitrile/0.01 M борной кислоты (40/60, о / о).
- Анализ FB1 на ВЭЖХ Shimadzu LC-20AT системы с аналитическими Zorbax ОРВ колонки (4.6 150 мм) и переменной длиной волны Shimatzu RF-10Axl детектор флуоресценции (возбуждение 335 нм / излучение 440 нм).
- Линейный градиент используется (растворитель: acetonitrile/0.1 М фосфат натрия (40/60), рН 3,3; растворитель В: ацетонитрил / 0,1 М фосфата натрия (60/40), рН 3,3) и градиент программы выглядит следующим образом: 100% до 100% В в течение 10 мин, 100% В в течение 5 мин.
- Анализ FB1 стандартов высокоэффективной жидкостной хроматографии, а пик измерений области используются для создания калибровочной кривой. Впоследствии, количественно FB1 уровня в образце путем сравнения площадей пиков с FB1 стандартной кривой.
5. Анализ Эргостерин
- Культура гриба на кукурузных зерен в течение 7-14 дней.
- После инкубационного периода, добавляют 10 мл хлороформа и методовanol (2:1, об / об) в каждом флаконе. После добавления, встряхните и образцы, а затем инкубируют флаконы в темное время суток при комнатной температуре в течение 24 часов.
- После 24 часов, центрифуги образцов, и собрать супернатант и фильтровать через 0,45 мкм мембрана нейлона.
- Вводите образца непосредственно в ВЭЖХ Shimadzu LC-20AT система оснащена 4,6 U ODS-C18 колонке (200 А, 250 В ± 4,6 мм) и Shimadzu SPD-20A UV / VIS детектор установлен контроль на 282 нм.
- Использование метанола (100%) при скорости потока 1,5 мл / мин в качестве подвижной фазы. Определить количественный эргостерола в образцах путем сравнения площадей пиков образцов стандартных кривой, полученной от ВЭЖХ-класса эргостерола.
6. Представитель Результаты
После посева и инкубации в камере влажности в течение двух-трех дней роста грибов должны начать появляться на ядрах. Семь дней после лечения, вегетативный рост на обработанных растений должны быть четко видны, whilэлектронного макета управления должны быть инфицированы (рис. 1В, сверху). Период инкубации больше способствуют более обильное вегетативного роста (рис. 1В, внизу). В условиях, описанных здесь (рис. 2G), А. flavus дикого типа NRRL 3357 отображается максимальные значения колонизации, афлатоксин накопления и конидий производства на 8, 6 и 8 дней соответственно (рис. 2, AC). Однако, когда заражение микотоксинами и conidiation сравниваются единицы эргостерола, наибольшие объемы наблюдались в 4 и 6 дней, соответственно (рис. 2, DE). Рисунок 2F суммирует эти биомассы грибов зависит от максимального значения наблюдений. Интересно, что 4-6 дней после прививки, ядра подвергаются деградации нуклеиновых кислот, с точки зрения общей РНК из образцов, на время курса (рис. 2Н, внизу).
Несколько исследований, включая нашу собственную, есть Examinред F. verticilliodies инфекции на кукурузу ядра 2,8,9,10,11,12 и успешно используется 7-13 дней, как раз-точек для наблюдения. Используя методы, описанные здесь, фумонизин уровнях в диапазоне от 3,500-8,000 нг / г ядра 4,13 и эргостерола уровнях в диапазоне от 5000-10000 нг / г ядра 14,13. Рисунок 3 показывает, представитель пиков фумонизин (вверху) и эргостерина (нижняя ) от ВЭЖХ хроматограммы. Измерение эргостерола может также осуществляться через поглощение спектров 15.
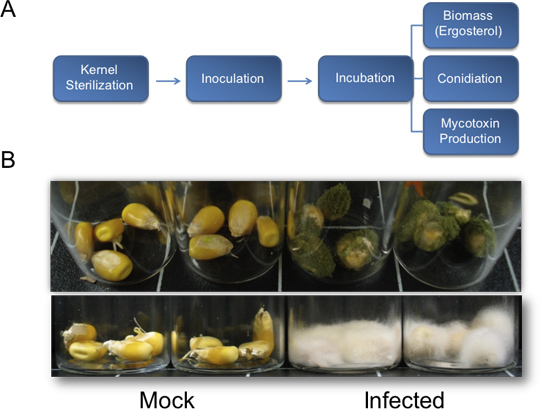
Рисунок 1. Принципиальная схема для количественной оценки биомассы грибов, спорогенеза и микотоксинов производства и репрезентативных результатов для вегетативного роста из ядра биопробы. А) Схема с изложением описанного метода для количественного определения фундаментальных биологических параметров, используемых для оценки грибковых патогенез кукурузы ядра. Б) представительрезультаты для ядра биопробы. Top А. flavus (NRRL3357) вегетативный рост на кукурузу ядер в B73 генетического фона. Семена были привиты с 200 мкл 10 6 спор / мл, а фотографии были сделаны через 7 дней после прививки. Нижняя, Ф. verticillioides привиты ядер в B73 фоне 13 дней после заражения. Ядра были привиты с 200 мкл 10 6 спор / мл.
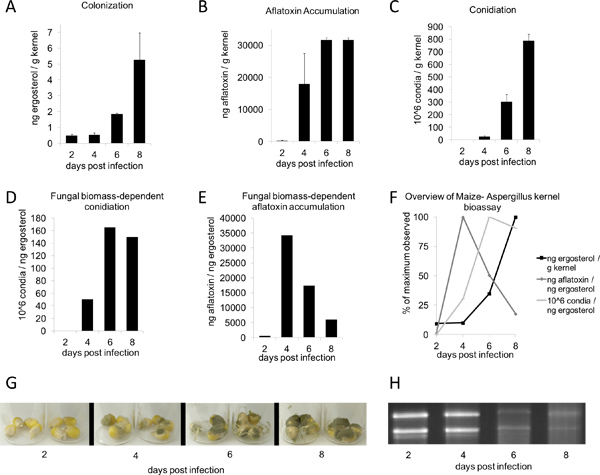
Рисунок 2. Aspergillus flavus ядро биопроб время курса. B73 ядра были привиты с 200 мкл 10 6 спор / мл Aspergillus flavus конидиального подвески и выдерживают в течение 2-8 дней (G). Все значения были определены из сухой средний вес 4 ядра (п = 3-4; среднее ± SE). А) Колонизация (на основе эргостерола), (B) афлатоксин, и (C) conidiation были количественно, используя методы, описанные выше. E) афлатоксин и (F) conidiation отображаютсяв зависимости от биомассы грибов, как измеряется через час эргостерола. F) Максимальные значения для эргостерола, афлатоксин накопления и conidiation в зависимости от биомассы грибов - максимальное значение для каждого количества наблюдается была установлена на 100%. (H) 1 мкг на полосу полной РНК время от курса.
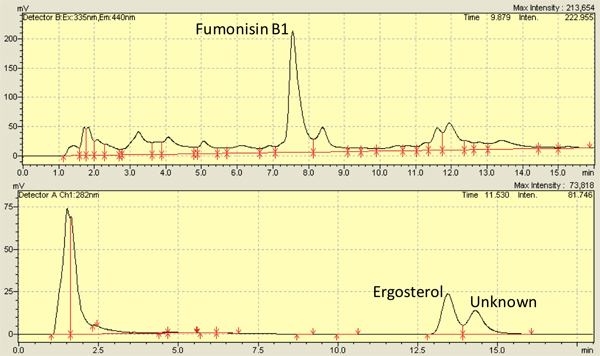
Рисунок 3. Представитель высокоэффективной жидкостной хроматографии (ВЭЖХ) хроматограмм для фумонизин B1 (вверху) и эргостерина (внизу), выделенных из ядер инфицированных verticillioides Fusarium (M3125).
Обсуждение
Методы, описанные здесь, были испытания и доказала свою надежную в поколение количественные результаты для грибковой колонизации, спорогенеза и производство микотоксинов. Кроме того, эти методы должны быть применимы к семенам из других видов растений, которые чувствительны к загряз...
Раскрытие информации
Мне нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Брэндона Хассетт и Карлос Ортис за техническую помощь. Эта работа была поддержана грантами NSF IOB-0544428, 0951272, IOS, IOS-а 0925561 доктора Майкла Коломиец, а также Министерства сельского хозяйства США Национального института сельского хозяйства и продовольствия (НИФА), Afri селекции растений и образования грант № 2010-85117 -20539 до доктора. Сет Мюррей, Томас Isakeit, и Михаил Коломиец.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Каталог # | |
| Картофельный агар с декстрозой | Фишер Scientifc | S71659A | |
| Твин-20 | Фишер Scientifc | BP337-100 | |
| Пластиковый контейнер инкубации | Sterilite | 1713LAB06 | |
| Смеситель | Vicam | 20200 | |
| 24 см складчатый фильтр документы | Vicam | 31240 | |
| 1,5 мкм стекла из микроволокна | Vicam | 31955 | |
| ФППА испытания колонки | Vicam | G1024 | |
| Afrla испытаний разработчика | Vicam | 32010 | |
| Метанол | Vicam | 35016 | |
| Ацетонитрил | Фишер Scientifc | AC14952-0025 | |
| Этанол | Фишер научtifc | AC39769-0025 | |
| C-18 твердых колонке экстракции (Prep сентября SPE C18 колонке) | Фишер Scientifc | 60108-304 | |
| O-phthalaldehyde (OPA) | Sigma Chemical Co | 79760-5г | |
| Борная кислота | Фишер Scientifc | BP168-500 | |
| Борат натрия | Фишер Scientifc | RDCS0330500 | |
| Меркаптоэтанол | Фишер Scientifc | 45-000-231 | |
| Shimadzu HPLC LC-20AT (насос) | Shimadzu Scientific Instruments, Inc | LC-20AT | |
| Zorbax ОРВ колонке (4.6x150mm) | Agilent Technologies | 443905-902 | |
| Shimatzu RF-10Axl детектор флуоресценции | Shimadzu Scientific Instruments, Inc | RF-10AXL | |
| Фосфат натрия | Фишер Scientifc | AC38987-0010 | |
| FB1 стандартам | Sigma Chemical Ко | F1147-1 мг | |
| Хлороформ | VWR | MK444410 | |
| 13 мм шприц фильтр 0,45 мкм мембрана нейлона (HPLC) | Наука Жизни Pall | 4426 | |
| Эргостерол | Sigma-Aldrich | 45 480-50G-F | |
| Сцинтилляционных флаконов | VWR | 66021-602 | |
| Хлористый натрий | Vicam | G1124 |
Ссылки
- Tsitsigiannis, D. I., Keller, N. P. Oxylipins as developmental and host-fungal communication signals. Trends Microbiol. 15, 109-118 (2007).
- Gao, X., Shim, W. -. B., Göbel, C., Kunze, S., Feussner, I., Meeley, R., Balint-Kurti, P., Kolomiets, M. Disruption of a maize 9-lipoxygenase results in increased resistance to fungal pathogens and reduced levels of contamination with mycotoxin fumonisin. Mol. Plant-Microbe Interact. 20, 922-933 (2007).
- Brodhagen, M., Tsitsigiannis, D. I., Hornung, E., Goebel, C., Feussner, I., Keller, N. P. Reciprocal oxylipin-mediated cross-talk in the Aspergillus - seed pathosystem. Mol. Microbiol. 67, 378-391 (2008).
- Gao, X., Brodhagen, M., Isakeit, T., Brown, S. H., Göbel, C., Betran, J., Feussner, I., Keller, N. P., Kolomiets, M. V. Inactivation of the lipoxygenase ZmLOX3 increases susceptibility of maize to Aspergillus spp. Mol. Plant-Microbe Interact. 22, 222-231 (2009).
- Gao, X. Q., Kolomiets, M. V. Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28, 79-88 (2009).
- Mukherjee, M., Kim, J. -. E., Park, Y. -. S., Kolomiets, M. V., Shim, W. -. B. Regulators of G protein signaling in F. verticillioides mediate differential host-pathogen responses on non-viable versus viable maize kernels. Mol. Plant Pathol. 12, 479-491 (2011).
- Zheng, M. Z., Richard, J. L., Binder, J. A review of rapid methods for the analysis of mycotoxins. Mycopathologia. 161, 261-273 (2006).
- Bacon, C. W., Bennett, R. M., Hinton, D. M., Voss, K. A. Scanning electron microscopy of Fusarium moniliforme within asymptomatic maize kernels and kernels associated with equine leukoencephalomalacia. Plant Dis. 76, 144-148 (1992).
- Munkvold, G. P., Hellmich, R. L., Rice, L. G. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and nontransgenic hybrids. Plant Dis. 83, 130-138 (1999).
- Sagaram, U. S., Shaw, B. D., Shim, W. -. B. Fusarium verticillioides GAP!, a gene encoding a putative glycolipid-anchored surface protein, participates in conidiation and cell wall structure but not virulence. Microbiol. 153, 2850-2861 (2007).
- Shim, W. -. B., Flaherty, J. E., Woloshuk, C. P. Comparison of Fumonisin B1 biosynthesis in maize germ and degermed kernels by Fusarium verticillioides. J. Food Protect. 66, 2116-2122 (2003).
- Shim, W. -. B., Woloshuk, C. P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1. Appl. Environ. Micrbiol. 67, 1607-1612 (2001).
- Christensen, S. A. . Conversation with: Won-Bo Shim. , (2011).
- Shin, J. -. H., Shim, W. -. B. Characterization of PPR1 and PPR2, genes encoding regulatory subunits of protein phosphatase 2A in Fusarium verticillioides. Phytopathol. 99, S119 (2009).
- Breivik, O. N., Owades, J. L. Spectrophotometric Semimicrodetermination of Ergosterol in Yeast. Yeast. Agric. and Food Chem. 5, 360-363 (1957).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены