Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification de la colonisation fongique, sporogénèse, et la production de mycotoxines utilisant Bioassays noyau
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La dévastation des cultures céréalières par moisissures infectant les semences a incité de nombreux efforts de recherche afin de mieux comprendre les interactions plante-pathogène. Pour étudier les semences fongiques interactions dans un environnement de laboratoire, nous avons développé une méthode robuste pour la quantification de la reproduction des champignons, la biomasse et contamination par les mycotoxines en utilisant des essais biologiques du noyau.
Résumé
Le pourrissement des grains par moisissures infectant les semences constitue l'un des plus grands défis économiques dans le monde entier à la production de céréales, sans parler des risques graves pour la santé humaine et animale. Parmi la production céréalière, le maïs est sans doute la culture la plus touchée, en raison de pertes dues à des agents pathogènes dans l'intégrité du grain et de la contamination des semences par les mycotoxines. Les deux mycotoxines les plus répandues et problématiques pour les producteurs de maïs et de la nourriture et les transformateurs d'alimentation sont les aflatoxines et les fumonisines, produite par Aspergillus flavus et Fusarium verticillioides, respectivement.
Des études récentes dans moléculaires des interactions plante-pathogène ont montré prometteur dans la compréhension des mécanismes spécifiques associés à des réponses de plantes à l'infection fongique et 1,2,3,4,5,6 contamination par les mycotoxines. Parce que de nombreux laboratoires sont en utilisant des tests du noyau pour étudier les interactions plante-pathogène, il existe un besoin pour une méthode normalisée pour quantifier différents paramètres biologiques, de sorterésultats des différents laboratoires peuvent être contre-interprété. Pour un moyen fiable et reproductible pour des analyses quantitatives sur les semences, nous avons développé des essais du noyau en laboratoire et des méthodes suivantes pour quantifier la croissance fongique, la biomasse, et la contamination par les mycotoxines. Quatre grains de maïs stérilisés sont inoculés dans des flacons en verre avec une suspension fongique (10 6) et incubé pendant une période prédéterminée. Flacons à échantillon sont ensuite sélectionnés pour le dénombrement des conidies par l'analyse de la biomasse hémocytomètre, basée sur l'ergostérol par chromatographie liquide haute performance (HPLC), la quantification aflatoxine en utilisant une méthode AflaTest fluorimètre, et la quantification des fumonisines par HPLC.
Protocole
1. Essais biologiques grain de maïs
- Deux semaines avant, la culture des champignons pathogènes sur Potato Dextrose Agar (PDA) à 28 ° C.
- Sélectionnez les noyaux avec la taille et de forme semblables, de préférence aplatie afin qu'ils jeter au niveau du fond des flacons de dosage biologique, et les placer dans des tubes de 50 ml de faucon. Noyaux sélectionnés doivent avoir été produites simultanément dans un même environnement pour assurer l'âge de semences ou de composition analogue métabolite.
- Surface stériliser les noyaux en secouant tubes à température ambiante pendant 5 minutes avec de l'éthanol 70%, 1 minute à l'eau stérile, et à 10 minutes avec de l'hypochlorite de sodium à 6%. Rincez, trois fois, pendant 5 minutes à chaque fois, avec de l'eau stérile tout en secouant continue. Séchez noyaux sur des serviettes en autoclave.
- Pour faciliter l'infection par Aspergillus flavus, créer une petite plaie sur l'embryon à côte avec une aiguille G 18 à la profondeur de 0,5 cm. Cependant, dans notre expérience une grande blessure est nécessaire pour Fusarium verticillioides infection. Therefore, utilisez une lame de rasoir pour couper dans l'embryon à côte à une profondeur de 0,5 mm.
- Préparer suspension de l'inoculum en grattant les plaques de culture dans environ 5 ml de autoclavé 0,01% de Tween-20 une solution pour libérer des spores et mycélium retirer par la gravité de filtrage à travers au moins 4 couches de gaze stérilisé à l'autoclave. Calculer la concentration de spores avec hémocytomètre et ajuster à 10 6 spores / ml pour A. flavus ou F. verticillioides. Si vous utilisez d'autres espèces de pathogènes ou de l'hôte, il est important d'évaluer les concentrations d'inoculum pour l'infection appropriées.
- Créer une chambre d'humidité dans un récipient en plastique (29,2 cm X 18,7 cm X 8,3 cm) bordée de cinq feuilles de papier essuie-tout et 100 ml d'eau stérile. Chambre n'est pas à l'eau ou à l'air et l'eau supplémentaire devrait être ajoutée tout au long de l'expérience pour garder des serviettes en papier humide.
- Placer les quatre noyaux dans une fiole de 20 ml autoclavé à scintillation en verre et d'enregistrer leur masse. Inoculer avec 200 ul suspension de spores,bouchon, et le vortex de noyaux enrober avec la suspension. Desserrer les écrous de permettre un échange librement l'air et le lieu dans la chambre de l'humidité.
Remarque: Pour les graines ou les champignons autres que ceux décrits dans ces méthodes, la quantité d'inoculum requis peut être différente et doit être déduit empiriquement.
- Incuber les noyaux sous une photopériode 12-h-light/12-h-dark à 28 ° C pendant 7 jours ou jusqu'à ce que désiré.
2. Énumération conidies
- Après la période d'infection, ajoutez 5 ml d'autoclave 0,01% de Tween-20 dans des flacons à scintillation contenant des grains infectés et vortex à fond pendant 1 minute.
- En utilisant une pointe de gros calibre pipette, diluer immédiatement en transférant deux séparés 200 aliquotes de suspension de spores dans des tubes Eppendorf 2,0 ml contenant 1,8 ml de 0,01% de Tween-20 (ou diluer au besoin en fonction de l'infection).
- Dénombrer chaque partie aliquote de 200 ul à deux reprises avec un hémocytomètre 4et comparer les niveaux de conidies entre les traitements.
3. Quantification par l'aflatoxine
- Ajouter les grains de 1 échantillon à 50 ml tasse de mélangeur avec 20 ml de méthanol à 80% et de 0,05 g de NaCl, la couverture et de mélange à haute vitesse pendant 1 min.
- Placer un papier filtre plissé sur un navire de collecte propre et verser dans le filtre extrait.
- Transférer 10 ml du filtrat dans un récipient propre, ajouter 20 ml d'eau distillée H 2 O, et bien mélanger.
- Échantillon de filtre à travers un filtre 1,5 um en microfibres de verre dans une tasse propre.
- Appliquer une ml d'extrait filtré pour colonne d'essai AFLA et, à l'aide d'air comprimé, forcer l'extrait filtré à travers la colonne à une vitesse de 1-2 gouttes par seconde jusqu'à ce vidés.
- Laver la colonne deux fois avec 1 ml d'eau distillée H 2 O et de passer à travers la colonne à 1-2 goutte / seconde jusqu'à ce que l'air qui en sort.
- Colonne Eluer avec 1ml de 100% méthanol de qualité HPLC à un 1-2 goutte / seconde vitesse collectées dans une cuve en verre.
- Ajouter1 ml de Developer test AFLA à éluat et bien mélanger. Cuvette en place fluorimètre calibré et lire à 60 sec.
Remarque: Lorsque vous utilisez le protocole Aflatest FGIS, la mesure de la fluorimètre est calculée sur la base environ 50 grammes d'échantillon initiales extraites dans 100 ml. Si vous considérez la dilution de l'échantillon avec de l'eau, le ml 1 appliqué à une colonne représente 0,166 grammes d'échantillon. Ainsi, lors de la modification du protocole, vous devez prendre en compte les différences de taille de l'échantillon et la solution d'extraction initiale. Par exemple, 2 grammes de grains sont extraits dans 20 ml de méthanol à 80%. C'est 0,1 grammes par ml. Lorsque 1 ml de l'échantillon est mélangé avec 2 ml d'eau, la proportion de l'échantillon dans le liquide est 0,033 grammes par ml. Si cet échantillon donne une lecture fluoromètre de 100 ppb, la concentration réelle est basée sur la proportion de l'échantillon à 0,166, c'est-à-ppb = (0,166 gramme X 100 ppb) / 0,1 gramme), ou 166 ppb. Pour l'aflatoxine autre quantificationcation des méthodes, voir la référence 7.
4. Fumonisine B1 (FB1) Analyse
- Lorsque champignon est cultivé sur des grains de maïs, d'extraire des échantillons de nuit avec 10 ml d'acétonitrile / eau (50/50, v / v) à température ambiante sans agitation. Par la suite, mélanger l'extrait (2 ml) avec de l'eau déminéralisée (6 ml), et appliquer ce mélange (8 ml) directement à l'extraction en phase solide C-18.
- Avant de charger l'échantillon, condition sine qua non de la colonne en phase C-18 solide d'extraction par rinçage avec 2 ml d'acétonitrile suivie par 2 ml d'eau.
- Après chargement de l'échantillon, la colonne est lavée avec 2 ml d'eau suivi par 2 ml d'acétonitrile / eau (15/85, v / v). Exemple de l'analyse HPLC (contenant FB1) est élue avec 2 ml d'acétonitrile / eau (70/30, v / v).
- Dérivatiser FB1 avec o-phtaldéhyde (OPA) par le transfert de 0,1 ml de la éluat de la colonne à un flacon contenant 0,1 ml de tampon borate (0,05 M borique acid/0.05 de sodium M borate [50/50, v / v], pH 8,5) et 0,1 ml OPA (0,1 mg / ml dans l'acétoneitrile avec 0,5% - mercaptoéthanol).
- Arrêter la réaction après 10 minutes en ajoutant 0,5 ml d'acide acetonitrile/0.01 M borique (40/60, v / v).
- Analyser FB1 sur un Shimadzu HPLC LC-20AT système équipé d'une colonne analytique Zorbax ODS (4,6 à 150 mm) et une longueur d'onde variable Shimatzu RF-10Axl détecteur de fluorescence (excitation 335 nm / émission 440 nm).
- Un gradient linéaire est utilisé (solvant A: acetonitrile/0.1 M phosphate de sodium (40/60), pH 3,3; solvant B: acétonitrile / phosphate de sodium 0,1 M (60/40), pH 3,3) et le programme de gradient est la suivante: Un 100%. à 100% de B en 10 min, B 100% pendant 5 minutes
- Analyser FB1 normes par HPLC, et les mesures de surface de pic sont utilisées pour générer la courbe standard. Par la suite, de quantifier le niveau FB1 dans un échantillon en comparant les zones de pointe avec FB1 courbe standard.
5. L'ergostérol Analyse
- Culture du champignon sur les grains de maïs pendant 7-14 jours.
- Après la période d'incubation, ajouter 10 ml de chloroforme: methAÑOL (2:1, v / v) dans chaque flacon. Une fois ajouté, secouez bien et échantillons puis incuber les flacons dans l'obscurité, à température ambiante pendant 24 heures.
- Après 24 heures, centrifuger les échantillons, et de recueillir le surnageant et le filtrer à travers une membrane de nylon 0,45 um.
- Injecter l'échantillon directement dans un Shimadzu HPLC LC-20AT système équipé d'un 4,6 U ODS C18 (200 A, 250 ± 4,6 mm) et un Shimadzu SPD-20A UV / VIS détecteur réglé pour surveiller à 282 nm.
- Utilisation du méthanol (100%) à un débit de 1,5 ml / min, tel que la phase mobile. Déterminer la quantification de l'ergostérol dans les échantillons en comparant les zones de pointe d'échantillons à une courbe standard générée à partir de HPLC ergostérol.
6. Les résultats représentatifs
Après ensemencement et l'incubation dans une chambre humide pendant deux à trois jours, l'apparition de champignons commencent à apparaître sur les grains. Sept jours après le traitement, la croissance végétative des plantes traitées devraient être clairement visibles, tout en recueillantcontrôles électroniques des simulacres devrait être infectés (figure 1B, en haut). Les périodes de plus d'incubation sont propices à la croissance végétative plus abondante (figure 1B, en bas). Dans les conditions décrites dans les présentes (figure 2G), A. flavus de type sauvage NRRL 3357 affichaient des valeurs maximales de la colonisation, l'accumulation de l'aflatoxine, et la production des conidies à 8, 6, et 8 jours, respectivement (figure 2, AC). Toutefois, lorsque la contamination par les mycotoxines et conidiation ont été comparés par unité de l'ergostérol, les plus grands niveaux ont été observés à 4 et 6 jours, respectivement (figure 2, DE). Figure 2F résume ces fongiques biomasse dépendant de valeur maximale observations. Fait intéressant, entre 4-6 jours après l'inoculation, les noyaux subissent une dégradation acide nucléique, comme on le voit par l'ARN total à partir d'échantillons sur l'évolution temporelle (Figure 2H, en bas).
Plusieurs études, y compris la nôtre, ont examined F. verticilliodies infection sur les grains de maïs 2,8,9,10,11,12 et utilisé avec succès 7-13 jours que le temps des points d'observations. En utilisant les méthodes décrites ici, les fumonisines niveaux allant de 3,500-8,000 ng / g gamme noyau 4,13 et niveaux d'ergostérol de 5.000-10.000 ng / g de noyau 14,13. Figure 3 montre des pics représentatifs pour les fumonisines (en haut) et l'ergostérol (en bas ) à partir de chromatogrammes HPLC. Mesure de l'ergostérol peut également être réalisée via 15 des spectres d'absorption.
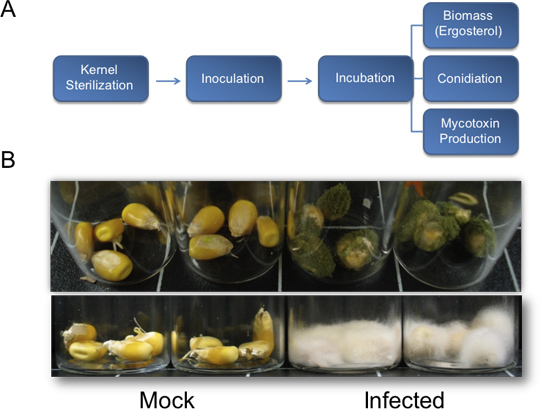
Figure 1. Diagramme pour la quantification de la biomasse fongique, sporogénèse, et la production de mycotoxines et des résultats représentatifs pour la croissance végétative à partir de bio-essais du noyau. Diagramme A) décrivant la méthode décrite pour la quantification des paramètres fondamentaux biologiques utilisés pour évaluer la pathogénie des champignons sur les grains de maïs. B) Représentantrésultats pour bioessais noyau. Haut, A. flavus (NRRL3357) sur la croissance végétative des grains de maïs dans l'arrière-plan B73 génétique. Les graines ont été inoculés avec 200 ul de 10 6 spores / mL et photos ont été prises 7 jours après l'inoculation. Bas, F. verticillioides inoculés dans les noyaux B73 fond après l'infection de 13 jours. Noyaux ont été inoculés avec 200 pi de 10 6 spores / mL.
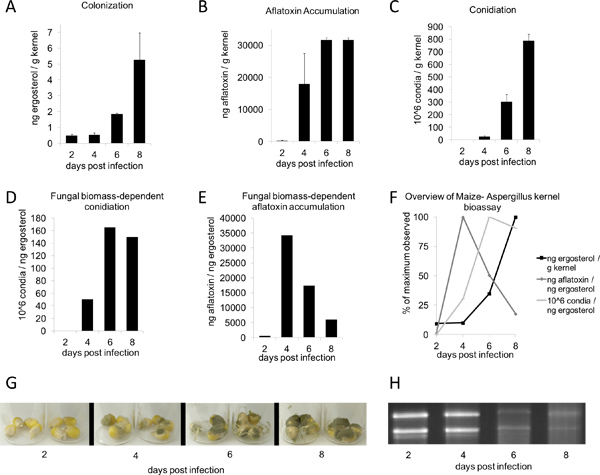
Figure 2. Bioessai Aspergillus flavus noyau temps-cours. B73 noyaux ont été inoculés avec 200 pi de 10 6 spores / ml Aspergillus flavus suspension de conidies et incubées pendant 2-8 jours (G). Toutes les valeurs ont été déterminées à partir de la moyenne du poids sec de 4 noyaux (n = 3-4; moyenne ± SE). A) La colonisation (basé sur l'ergostérol), (B) l'aflatoxine, et (C) ont été quantifiées à l'aide conidiation méthodes décrites ci-dessus. E) l'aflatoxine et (F) conidiation sont affichésen fonction de la biomasse fongique, telle que mesurée à h ergostérol. F) Les valeurs maximales pour l'ergostérol, l'accumulation de l'aflatoxine, et conidiation en fonction de la biomasse fongique - les valeurs maximales pour chaque quantité observée a été fixé à 100%. (H) 1 mg par voie d'ARN total de temps bien sûr.
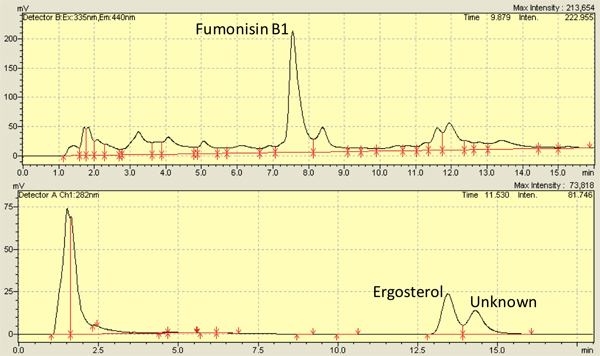
Figure 3. Représentant chromatographie liquide haute performance (HPLC) chromatogrammes pour les fumonisines B1 (en haut) et l'ergostérol (en bas) isolée à partir de grains infectés par Fusarium verticillioides (M3125).
Discussion
Les méthodes décrites ici ont été largement testées et éprouvées pour être robuste dans la génération des résultats quantifiables pour la colonisation fongique, sporogénèse, et la production de mycotoxines. En outre, ces méthodes devraient être applicables aux semences des espèces végétales autres qui sont sensibles à la contamination par des champignons (par exemple les arachides mycotoxigéniques, blé, coton, pistaches, etc.) Pour compétentes analyses d'interaction plante-pathogène, il est...
Déclarations de divulgation
Je n'ai rien à communiquer.
Remerciements
Nous tenons à remercier Brandon Hassett et Carlos Ortiz pour leur assistance technique. Ce travail a été soutenu par la NSF subventions IOB-0544428, 0951272-IOS, IOS et-0925561 au Dr Michael Kolomiets, et par l'Institut national de l'USDA pour l'alimentation et l'agriculture (NIFA), l'amélioration des plantes et de l'éducation AFRI Grant # 2010-85117 -20539 à MM. Seth Murray, Thomas Isakeit, et Kolomiets Michael.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Catalogue # | |
| Potato Dextrose Agar | Fisher Scientifique | S71659A | |
| Tween-20 | Fisher Scientifique | BP337-100 | |
| Récipient d 'incubation en plastique | Sterilite | 1713LAB06 | |
| Mixer | Vicam | 20200 | |
| 24 cm Filtres plissés | Vicam | 31240 | |
| 1,5 microfibres de verre pm | Vicam | 31955 | |
| Colonne de test afla | Vicam | G1024 | |
| Afrla test pour un développeur | Vicam | 32010 | |
| Le méthanol | Vicam | 35016 | |
| Acétonitrile | Fisher Scientifique | AC14952-0025 | |
| L'éthanol | Fisher Scientifc | AC39769-0025 | |
| Colonne C-18 extraction en phase solide (SPE Prep septembre colonne C18) | Fisher Scientifique | 60108-304 | |
| O-phtalaldéhyde (OPA) | Sigma Chemical Co | 79760-5g | |
| L'acide borique | Fisher Scientifique | BP168-500 | |
| Le borate de sodium | Fisher Scientifique | RDCS0330500 | |
| Mercaptoéthanol | Fisher Scientifique | 45-000-231 | |
| Shimadzu HPLC LC-20AT (pompe) | Shimadzu Scientific Instruments, Inc | CL-20AT | |
| Zorbax ODS colonne (4.6x150mm) | Agilent Technologies | 443905-902 | |
| Shimatzu RF-10Axl détecteur de fluorescence | Shimadzu Scientific Instruments, Inc | RF-10AXL | |
| Phosphate de sodium | Fisher Scientifique | AC38987-0010 | |
| FB1 normes | Sigma Chemical Co. | F1147-1mg | |
| Chloroforme | VWR | MK444410 | |
| Filtre 13 mm seringue à 0,45 um membrane de nylon (HPLC) | Pall Life Science | 4426 | |
| L'ergostérol | Sigma-Aldrich | 45 480-50G-F | |
| Flacons à scintillation | VWR | 66021-602 | |
| Chlorure de sodium | Vicam | G1124 |
Références
- Tsitsigiannis, D. I., Keller, N. P. Oxylipins as developmental and host-fungal communication signals. Trends Microbiol. 15, 109-118 (2007).
- Gao, X., Shim, W. -. B., Göbel, C., Kunze, S., Feussner, I., Meeley, R., Balint-Kurti, P., Kolomiets, M. Disruption of a maize 9-lipoxygenase results in increased resistance to fungal pathogens and reduced levels of contamination with mycotoxin fumonisin. Mol. Plant-Microbe Interact. 20, 922-933 (2007).
- Brodhagen, M., Tsitsigiannis, D. I., Hornung, E., Goebel, C., Feussner, I., Keller, N. P. Reciprocal oxylipin-mediated cross-talk in the Aspergillus - seed pathosystem. Mol. Microbiol. 67, 378-391 (2008).
- Gao, X., Brodhagen, M., Isakeit, T., Brown, S. H., Göbel, C., Betran, J., Feussner, I., Keller, N. P., Kolomiets, M. V. Inactivation of the lipoxygenase ZmLOX3 increases susceptibility of maize to Aspergillus spp. Mol. Plant-Microbe Interact. 22, 222-231 (2009).
- Gao, X. Q., Kolomiets, M. V. Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28, 79-88 (2009).
- Mukherjee, M., Kim, J. -. E., Park, Y. -. S., Kolomiets, M. V., Shim, W. -. B. Regulators of G protein signaling in F. verticillioides mediate differential host-pathogen responses on non-viable versus viable maize kernels. Mol. Plant Pathol. 12, 479-491 (2011).
- Zheng, M. Z., Richard, J. L., Binder, J. A review of rapid methods for the analysis of mycotoxins. Mycopathologia. 161, 261-273 (2006).
- Bacon, C. W., Bennett, R. M., Hinton, D. M., Voss, K. A. Scanning electron microscopy of Fusarium moniliforme within asymptomatic maize kernels and kernels associated with equine leukoencephalomalacia. Plant Dis. 76, 144-148 (1992).
- Munkvold, G. P., Hellmich, R. L., Rice, L. G. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and nontransgenic hybrids. Plant Dis. 83, 130-138 (1999).
- Sagaram, U. S., Shaw, B. D., Shim, W. -. B. Fusarium verticillioides GAP!, a gene encoding a putative glycolipid-anchored surface protein, participates in conidiation and cell wall structure but not virulence. Microbiol. 153, 2850-2861 (2007).
- Shim, W. -. B., Flaherty, J. E., Woloshuk, C. P. Comparison of Fumonisin B1 biosynthesis in maize germ and degermed kernels by Fusarium verticillioides. J. Food Protect. 66, 2116-2122 (2003).
- Shim, W. -. B., Woloshuk, C. P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1. Appl. Environ. Micrbiol. 67, 1607-1612 (2001).
- Christensen, S. A. . Conversation with: Won-Bo Shim. , (2011).
- Shin, J. -. H., Shim, W. -. B. Characterization of PPR1 and PPR2, genes encoding regulatory subunits of protein phosphatase 2A in Fusarium verticillioides. Phytopathol. 99, S119 (2009).
- Breivik, O. N., Owades, J. L. Spectrophotometric Semimicrodetermination of Ergosterol in Yeast. Yeast. Agric. and Food Chem. 5, 360-363 (1957).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon