È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione di colonizzazione fungina, sporogenesi, e la produzione di micotossine Uso Bioassays Kernel
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La devastazione delle colture di cereali da semi-infezione funghi ha spinto numerosi sforzi di ricerca per comprendere meglio le interazioni pianta-patogeno. Per studiare le interazioni semi-fungine in un ambiente di laboratorio, abbiamo sviluppato un metodo affidabile per la quantificazione della riproduzione fungina, la biomassa, e la contaminazione da micotossine mediante biotest del kernel.
Abstract
La putrefazione di cereali da seme-infettanti funghi rappresenta una delle più grandi sfide economiche a livello mondiale di produzione di cereali, per non parlare di gravi rischi per la salute umana e animale. Tra la produzione di cereali, il mais è probabilmente la coltura più colpita, a causa di agenti patogeni indotte perdite di integrità del grano e di semi di contaminazione da micotossine. I due micotossine più diffuse e problematiche per i coltivatori di mais e degli alimenti e dei mangimi sono processori aflatossina e fumonisina, prodotta da Aspergillus flavus e Fusarium verticillioides, rispettivamente.
Recenti studi molecolari delle interazioni pianta-patogeno hanno dimostrato promessa la comprensione dei meccanismi specifici associati con le risposte delle piante alle infezioni fungine e contaminazione da micotossine 1,2,3,4,5,6. Poiché molti laboratori utilizzando saggi kernel per studiare le interazioni pianta-patogeno, vi è la necessità di un metodo standard per quantificare diversi parametri biologici, cosìrisultati dei diversi laboratori possono essere cross-interpretato. Per un mezzo robusto e riproducibili per le analisi quantitative sui semi, abbiamo sviluppato in laboratorio e metodi di test del kernel successivi per quantificare la crescita di funghi, biomasse e contaminazione da micotossine. Quattro chicchi di mais sterilizzati vengono inoculati in fiale di vetro con una sospensione fungina (10 6) e incubati per un periodo predeterminato. Vial vengono scelti per il conteggio di conidi mediante analisi biomassa emocitometro, ergosterolo basato mediante cromatografia liquida ad alta prestazione (HPLC), quantificazione aflatossine utilizzando un metodo AflaTest fluorometro, e quantificazione fumonisina mediante HPLC.
Protocollo
1. Kernel Bioassay mais
- Due settimane prima, la cultura dei patogeni fungini, in agar patata destrosio (PDA) a 28 ° C.
- Selezionare kernel con dimensioni e forma simili, preferibilmente appiattito in modo che giaceva a livello con la parte inferiore di fiale bioassay, e il luogo in provette da 50 ml Falcon. Kernel selezionati devono essere stati prodotti in concomitanza stesso ambiente per garantire età simile seme e la composizione metabolita.
- Superficie sterilizzare kernel agitando provette a temperatura ambiente per 5 minuti con il 70% di etanolo, 1 minuto con acqua sterile, e 10 minuti con ipoclorito di sodio al 6%. Risciacquare, tre volte, per 5 minuti ogni volta, con acqua sterile sotto agitazione continua. Kernel Pat secco su asciugamani in autoclave.
- Per facilitare infezione di Aspergillus flavus, crea una piccola ferita sull'embrione lato con un ago 18 G alla profondità di 0,5 cm. Tuttavia, nella nostra esperienza una ferita più grande è necessaria per l'infezione da Fusarium verticillioides. Therefore, utilizzare una lama di rasoio per tagliare nell'embrione lato ad una profondità di 0,5 mm.
- Preparare la sospensione inoculo raschiando coltivate in piastre di circa 5 ml di autoclavato 0,01% Tween-20 la soluzione per liberare le spore e rimuovere micelio per gravità filtrando attraverso almeno 4 strati di garza autoclavato. Calcolare la concentrazione di spore emocitometro e regolare a 10 6 spore / ml per A. flavus o F. verticillioides. Se si utilizzano altre specie di patogeni o di ospite, è importante valutare concentrazioni di inoculo per infezione appropriato.
- Creare una camera umida in un contenitore di plastica (29,2 cm X 18,7 cm X 8,3 cm) foderata con cinque fogli di carta da cucina e 100 ml di acqua sterile. Camera non è acqua o a tenuta d'aria e l'acqua va aggiunto tutto esperimento per mantenere i tovaglioli di carta umida.
- Inserire quattro kernel in un autoclavato fiala di scintillazione 20 ml di vetro e registrare la loro massa. Inoculare con 200 microlitri sospensione di spore,cap, e vortex per rivestire in modo uniforme kernel con sospensioni. Allentare i cappucci per consentire liberamente ricambio d'aria e il luogo in camera di umidità.
Nota: Per semi o funghi diversi da quelli descritti in questi metodi, la quantità di inoculo richiesto può essere diverso e dovrebbe essere derivato sperimentalmente.
- Incubare kernel sotto un fotoperiodo 12-h-light/12-h-dark a 28 ° C per 7 giorni o fino a quando desiderato.
2. Conidi Enumerazione
- Dopo il periodo di infezione, aggiungere 5 ml di autoclavato 0,01% Tween-20 a scintillazione fiale contenenti kernel infetti e vortex accuratamente per 1 minuto.
- Utilizzo di un ampio foro punta della pipetta, immediatamente diluire trasferendo due distinte aliquote 200 pl di sospensione di spore in 2.0 ml provette Eppendorf contenenti 1,8 ml di 0,01% Tween-20 (o se necessario diluire seconda infezione).
- Enumerare ogni 200 microlitri aliquota due volte con un emocitometro 4e confrontare i livelli di conidi tra i trattamenti.
3. Aflatossina Quantificazione
- Aggiungere kernel campione da 1 a 50 ml miscelatore tazza con 20 ml di 80% metanolo e 0,05 g di NaCl, coperchio e la miscela ad alta velocità per 1 min.
- Mettere un filtro a pieghe in un recipiente di raccolta pulito e versare estratto nel filtro.
- Trasferire 10 ml di filtrato in un recipiente pulito, aggiungere 20 ml di acqua distillata H 2 O, e mescolare bene.
- Campione di filtrare attraverso un filtro in microfibra 1,5 micron di vetro in una tazza pulita.
- Applicare 1 ml di estratto filtrato a test colonna Afla e, mediante aria compressa, forzare l'estratto filtrato attraverso la colonna ad una velocità di 1-2 gocce / secondo fino svuotati.
- Lavare la colonna due volte con 1 ml di acqua distillata H 2 O e passare attraverso la colonna a 1-2 goccia / secondo fino a quando l'aria passa attraverso.
- Colonna eluire con metanolo% 1ml di 100 HPLC ad un 1-2 goccia / secondo tasso raccolti in una cuvetta di vetro.
- Aggiungere1 ml di Developer test Afla di eluato e mescolare bene. Luogo in cuvetta fluorimetro tarato e leggere a 60 sec.
Nota: Quando si utilizza il protocollo Aflatest FGIS, la misura dal fluorimetro viene calcolata in base al verificarsi di un iniziale 50 grammi di campione estratto in 100 ml. Se si considera la diluizione del campione con acqua, il 1 ml applicato ad una colonna rappresenta 0,166 grammi di campione. Così, quando si modifica il protocollo, è necessario tener conto delle differenze di dimensione del campione e la soluzione di estrazione iniziale. Ad esempio, 2 grammi di kernel sono estratte in 20 ml di metanolo 80%. Questo è 0,1 grammi / ml. Quando 1 ml di questo campione viene miscelato con 2 ml di acqua, la proporzione del campione nel liquido è ora 0,033 grammi / ml. Se questo esempio fornisce una lettura fluorometro di 100 ppb, la concentrazione effettiva è basata sulla percentuale di campione di 0,166, cioè, ppb = (0,166 grammi X 100 ppb) / 0,1 grammo), o 166 ppb. Per le aflatossine quantifi alternativemetodi di cationi, vedere il riferimento 7.
4. Fumonisina B1 (FB1) Analisi
- Quando fungo è cresciuto su chicchi di mais, estrarre campioni overnight con 10 ml di acetonitrile / acqua (50/50, v / v) a temperatura ambiente senza agitazione. Successivamente, mescolare l'estratto (2 ml) con acqua deionizzata (6 ml), e applicare questa miscela (8 ml) direttamente al di estrazione in fase solida C-18.
- Prima di caricare campione, presupposto il C-18 solida colonna di estrazione in fase di risciacquo con 2 ml di acetonitrile seguito da 2 ml di acqua.
- Dopo aver caricato il campione, la colonna viene lavata con 2 ml di acqua seguita da 2 ml di acetonitrile / acqua (15/85, v / v). Campione per l'analisi HPLC (contenente FB1) viene eluito con 2 ml di acetonitrile / acqua (70/30, v / v).
- Derivatizzare FB1 con o-phthaldehyde (OPA), trasferendo 0,1 ml di eluato colonna ad una fiala contenente 0,1 ml di tampone borato (0,05 M borico acid/0.05 M sodio borato [50/50, v / v], pH 8,5) e 0,1 OPA ml (0,1 mg / ml in acetoneitrile con 0,5% - mercaptoetanolo).
- Arrestare la reazione dopo 10 minuti aggiungendo 0,5 ml di acetonitrile/0.01 M di acido borico (40/60, v / v).
- Analizzare FB1 su una HPLC Shimadzu LC-20at sistema dotato di una colonna analitica Zorbax ODS (4,6 150 mm) e una lunghezza d'onda variabile Shimatzu RF-10Axl fluorescenza (eccitazione 335 nm / emissione 440 nm).
- Un gradiente lineare viene usato (solvente A: acetonitrile/0.1 M fosfato di sodio (40/60), pH 3,3; solvente B: acetonitrile / 0,1 M fosfato di sodio (60/40), pH 3,3) e il programma è il seguente gradiente: A 100% al 100% B in 10 min, 100% B per 5 min.
- Analisi mediante HPLC standard FB1, e misurazioni di area di picco sono utilizzati per generare curva standard. Successivamente, quantificare FB1 livello in un campione confrontando le aree dei picchi con FB1 curva standard.
5. Analisi ergosterolo
- Cultura il fungo sulla chicchi di mais per 7-14 giorni.
- Dopo il periodo di incubazione, aggiungere 10 ml di cloroformio: methI LAVORI (2:1, v / v) in ciascun flacone. Una volta aggiunto, agitare bene e poi i campioni incubare fiale al buio a temperatura ambiente per 24 ore.
- Dopo 24 ore, centrifugare i campioni, e raccogliere il supernatante e filtrarli attraverso la membrana di nylon 0,45 um.
- Iniettare il campione direttamente in un HPLC Shimadzu LC-20at impianto dotato di 4,6 U ODS-C18 colonna (200 Å, 250 ± 4,6 mm) e uno Shimadzu SPD-20A UV / VIS rilevatore impostato per monitorare a 282 nm.
- Utilizzare metanolo (100%) ad una portata di 1,5 mL / min come fase mobile. Determinare quantificazione dell'ergosterolo in campioni confrontando aree di picco di campioni ad una curva standard generata da HPLC ergosterolo.
6. Risultati rappresentativi
A seguito di inoculo e l'incubazione in una camera umida per due o tre giorni, la crescita di funghi dovrebbero cominciare ad apparire sul kernel. Sette giorni dopo il trattamento, la crescita vegetativa sulle piante trattate devono essere chiaramente visibili, whilcontrolli elettronici finte dovrebbe essere infetto (Figura 1B, in alto). I periodi di incubazione più sono favorevoli a più copiosa crescita vegetativa (Figura 1B, in basso). Nelle condizioni descritte nel presente documento (Figura 2G), A. flavus wild-type NRRL 3357 valori visualizzati massimi di colonizzazione, l'accumulo di aflatossina, e la produzione di conidi a 8, 6, e 8 giorni, rispettivamente (Figura 2, AC). Tuttavia, quando la contaminazione da micotossine e conidiation sono stati confrontati per unità di ergosterolo, i livelli più elevati sono stati osservati a 4 e 6 giorni, rispettivamente (Figura 2, DE). Figura 2F riassume queste biomasse fungine-dipendenti il massimo valore osservazioni. È interessante notare che tra 4-6 giorni dopo l'inoculazione, i gherigli di subire la degradazione degli acidi nucleici, visto da RNA totale da campioni sul tempo-corso (Figura 2H, in basso).
Diversi studi, compresa la nostra, hanno esaed F. verticilliodies infezione chicchi di mais 2,8,9,10,11,12 e utilizzato con successo 7-13 giorni alla scadenza di punti per le osservazioni. Usando i metodi descritti in questa sede, la fumonisina gamma dei livelli da 3,500-8,000 ng / g gamma kernel 4,13 e livelli di ergosterolo da 5.000-10.000 ng / g kernel 14,13. La figura 3 mostra picchi rappresentativi per fumonisina (in alto) e dell'ergosterolo (in basso ) da cromatogrammi HPLC. Misurazione dell'ergosterolo può anche essere effettuata tramite spettri di assorbanza 15.
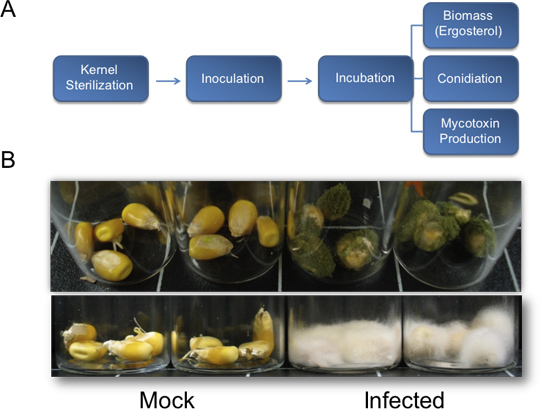
Figura 1. Diagramma di flusso per la quantificazione della biomassa fungina, sporogenesi, e la produzione di micotossine e dei risultati rappresentativi per la crescita vegetativa da biotest del kernel. A) Diagramma di flusso che illustra il metodo descritto per la quantificazione dei fondamentali parametri biologici utilizzati per valutare la patogenesi fungina sul chicchi di mais. B) Rappresentanterisultati di test biologici del kernel. Top, A. flavus (NRRL3357) la crescita vegetativa a chicchi di mais in background genetico B73. I semi sono stati inoculati con 200 microlitri di 10 6 spore / mL e la foto sono state scattate sette giorni dopo l'inoculazione. In basso, F. verticillioides inoculato kernel B73 in fondo dopo 13 giorni dall'infezione. Kernels sono state inoculate con 200 pl di 10 6 spore / mL.
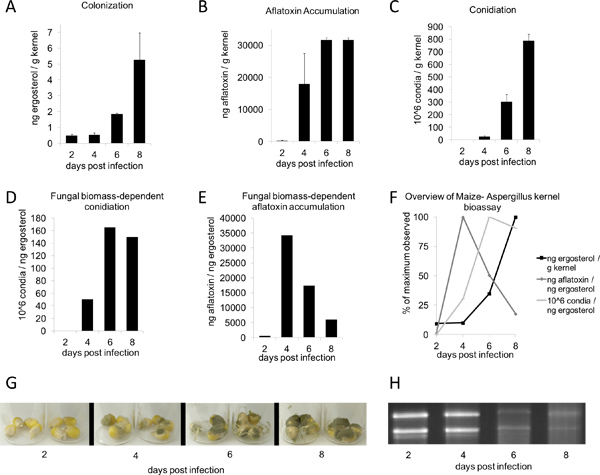
Figura 2. Aspergillus flavus biotest kernel time-course. B73 kernel sono state inoculate con 200 microlitri di 10 6 spore / ml sospensione Aspergillus flavus conidi e incubati per 2-8 giorni (G). Tutti i valori sono stati determinati dalla media peso a secco di 4 kernel (n = 3-4; media ± SE). A) colonizzazione (basato su ergosterolo), (B) aflatossina, e (C) conidiation sono stati quantificati usando i metodi descritti sopra. E) L'aflatossina e (F) conidiation vengono visualizzatiin funzione di biomassa fungina come misurata attraverso ergosterolo h. F) i valori massimi per ergosterolo, l'accumulo di aflatossina e conidiation in funzione della biomassa fungina - valori massimi per ogni quantità osservato è stato fissato al 100%. (H) 1 mg per ogni corsia di RNA totale di time-course.
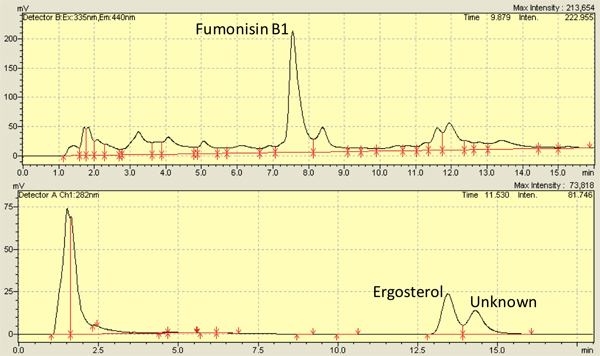
Figura 3. Rappresentativi High Performance cromatografia liquida (HPLC) cromatogrammi per la fumonisina B1 (in alto) e dell'ergosterolo (in basso) isolato dal kernel con infezione da Fusarium verticillioides (M3125).
Discussione
I metodi descritti qui sono stati ampiamente testati e di comprovata robustezza nella generazione di risultati quantificabili per la colonizzazione fungina, sporogenesi, e la produzione di micotossine. Inoltre, questi metodi dovrebbe essere applicabile a semi di altre specie di piante che sono sensibili alla contaminazione da funghi micotossigeni (es. arachidi, grano, cotone, pistacchi, ecc.) Per competenti pianta-patogeno analisi di interazione, è imperativo che i semi essere mantenuto in vita. Un sito piccola feri...
Divulgazioni
Non ho nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare Brandon Hassett e Carlos Ortiz per la loro assistenza tecnica. Questo lavoro è stato sostenuto dal contributi NSF IOB-0544428, 0951272-IOS, IOS-0925561 e al Dr. Michael Kolomiets, e dalla USDA National Institute of Food and Agriculture (NIFA), la selezione vegetale AFRI e borsa di studio # 2010-85117 -20.539 a Drs. Seth Murray, Thomas Isakeit e Kolomiets Michael.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Catalogo # | |
| Agar Potato Destrosio | Fisher Scientifico | S71659A | |
| Tween-20 | Fisher Scientifico | BP337-100 | |
| Incubazione contenitore di plastica | Sterilite | 1713LAB06 | |
| Miscelatore | VICAM | 20200 | |
| 24 centimetri filtro pieghettato Papers | VICAM | 31240 | |
| 1,5 um microfibra di vetro | VICAM | 31955 | |
| Afla test della colonna | VICAM | G1024 | |
| Afrla test Developer | VICAM | 32010 | |
| Metanolo | VICAM | 35016 | |
| Acetonitrile | Fisher Scientifico | AC14952-0025 | |
| Etanolo | Fisher Scientifc | AC39769-0025 | |
| C-18 estrazione colonna a fase solida (Prep settembre colonna SPE C18) | Fisher Scientifico | 60108-304 | |
| O-ftalaldeide (OPA) | Sigma Chemical Co | 79760-5g | |
| Acido borico | Fisher Scientifico | BP168-500 | |
| Sodio borato | Fisher Scientifico | RDCS0330500 | |
| Mercaptoetanolo | Fisher Scientifico | 45-000-231 | |
| HPLC Shimadzu LC-20at (Pump) | Shimadzu Scientific Instruments, Inc. | LC-20at | |
| Zorbax ODS colonna (4.6x150mm) | Agilent Technologies | 443905-902 | |
| Shimatzu RF-10Axl rivelatore a fluorescenza | Shimadzu Scientific Instruments, Inc. | RF-10AXL | |
| Fosfato di sodio | Fisher Scientifico | AC38987-0010 | |
| FB1 standard | Sigma Chemical Co. | F1147-1mg | |
| Cloroformio | VWR | MK444410 | |
| 13 mm con filtro per siringa membrana di nylon 0,45 um (HPLC) | Pall Life Science | 4426 | |
| Ergosterolo | Sigma-Aldrich | 45480-50G-F | |
| Scintillazione fiale | VWR | 66021-602 | |
| Cloruro di sodio | VICAM | G1124 |
Riferimenti
- Tsitsigiannis, D. I., Keller, N. P. Oxylipins as developmental and host-fungal communication signals. Trends Microbiol. 15, 109-118 (2007).
- Gao, X., Shim, W. -. B., Göbel, C., Kunze, S., Feussner, I., Meeley, R., Balint-Kurti, P., Kolomiets, M. Disruption of a maize 9-lipoxygenase results in increased resistance to fungal pathogens and reduced levels of contamination with mycotoxin fumonisin. Mol. Plant-Microbe Interact. 20, 922-933 (2007).
- Brodhagen, M., Tsitsigiannis, D. I., Hornung, E., Goebel, C., Feussner, I., Keller, N. P. Reciprocal oxylipin-mediated cross-talk in the Aspergillus - seed pathosystem. Mol. Microbiol. 67, 378-391 (2008).
- Gao, X., Brodhagen, M., Isakeit, T., Brown, S. H., Göbel, C., Betran, J., Feussner, I., Keller, N. P., Kolomiets, M. V. Inactivation of the lipoxygenase ZmLOX3 increases susceptibility of maize to Aspergillus spp. Mol. Plant-Microbe Interact. 22, 222-231 (2009).
- Gao, X. Q., Kolomiets, M. V. Host-derived lipids and oxylipins are crucial signals in modulating mycotoxin production by fungi. Toxin Rev. 28, 79-88 (2009).
- Mukherjee, M., Kim, J. -. E., Park, Y. -. S., Kolomiets, M. V., Shim, W. -. B. Regulators of G protein signaling in F. verticillioides mediate differential host-pathogen responses on non-viable versus viable maize kernels. Mol. Plant Pathol. 12, 479-491 (2011).
- Zheng, M. Z., Richard, J. L., Binder, J. A review of rapid methods for the analysis of mycotoxins. Mycopathologia. 161, 261-273 (2006).
- Bacon, C. W., Bennett, R. M., Hinton, D. M., Voss, K. A. Scanning electron microscopy of Fusarium moniliforme within asymptomatic maize kernels and kernels associated with equine leukoencephalomalacia. Plant Dis. 76, 144-148 (1992).
- Munkvold, G. P., Hellmich, R. L., Rice, L. G. Comparison of fumonisin concentrations in kernels of transgenic Bt maize hybrids and nontransgenic hybrids. Plant Dis. 83, 130-138 (1999).
- Sagaram, U. S., Shaw, B. D., Shim, W. -. B. Fusarium verticillioides GAP!, a gene encoding a putative glycolipid-anchored surface protein, participates in conidiation and cell wall structure but not virulence. Microbiol. 153, 2850-2861 (2007).
- Shim, W. -. B., Flaherty, J. E., Woloshuk, C. P. Comparison of Fumonisin B1 biosynthesis in maize germ and degermed kernels by Fusarium verticillioides. J. Food Protect. 66, 2116-2122 (2003).
- Shim, W. -. B., Woloshuk, C. P. Regulation of fumonisin B1 biosynthesis and conidiation in Fusarium verticillioides by a cyclin-like (C-type) gene, FCC1. Appl. Environ. Micrbiol. 67, 1607-1612 (2001).
- Christensen, S. A. . Conversation with: Won-Bo Shim. , (2011).
- Shin, J. -. H., Shim, W. -. B. Characterization of PPR1 and PPR2, genes encoding regulatory subunits of protein phosphatase 2A in Fusarium verticillioides. Phytopathol. 99, S119 (2009).
- Breivik, O. N., Owades, J. L. Spectrophotometric Semimicrodetermination of Ergosterol in Yeast. Yeast. Agric. and Food Chem. 5, 360-363 (1957).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon