A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مصقول وعززت ضعيفة، جمجمة نافذة على المدى الطويل التصوير من مخ الفأر
In This Article
Summary
نقدم وسيلة لتشكيل نافذة التصوير في جمجمة الفأر الذي يمتد ملليمتر وغير مستقرة لشهور دون التهاب في الدماغ. هي مناسبة تماما هذه الطريقة لدراسات طولية من تدفق الدم، وديناميات الخلوية، وخلية / بنية الأوعية الدموية باستخدام ثنائي الفوتون المجهري.
Abstract
في الجسم الحي التصوير من وظيفة القشرية يتطلب الوصول البصري إلى الدماغ دون انقطاع للبيئة داخل الجمجمة. نقدم وسيلة لتشكيل الجمجمة مصقول وعززت ضعيفة (منافذ) نافذة في جمجمة الفأر الذي يمتد على عدة ملليمترات في القطر وغير مستقر لعدة أشهر. وضعفت الجمجمة من 10 الى 15 ميكرون في سمك مع اليد التي عقدت التدريبات لتحقيق وضوح بصري، ومن ثم مضافين مع الغراء cyanoacrylate وغطاء زجاجي على: 1) توفير صلابة، 2) منع إعادة نمو العظام و3) الحد من تشتت الضوء من المخالفات الموجودة على سطح العظم. منذ الجمجمة لم يتم اختراق، وتقلص إلى حد كبير أي التهاب يمكن أن تؤثر على عملية التي تجري دراستها. لا يمكن أن يتحقق أعماق التصوير لمدة تصل إلى 250 ميكرون تحت سطح القشرة باستخدام ثنائي الفوتون المجهري المسح الضوئي ليزر. هي مناسبة تماما هذه النافذة لدراسة الدماغ تدفق الدم ووظيفة الخلوية على حد سواء في الأعمال التحضيرية تخدير ومستيقظا. فإنه يوفر المزيد من البروتوكول الاختياريportunity للتلاعب نشاط الخلية باستخدام optogenetics أو لعرقلة تدفق الدم في الأوعية التي تستهدفها تشعيع تعميم الضيائية.
Protocol
1. التحضير لجراحة ط
- تنظيف الأدوات الجراحية بواسطة sonicating في خليط من الحليب Maxizyme والجراحي في نظافة بالموجات فوق الصوتية. الأوتوكلاف الأدوات الجراحية قبل كل تجربة.
- ضمان أن تكون جميع الكواشف اللازمة والمستهلكات المتاحة. وهناك قائمة من الكواشف والمستهلكات في الجدول رقم 2. وينبغي أن الكواشف والمستهلكات التي تأتي في اتصال مع الأنسجة يتعرض تكون عقيمة، عندما يكون ذلك ممكنا.
- حث التخدير. وصفت المسكنات المعتادة المناسبة للدراسة بقاء في الجدول رقم 1. ضمان طائرة الجراحية للتخدير عن طريق التحقق من عدم وجود رد الفعل قرصة اصبع القدم. سن الأمثل للفأر هو 3 إلى 6 أسابيع من العمر. على جماجم من الفئران الأصغر سنا أكثر نعومة وأكثر صعوبة لرقيقة. أقدم الفئران لها سمكا الجماجم التي من شأنها أن ينزف أكثر أثناء إجراء رقيق.
- تأمين الحيوانية في إطار التجسيمي 1. وهناك قائمة من المعدات الجراحية في الجدول رقم 2.
- الحفاظ على درجة حرارة الجسمتلح على 37 درجة مئوية باستخدام التغذية المرتدة مسبار المستقيم تنظيم وسادة الحرارة.
- تطبيق مرهم للعين للعيون على الاحتفاظ بالرطوبة.
- حلق فروة الرأس مع حلاقة كهربائي صغير.
- تنظيف فروة الرأس مع Betadine، تليها ينظف مع 70٪ (V / V) ايزوبروبيل.
- إذا رغبت، أن تحقق معدلات ضربات القلب والتنفس هي ضمن المعدل الطبيعي باستخدام نبض oximeter. للماوس، ينبغي لهذه الأرقام وسط حوالي 10 هرتز و 2 على التوالي.
- الحارة 1 قسامة من معقمة يتم ترشيحها السائل الدماغي الشوكي الاصطناعي (ACSF) إلى 37 درجة مئوية (125 ملم كلوريد الصوديوم، و 10 جلوكوز ملم، 10 ملم HEPES، 3.1 ملليمتر
CaCl 2، 1.3 ملي MgCl 2، ودرجة الحموضة 7.4) (جميع المواد الكيميائية من سيجما) 2.
2. شن رئيس الإطار
- إزالة فروة الرأس على سطح الجمجمة ظهري كله مع زوج من مقص وملقط جراحي. تقليم الجلد أفقيا على حواف عضلات الصدغي على جانبي الجمجمة وآخرerior لعضلات الرقبة (الشكل 1A).
- استخدام شفرة مشرط لإزالة سمحاق رقيقة من سطح الجمجمة.
- تنظيف الجمجمة مع قطعة من القطن رطبة يميل قضيب وتجف على سطح الجمجمة مع تيار من الهواء من الغبار يمكن. ثم تطبيق طبقة رقيقة من الغراء cyanoacrylate على سطح الجمجمة كامل. السماح للالغراء لتجف تماما. هذا مطلوب طبقة من الغراء لتمسك السليم للأسمنت الأسنان في الخطوات اللاحقة. الغراء cyanoacrylate لا تحتاج الى تعقيم.
- إرفاق موصل معدن على سطح الجمجمة، بعيدا عن المنطقة من النافذة المطلوبة. لمستحضرات مخدرة، قد تكون حصلت على الجوز صغير في الجمجمة مع لمسة من الغراء cyanoacrylate، والتي يمكن في وقت لاحق أن ثمل في الإعداد والتصوير باستخدام الترباس (الشكل 1B، 1L و1N). ختم مساعدات من الجوز مع الشريط للتأكد من أن الغراء لا يدخل ضمن هذه المواضيع من خلال الحجز في الجمجمة. ويجب تعقيم الجوز والشريط عن طريق جهاز الأوتوكليف قبل الجراحة.
- للتحضير والتصوير مستيقظا، ونعلق موصل أكثر جمودا مخصصة مع نقاط المرفق 2 (الشكل 1M و1N). حفر اثنين من الثقوب في الجمجمة فوق نصف الكرة القشرية المقابل مع لدغ مم الحفر ونصف، وإدخال ثم 2 # 000 الذاتي التنصت على مسامير. وسوف تساعد على ترسيخ هذه البراغي على رأس جبل في الجمجمة. تطبيق واحد فقط بدوره الكامل لولبية، وذلك لتجنب الضغط على القشرة الكامنة. ثم، تعلق الصليب المعدنية المخصصة بار مع لمسة صغيرة من الغراء cyanoacrylate على المخيخ. السماح للالغراء cyanoacrylate حتى يجف تماما. هذا الموصل معدن يقلل بدرجة كبيرة من درجات الحرية ويبسط الانتقال من حقل التصوير نفسه في الدراسات الطولية. شريط عريض يعطي مجالا واسعا لوضع قطب كهربائي وتنشيط vibrissae. خطط تفصيلية لتوليد جبل رأس مخصصة وجهاز مرفق على شبكة الإنترنت (sics / links.html "ينبغي> http://physics.ucsd.edu/neurophysics/links.html). يتم تعقيمها ومسامير وعبر شريط عن طريق جهاز الأوتوكليف قبل الجراحة.
- تغطية سطح الجمجمة كلها، باستثناء موقع من النافذة، مع طبقة من الاسمنت الأسنان (الشكل 1C و 1D). ضمان تغطية جميع الحواف المكشوفة من الجلد بواسطة الأسمنت. مكونات الاسمنت الأسنان لا يجب أن يتم تعقيمها.
3. الجيل من ملمع وعززت ضعيفة، جمجمة (منافذ) النافذة
- تأكد من أن نتوءات حادة الحفر وتجنب إعادة استخدامها. باستخدام سرعة منخفضة على حفر الأسنان، رقيقة 1 مم 2 من 2 ملم على منطقة القشرة الحسية الجسدية مع ½ مم لدغ. البديل بين ترطيب الجمجمة مع ACSF ثم تجفيف سطح الجمجمة مع تيار من الهواء لطيف من المنفضة الغاز؛ الرطب للتبريد، وجاف لمنع تجلط. وهذا يتطلب التخفيف من خلال طبقة إسفنجي من الجمجمة، والتي قد تنزف، ولكن يمكن أن سيطروا علىبقلم بيغ مع ACSF (الشكل 1E). الجمجمة يبدأ المرن تحت ضغط طفيف من التدريبات عندما يكون ~ 50 ميكرون، والأوعية حنوني يجب أن يكون مرئيا من خلال العظام الرطب (الشكل 1F). في هذا سماكة، وبقع صغيرة بيضاء داخل العظام تصبح مرئية لبضع ثوان مباشرة بعد مبلل على سطح الجمجمة الجافة.
- عند هذه النقطة، رقيقة العظم إلى أبعد من ذلك. استخدام سرعة أبطأ الحفر، أي 1000 دورة في الدقيقة، التي تحلق على سطح الجمجمة مع لمسة طفيفة. استخدام حركات صغيرة تسيطر عليها في حين عقد مثل هذه التدريبات من ركلة جزاء و لا تنطبق إلا قوة في الاتجاه الجانبي. وينبغي أن العظم ~ و10-15 ميكرون في سمك النهائية (الشكل 1G). عندما العظام رقيقة بما فيه الكفاية، فإن بقع بيضاء صغيرة في العظام لم تعد أن تكون واضحة عند مبلل على سطح الجمجمة الجافة.
- تلميع المنطقة نافذة مع مسحوق أكسيد القصدير. إرفاق مثقاب مسبقة الصنع التي تم مغموسة في تسرب السيليكون وحوض السمك معتعادل ترك سوط مدبب (أقحم، الشكل. 1H). وينبغي إعداد السوط سيليكون واحدة على الأقل قبل يوم من عملية جراحية، ومعقمة مع 70٪ الأيزوبروبانول قبل استخدامها. وضع قرصة صغيرة من مسحوق على النافذة جنبا إلى جنب مع قطرة من ACSF (الشكل 1H). التحرك من الطين على نافذة لمدة تصل إلى عشر دقائق عن طريق لمس بلطف غيض من سوط الانتقال الى سطح الجمجمة. تدفق بعيدا مسحوق أكسيد القصدير تماما من الإطار باستخدام ACSF وتجفيف العظام تماما مع تيار من الهواء لطيف. يجب إزالة المخالفات السطحية ورقائق العظام الملتصقة التي خلفتها عمليات الحفر في الخطوات السابقة بعد تلميع (الشكل 1H و1I). من مسحوق أكسيد القصدير لا تحتاج الى تعقيم.
- قص قطعة مربعة من لا. 0 غطاء زجاجي أصغر قليلا من حجم النافذة. استخدام الكاتب ليسجل بلطف فصل الخطوط الأفقية والعمودية في زلة غطاء باستخدام حافة مستقيمة. ثم ضع الغطاء زلة في طبق بيتري وKNاوك الطبق ضد حافة طاولة للفصل بين قطع الزجاج. ويمكن بعد ذلك طبق بيتري كله أن تعقم لضمان العقم.
- تضع غطاء زجاجي بحجم مناسب بالقرب من نافذة المجففة. تطبيق لمسة صغيرة من الغراء cyanoacrylate خلال نافذة باستخدام غيض من كسر القطن خشبي قضيب طرف، ودفع بسرعة قبل القطع قطعة من الزجاج غطاء فوق الغراء. تجنب خلق فقاعات تحت غطاء زجاجي. دفع برفق غطاء زجاجي على سطح الجمجمة، وعقد لبضع ثوان (الشكل 1J و1O). السماح للالغراء لتجف تماما خلال 15 دقيقة. ويمكن إزالة الغراء cyanoacrylate الزائدة من السطح العلوي للغطاء زجاجي بشفرة مشرط بعد تجفيفها. ختم حواف غطاء زجاجي مع الاسمنت الأسنان وتشكيل مرتفعة قليلا بشكل جيد لعقد المياه لعدسة غمس (الشكل 1K و1O).
4. انتعاش
- وضع حيوان في قفص جراحة التالية دافئ. مراقبةحيوان دوريا حتى يتعافى تماما من التخدير.
- إذا كان المقصود من إعداد البقاء على قيد الحياة لأكثر من يوم واحد، وتوفير البوبرينورفين (0.03 ميكروغرام لكل القوارض ز) لتسكين. نحن عادة صورة للحيوان واحد على الاقل بعد يوم من غرس الأولي.
5. التحضير والتصوير
- استقرار الحيوان على اللوح الضوئي للتصوير، وذلك باستخدام الإطار كوسيلة لدعم رئيس (الشكل 1L و1M). ويمكن إجراء جهاز ضبط النفس من المكونات الميكانيكية المتاحة تجاريا من Qioptiq أو ThorLabs. ويمكن نقل لوحة لدينا منفصلة بين الأجنحة الجراحية والتصوير واثنين من الفوتون، مع الحيوانات وجميع أجهزة الرصد الفسيولوجي المجتمعين كوحدة واحدة 3.
- إذا كان المطلوب تصوير معدل جريان الدم، حقن 0.05 مل من 5٪ (W / V) فلوري، ديكستران صبغ المذاب في المياه المالحة عقيمة إما عن طريق الوريد ذيل أو الوريد تحت الحجاج لتسمية مصل الدم (الشكل 2A و 2C إلى 2H ) 4-7. هذا يجب أن يتم تحت التخدير العام. ربما تحت الحجاج إدارة الوريد يكون من الأسهل للمبتدئين، وحلول ديكستران هي أكثر لزوجة. يمكن للعرق ذيل يكون من الصعب تحديد مكان في الفئران داكن اللون، وعلى المنوال يميل الى الانهيار بعد فشل الحقن. لتصوير الأوعية الدموية مع انبعاث الخضراء، واستخدام الفصيلة فلوريسئين ديكستران. لانبعاث الحمراء، واستخدم الأحمر تكساس ديكستران. مع ارتفاع dextrans الوزن الجزيئي، فإن الصبغة تبقى في التداول لعدة ساعات. بدلا من ذلك، يمكن تصوير الحيوانات مع تسميات فلوري الذاتية مباشرة في الطول الموجي المناسب إثارة اثنين من الفوتون. يمكن تجميد الحل ديكستران في aliquots لاستخدامها في المستقبل.
- نظف برفق سطح نافذة مع قطعة من القطن رطبة يميل قضيب.
- للتصوير لفترات طويلة من الاستعدادات تخدير، حقن intraperitoneally قارع الأجراس lactated العقيمة في حل في وحدة تخزين من 3 ساعات لكل ميكرولتر 2 غرام كل على الحفاظ على سوائل الجسم والاحتياجات من الطاقة.
- عند الحيوانات التصوير في حالة اليقظة، والحد من ضبط النفس رئيس لبضع ساعات فقط في وقت واحد للحد من مستويات التوتر. عودة الحيوان إلى القفص الرئيسية بين جلسات التصوير عن الغذاء والماء.
6. ممثل النتائج
وهناك نافذة ناجحة تسمح أعماق تصوير ما يصل الى 250 ميكرون تحت سطح حنوني لعدة أشهر. وقد استخدم هذا الأسلوب للدراسة في تدفق الدم المجراة الشعرية 4، 8، وتفعيل دبقية صغيرة 8، 9، وهيكل شجيري ضمن لحمة القشرية 8. في مثال واحد، ونحن نستخدم اثنين من الفوتون التصوير لإظهار الأوعية الدموية القشرية لThy1 الأصفر فلوري تخدير الماوس (YFP) بروتين، بعد أن يتم تسمية مصل الدم عن طريق الحقن في الوريد من تكساس الأحمر ديكستران (الشكل 2A). الأوعية الجافية وغالبا ما تكون وضوحا قليلا فوق سطح القشرة في الأم الجافية (الشكل 2C، السهم). حنوني الشرايين الكبيرة ولى الوريداته على السطح القشري (الشكل 2D). اختراق السفن فرع من هذه الشبكة السطحية والغوص في القشرة حيث يفرع إلى السرير الشعرية الكثيفة التي تغذي الأنسجة القشرية (الشكل 2E إلى 2H). العرش شجيري من YFP العميق معربا عن الخلايا العصبية القشرية، والذاتية إشارة إلى هذا الخط الماوس، يمكن تصويرها في وقت واحد في القناة الثانية 10 (الشكل 2B إلى 2H). وقد جمعت هذه هي الإشارة الثانية متناسق من العظام في القناة الثالثة، ويمكن استخدامها لقياس سماكة من الجمجمة ضعيفة بعد جمع اكوام من صورة (الشكل 2A إلى 2C).
وأثر تأثيرا عميقا على ديناميكية الأوعية الدموية القشرية بواسطة التخدير 11. في المثال الثاني، نعرض شريط فيديو لvasoactivity العفوية التي تم جمعها من قبل اثنين من الفوتون المجهري من الفأر مستيقظا اعتادوا. وينظر إلى التذبذبات حركي بارز في قطر التجويف مع شرين حنوني، ولكن ليس مع الوريد المجاورة. هذايخف نطاق القاعدية من vasoactivity مع 4 التخدير يوريتان. لقياس التغيرات العفوية وأثار في تدفق الدم، ونحن نستخدم تكيف خط تقنيات المسح للقبض على كل من قطر الأوعية الدموية وخلايا الدم الحمراء سرعة السفن الفردية. موارد مفصلة عن كمية الدم تدفق التصوير باستخدام اثنين من الفوتون المجهري تتوفر 3 و 12.
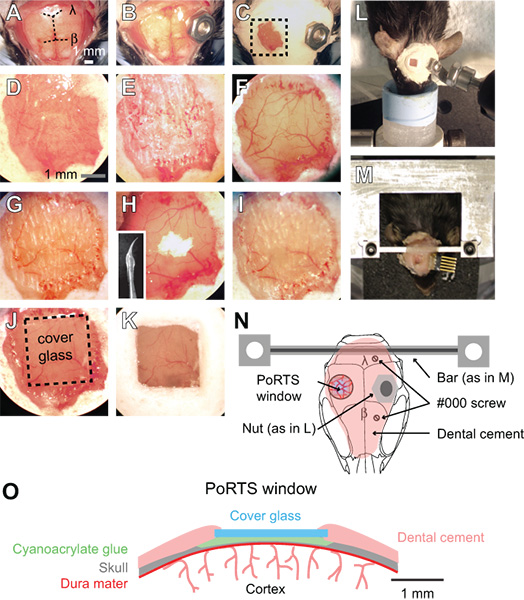
الشكل 1. إجراءات نافذة الموانئ. (A K ل) صور من خطوات متتابعة في الإجراء لتوليد نافذة الموانئ. انظر النص للحصول على تعليمات مفصلة. β = bregma وλ = امدا. (L) بولت والجوز نظام لتأمين الرأس أثناء التصوير من الاستعدادات تخدير. (M) آلة مخصصة عبر جبل رأس شريط للتحضير مستيقظا. في هذا المثال، تم زرعها أيضا موصل للتسجيلات مخطط كهربية قشر الدماغ المتكررة. (N)رسم تخطيطي يظهر رأي ظهري من جبل رأس والموقف من مختلف المكونات. والمقصود الجوز المستخدمة في لوحة L كبديل للشريط عبر استخدام في لوحة محمد اثنان # 000 والتنصت على الذات براغي تضاف مع جبل شريط الصليب من أجل استقرار واضاف مع الاستعدادات التصوير مستيقظا. (O) رسم تخطيطي يظهر المقطع العرضي من نافذة الموانئ.
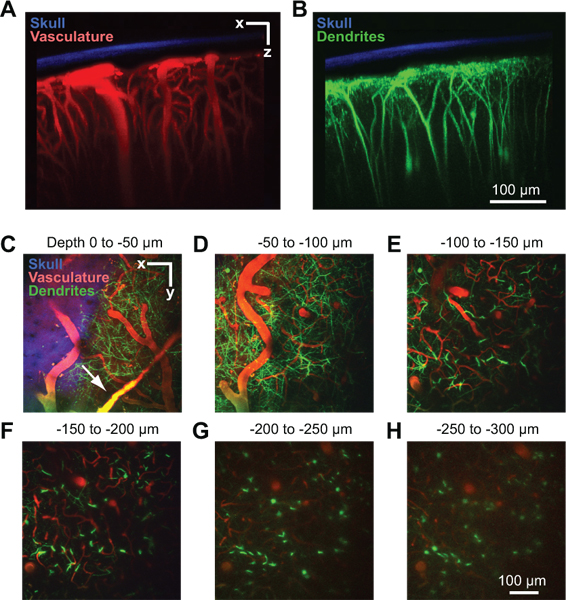
الشكل 2. ثنائي الفوتون التصوير من بنية الأوعية الدموية والخلايا العصبية في القشرة الماوس. وقد تم جمع جميع الصور من خلال نافذة المنافذ في ماوس Thy1-YFP في الساعة 2 بعد أيام من زرع نافذة 10. القصوى إسقاط ما يزيد على 150 ميكرون من الأنسجة في اتجاه الاكليلية تبين الجمجمة ضعيفة في ما يتعلق الأوعية الدموية (A) والتشعبات (B). تم الكشف عن العظام (الأزرق) من خلال جمع ومضان 2 التوافقي في الانبعاثات نانومتر 450 نانومتر مع الإثارة 900 8. وصفت والأوعية الدموية (الحمراء) التي تحقن عن طريق الوريد 70 كيلو دالتون ديكستران الأحمر تكساس 6. الحقول الجذعية من الخلايا العصبية (الخضراء) هي الذاتية إلى خط Thy1-YFP الماوس المعدلة وراثيا. (CH) التوقعات القصوى أكثر من 50 ميكرون من الأنسجة في اتجاه أفقي على أعماق مختلفة تحت الحنون. البيانات من المكدس نفس الصورة تظهر في لوحات ألف وباء السحائي السفن قد تكون مرئية فقط فوق سطح القشرية (السهم في C).
المختصرات
ACSF = الاصطناعي السائل الشوكي الدماغي
PORTS = مصقول وعززت نافذة الجمجمة ضعيفة
YFP = بروتين فلوري أصفر
أنا تأكد من أن تتم الموافقة على الإجراءات التي وصفها المحلي الخاص بك رعاية الحيوانات المؤسسية واستخدام اللجنة.
Discussion
ثنائي الفوتون التصوير من خلال نافذة الموانئ يتطلب انتقال العدوى عن طريق العظام ضعيفة ودورا، والذي خفف من ضوء الليزر، ويضيف الانحرافات البصرية في أعماق أكبر 8. لكن، على الرغم من هذا العائق، لا يمكن تحقيق أعماق التصوير يصل إلى 250 ميكرون تحت سطح حنوني مع الإثارة نا...
Disclosures
لا شيء للكشف.
Acknowledgements
وأيد هذا العمل من قبل جمعية القلب الاميركية (في مرحلة ما بعد الدكتوراه زمالة إلى AYS)، والمعاهد الوطنية للصحة (MH085499، EB003832، وOD006831 إلى DK). نشكر بيت فريدمان وبليندر بابلو للتعليق على المخطوطة.
Materials
| Name | Company | Catalog Number | Comments | |||
| وكيل | طريق التسليم | جرعة للماوس | مدة | ملاحظات | مصدر | المرجع المرجع |
| بنتوباربيتال (Nembutal) | الملكية الفكرية | 90 ميكروغرام / غرام | 15-60 دقيقة | ضيق هامش السلامة. العمل لمدة تصل إلى الجرعة المناسبة من التخدير ببطء. استكمال 10٪ من جرعة التحريض على النحو المطلوب. | 036093؛ بتلر شين | 7 |
| الكيتامين (Ketaset) مختلطة مع زيلازين (Anased) | الملكية الفكرية | 60 ميكروغرام / غرام (K) 10 ميكروغرام / ز (X) (المزيج في حقنة واحد) | 20-30 دقيقة | وشارك في زيلازين حقن بوصفها ارتخاء العضلات والمسكنات. تكملة الكيتامين فقط في 50٪ من جرعة التحريض على النحو المطلوب. | (K) 010177، (X) 033198؛ بتلر شين | 7 |
| Isoflurane (Isothesia) | استنشاق | 4٪ يعني تركيز السنخية (MAC) لتحريض، 1-2٪ لجنة الهدنة العسكرية للصيانة | 4-6 ح. | المنصوص عليها في خليط من الأوكسجين 70٪ وأكسيد النيتروز بنسبة 30٪. التخدير لفترة طويلة يؤدي إلى إبطاء الانتعاش. | 029403؛ بتلر شين | 26 |
مقترح الجدول 1. وكلاء مخدر للدراسات البقاء على قيد الحياة.
| البند | شركة | CATALOG # / MODEL |
| Betadine | بتلر شين | 6906950 |
| البوبرينورفين (Buprenex) | بتلر شين | 031919 |
| فلوريسئين الفصيلة ديكستران (2)، نجمة داود الحمراء الوزن الجزيئي | سيغما | FD2000S |
| ايزوبروبيل | الصياد | AC42383-0010 |
| Lactated محلول رينغر | بتلر شين | 009846؛ |
| يدوكائين حل، 2٪ (V / V) | بتلر شين | 002468 |
| ملحي | بتلر شين | 009861 |
| الجراحية الحليب | بتلر شين | 014325 |
| تكساس الأحمر دكستران، وزن جزيئي 70 كيلو دالتون | إينفيتروجن | D1864 |
| Maxizyme | بتلر شين | 035646 |
| المستهلكات | ||
| كربيد نتوءات، 1/2 مم حجم رأس | أدوات العلم غرامة | 19007-05 |
| تطبيقها طرف Cottoned | فيشر العلمية | 23-400-100 |
| تغطية زجاج، لا. 0 سمك | توماس العلمية | 6661B40 |
| Cyanoacrylate الغراء | ND صناعات | 31428 H04308 |
| الغاز المنفضة | رومنسيه | N82E16848043429 |
| قبضة مسحوق الاسمنت | DENTSPLY | 675571 |
| قبضة الأسمنت المذيبات | DENTSPLY | 675572 |
| حقنة الانسولين، 0.3 حجم مل مع إبرة قياس 29.5 | بتلر شين | 018384 |
| الجوز والترباس لتأمين رأس | Digikey | الجوز، H723-ND؛ الترباس، R2-56X1/4-ND |
| البصريات مرهم | بتلر شين | 039886 |
| مشرط ريش | فيشر العلمية | 12-460-448 |
| براغي، والتنصت على الذات # 000 | الجماعة الاسلامية موريس الشركة | FF000CE125 |
| سيليكون مانع التسرب حوض السمك | Perfecto التصنيع | 31001 |
| القصدير مسحوق | ماما والمعادن | EQT-TINOX |
| معدات | ||
| زجاج الكاتب | فيشر العلمية | 08-675 |
| تشريح المجهر | كارل زايس | OPMI FC-1 |
| تعمل بالطاقة الكهربائية الحفر | Foredom أو Osada | K.1020 (Foredom) أو EXL M40-(Osada) |
| الحلاقة الكهربائية | فاهل | سلسلة 8900 |
| الملقط، لا دومون. 55 | أدوات العلم غرامة | 11255-20 |
| وسادة ردود فعل منظم الحرارة | FHC | 40-90-8 (الثرمستور المستقيم، 40-90-5D-02؛ حأكل وسادة، 40-90-2-07) |
| Isoflurane المرذاذ | Ohmeda | IsoTec4 |
| نبض oximeter | ستار العلوم الحياتية | MouseOx |
| مفك البراغي، مصغر | العلية واد | 26B09.01 |
| التجسيمي إطار | Kopf الآلات | نموذج 900 (مع قناع التخدير الماوس وعدم تمزق القضبان الأذن) |
| مقص جراحي، نهاية كليل | أدوات العلم غرامة | 14078-10 |
| بالموجات فوق الصوتية الأنظف | فيشر العلمية | 15-335-30 |
الجدول 2. قائمة محددة من الكواشف والمستهلكات والمعدات.
References
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D., Yuste, R. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. , 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. . Laboratory animal anesthesia. , (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved