Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une poli et renforcé Diluée-crâne fenêtre for Long-term imagerie du cerveau de souris
Dans cet article
Résumé
Nous présentons une méthode pour former une fenêtre d'imagerie dans le crâne de la souris qui s'étend millimètres et est stable pendant des mois sans inflammation du cerveau. Cette méthode est bien adaptée pour les études longitudinales de la circulation sanguine, la dynamique cellulaire et cellulaire / structure vasculaire en utilisant la microscopie à deux photons.
Résumé
L'imagerie in vivo de la fonction corticale nécessite un accès optique au cerveau sans interruption de l'environnement intracrânienne. Nous présentons une méthode pour former un crâne poli et armé amincie (ports) fenêtre dans le crâne de la souris qui s'étend sur plusieurs millimètres de diamètre et est stable depuis des mois. Le crâne est amincie à 10 à 15 um d'épaisseur avec une perceuse à main pour réaliser une clarté optique, et est ensuite recouverte d'une colle cyanoacrylate et une vitre de protection à: 1) fournir une rigidité, 2) inhiber la repousse osseuse et 3) réduire la diffusion de la lumière des irrégularités sur la surface osseuse. Depuis le crâne n'est pas violé, une inflammation qui pourrait affecter le processus de l'étude est considérablement réduit. Des profondeurs d'imagerie allant jusqu'à 250 um en dessous de la surface corticale peut être réalisé en utilisant la microscopie biphotonique à balayage laser. Cette fenêtre est bien adapté pour étudier le débit sanguin cérébral et la fonction cellulaire dans les préparations à la fois anesthésiés et éveillés. Il offre en outre l'opportunity de manipuler l'activité des cellules à l'aide optogénétique ou d'interrompre le flux sanguin dans les vaisseaux ciblés par irradiation de la circulation photosensibilisants.
Protocole
1. Préparation pour la chirurgie i
- Nettoyer les outils chirurgicaux par sonication dans un mélange de lait et de chirurgie Maxizyme dans un nettoyeur à ultrasons. Autoclaver les instruments chirurgicaux avant chaque expérience.
- Veiller à ce que tous les réactifs nécessaires et consommables sont disponibles. Une liste des réactifs et consommables est fourni dans le tableau 2. Réactifs et consommables qui entrent en contact avec les tissus exposés doivent être stériles, lorsque cela est possible.
- Induire une anesthésie. Anesthésiques typiques appropriés pour les études de survie sont décrites dans le tableau 1. Veiller à ce plan chirurgical de l'anesthésie en vérifiant l'absence de réflexe pincement de l'orteil. L'âge optimal de la souris est de 3 à 6 semaines d'âge. Les crânes de jeunes souris sont plus doux et plus difficiles à éclaircir. Les souris plus âgées sont plus épaisses crânes qui saignent plus au cours de la procédure d'amincissement.
- Fixer l'animal dans un cadre stéréotaxique 1. Une liste de matériel chirurgical est fourni dans le tableau 2.
- Maintenir température du corpsture à 37 ° C en utilisant une rétroaction sonde rectale et réglementé pad thermique.
- Appliquer une pommade ophtalmique pour les yeux pour retenir l'humidité.
- Rasage du cuir chevelu avec un rasoir électrique petite.
- Nettoyer le cuir chevelu avec Bétadine, suivie par pistonnage à 70% (v / v) d'alcool isopropylique.
- Si vous le souhaitez, vérifiez que la fréquence cardiaque et la respiration sont dans une fourchette normale en utilisant un oxymètre de pouls. Pour une souris, ces chiffres devraient se concentrer autour de 10 Hz et 2, respectivement.
- Réchauffez une aliquote de filtration stérile de fluide céphalo-rachidien artificiel (ACSF) à 37 ° C (125 mM NaCl, 10 mM de glucose, 10 mM d'HEPES, 3,1 mM
CaCl 2, 1,3 mM MgCl 2, pH 7,4) (tous les produits chimiques de Sigma) 2.
2. Montage d'un Cadre Chef
- Retirez le cuir chevelu sur la surface du crâne dorsale ensemble avec une paire de pinces et de ciseaux chirurgicaux. Couper la peau latéralement aux bords des muscles temporelles de chaque côté du crâne et de posterior aux muscles du cou (fig. 1A).
- Utilisation d'une lame de scalpel pour enlever le périoste mince de la surface du crâne.
- Nettoyez le crâne avec un coton-tige humide et séchez la surface du crâne avec un flux d'air à partir d'une poussière possible. Ensuite, appliquez une fine couche de colle cyanoacrylate à la surface du crâne entier. Laissez la colle sécher complètement. Cette couche de colle est nécessaire pour une bonne adhérence du ciment dentaire dans des étapes ultérieures. La colle cyanoacrylate n'a pas besoin d'être stérilisés.
- Attacher un connecteur métallique sur la surface du crâne, l'écart de la zone de la fenêtre souhaité. Pour les préparations anesthésiés, une petite noix peut être fixé sur le crâne avec un peu de colle cyanoacrylate, qui peuvent ensuite être vissée dans la configuration d'imagerie à l'aide d'un boulon (Fig. 1B, 1L et 1N). Sceller l'arrière de l'écrou avec du ruban adhésif afin d'assurer que la colle ne pénètre pas dans les discussions lors de la fixation sur le crâne. L'écrou et la bande doivent être stérilisés par autoclavage avant la chirurgie.
- Pour les préparations d'imagerie éveillés, fixez un connecteur plus rigide personnalisé avec deux points de fixation (Fig. 1M et 1N). Percez deux trous dans le crâne sur l'hémisphère controlatéral corticale avec un ½ mm de forage bavure, puis introduire deux # 000 vis auto-taraudeuses. Ces vis aidera à ancrer la tête de monter sur le crâne. Appliquer un seul tour complet de la vis, afin d'éviter l'application de pression au cortex sous-jacent. Ensuite, fixez la barre de métal sur mesure croisée avec une petite goutte de colle cyanoacrylate sur le cervelet. Laissez la colle cyanoacrylate pour sécher complètement. Ce connecteur métallique réduit considérablement les degrés de liberté et simplifie la réinstallation de l'Imagerie même dans les études longitudinales. Une barre transversale large donne amplement d'espace pour le placement des électrodes et la stimulation de vibrisses. Des plans détaillés pour la génération de la monture de tête personnalisé et dispositif de fixation sont disponibles en ligne (SICS / liens.html "> http://physics.ucsd.edu/neurophysics/links.html). Les vis et la barre transversale doivent être stérilisés par autoclavage avant la chirurgie.
- Couvrir toute la surface du crâne, à l'exclusion de l'emplacement de la fenêtre, d'une couche de ciment dentaire (figure 1C et 1D). Veiller à ce que tous les bords exposés de la peau sont couverts par le ciment. Les composants du ciment dentaire n'ont pas besoin d'être stérilisés.
3. La nouvelle génération d'un poli et renforcé Diluée-crâne (ports) Fenêtre
- Veiller à ce que les bavures de forage sont tranchants et éviter de les réutiliser. En utilisant une faible vitesse sur la fraise de dentiste, mince de 2 mm par 2 mm sur la région du cortex somato-sensoriel avec un ½ mm bavure. Alternez entre mouiller le crâne avec l'ACSF, puis le séchage de la surface du crâne avec un léger courant d'air à partir d'un époussetage à gaz; humide pour le refroidissement, et au sec pour l'éclaircissage. Ce doit être diluée à travers la couche spongieuse du crâne, qui peuvent saigner, mais peut être controlled par rinçage avec ACSF (Fig. 1E). Le crâne commence à fléchir sous la pression légère de la perceuse quand il est ~ 50 um, et les vaisseaux pie-mère doit être visible à travers l'os par voie humide (Fig. 1F). A cette épaisseur, de petites taches blanches à l'intérieur de l'os devient visible pendant quelques secondes immédiatement après la surface du crâne sec est humidifié.
- À ce stade, l'os mince encore. Utilisez une vitesse plus lente de forage, c'est-à 1000 tours par minute, qui rase la surface du crâne avec seulement une légère touche. Utilisation de petits mouvements contrôlés tout en maintenant la fraise comme un stylo et seulement appliquer une force dans la direction latérale. L'os doit être ~ de 10 à 15 um à son épaisseur finale (Fig. 1G). Lorsque l'os est suffisamment mince, les petites taches blanches dans l'os ne sera plus visible lorsque la surface du crâne sec est humidifié.
- Polir la zone de la fenêtre avec de la poudre d'oxyde d'étain. Fixer une mèche pré-mesure qui a été trempé dans l'aquarium d'étanchéité de silicone et avecétabli, en laissant un fouet conique (en médaillon, Fig. 1H). Le fouet en silicone doit être préparé au moins un jour avant la chirurgie, et stérilisés à l'isopropanol à 70% avant de les utiliser. Placez une petite pincée de poudre sur la fenêtre avec une baisse de l'ACSF (Fig. 1H). Agiter la suspension sur la fenêtre pour un maximum de dix minutes en effleurant du bout du fouet en mouvement à la surface du crâne. Évacuez la poudre d'oxyde d'étain fond de la fenêtre à l'aide ACSF et sécher soigneusement l'os avec un léger courant d'air. Les irrégularités de surface et des fragments d'os adhérentes laissés par forage dans les étapes précédentes doivent être enlevés après polissage (Fig. 1H et 1I). La poudre d'oxyde d'étain n'a pas besoin d'être stérilisé.
- Couper des morceaux carrés de pas. 0 lamelle légèrement plus petit que la taille de la fenêtre. Utilisez un scribe pour marquer délicatement séparés lignes horizontales et verticales dans la lamelle à l'aide d'une règle droite. Ensuite, placez la lamelle dans une boîte de Pétri et knock le plat contre un bord de table pour séparer les morceaux de verre. Le plat de Petri toute peuvent ensuite être passés à l'autoclave pour assurer la stérilité.
- Placer une vitre de protection de taille appropriée à proximité de la fenêtre séchée. Appliquer une noisette de colle cyanoacrylate sur la fenêtre en utilisant la pointe d'un applicateur de coton cassé bois pointe, et rapidement pousser la pièce prédécoupée de couvercle en verre au sommet de la colle. Éviter de créer des bulles en dessous de la vitre de protection. Poussez doucement le couvercle en verre contre la surface du crâne, et maintenez pendant quelques secondes (Fig. 1J et 1O). Laissez la colle sécher pendant 15 minutes. Excès de colle cyanoacrylate peut être enlevé de la surface supérieure de la vitre de protection avec une lame de scalpel après qu'il a été séché. Sceller les bords de la vitre de protection avec un ciment dentaire et former une légèrement soulevée et à retenir l'eau de la lentille d'immersion (1K fig. et 1O).
4. Récupération
- Placez l'animal dans un cabinet suivant cage chaud. Surveiller l'animaux périodiquement jusqu'à ce qu'il récupère complètement de l'anesthésie.
- Si la préparation est destinée à survivre pendant plus d'une journée, de fournir la buprénorphine (0,03 pg par les rongeurs g) pour l'analgésie. En général, nous l'image de l'animal au moins un jour après l'implantation initiale.
5. Préparation d'imagerie
- Stabiliser l'animal sur une planche à pain pour l'imagerie optique, en utilisant le cadre comme un support de tête (Fig. 1L et 1M). Un appareil de retenue peut être fabriqué à partir de composants disponibles dans le commerce optomécaniques de Qioptiq ou Thorlabs. Notre plaque séparée peuvent être transportés entre les suites de chirurgie et d'imagerie à deux photons avec l'animal et tous les dispositifs de surveillance physiologique assemblés comme une seule unité 3.
- Si imagerie débit sanguin est désiré, injecter 0,05 ml de 5% (p / v) fluorescente-dextrane colorant dissous dans une solution saline stérile soit par la veine de queue ou d'une veine sous-orbitaire pour étiqueter le sang (fig. 2A à 2C et 2H sérum ) 4-7. Cela doit être fait sous anesthésie générale. L'administration sous-orbitaire veine peut être plus facile pour les débutants, comme des solutions de dextrane sont plus visqueuses. La veine de la queue peut être difficile à localiser dans l'obscurité des souris colorées, et la veine a tendance à s'affaisser après une injection échoué. Pour l'imagerie vasculaire avec le vert des émissions, utiliser un isothiocyanate de fluorescéine dextrane. Pour l'émission, rouge, utiliser un Texas Red dextran. Grâce à la haute dextranes de poids moléculaire, le colorant resteront en circulation pendant plusieurs heures. En variante, les animaux avec des marqueurs fluorescents endogènes peut être imagée directement à la longueur d'onde d'excitation à deux photons appropriée. La solution de dextrane peuvent être congelés en aliquotes pour une utilisation future.
- Nettoyez délicatement la surface de la fenêtre avec un coton-tige humide.
- Pour l'imagerie prolongée de préparations anesthésiés, injecter par voie intrapéritonéale solution stérile de Ringer lactate à l'adresse d'un volume de 3 uL par gramme toutes les 2 heures afin de maintenir les fluides corporels et les besoins en énergie.
- Lorsque les animaux d'imagerie dans l'état de veille, de limiter l'appuie-tête à seulement quelques heures à la fois de réduire les niveaux de stress. Retour à l'animal de la cage entre les sessions d'imagerie pour la nourriture et l'eau.
6. Les résultats représentatifs
Une fenêtre réussie permettra d'imagerie des profondeurs allant jusqu'à 250 um en dessous de la surface piale pendant plusieurs mois. Cette méthode a été utilisée pour étudier in vivo dans le flux sanguin capillaire 4, 8, activation de la microglie 8, 9, et la structure dendritique dans le cortex du parenchyme 8. Dans un exemple, nous utilisons l'imagerie à deux photons pour montrer la vascularisation corticale d'un anesthésié Thy1 jaune protéines (YFP) de la souris fluorescente, après le sérum sanguin est marqué par une injection intraveineuse de Texas Red dextran (Fig. 2A). Dural navires sont souvent visibles légèrement au-dessus de la surface corticale dans la dure-mère (Fig. 2C, flèche). Les grandes artérioles pie-mère et veinules lie sur la surface corticale (figure 2D). Pénétrant branche navires de ce réseau de surface et plongée dans le cortex où elles se ramifient en un lit dense capillaire qui nourrit le tissu cortical (Fig. 2E à 2H). Mandrins dendritiques de la YFP profonde exprimant neurones corticaux, une endogène à cette ligne de signal de la souris, peut être imagée simultanément dans un second canal 10 (Fig. 2B au 2H). Le signal de second harmonique de l'os ont été recueillis dans un troisième canal, et peut être utilisé pour évaluer l'épaisseur du crâne amincie après la collecte des piles d'images (Fig. 2A à 2C).
Corticales dynamique vasculaires sont profondément affectés par les anesthésiques 11. Dans un deuxième exemple, nous montrer une vidéo de vasoactivité spontanée recueillies par microscopie à deux photons d'une souris habitués éveillé. Oscillations vasomoteurs éminents dans le diamètre de la lumière sont observés avec une artériole pial, mais pas avec une veinule voisin. Cettelarge base de vasoactivité est diminué avec 4 anesthésie à l'uréthane. Pour quantifier les changements spontanés et évoqués dans le flux sanguin, nous utilisons adaptées ligne techniques de balayage pour capturer à la fois le diamètre vasculaire et rouge vitesse des globules de navires individuels. Des ressources détaillées sur l'imagerie du flux sanguin quantitative à l'aide microscopie à deux photons sont disponibles 3, 12.
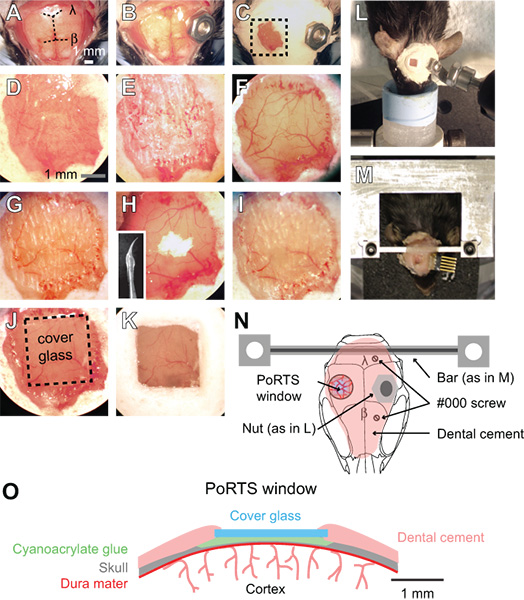
Figure 1. Procédure pour une fenêtre Ports. (A la maternelle à la) Images d'étapes séquentielles dans la procédure pour générer une fenêtre Ports. Voir le texte pour obtenir des instructions détaillées. β = λ = bregma et lambda. (L) système de Boulon et écrou de fixation de la tête lors de l'imagerie des préparations anesthésiées. (M) usinés croix de montage tête de barre pour les préparations éveillés. Dans cet exemple, un connecteur a également été implanté pour les enregistrements électrocorticogramme répétées. (N)Schéma montrant une vue dorsale de la monture de tête et la position des différentes composantes. L'écrou utilisé dans L panneau est conçu comme alternative à la barre transversale à l'aide dans le panneau de M. Deux # 000 vis auto-taraudeuses sont ajoutés à la barre transversale de montage pour plus de stabilité avec des préparations d'imagerie éveillés. Schéma (O) montrant la section transversale d'un fenêtre Ports.
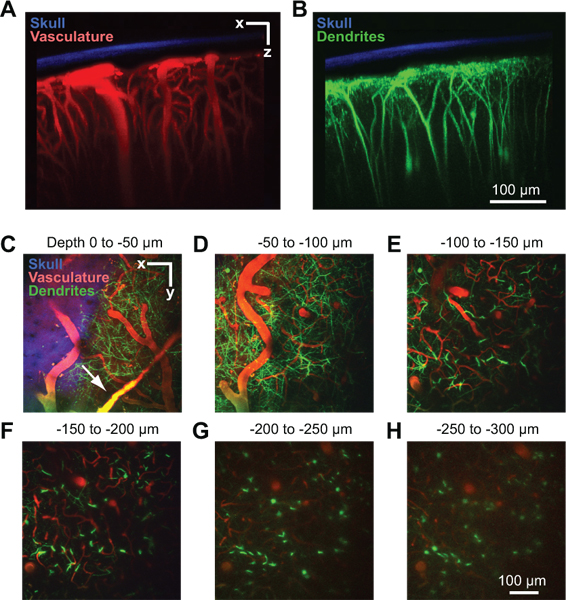
Figure 2. L'imagerie à deux photons de la structure vasculaire et neuronale dans le cortex de la souris. Toutes les images ont été recueillies à travers une fenêtre de ports dans une souris Thy1-YFP moins 2 jours après implantation 10 fenêtre. Projection maximale de plus de 150 um de tissu dans l'orientation coronale affichant le crâne amincie par rapport à la vascularisation (A) et les dendrites (B). L'os (bleu) a été détectée par la collecte de la fluorescence de seconde harmonique à 450 nm d'émission de 900 nm d'excitation 8. La vascularisation (rouge) a été marqué par injection intraveineuse de 70 kDa Texas Red dextran 6. Les champs dendritiques des neurones (vert) sont endogènes à la ligne Thy1-YFP souris transgénique. (CH) des projections maximales de plus de 50 um de tissus dans l'orientation horizontale à différentes profondeurs en dessous de la pie-mère. Les données proviennent de la pile même image montre dans les panneaux A et B. navires Dural peut être visible juste au-dessus de la surface corticale (flèche C).
Abréviations
ACSF = artificielle liquide céphalo-rachidien
PORTS = fenêtre poli et armé du crâne amincie
YFP = protéine fluorescente jaune
i Veiller à ce que les procédures décrites sont approuvés par votre soin des animaux locale institutionnel et l'utilisation Comité.
Discussion
Imagerie biphotonique à travers une fenêtre ports exige la transmission à travers l'os aminci et la dure-mère, ce qui atténue la lumière laser et ajoute des aberrations optiques à plus grande profondeur 8. Cependant, malgré cet inconvénient, les profondeurs d'imagerie jusqu'à 250 um en dessous de la surface piale peut être atteint avec 900 nm d'excitation. Des profondeurs d'imagerie plus élevés peuvent en principe être possible avec des longueurs d'onde d'excitation p...
Déclarations de divulgation
Rien de divulguer.
Remerciements
Ce travail a été soutenu par l'American Heart Association (post-doctoral à AYS) et le National Institutes of Health (MH085499, EB003832 et OD006831 à DK). Nous tenons à remercier Beth Friedman et Pablo Blinder pour les commentaires sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments | |||
| Agent | Route de la livraison | Dose pour la souris | Durée | Remarques | Source | Ref Ref |
| Pentobarbital (Nembutal) | IP | 90 pg / g | 15-60 min | Marge de sécurité étroite. Travailler jusqu'à la dose appropriée de l'anesthésie lentement. Supplément de 10% de la dose d'induction selon les besoins. | 036093; Butler Schein | 7 |
| La kétamine (Ketaset) mélangé avec xylazine (Anased) | IP | 60 pg / g (K) 10 pg / g (X) (mélange dans une même seringue) | 20-30 min | Xylazine est co-injecté comme relaxant musculaire et analgésique. Supplément que kétamine à 50% de la dose d'induction selon les besoins. | (K) 010177, (X) 033 198; Butler Schein | 7 |
| L'isoflurane (Isothesia) | Inhalation | 4% de la concentration moyenne alvéolaire (MAC) pour l'induction, 1-2% de la MAC pour l'entretien | 4-6 h. | À condition en mélange de l'oxygène 70% et 30% de protoxyde d'azote. L'anesthésie prolongée conduit à ralentir la récupération. | 029403; Butler Schein | 26 |
Tableau 1. Suggérée agents anesthésiques pour les études de survie.
| ARTICLE | SOCIÉTÉ | CATALOGUE # / MODÈLE |
| Betadine | Butler Schein | 6906950 |
| La buprénorphine (Buprenex) | Butler Schein | 031919 |
| Fluorescéine isothiocyanate dextrane, 2 MDa poids moléculaire | Sigma | FD2000S |
| L'alcool isopropylique | Pêcheur | AC42383-0010 |
| Solution de lactate de Ringer | Butler Schein | 009846; |
| Lidocaïne, 2% (v / v) | Butler Schein | 002468 |
| Saline | Butler Schein | 009861 |
| Lait chirurgicale | Butler Schein | 014325 |
| Rouge Texas dextrane, 70 kDa de poids moléculaire | Invitrogen | D1864 |
| Maxizyme | Butler Schein | 035646 |
| DISPOSABLES | ||
| Carbide bavures, taille de la pointe 1/2 mm | Outils belle science | 19007-05 |
| Applicateurs pointe pigé | Fisher Scientific | 23-400-100 |
| Couvercle en verre, pas. 0 épaisseur | Thomas scientifique | 6661B40 |
| La colle cyanoacrylate | Industries ND | 31428 H04308 |
| Époussetage à gaz | Newegg | N82E16848043429 |
| Poudre de ciment Grip | Dentsply | 675571 |
| Ciment Grip solvant | Dentsply | 675572 |
| Seringue à insuline, 0,3 ml de volume avec 29,5 aiguille de la jauge | Butler Schein | 018384 |
| D'écrous et de boulons pour fixer la tête | Digikey | Nut, H723-ND; boulon, R2-56X1/4-ND |
| Pommade ophtalmique | Butler Schein | 039886 |
| Lames de bistouri | Fisher Scientific | 12-460-448 |
| Vis, autotaraudante # 000 | JI Morris Company | FF000CE125 |
| Silicone aquarium d'étanchéité | Perfecto Fabrication | 31001 |
| Poudre d'oxyde d'étain | Maman Minerals | EQT-TINOX |
| ÉQUIPEMENT | ||
| Scribe de verre | Fisher Scientific | 08-675 |
| Microscope à dissection | Carl Zeiss | OPMI-1 FC |
| Perceuse électrique alimenté | Foredom ou Osada | K.1020 (Foredom) ou EXL-M40 (Osada) |
| Rasoir électrique | Wahl | Série 8900 |
| Forceps, Dumont ne. 55 | Outils belle science | 11255-20 |
| Coussin chauffant Commentaires réglementé | FHC | 40-90-8 (thermistor rectal, 40-90-5D-02; hmanger pad, 40-90-2-07) |
| Vaporisateur isoflurane | Ohmeda | IsoTec4 |
| Oxymètre de pouls | Starr Sciences de la Vie | MouseOx |
| Tournevis, miniature | Garret Wade | 26B09.01 |
| Cadre stéréotaxique | Kopf Instruments | Modèle 900 (avec masque d'anesthésie de la souris et les non-rupture barres d'oreilles) |
| Ciseaux chirurgicaux, extrémité émoussée | Outils belle science | 14078-10 |
| Nettoyeur à ultrasons | Fisher Scientific | 15-335-30 |
Tableau 2. Liste des réactifs spécifiques, consommables et équipements.
Références
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D., Yuste, R. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. , 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. . Laboratory animal anesthesia. , (1987).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon