Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Eine polierte und verstärkte ausgedünnten Schädel Fenster für Langzeit-Imaging im Gehirn der Maus
In diesem Artikel
Zusammenfassung
Wir stellen eine Methode, um ein bildgebendes Fenster in der Maus, die Schädel Millimeter überspannt und ist seit Monaten ohne Entzündung des Gehirns stabil zu bilden. Diese Methode wird auch für longitudinale Studien des Blutflusses, Zelluläre Dynamik und Zell / vaskuläre Struktur mit zwei-Photonen-Mikroskopie geeignet.
Zusammenfassung
In-vivo-Bildgebung der kortikalen Funktion erfordert optische Zugang zum Gehirn ohne Störung des intrakraniellen Umwelt. Wir stellen eine Methode, um eine polierte und verstärkte ausgedünnt Schädel (Ports) Fenster in der Maus Schädel, die mehrere Millimeter im Durchmesser überspannt und ist über Monate stabil zu bilden. Der Schädel auf 10 bis 15 um in der Dicke mit einer Hand gehalten Bohrer optische Klarheit zu erreichen verdünnt und dann mit Sekundenkleber und ein Deckglas zu überlagern: 1) für Steifigkeit, 2) zu verhindern Knochenwachstum und 3) zu reduzieren Lichtstreuung von Unregelmäßigkeiten auf der Knochenoberfläche. Da der Schädel nicht verletzt ist, wird jede Entzündung, die den Prozess beeinflussen könnten, untersucht stark reduziert. Imaging Tiefen von bis zu 250 mu m unterhalb der kortikalen Oberfläche kann mit Hilfe der Zwei-Photonen-Laser-Scanning-Mikroskopie werden. Dieses Fenster eignet sich gut zur Hirndurchblutung und zelluläre Funktion in beide betäubt und wach Vorbereitungen zu studieren. Es bietet darüber hinaus den OPPortunity zu manipulieren Zellaktivität mit Optogenetik oder um den Blutfluss in ausgewählten Behältern durch Bestrahlung der zirkulierenden Photosensibilisatoren stören.
Protokoll
1. Vorbereitung für Chirurgie I
- Reinigen Sie die chirurgischen Instrumente im Ultraschallbad in einer Mischung aus Maxizyme und Chirurgische Milch in einem Ultraschallreiniger. Autoklavieren chirurgische Instrumente vor jedem Experiment.
- Stellen Sie sicher, dass alle notwendigen Reagenzien und Verbrauchsmaterial zur Verfügung stehen. Eine Liste von Reagenzien und Verbrauchsmaterial ist in Tabelle 2 bereitgestellt. Reagenzien und Einwegartikel, die in Kontakt mit dem freiliegenden Gewebe zu kommen, sollte steril sein, wenn möglich.
- Induzieren Anästhesie. Typische Anästhetika für das Überleben sind in Tabelle 1 beschrieben. Stellen Sie sicher, chirurgische Ebene der Anästhesie, indem Sie für fehlende Zehen Prise Reflex. Die optimale Alter von Maus beträgt 3 bis 6 Wochen alt sind. Die Schädel von jüngeren Mäuse sind weicher und schwieriger zu dünn. Ältere Mäuse haben dickere Schädel, die mehr während der Durchforstung Verfahren wird bluten.
- Sichern Sie das Tier in einem stereotaktischen Rahmen ein. Eine Liste von chirurgischen Einrichtungen ist in Tabelle 2 bereitgestellt.
- Pflegen Körpertemperaturtur bei 37 ° C unter Verwendung einer Rückkopplung geregelt rektale Sonde und Wärmekissen.
- Bewerben Augensalbe in die Augen, Feuchtigkeit zu speichern.
- Rasieren Sie die Kopfhaut mit einem kleinen elektrischen Rasierapparat.
- Reinigen der Kopfhaut mit Betadin, durch einen Abstrich mit 70% (v / v) Isopropyl-Alkohol.
- Wenn gewünscht, prüfen Sie, ob Herz-und Atemfrequenz in einem normalen Bereich mit einem Pulsoximeter sind. Für eine Maus, sollten diese Zahlen Zentrum um 10 und 2 Hz zur Verfügung.
- Wärmen Sie einen aliquoten Teil sterilfiltriert künstliche Rückenmarksflüssigkeit (ACSF) bis 37 ° C (125 mM NaCl, 10 mM Glucose, 10 mM HEPES, 3,1 mM
CaCl 2, 1,3 mM MgCl 2, pH 7,4) (alle Chemikalien von Sigma) 2.
2. Montage eines Kopfrahmen
- Entfernen Sie die Kopfhaut über den gesamten Schädel dorsalen Oberfläche mit einer Pinzette und Scheren. Schneiden der Haut seitlich an den Kanten der zeitlichen Muskeln auf beiden Seiten des Schädels und Schreibenerior zu den Muskeln des Halses (1A).
- Mit einem Skalpell-Klinge, um den dünnen Periost von der Oberfläche des Schädels zu entfernen.
- Reinigen Sie den Schädel mit einem feuchten Wattestäbchen und trocknen Sie die Oberfläche mit einem Schädel Luftstrom aus einem Staub kann. Dann bewerben Sie sich eine dünne Schicht Sekundenkleber auf den gesamten Schädel Oberfläche. Lassen Sie den Kleber gut trocknen lassen. Diese Schicht von Klebstoff ist für eine ordnungsgemäße Haftung der Dentalzement in den nachfolgenden Schritten erforderlich. Die Sekundenkleber muss nicht sterilisiert werden.
- Bringen Sie ein Metall-Stecker an der Kopfoberfläche, weg von der Fläche des gewünschten Fensters. Für narkotisierten Vorbereitungen, kann eine kleine Nuss auf den Schädel mit einem Klecks Sekundenkleber, der später in die Setup-Bildgebung mit einer Schraube (Abb. 1B, 1L und 1N) eingeschraubt werden kann gesichert werden. Verschließen Sie die Rückseite der Mutter mit Klebeband, um sicherzustellen, dass Kleber nicht in die Themen während der Befestigung an der Schädelbasis. Die Mutter und Band sollte sterilisiert werden durch Autoklavieren vor der Operation.
- Für wach Bildgebung Vorbereitungen, fügen Sie eine benutzerdefinierte steifer Verteiler mit zwei Befestigungspunkten (Abb. 1 M und 1 N). Bohren Sie zwei Löcher in den Schädel über der kontralateralen kortikalen Hemisphäre mit einem ½ mm Bohrer Grat, und dann führen zwei # 000 Blechschrauben. Diese Schrauben verankern hilft der Kopf auf den Schädel zu montieren. Tragen Sie nur eine volle Umdrehung der Schraube, um zu vermeiden, Druck auf die darunter liegenden Kortex. Dann fügen Sie die benutzerdefinierte Metall Querstange mit einem kleinen Klecks Sekundenkleber über dem Kleinhirn. Lassen Sie den Sekundenkleber gut trocknen lassen. Dieses Metall-Stecker reduziert die Freiheitsgrade und vereinfacht die Verlagerung von der gleichen Bildfeld in Längsschnittstudien. Eine breite Querstange gibt reichlich Raum für Platzierung der Elektroden und Stimulation der Tasthaare. Detaillierte Pläne für die Erzeugung der Sitte Galgens und Befestigungsvorrichtung sind online verfügbar (SICS / links.html "> http://physics.ucsd.edu/neurophysics/links.html). Die Schrauben und Querstange sollte durch Autoklavieren vor der Operation sterilisiert werden.
- Decken den gesamten Kopfoberfläche, ohne die Position des Fensters, mit einer Schicht von Zahnzement (1C und 1D). Sicherstellen, dass alle freiliegenden Kanten der Haut durch Zement abgedeckt werden. Die Komponenten der Dentalzement müssen nicht sterilisiert werden.
3. Die Erzeugung eines poliert und verstärkt ausgedünnten Schädel (Ports) Fenster
- Stellen Sie sicher, dass Bohrer scharf sind und Grate zu vermeiden wiederzuverwenden. Mit einer niedrigen Geschwindigkeit auf der Dentalbohrers, dünn ein 2 mm x 2 mm über der Region somatosensorischen Kortex mit einer ½ mm-Fräse. Wechseln Sie zwischen Benetzung der Schädel mit ACSF und anschließendes Trocknen des Schädels Oberfläche mit einem leichten Luftstrom aus einem Gas Staubtuch; nass für die Kühlung, für die Durchforstung und trocken. Dies erfordert eine Ausdünnung durch die spongiöse Schicht des Schädels, die bluten können, aber kann kontrollierened durch Spülen mit ACSF (Abb. 1E). Der Schädel beginnt, unter dem leichten Druck des Bohrers zu beugen, wenn es ~ 50 um beträgt, und der Pia-Gefäße sollten durch nasse Knochen (Abb. 1F) sichtbar. Bei dieser Dicke wird kleine weiße Punkte innerhalb des Knochens sichtbar für ein paar Sekunden unmittelbar nach dem trockenen Schädel Oberfläche befeuchtet ist.
- An diesem Punkt dünnen der Knochen noch weiter. Verwenden Sie einen Bohrer langsamer Geschwindigkeit, also 1000 Umdrehungen pro Minute, die den Schädel rasiert Oberfläche nur mit einem leichten Anflug. Verwenden Sie kleine kontrollierte Bewegungen und halten den Bohrer wie ein Stift und nur mit Gewalt in seitlicher Richtung. Die Knochen werden sollte ~ 10 bis 15 um auf seine endgültige Dicke (Abb. 1G). Wenn die Knochen dünn genug ist, werden die kleinen weißen Flecken im Knochen nicht mehr sichtbar sein, wenn die trockenen Schädel Oberfläche angefeuchtet wird.
- Polieren Sie die Fenster Region mit Zinn-Oxid-Pulver. Befestigen Sie eine vorgefertigte Bohrer, die in Silicon-Dichtstoff Aquarium und mit getauchtengezogen, so dass eine verjüngte Peitsche (kleines Bild, Abb. 1H). Die Silikon-Peitsche sollte mindestens einen Tag vor der Operation vorbereitet werden, und mit 70% Isopropanol vor dem Gebrauch. Geben Sie eine kleine Prise Pulver auf das Fenster zusammen mit einem Tropfen ACSF (Abb. 1H). Schwenken Sie den Brei auf das Fenster, für bis zu 10 Minuten durch leichtes Berühren der Spitze des sich bewegenden Peitsche auf der Kopfoberfläche. Wegspülen die Zinnoxidpulver gründlich aus dem Fenster mit ACSF und trocknen Sie die Knochen gründlich mit einem leichten Luftstrom. Unregelmäßigkeiten der Oberfläche und adhärenten Knochensplitter durch Bohrungen in den vorherigen Schritten nach links sollte nach dem Polieren (Abb. 1H und 1I) entfernt werden. Die Zinn-Oxid-Pulver muss nicht sterilisiert werden.
- Schneiden Sie quadratische Stücke von No. 0 Deckglas geringfügig kleiner als die Größe des Fensters. Verwenden Sie einen Schreiber, um sanft punkten getrennt horizontalen und vertikalen Linien in das Deckglas mit einer geraden Kante. Dann das Deckglas in einer Petrischale und knock das Gericht gegen eine Tischkante, um die Glasstücke zu trennen. Die gesamte Petrischale kann anschließend autoklaviert, um die Sterilität zu gewährleisten.
- Platzieren Sie eine entsprechend große Deckglas in der Nähe der getrocknete Fenster. Tragen Sie eine kleine Klecks Sekundenkleber auf das Fenster mit der Spitze eines gebrochenen hölzernen Wattestäbchen, und schnell drücken Sie die vorgeschnittenen Stück Deckglas oben auf dem Leim. Vermeiden Sie Blasen unter dem Deckglas. Drücken Sie vorsichtig die Abdeckung Glas gegen den Schädel Oberfläche, und halten Sie für einige Sekunden (Abb. 1J und 1O). Lassen Sie den Kleber gut trocknen über 15 Minuten. Überschüssiges Sekundenkleber kann von der oberen Oberfläche des Deckglases mit einer Skalpell-Klinge entfernt werden, nachdem sie getrocknet wird. Seal die Ränder des Deckglases mit Zahnzement und bilden eine leicht Brunnen, um Wasser für die Tauch-Objektiv (Abb. 1K und 1O) halten angehoben.
4. Erholung
- Platzieren Sie das Tier in einem warmen Käfig nach einer Operation. Überwachen Sie dieTier in regelmäßigen Abständen, bis sie vollständig erholt aus der Narkose.
- Wenn die Herstellung soll für mehr als einen Tag überleben, bereitzustellen Buprenorphin (0,03 g pro g Nagetier) zur Analgesie. Wir typischerweise Bild des Tieres mindestens einen Tag nach der anfänglichen Implantation.
5. Imaging Vorbereitung
- Stabilisieren des Tieres auf einer optischen Steckbrett Bildgebung unter Verwendung des Rahmens als Kopfstütze (Abb. 1L und 1M). Rückhaltesystem Vorrichtung können aus kommerziell erhältlichen mechanische Komponenten aus Qioptiq oder ThorLabs werden. Unser separater Platte kann zwischen chirurgischen und Zwei-Photonen-Imaging-Suiten mit dem Tier und aller physiologischen Überwachungsgeräten als eine Einheit 3 zusammengebaut transportiert werden.
- Wenn Blutflußabbildung gewünscht wird, zu injizieren 0,05 ml von 5% (w / v) fluoreszierenden Farbstoff-Dextran in steriler Kochsalzlösung entweder durch die Schwanzvene oder infraorbitalis Vene gelöst, um das Blutserum (2A und 2C 2H kennzeichnen ) 4-7. Dies muss unter Vollnarkose durchgeführt werden. Infraorbitalis Vene Verwaltung möglicherweise einfacher für Anfänger, als Dextranlösungen zäher sind. Die Schwanzvene kann schwierig sein, mit dunklen Mäusen zu suchen, und die Vene dazu neigt, nach einer Injektion nicht verdecken. Für die Bildgebung Gefäßsystem mit grüner Emission, verwenden Sie ein Fluoresceinisothiocyanat Dextran. Für rote Emission, verwenden Sie ein Texas Red Dextran. Bei hohen Dextranen, wird der Farbstoff in Umlauf für mehrere Stunden bleiben. Alternativ können Tiere mit endogenen Fluoreszenzmarkierungen direkt an den entsprechenden Zwei-Photonen-Anregungs abgebildet werden. Das Dextran-Lösung in Aliquots für eine spätere Verwendung eingefroren werden.
- Reinigen Sie das Fenster Oberfläche mit einem feuchten Wattestäbchen.
- Für eine längere Bildgebung von narkotisierten Vorbereitungen, injizieren sterile Ringer-Laktat-Lösung intraperitoneal bei einem Volumen von 3 ul pro Gramm alle 2 Stunden, um Körperflüssigkeiten und Energiebedarf zu erhalten.
- Bei der Abbildung Tieren im Wachzustand, begrenzen Kopfstütze auf nur wenige Stunden am Stück, um Stress zu reduzieren. Bringen Sie das Tier auf dem Weg nach Hause Käfig zwischen Imaging-Sitzungen für Nahrung und Wasser.
6. Repräsentative Ergebnisse
Ein erfolgreiches Fenster können bildgebende Tiefen bis zu 250 mu m unterhalb der Pia-Oberfläche für mehrere Monate. Diese Methode wurde verwendet, um in vivo Kapillarblutflusses 4, 8, Mikrogliaaktivierung 8, 9, und dendritischen Struktur innerhalb des Rindenparenchym 8 studierst. In einem Beispiel verwenden wir zwei-Photonen-Tomographie, um die kortikalen Gefäßsystem eines anästhesierten Thy1-gelb fluoreszierendes Protein (YFP) Maus zeigen, nachdem das Blutserum durch intravenöse Injektion von Texas Red Dextran (Abb. 2A) beschriftet ist. Dural Schiffe sind oft sichtbar etwas oberhalb der kortikalen Oberfläche in der Dura mater (Abb. 2C, Pfeil). Große pialen Arteriolen und Venolen lie auf der kortikalen Oberfläche (Abb. 2D). Penetrationsgefäß Zweig von dieser Oberfläche Netz und tauchen ein in die Hirnrinde, wo sie in ein dichtes Kapillarbett, die die kortikale Gewebe ernährt (Abb. 2E bis 2H) verzweigen. Dendritische Dorne tiefer YFP kortikalen Neuronen exprimiert, ein Signal endogenen dieser Mauslinie, können gleichzeitig in einem zweiten Kanal 10 (2B bis 2H) abgebildet werden. Die zweite harmonische Signal des Knochens wurde in einem dritten Kanal gesammelt und verwendet werden, um die Dicke des dünner Schädel nach der Entnahme des Bildes Stapel (2A bis 2C) abzuschätzen.
Kortikale vaskuläre Dynamik sind zutiefst Anästhetika 11 betroffen. In einem zweiten Beispiel zeigen wir ein Video von spontanen Vasoaktivität durch Zwei-Photonen-Mikroskopie von einem habituierten wach Maus gesammelt. Klare vasomotorischen Schwingungen im Lumendurchmesser mit einem Pia-Arterie gesehen, aber nicht mit einem benachbarten Venole. Diesbasalen Bereich der Vasoaktivität ist mit Urethannarkose 4 vermindert. Um spontanen und evozierten Veränderungen im Blutfluss zu quantifizieren, verwenden wir angepasst Linie Scan-Techniken, um sowohl die Gefäßdurchmesser und roten Blutkörperchen Geschwindigkeit der einzelnen Fahrzeuge erfassen. Detaillierte Ressourcen auf quantitativen Blutfluss Bildgebung mittels Zwei-Photonen-Mikroskopie sind 3, 12.
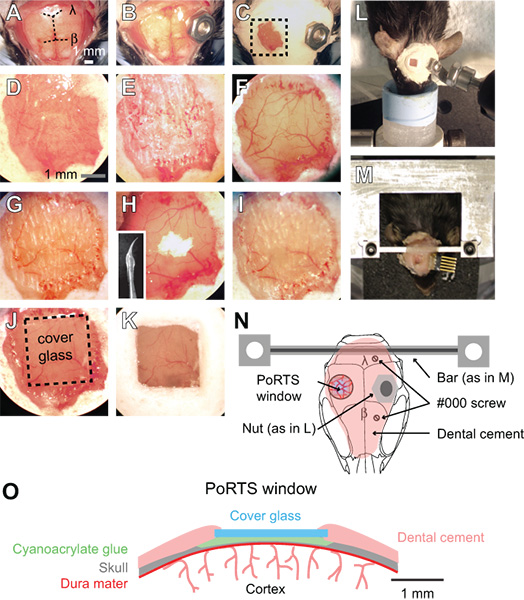
Abbildung 1. Vorgehensweise bei einer Ports Fenster. (A bis K) Bilder von aufeinander folgenden Schritte in dem Verfahren zur Erzeugung eines Ports Fenster. Siehe Text für detaillierte Anweisungen. β = Bregma und λ = Lambda. (L) aus Schrauben und Muttern zur Befestigung des Kopfes während der Bildgebung von narkotisierten Vorbereitungen. (M) Custom bearbeitet Querstange Kopfhalterung für Zubereitungen wach. In diesem Beispiel wurde ein Verbinder auch zur wiederholten Aufzeichnungen Elektrokortikogramm implantiert. (N)Schematische Darstellung dorsale Ansicht des Galgens und Position der verschiedenen Komponenten. Die Mutter in L-Panel verwendet wird als Alternative zu der Querstange mit Panel in M. Zwei bedeutete # 000 selbstschneidende Schrauben sind mit der Traverse für stabilen Stand mit wach Bildgebung Vorbereitungen aufgenommen. (O) Schematische Darstellung Querschnitt eines Ports Fenster.
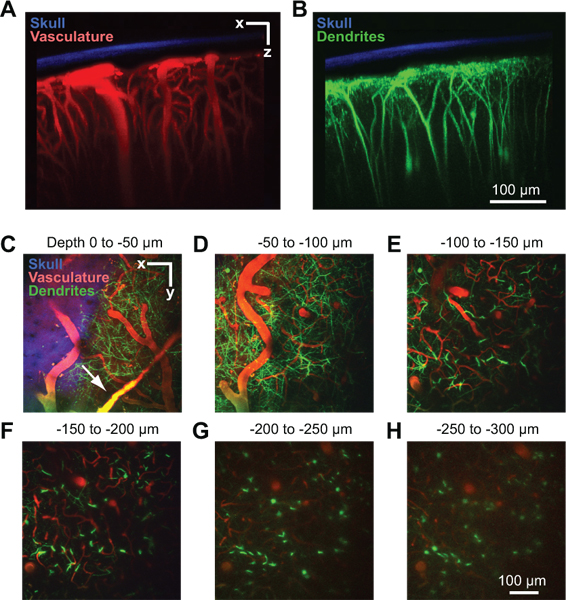
Abbildung 2. Zwei-Photonen-Imaging von Gefäßen und neuronale Struktur im Kortex der Maus. Alle Bilder wurden durch einen Ports Fenster in einem Thy1-YFP Maus 2 Tage nach der Implantation Fenster 10 gesammelt. Maximale Projektion über 150 um von Gewebe in der koronalen Orientierung zeigt den verdünnten Schädel in Bezug auf das Gefäßsystem (A) und Dendriten (B). Der Knochen (blau) durch das Sammeln der zweiten Harmonischen Fluoreszenz bei 450 nm Emission mit 900 nm Anregung erkannt 8. Das Gefäßsystem (rot) wurde von intravenös injizierten 70 kDa Texas Red Dextran 6 beschriftet. Die dendritischen Felder von Neuronen (grün) sind endogene dem Thy1-YFP transgene Mauslinie. (CH) Maximale Projektionen über 50 mu m von Gewebe in der horizontalen Ausrichtung in verschiedenen Tiefen unterhalb der Pia. Die Daten sind aus dem gleichen Bildstapel in Panels A und B gezeigt Dural Gefäße sichtbar sein knapp oberhalb der kortikalen Oberfläche (Pfeil in C).
Abkürzungen
ACSF = künstliche Rückenmarksflüssigkeit
PORTS = poliert und verstärkte ausgedünnt Schädel Fenster
YFP = gelb fluoreszierendes Protein
i Stellen Sie sicher, dass die Verfahren beschrieben, die von Ihrem lokalen institutionellen Animal Care sind genehmigt und Verwenden Ausschuss.
Diskussion
Zwei-Photonen-Bildgebung durch eine Ports Fenster erfordert die Übertragung durch den ausgedünnten Knochen und Dura, welches das Laserlicht dämpft und fügt optischen Aberrationen in größeren Tiefen 8. Doch trotz dieses Nachteils kann bildgebenden Tiefen bis zu 250 mu m unterhalb der Pia-Oberfläche mit 900 nm Anregung erreicht werden. Größere Tiefen Bildgebung kann im Prinzip möglich sein, mit mehr Anregungswellenlängen 13. Ein wesentlicher Vorteil dieser Methode ist das Fehlen von kortik...
Offenlegungen
Nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde von der American Heart Association (Postdoc-Stipendium an AYS) und der National Institutes of Health (MH085499, EB003832 und OD006831 zu DK) unterstützt. Wir bedanken uns bei Beth Friedman und Pablo Blinder für Anmerkungen zum Manuskript.
Materialien
| Name | Company | Catalog Number | Comments | |||
| Agent | Route der Lieferung | Dosis für die Maus | Dauer | Hinweise | Quelle | Ref |
| Pentobarbital (Nembutal) | IP | 90 ug / g | 15-60 min | Schmale Sicherheitsmarge. Arbeiten Sie bis zu richtigen Dosis der Narkose langsam. Zuschlag 10% der Induktionsdosis wie erforderlich. | 036093; Butler Schein | 7 |
| Ketamin (Ketaset) mit Xylazin (Anased) gemischt | IP | 60 ug / g (K) 10 ug / g (X) (Mischung in derselben Spritze) | 20-30 min | Xylazin wird als Muskelrelaxans und Analgetikum co-injiziert. Zuschlag nur Ketamin bei 50% der Induktion Dosis erforderlich. | (K) 010.177, (X) 033.198; Butler Schein | 7 |
| Isofluran (Isothesia) | Inhalation | 4% bedeuten alveolare Konzentration (MAC) für die Induktion; 1-2% MAC für die Wartung | 06.04 Uhr. | Bildquelle in einer Mischung aus 70% Sauerstoff und 30% Distickstoffmonoxid. Längerer Betäubung führt zur Genesung verlangsamen. | 029403; Butler Schein | 26 |
Tabelle 1. Empfohlene Anästhetika für das Überleben Studien.
| ITEM | UNTERNEHMEN | Catalog # / MODELL |
| Betadine | Butler Schein | 6906950 |
| Buprenorphin (Buprenex) | Butler Schein | 031919 |
| Fluoresceinisothiocyanat Dextran, 2 MDa Molekulargewicht | Sigma | FD2000S |
| Isopropylalkohol | Fischer | AC42383-0010 |
| Ringer-Laktat-Lösung | Butler Schein | 009846; |
| Lidocain-Lösung, 2% (v / v) | Butler Schein | 002468 |
| Saline | Butler Schein | 009861 |
| Chirurgische Milk | Butler Schein | 014325 |
| Texas Red Dextran, 70 kDa Molekulargewicht | Invitrogen | D1864 |
| Maxizyme | Butler Schein | 035646 |
| EINWEGARTIKEL | ||
| Hartmetallfräser, 1/2 mm Düsengröße | Fine Science Tools | 19007-05 |
| Cottoned Spitze Applikatoren | Fisher Scientific | 23-400-100 |
| Deckglas, nein. 0 Dicke | Thomas Scientific | 6661B40 |
| Sekundenkleber | ND Industries | 31428 H04308 |
| Gas-Staubtuch | Newegg | N82E16848043429 |
| Grip Zementpulver | Dentsply | 675571 |
| Grip Zement Lösungsmittel | Dentsply | 675572 |
| Insulinspritze, 0,3 ml Volumen mit 29,5 Gauge-Nadel | Butler Schein | 018384 |
| Mutter und Schraube, um den Kopf zu sichern | Digikey | Nuss-, H723-ND, Bolzen, R2-56X1/4-ND |
| Ophthalmische Salbe | Butler Schein | 039886 |
| Skalpellklingen | Fisher Scientific | 12-460-448 |
| Schrauben, selbstschneidend # 000 | JI Morris Company | FF000CE125 |
| Silikon-Dichtstoff Aquarium | Perfecto Fertigung | 31001 |
| Zinnoxidpulver | Mamas Minerals | EQT-TiNOX |
| EQUIPMENT | ||
| Glas-Schreiber | Fisher Scientific | 08-675 |
| Seziermikroskop | Carl Zeiss | OPMI-1 FC |
| Elektrische Bohrmaschine | Foredom oder Osada | K.1020 (Foredom) oder EXL-M40 (Osada) |
| Elektrische Rasierer | Wahl | Serie 8900 |
| Pinzetten, Dumont-Nr. 55 | Fine Science Tools | 11255-20 |
| Ihre Meinung geregelten Heizkissen | FHC | 40-90-8 (rektal Thermistor, 40-90-5D-02; hessen-Pad, 40-90-2-07) |
| Isofluran Verdampfer | Ohmeda | IsoTec4 |
| Pulsoximeter | Starr Life Sciences | MouseOx |
| Schraubendreher, Miniatur | Garret Wade | 26B09.01 |
| Stereotaktischen Rahmen | Kopf Instruments | Modell 900 (mit der Maus Narkosemaske und Nicht-Bruch Ohr Bars) |
| Chirurgische Schere, stumpfen Ende | Fine Science Tools | 14078-10 |
| Ultraschallreiniger | Fisher Scientific | 15-335-30 |
Tabelle 2. Liste der spezifischen Reagenzien, Verbrauchsmaterialien und Geräten.
Referenzen
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D., Yuste, R. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. , 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. . Laboratory animal anesthesia. , (1987).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten