Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un pulido y reforzado Diluido cráneo-Ventana para a largo plazo de imágenes del cerebro de ratón
En este artículo
Resumen
Se presenta un método para formar una ventana de imagen en el cráneo del ratón que se extiende milímetros y es estable durante meses sin inflamación del cerebro. Este método es muy adecuado para estudios longitudinales de flujo de sangre, la dinámica celular, y células / estructura vascular utilizando microscopía de dos fotones.
Resumen
En vivo de imágenes de la función cortical requiere acceso óptico hasta el cerebro, sin alteración del medio ambiente intracraneal. Se presenta un método para formar un cráneo pulido y reforzado con adelgazado (puertos) ventana en el cráneo del ratón que se extiende por varios milímetros de diámetro y se mantiene estable desde hace meses. El cráneo está adelgazada para 10 a 15 micras de espesor con un taladro de mano para lograr la claridad óptica, y después se cubrió con pegamento de cianoacrilato y una cubierta de vidrio para: 1) proporcionar rigidez, 2) inhibir la regeneración ósea y 3) reducir la dispersión de luz a partir de las irregularidades sobre la superficie del hueso. Dado que el cráneo no se rompe, la inflamación que puede afectar al proceso objeto de estudio se reduce considerablemente. Profundidades de imagen de hasta 250 micras por debajo de la superficie cortical se puede lograr utilizando dos fotones de microscopía de barrido láser. Esta ventana se adapta bien para estudiar el flujo sanguíneo cerebral y la función celular en forma de preparados tanto anestesiados y despierto. Además, ofrece la optunidad para manipular la actividad de células utilizando optogenética o para interrumpir el flujo de sangre en los vasos dirigidos por irradiación de circulante fotosensibilizadores.
Protocolo
1. Preparativos para la operación i
- Limpiar los instrumentos quirúrgicos por tratamiento con ultrasonidos en una mezcla de leche Maxizyme y Quirúrgicas en un limpiador ultrasónico. Autoclave de los instrumentos quirúrgicos antes de cada experimento.
- Asegúrese de que todos los reactivos necesarios y desechables están disponibles. Una lista de los reactivos y desechables se proporciona en la Tabla 2. Los reactivos y material desechable que entran en contacto con los tejidos expuestos deben ser estériles, cuando sea posible.
- Inducir la anestesia. Anestésicos típicos adecuados para estudios de supervivencia se describen en la Tabla 1. Asegúrese de plano quirúrgico de anestesia mediante la comprobación de la falta de reflejo de los pies pizca. La edad óptima de ratón es de 3 a 6 semanas de edad. Los cráneos de los ratones más jóvenes son más suaves y más difícil de fina. Los ratones más viejos tienen más gruesos cráneos que sangran más durante el proceso de adelgazamiento.
- Asegure que el animal en un marco estereotáxico 1. Una lista de equipo quirúrgico se proporciona en la Tabla 2.
- Mantener la temperatura corporaltura a 37 ° C por medio de una retroalimentación regular de la sonda rectal y almohadilla de calor.
- Aplique una pomada oftálmica a los ojos para retener la humedad.
- Afeitar el cuero cabelludo con una navaja de afeitar eléctrica pequeña.
- Limpiar el cuero cabelludo con Betadine, seguido por raspado con 70% (v / v) de alcohol isopropílico.
- Si lo desea, compruebe que la frecuencia cardíaca y la respiración estén dentro del rango normal con un oxímetro de pulso. Para un ratón, estas cifras deben centrarse alrededor de 10 Hz y 2, respectivamente.
- Calentar una parte alícuota de esterilizada por filtración artificial líquido cefalorraquídeo (ACSF) a 37 ° C (125 mM NaCl, 10 mM de glucosa, 10 mM HEPES, 3,1 mM
CaCl 2, 1,3 mM de MgCl 2, pH 7,4) (todos los productos químicos de Sigma) 2.
2. Montaje de un marco para la cabeza
- Quitar el cuero cabelludo sobre la superficie del cráneo dorsal entero con un par de pinzas y tijeras quirúrgicas. Recortar la piel lateralmente a los bordes de los músculos temporales a cada lado del cráneo y posterior a los músculos del cuello (fig. 1A).
- Utilizar una hoja de bisturí para eliminar el periostio delgada de la superficie del cráneo.
- Limpie el cráneo con un algodón húmedo aplicador con punta y secar la superficie del cráneo con una corriente de aire de un polvo posible. A continuación, aplicar una capa delgada de pegamento de cianoacrilato a toda la superficie del cráneo. Deje que el pegamento se seque completamente. Esta capa de pegamento es necesario para la adherencia adecuada del cemento dental en pasos posteriores. El pegamento de cianoacrilato no necesita ser esterilizado.
- Coloque un conector de metal a la superficie del cráneo, lejos de la zona de la ventana deseada. Para los preparados anestesiados, una tuerca pequeña puede ser asegurada al cráneo con una gota de pegamento de cianoacrilato, que más tarde puede ser atornillado en la configuración de imagen usando un perno (Fig. 1B, 1L y 1N). Sellar la parte posterior de la tuerca con la cinta para asegurar que el pegamento no entra en los hilos durante la colocación en el cráneo. La tuerca y la cinta debe ser esterilizado en autoclave antes de la cirugía.
- Para la preparación de imágenes despiertan, adjuntar un conector personalizado más rígido con dos puntos de fijación (Fig. 1M y 1N). Haga dos agujeros en el cráneo en el hemisferio contralateral cortical con una fresa de ½ mm de perforación, a continuación, introducir dos # 000 tornillos autorroscantes. Estos tornillos le ayudará a anclar la cabeza montar en el cráneo. Aplicar sólo una vuelta completa del tornillo, con el fin de evitar la aplicación de presión a la corteza subyacente. Luego, coloque la barra de metal cruz personalizado con un pequeño toque de pegamento de cianoacrilato en el cerebelo. Deje que el pegamento de cianoacrilato se seque completamente. Este conector de metal reduce en gran medida los grados de libertad y simplifica el traslado de la campo de la imagen misma en estudios longitudinales. Una barra transversal de ancho ofrece un amplio espacio para la colocación de electrodos y la estimulación de vibrisas. Planes detallados para la generación de la cabeza de montaje personalizado y dispositivo de fijación están disponibles en línea (SICS / links.html "> http://physics.ucsd.edu/neurophysics/links.html). Los tornillos y barras cruzadas deben ser esterilizados en autoclave antes de la cirugía.
- Cubrir la superficie del cráneo completo, excluyendo la ubicación de la ventana, con una capa de cemento dental (Fig. 1C y 1D). Asegurarse de que todos los bordes de la piel expuestas están cubiertas por el cemento. Los componentes del cemento dental no necesitan ser esterilizados.
3. La generación de un pulido y reforzado Diluido y el cráneo (puertos) Ventana
- Asegúrese de que las rebabas de perforación son nítidas y evitar su reutilización. Utilizando una velocidad baja en el taladro dental, delgada de 2 mm por 2 mm de la región en la corteza somatosensorial con un ½ mm rebabas. Alternar entre mojar el cráneo con ACSF y luego de secar la superficie del cráneo con una suave corriente de aire procedente de un plumero de gas, para la refrigeración húmeda y seca para el adelgazamiento. Para ello es necesario adelgazamiento en la capa esponjosa del cráneo, que puede sangrar, pero puede ser controlled mediante el lavado con ACSF (Fig. 1E). El cráneo empieza a flexionar bajo la ligera presión de la broca cuando está aproximadamente 50 micras, y los vasos piales debe ser visible a través del hueso húmedo (Fig. 1F). En este espesor, pequeñas manchas blancas en el hueso será visible durante unos pocos segundos inmediatamente después de la superficie del cráneo seco se humedece.
- En este punto, el hueso delgado aún más. Utilice una velocidad de perforación más lenta, es decir, 1.000 rpm, lo que se afeita la superficie del cráneo con sólo un ligero toque. Use pequeños movimientos controlados mientras se mantiene el taladro como una pluma y sólo aplicar la fuerza en la dirección lateral. El hueso debe ser ~ de 10 a 15 micras en su espesor final (Fig. 1G). Cuando el hueso es lo suficientemente delgada, las pequeñas manchas blancas en el hueso ya no será visible cuando la superficie del cráneo seco se humedece.
- Pulir la región de ventana con polvo de óxido de estaño. Adjunte una broca de pre-hecho que se ha sumergido en el sellador de silicona del acuario y conelaborado, dejando a un látigo cónico (en el recuadro, la figura. 1H). El látigo de silicona debe ser preparado por lo menos un día antes de la cirugía, y se esteriliza con isopropanol al 70% antes de su uso. Ponga una pizca de polvo en la ventana junto con una gota de ACSF (Fig. 1H). Agitar la suspensión durante la ventana de hasta diez minutos tocando suavemente la punta del látigo en movimiento a la superficie del cráneo. Quitarse el polvo de óxido de estaño a fondo de la ventana con ACSF y secar el hueso completamente con una suave corriente de aire. Irregularidades de la superficie y chips óseos dejados por los adherentes de perforación en los pasos anteriores deben retirarse después del pulido (Fig. 1H y 1I). El polvo de óxido de estaño no necesita ser esterilizado.
- Corte los pedazos cuadrados de ninguna. 0 cubierta de vidrio ligeramente más pequeño que el tamaño de la ventana. Use un escriba para anotar cuidadosamente separados líneas horizontales y verticales en la hoja de la cubierta usando un borde recto. A continuación, coloque el cubreobjetos en una placa de Petri y knock el plato contra un borde de la mesa para separar las piezas de vidrio. La totalidad de placa de Petri se puede entonces en autoclave para garantizar la esterilidad.
- Coloque una cubierta de vidrio de tamaño adecuado cerca de la ventana de secado. Aplique una pequeña gota de pegamento de cianoacrilato sobre la ventana con la punta de un aplicador de madera rota punta de algodón, y rápidamente empuja la pieza precortada de la cubierta de vidrio encima de la cola. Evitar la creación de burbujas debajo de la cubierta de vidrio. Empuje suavemente la cubierta de vidrio contra la superficie del cráneo, y mantener durante unos segundos (Fig. 1J y 1O). Deje que el pegamento se seque completamente durante 15 minutos. El exceso de pegamento de cianoacrilato se puede quitar de la superficie superior de la cubierta de vidrio con una hoja de bisturí después se secó. Sellar los bordes de la cubierta de vidrio con cemento dental y formar un ligeramente elevado así para retener el agua para la lente de inmersión (Fig. 1K y 1O).
4. Recuperación
- Colocar el animal en una jaula de la cirugía siguiente tibia. Supervisar ellos animales periódicamente hasta que se recupere completamente de la anestesia.
- Si la preparación está destinada a sobrevivir durante más de un día, que la buprenorfina (0,03 mg por roedores g) para la analgesia. Por lo general la imagen del animal por lo menos un día después de la implantación inicial.
5. Preparación de imágenes
- Estabilizar el animal en una mesa óptica para formación de imágenes, utilizando el marco como un soporte para la cabeza (fig. 1L y 1M). Un aparato de retención puede hacerse a partir de componentes optomecánicos comercialmente disponible de Qioptiq o Thorlabs. Nuestra placa separada puede ser transportada entre las suites de imágenes quirúrgicas y dos fotones con el animal y todos los dispositivos de monitorización fisiológica ensamblados como una unidad 3.
- Si la imagen del flujo sanguíneo se desea, se inyectan 0,05 ml de 5% (w / v) fluorescente-dextrano colorante disuelto en solución salina estéril a través de la vena de la cola o la vena infraorbitario para etiquetar el suero sanguíneo (Fig. 2A y 2C a 2H ) 4-7. Esto debe hacerse bajo anestesia general. La administración de la vena infraorbitario puede ser más fácil para los principiantes, como soluciones de dextrano es más viscoso. La vena de la cola puede ser difíciles de localizar en los ratones de colores oscuros, y la vena tiende a colapsarse después de una inyección fallado. Para imágenes de vasos con el verde de las emisiones, utilizar un dextrano isotiocianato de fluoresceína. Por emisión roja, utilizar un dextrano Rojo Texas. Con altas dextranos de peso molecular, el colorante se mantendrá en circulación durante varias horas. Alternativamente, los animales con endógenos marcadores fluorescentes pueden tomarse imágenes directamente a la longitud de onda de excitación apropiada de dos fotones. La solución de dextrano se puede congelar en alícuotas para uso futuro.
- Limpie suavemente la superficie de la ventana con un algodón húmedo aplicador con punta.
- Para imágenes prolongado de preparaciones anestesiados, inyectar por vía intraperitoneal de Ringer estéril lactato solución a un volumen de 3 l por gramo cada 2 horas para mantener los fluidos corporales y los requisitos de energía.
- Cuando los animales de imagen en el estado de vigilia, limitar el reposacabezas a sólo unas pocas horas a la vez para reducir los niveles de estrés. Volver al animal a la jaula de alojamiento entre las sesiones de formación de imágenes para la alimentación y el agua.
6. Los resultados representativos
Una ventana éxito permitirá profundidades de imagen de hasta 250 micras por debajo de la superficie pial durante varios meses. Este método ha sido utilizado para estudiar en el flujo de sangre capilar in vivo 4, 8, activación microglial 8, 9, y la estructura dendrítica en el parénquima cortical 8. En un ejemplo, podemos utilizar dos fotones de imágenes para mostrar el resultado de la vasculatura cortical de un anestesiado Thy1-amarillo proteína fluorescente (YFP) ratón, después de que el suero sanguíneo se etiqueta por inyección intravenosa de Rojo Texas dextrano (Fig. 2A). Vasos durales son a menudo visibles ligeramente por encima de la superficie cortical en la duramadre (Fig. 2C, flecha). Las grandes las arteriolas piales y li vénulase en la superficie cortical (Fig. 2D). Vasos rama penetrante de esta red de superficie y sumergirse en la corteza donde se ramifican en una cama densa capilar que nutre el tejido cortical (Fig. 2E a 2H). Cenadores dendríticas de YFP profunda expresión de las neuronas corticales, una señal endógena a esta línea de ratón, se pueden visualizar al mismo tiempo en un segundo canal 10 (Fig. 2B 2H). La señal de segundo armónico del hueso se recogió en un tercer canal, y puede ser utilizado para medir el espesor del cráneo adelgazado después de la recogida de pilas de imágenes (fig. 2A a 2C).
Corticales dinámica vascular se ven profundamente afectados por los anestésicos 11. En un segundo ejemplo, se muestra un video de vasoactividad espontánea recogidos por microscopia de dos fotones de un ratón despierto habituado. Oscilaciones prominentes vasomotores en el diámetro de la luz se ven con una arteriola pial, pero no con una vénula vecino. Esterango basal de vasoactividad se ve disminuida con 4 uretano anestesia. Para cuantificar los cambios espontáneos y evocados en el flujo sanguíneo, utilizamos técnicas adaptadas de la línea de exploración para captar tanto el diámetro vascular y la velocidad de los glóbulos rojos de las embarcaciones individuales. Los recursos detallados sobre técnicas cuantitativas de imagen del flujo sanguíneo utilizando la microscopia de dos fotones están disponibles 3, 12.
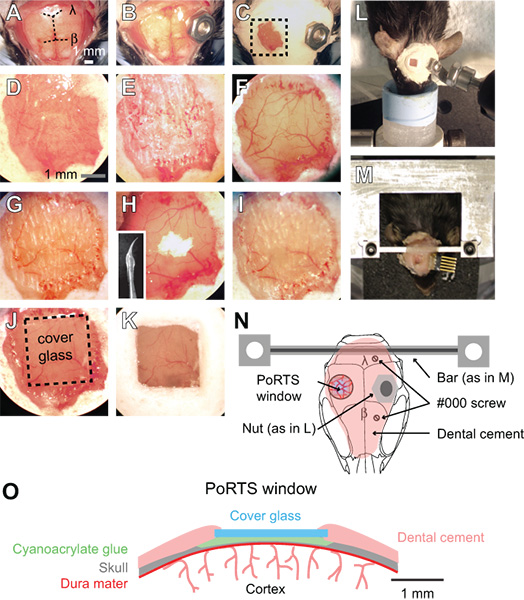
Figura 1. Procedimiento para una ventana Puertos. (K a) Las imágenes de los pasos secuenciales en el procedimiento para la generación de una ventana de Puertos. Véase el texto para obtener instrucciones detalladas. β = bregma y lambda = λ. (L) y la tuerca del perno del sistema para asegurar la cabeza durante la exploración de los preparativos anestesiados. (M)-formada montaje cruz la cabeza de barras para los preparativos despiertos. En este ejemplo, un conector se implantó también para las grabaciones electrocorticogram repetidas. (N)Diagrama esquemático que muestra la vista dorsal de la cabeza y la posición de montaje de varios componentes. La tuerca de L utilizado en el panel que se entiende como una alternativa a la barra transversal con dos en el panel de M. # 000 tornillos autorroscantes se añaden con el soporte de la barra transversal para una mayor estabilidad en los preparativos de imagen despiertos. (S) Diagrama esquemático que muestra la sección transversal de una ventana PUERTOS.
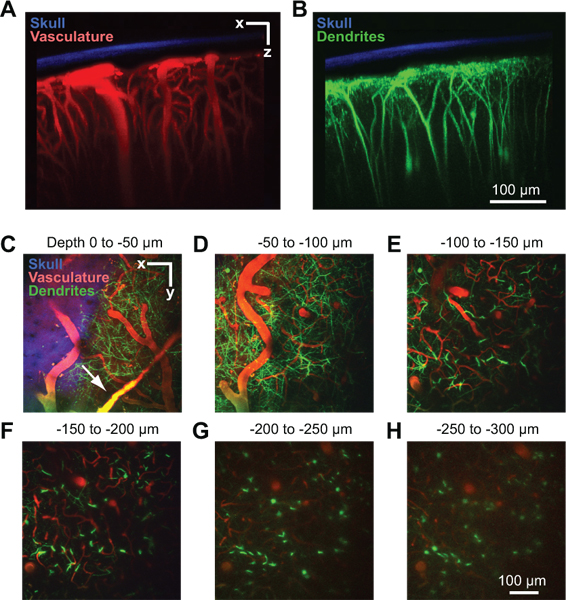
Figura 2. Imágenes de dos fotones de la estructura vascular y neuronal en la corteza del ratón. Todas las imágenes se recogieron a través de una ventana de puertos en un ratón Thy1-YFP menos 2 días después de la implantación de los 10. Proyección máxima de más de 150 micras de tejido en la orientación coronal que muestra el cráneo adelgazada en relación con la vasculatura (A) y dendritas (B). El hueso (azul) se detectó mediante la recopilación de la fluorescencia del segundo armónico en la emisión de 450 nm a 900 nm de excitación 8. La vasculatura (rojo) se marcó por vía intravenosa inyecta 70 kDa Rojo Texas dextrano 6. Los campos dendríticas de las neuronas (verde) son endógenos a la línea de ratón transgénico Thy1-YFP. (CH) proyecciones máximas de más de 50 micras de tejido en la orientación horizontal a diferentes profundidades por debajo de la PIA. Los datos son de la pila de la misma imagen se muestra en los paneles A y B. vasos durales puede ser visible justo por encima de la superficie cortical (flecha en C).
Abreviaturas
ACSF = artificial líquido cefalorraquídeo
PUERTOS = pulido y reforzado con el cráneo adelgazado ventana
YFP = proteína fluorescente de color amarillo
i Asegúrese de que los procedimientos descritos son aprobados por el local de Atención de Animales institucional y el empleo Comisión.
Discusión
De dos fotones de imágenes a través de una ventana de los puertos exige la transmisión a través del hueso adelgazado y la duramadre, que atenúa la luz del láser, y añade las aberraciones ópticas a mayores profundidades 8. Sin embargo, a pesar de este inconveniente, las profundidades de imagen de hasta 250 micras por debajo de la superficie pial se puede lograr con 900 nm de excitación. Mayores profundidades de imagen puede ser en principio posible con longitudes de onda de excitación más largos
Divulgaciones
No hay nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la American Heart Association (beca posdoctoral de AYS) y los Institutos Nacionales de Salud (MH085499, EB003832 y OD006831 a DK). Damos las gracias a Bet Friedman y Blinder Pablo de comentarios sobre el manuscrito.
Materiales
| Name | Company | Catalog Number | Comments | |||
| Agente | Ruta de la entrega | Dosis para el ratón | Duración | Notas | Fuente | Ref. Ref. |
| Pentobarbital (Nembutal) | IP | 90 ug / g | 15-60 min | Estrecho margen de seguridad. Trabajar hasta una dosis adecuada de anestesia lentamente. Suplemento 10% de la dosis de inducción según sea necesario. | 036093; mayordomo Schein | 7 |
| La ketamina (Ketaset) mezclado con xilazina (Anased) | IP | 60 mg / g (K) 10 mg / g (X) (mezcla en la misma jeringa) | 20-30 min | Xilazina es co-inyectado como un relajante muscular y analgésico. Suplemento sólo ketamina a 50% de la dosis de inducción según sea necesario. | (K) 010 177, (X) 033 198; Butler, Schein | 7 |
| El isoflurano (Isothesia) | Inhalación | 4% de media de la concentración alveolar (MAC) para la inducción; 1.2% MAC para el mantenimiento | 4-6 h. | Siempre en mezcla de 70% de oxígeno y 30% de óxido nitroso. La anestesia prolongada conduce a la lenta recuperación. | 029403; mayordomo Schein | 26 |
Tabla 1. Sugerido agentes anestésicos para los estudios de supervivencia.
| TEMA | EMPRESA | Catálogo # / MODELO |
| Betadine | Butler, Schein | 6906950 |
| La buprenorfina (Buprenex) | Butler, Schein | 031919 |
| Isotiocianato de fluoresceína dextrano, 2 de peso molecular MDa | Sigma | FD2000S |
| El alcohol isopropílico | Pescador | AC42383-0010 |
| Solución de Ringer Lactato | Butler, Schein | 009846; |
| La lidocaína solución, 2% (v / v) | Butler, Schein | 002468 |
| Salina | Butler, Schein | 009861 |
| Leche quirúrgica | Butler, Schein | 014325 |
| Rojo Texas dextrano, 70 kDa de peso molecular | Invitrogen | D1864 |
| Maxizyme | Butler, Schein | 035646 |
| DESECHABLES | ||
| Carburo de rebabas, tamaño de la punta 2.1 mm | Herramientas de Bellas Ciencia | 19007-05 |
| Aplicadores cottoned punta | Fisher Scientific | 23-400-100 |
| Cubierta de vidrio, no. 0 espesor | Thomas Scientific | 6661B40 |
| Pegamento de cianoacrilato | ND Industrias | 31428 H04308 |
| Gas plumero | Newegg | N82E16848043429 |
| Grip polvo de cemento | Dentsply | 675571 |
| Grip cemento solvente | Dentsply | 675572 |
| Jeringa de insulina, 0,3 ml de volumen, con aguja de calibre 29,5 | Butler, Schein | 018384 |
| Tuerca y tornillo para asegurar la cabeza | Digikey | Nut, H723-ND, perno, R2-56X1/4-ND |
| Pomada oftálmica | Butler, Schein | 039886 |
| Las hojas de bisturí | Fisher Scientific | 12-460-448 |
| Tornillos, autorroscante # 000 | JI Morris Empresa | FF000CE125 |
| De silicona de acuario sellador | Perfecto Manufactura | 31001 |
| Polvo de óxido de estaño | Minerales de mamá | EQT-TINOX |
| EQUIPO | ||
| Vidrio escribano | Fisher Scientific | 08-675 |
| Microscopio de disección | Carl Zeiss | OPMI-1 FC |
| Taladro eléctrico alimentado | Foredom o Osada | K.1020 (Foredom) o EXL-M40 (Osada) |
| Maquinilla de afeitar eléctrica | Wahl | Serie 8900 |
| Pinzas, Dumont no. 55 | Herramientas de Bellas Ciencia | 11255-20 |
| Comentarios almohadilla de calor regulado | FHC | 40-90-8 (termistor rectal, 40-90-5D-02; hcomer almohadilla, 40-90-2-07) |
| Vaporizador de isoflurano | Ohmeda | IsoTec4 |
| Oxímetro de pulso | Starr Ciencias de la Vida | MouseOx |
| Destornillador en miniatura | Garret Wade | 26B09.01 |
| Marco estereotáxico | Kopf Instruments | Modelo 900 (con la máscara del ratón anestesia y no ruptura de las barras de las orejas) |
| Tijeras quirúrgicas, extremo romo | Herramientas de Bellas Ciencia | 14078-10 |
| Limpiador ultrasónico | Fisher Scientific | 15-335-30 |
Tabla 2. Lista de los reactivos específicos, desechables y equipo.
Referencias
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D., Yuste, R. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. , 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. . Laboratory animal anesthesia. , (1987).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados