A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحليل التطبع الخلوي من الجزيئات الدقيقة والبكتيريا التي متعددة الأطياف التصوير التدفق الخلوي
In This Article
Summary
في هذه المقالة، نحن وصف طريقة استخدام متعددة الأطياف التدفق الخلوي التصوير لقياس استيعاب النانوية polyanhydride أو البكتيريا بواسطة الخلايا 264.7 الخام.
Abstract
ظهرت نظم الجسيمات النانوية وأدوات قيمة في مجال تقديم اللقاحات من خلال قدرتها على تحقيق كفاءة البضائع، بما في ذلك البروتينات، إلى الخلايا مستضد تقديم 1-5. تدخيل النانوية (NP) بواسطة الخلايا مستضد تقديم هو خطوة حاسمة في توليد استجابة فعالة المناعي للمستضد مغلفة. لتحديد كيف يمكن للتغييرات في صياغة جسيمات متناهية الصغر وظيفة الأثر، وسعينا لتطوير إنتاجية عالية، بروتوكول تجريبي الكمية التي كانت متوافقة مع الكشف عن الجسيمات النانوية المنضوية فضلا عن البكتيريا. حتى الآن، وكانت اثنين من التقنيات مستقلة، المجهري والتدفق الخلوي، والأساليب المستخدمة في دراسة البلعمة النانوية. طبيعة إنتاجية عالية من التدفق الخلوي يولد بيانات إحصائية قوية. ولكن نظرا لدقة منخفضة، فإنه فشل لتحديد بدقة المنضوية مقابل النانوية متجهة الخلية. المجهري يولد صورا مع القرار المكانية العالية؛ حowever، وهو مضيعة للوقت وينطوي على أحجام عينة صغيرة 6-8. متعددة الأطياف التدفق الخلوي التصوير (MIFC) هي التكنولوجيا الجديدة التي تتضمن جوانب من كلا المجهري والتدفق الخلوي الذي ينفذ متعددة الألوان الطيفية مجال التصوير مضان ومشرق في نفس الوقت من خلال مجموعة أساسية الصفحي. هذه القدرة يقدم تحليلا دقيقا لشدة إشارة الفلورسنت والعلاقات المكانية بين مختلف الهياكل والميزات الخلوية بسرعة عالية.
هنا، نحن تصف طريقة استخدام MIFC لتوصيف السكان الخلية التي قد استوعبت النانوية polyanhydride أو السالمونيلا التيفية الفأرية الملهبة للضرب مصلي. وصفنا أيضا إعداد تعليق جسيمات متناهية الصغر، ووضع العلامات الخلية، واقتناء على نظام X ImageStream وتحليل البيانات باستخدام تطبيق الأفكار. علينا أن نبرهن أيضا تطبيق تقنية التي يمكن استخدامها للتمييز بين ع تدخيلathways للجسيمات الدقيقة والبكتيريا باستخدام مثبط حركة الخلايا-D كما المانع من الأكتين بوساطة البلعمة.
Protocol
1. RAW الثقافة خلية 264.7
- حصاد الخام 264.7 الخلايا من قوارير بها عندما تصل confluency عن طريق كشط لهم بلطف مع مكشطة الخلية. العد وطبق وضعها في طبق خلية ثقافة 24-جيدة في كثافة من 5 خلايا س 5 10 / جيدا في 0.5 مل كاملة Dulbecco ومتوسطة النسر المحورة (cDMEM؛ حرارة المعطل الجنين بنسبة 10٪ مصل بقري (FBS)، 2 مم Glutamax، و 10 HEPES ملم) واحتضان بين عشية وضحاها في 37 درجة مئوية في حاضنة 5٪ CO 2.
2. المسببة للأمراض السالمونيلا الملهبة للضرب مصلي التيفية الفأرية 14028 تحويل والثقافة
- أعرض البلازميدات المؤتلف التعبير عن بروتين الفلورية الخضراء (GFP) لS. التيفية الفأرية بواسطة electroporation. أولا، تعد الثقافة من ضرب مصلي السالمونيلا التيفية الفأرية الملهبة (آي تي سي سي 14028) في مرق LB واحتضان بين عشية وضحاها في 37 درجة مئوية مع تهوية.
- وفي اليوم التالي، بيليه 1 مل من البكتيريا في أقصى سرعة في microcentrifuge. غسل الخلايا FOمرة اور مع 1 مل من اجتماعات الأطراف الباردة / حل الجلسرين (1 مم 3 - (N-morpholino) propanesulfonic حامض (اجتماعات الأطراف) عازلة في الجلسرين 20٪) من قبل resuspending بلطف مع بيليه ماصة بين كل غسيل 9. بعد غسل النهائي، resuspend على بيليه في 50 ميكرولتر من اجتماعات الأطراف / الجلسرين إلى ~ والتي 0.5 ميكروغرام من pAKgfp1 أو pAKgfplux1 البلازميد تم إضافة 10.
- نقل تعليق خلية إلى ما قبل مبرد كوفيت 1 مم electroporation الفجوة وelectroporate باستخدام إعدادات: 1800 V، 200 واط، 25 MF. فورا بعد الولادة النبض، إضافة 1 مل من مرق LB ونقل تعليق خلية لأنبوب جديد 15 مليلتر. السماح للخلايا لاسترداد في 37 درجة مئوية مع تهوية. بعد ساعة واحدة، والتركيز على الخلايا بواسطة الطرد المركزي وresuspend في ميكرولتر 100 ~ من طاف المتبقية.
- أخيرا، لوحة الخلايا التي تحتوي على لوحات LB 100 ميكروغرام / مل الأمبيسيلين واحتضان بين عشية وضحاها في 37 درجة مئوية. ويجري تنقية المستعمرات واحد بواسطة restreaking مع اختيار المضادات الحيوية والتعبير من أنا GFPوأكد ق بواسطة الاضاءة مع الفصيلة فلوريسئين القياسية (FITC) تصفية مجموعة.
- تطعيم 10 مل من مرق LB التي تحتوي على 25 ميكروغرام / مل أمبيسيلين (أو المضادات الحيوية المناسبة) مع loopful من السالمونيلا التي تم تحويلها إلى GFP صريح ثابت.
- تنمو البكتيريا بين عشية وضحاها في 37 درجة مئوية.
- تمييع 01:10 السالمونيلا في أنبوب ثقافة جديدة تحتوي على 10 مل LB تستكمل مع الأمبيسيلين واحتضانها لمدة 5 ساعات عند 37 درجة مئوية.
- قياس الامتصاصية للثقافة في 600 نانومتر، وحساب تركيز السالمونيلا لكل مل باستخدام إنشاء سابقا منحنى النمو.
- يخفف من السالمونيلا في cDMEM (0.5 مل / جيد) للحصول على عدد وافر من العدوى (وزارة الداخلية) من 100 في الخلية 264.7 الخام.
3. إعداد تعليق الجسيمات النانوية
- تلفيق 1٪ FITC محملة النانوية كما هو موضح سابقا 11. لفترة وجيزة، هي ملفقة من قبل جزيئات polyanhydrideالمضادة للمذيب nanoencapsulation، التي يتم فيها حل البوليمر في كلوريد الميثيلين (4 درجات مئوية عند تركيز 25 ملغ / مل)، وعجلت في البنتان (-30 درجة مئوية في الميثيلين كلوريد نسبة 1:200: البنتان). استرداد النانوية عن طريق الترشيح فراغ. بعد تبخر أي مذيب المتبقية، وتزن polyanhydride المجففة النانوية باستخدام معقم وزن الورق.
- إضافة 5 ملغ من الجسيمات النانوية إلى 0.5 مل من الفوسفات مخزنة المالحة الباردة (PBS، الكالسيوم والمغنيسيوم حرة، ودرجة الحموضة 7.4) في أنبوب مل microcentrifuge 1.5 ويبقيه على الجليد حتى تضاف إلى جزيئات الخلايا 264.7 الخام.
- يصوتن على تعليق جسيمات متناهية الصغر (مع الحفاظ على الجليد) باستخدام الموجات فوق الصوتية المعالج السائل مزودة microtip لحوالي 25 ق بين 4 و 6 جول.
4. البلعمة الفحص
- يمهد للمعالجة مجموعة فرعية من الخلايا 264.7 RAW مع 5 ميكروغرام / مل مثبط حركة الخلايا D-1 ساعة قبل إدخال NP أو السالمونيلا بواسطة الشفط المتوسطة والنسخ المماثالتفوق مع cDMEM جديدة تستكمل مع المانع. عودة الثقافات إلى 37 درجة مئوية الحاضنة.
- بعد حضانة ح 1 مع المانع، وإزالة لوحات من الحاضنة، دوامة تعليق جسيمات متناهية الصغر، وإضافة 10 ميكروليتر إلى آبار المناسبة.
- دوامة من السالمونيلا وتصيب الخام 264.7 خلايا مع وزارة الداخلية من 100 بإضافة بكتيريا لآبار المناسبة.
- اضغط على لوحة مرات قليلة لخلط واحتضان عند 37 درجة مئوية أو 4 درجات مئوية (السيطرة) لمدة 45 دقيقة.
- إزالة لوحات من الحاضنة أو الثلاجة ومكان على الجليد. غسل الخلايا مرتين مع المثلجة PBS (بدون الكالسيوم والمغنيسيوم 2 + 2 +) بواسطة الشفط، والتخلص من متوسط العمر لإزالة الجزيئات غير منضم، السالمونيلا، والقتلى أو فصل الخلايا الخام 264.7.
- لقطف الخام 264.7 الخلايا بعد غسل الثانية، تضاف 250 ميكرولتر من الجليد الباردة برنامج تلفزيوني وكشط بلطف الآبار.
- الماصة الخلايا تحصد في رأي واضح والمفاجئة قبعة صغيرةمنبذة أنابيب والاحتفاظ بها على الجليد.
- غسل الخلايا عن طريق إضافة 1 مل من عازلة غسل الباردة (2٪ FBS حرارة المعطل، 0.1٪ أزيد الصوديوم في برنامج تلفزيوني)، وأجهزة الطرد المركزي في ز × 250 لمدة 10 دقيقة في 4 درجات مئوية.
- تجاهل طاف وإزالة الفاصلة المتبقية من خلال الاستفادة من أنبوب microcentrifuge مقلوب على منشفة ورقية. Resuspend وبيليه الخلية التي يخدش بلطف أنبوب microcentrifuge عبر أنبوب اختبار رف.
- إصلاح الخام 264.7 الخلايا وذلك بإضافة 100 ميكروليتر من بارافورمالدهيد 4٪ (منهاج العمل) في برنامج تلفزيوني، والسماح للخلايا للوقوف لمدة 15 دقيقة في درجة حرارة الغرفة (RT).
- غسل الخام 264.7 الخلايا عن طريق إضافة 1 مل من بيرم / غسيل العازلة دينار بحريني (العلوم البيولوجية)، وأجهزة الطرد المركزي في ز × 250 لمدة 10 دقيقة في 4 درجات مئوية.
- كرر الخطوة 4.9.
- وصمة عار على الخام 264.7 الخلايا لالأكتين وذلك بإضافة 100 ميكروليتر من بيرم / غسيل العازلة التي تحتوي على فلور اليكسا phalloidin 660 (AF 660، 1:150 التخفيف) لمدة 15 دقيقة في RT. كرر الخطوات من 4.11 و 4.12.
- Resuspend الخام 264.7 خلايا في 50 ميكرولتر منبرنامج تلفزيوني يحتوي على 1٪ PFA وتخزينها في الظلام في 4 درجات مئوية حتى الاستحواذ.
نصائح وملاحظات:
- وينبغي إعداد العينات واحد مضان اللون في هذه الخطوة لاستخدامها كعناصر تحكم تعويضات أثناء إعداد الصك العاشر ImageStream. التعويضات شملت الضوابط في هذه التجربة هي: خام 264.7 خلايا (غير المسمى لالأكتين) حضنت مع النانوية؛ الخام 264.7 الخلايا (وليس المسمى لالأكتين) حضنت مع السالمونيلا؛ الأكتين المسمى فقط الخام 264.7 الخلايا.
- للدراسات المانع، من المهم أن تشمل السيطرة على السيارة التي حلت المانع كمجموعة تحكم. في هذه التجربة، تم حل مثبط حركة الخلايا-D في DMSO 100٪. ولذلك، فإننا الخلايا المحتضنة في cDMEM المحتوية على DMSO ومن ثم تقييم واستيعاب النانوية أو السالمونيلا. لم نكتشف أي فرق كبير بين مجموعة المتوسط وDMSO التحكم (لا تظهر البيانات).
- ساmple دليل إعداد متوفرة على موقع Amnis ( https://www.amnis.com/images/1__Sample_Prep_Guide_3L_-_0418081.pdf ) هو موردا جيدا للتحقق من مدى توافق fluorophores مع X ImageStream. للوصول إلى هذه الوثيقة، يجب على المستخدمين تسجيل الأولى (معفاة من رسوم) مع أميس.
5. اقتناء العينة على X ImageStream
- السلطة حتى العاشر ImageStream وإطلاق الإلهام.
- تهيئة Fluidics. وينبغي في نهاية هذا السيناريو SpeedBeads تكون قيد التشغيل.
- في القائمة ملف، اختر تحميل القالب الافتراضي.
- في وجهة النظر القائمة معرض الصور، حدد الكل واضغط على تشغيل لبدء الإعداد والتصوير والخرز.
- ضبط الأساسية تتبع لمركز الصور أفقيا (عند الضرورة).
- حدد (BF) Brightfield قناة وفوق الكثافة مجموعة.
- انتظر حتى السيرة الذاتية هي سرعة تدفق باستمرار جنيهSS من 0.2 في المئة.
- معايرة صك يوميا. في علامة التبويب المساعد، انقر فوق ابدأ كل لتشغيل المعايرة والاختبارات والتحقق من أن جميع مرت.
- اضغط على قفل فلوش وتحميل (FLL) لتحميل عينة الأولى. تحميل ألمع عينة في التجربة أن fluoresces مع بعضها ملون تألقي المستخدمة. من المهم جدا أن تقوم بتشغيل هذه العينة الأولى لتأسيس الإعدادات صك وبعد ذلك لا تغييرها للتجربة بأكملها.
- بدوره على كل الليزر المستخدمة في التجربة وتعيين قوة ليزر لذلك كل ملون تألقي له قيم بكسل كحد أقصى ما بين 100 و 4000 تهمة، إذا ما قيست في مؤامرات التشرذم.
- وضع معايير تصنيف الخلية، للقضاء على مجموعة من الكائنات غير المرغوب فيها. لجمع البيانات من الخلايا فقط، حدد الحد الأدنى في منطقة قناة BF إلى 50 ميكرون. وسوف ينظر الكائنات مع مساحة أقل من 50 ميكرون الحطام ولن يتم الحصول عليها. تحديد القنوات التي سيتم جمعها.
- أدخل اسم الملف، المجلد الوجهة، وضع تسلسل# ل(1) وعدد من الفعاليات لاكتساب.
- انقر فوق تشغيل اكتساب لجمع وحفظ أول ملف بيانات التجربة.
- فوق FLL وتشغيل العينة التجريبية المقبلة. كرر حتى الانتهاء من جمع كل العينات التجريبية.
- فوق إعدادات شركات (إيقاف brightfield الليزر ومبعثر وتمكن من جمع كل القنوات) وجمع 500 عينة من الخلايا إيجابية كل الملون واحدة لكل fluorophore في التجربة لتطوير مصفوفة التعويض.
لتلخيص، يمكن تشغيل العينات وفقا للترتيب التالي:
- ألمع العينة الأولى.
- عينات الاختبار المتبقية.
- التعويضات التي تحتوي على واحدة تسيطر على مضان اللون.
نصائح وملاحظات:
- ويمكن حفظ قالب إلهام وإعادة شحنها لضبط إعدادات الجهاز. حالما يتم حفظ القوالب، ويمكن استخدام الاوتوماتيكى للتشغيل غير المراقب لتشغيل نماذج تجريبية مع قالب واحد وشارك فيmpensation يسيطر مع نموذج لسيطرة كل لون واحد.
- التكوين X ImageStream عن هذه التجارب: 488 و 658 ليزر إثارة نانومتر؛ 785 ليزر مبعثر نانومتر؛ 40X (0.75 NA) هدف، 6 نظام قناة مع كومة ISX معيار التصفية. تم استخدام خيار الاوتوماتيكى للسماح اكتساب غير المراقب من العينات.
- تم استخدام الإعدادات التالية للتجربة. تعيين ليزر 785 نانومتر تم تصوير النانوية مع ليزر 488 نانومتر لتعيين 10mW، ليزر 658 نانومتر لتعيين 50 ميغاواط، الى 2 ميجاوات و BF في القناة 1. الخلايا المصابة السالمونيلا تم تصويرها مع ليزر 488 نانومتر لتعيين 20 ميغاواط، تعيين 785 نانومتر ليزر 658 نانومتر ليزر لتعيين 50 ميغاواط، الى 2 ميغاواط، وBF في القناة 1. وقد تم جمع ضوابط التعويض في حالة عدم وجود BF و 785. وتم تصوير أحداث لا يقل عن 5000 (أي الخلايا) لكل عينة من عينات الاختبار.
6. صورة التحليل
- إطلاق الأفكار، وعلى المعالج التطبع، والحمل على نقرا مزدوجا فوق(ه) من عينة الاختبار. ملفات الريف.
- إنشاء مصفوفة التعويض من خلال النقر على 'مصفوفة جديدة "في الخطوة 2. يتم تشغيل المعالج التعويض. إضافة ملفات لعناصر لون واحد في التجربة. انقر فوق التالي خلال المعالج بعد الاتجاهات حتى يتم حفظ الملف مصفوفة التعويضات وتحميلها في مربع في الخطوة 2 من المعالج التطبع.
- انقر فوق التالي واتبع التعليمات حتى يتم إنشاء ملف. DAF.
- تعيين خصائص عرض الصور عن طريق اختيار القنوات التي استخدمت خلال اكتساب صورة. انقر على الفصل 2 (FITC)، والفصل 5 (AF 660). (BF والتعاون بين بلدان الجنوب هي الافتراضي المحدد).
- حدد القناة صورة لجعل حدود الخلية (CH01)، والقناة التي تم جمعها النانوية أو البكتيريا (CH02).
- يتم إنشاء مخطط الانتشار من المنطقة Brightfield مقابل نسبة الارتفاع Brightfield من كافة الخلايا. تحديد عدد السكان خلية واحدة من خلال النقر على النقاط الفردية والمعزولة حول singlets. الخلايا وحيدة لديها نسبة جانب من جوانبجولة (1) والحلل نحو 0.5 (الشكل 1A).
- رسم بياني للجذر التدرج Brightfield متوسط يتم إنشاء مربع (RMS) من الصورة brightfield وتعيين رأي السكان في معرض صورة بن لتحديد (الشكل 1B). انقر على صناديق لتحديد مكان الخلايا في أفضل التركيز تبدأ ورسم خط المنطقة إلى خلايا بوابة تركيزا. ارتفاع الانحدار RMS، كان ذلك أفضل تركيزا. تجاوز الخطوة التالية إلا إذا كانت هناك بقع أخرى تريد على بوابة.
- يتم إنشاء مبعثر مؤامرة جديدة من شدة القناة 2 على بكسل محور س مقابل ماكس من CH2 على المحور ص (الشكل 1C). انقر على النقاط وعرض الصور لمساعدتك على رسم المنطقة حول الخلايا التي هي ايجابية للجزيئات أو بكتيريا.
- يتم إنشاء رسم بياني لميزة التطبع مع هذه المنطقة التي تبدأ من 0، التي ينبغي تعديلها من خلال مراقبة الصور (1D الشكل). ميزة التطبع هو نسبةشدة داخل الخلية إلى كثافة خلية كاملة. يتم تحجيم ذلك مثل أن في قيمة 0 ما يقرب من نصف كثافة هو في الداخل. وقد خلق المعالج منطقة لتعيين داخل بجعل القناع التي استخدمت المدخلات صورة الخلية من الخطوة 5 للعثور على سطح الخلية وهذا تآكلت بنسبة 4 بكسل. لاحظ أنه يمكن ضبطها يدويا هذا القناع لأنواع مختلفة من الخلايا عند الضرورة. في هذه التجربة، ونحن ضبطها يدويا ميزة من خلال خلق قناع كائن في صورة brightfield الأولى وتآكل هذه من قبل 4 بكسل. ثم تم حساب ميزة التطبع على أساس هذا القناع بكسل 4 كائن المتآكلة. هذه الميزة تسمح لنا أن نميز بين جزيئات المنضوية والبكتيريا، التي تملك غالبية إشارة على التألق ضمن حدود قناع، من جزيئات سطح محدد والبكتيريا، التي تملك غالبية إشارة على التألق خارج الحدود قناع (الشكل 2).
- إنشاء رسم بياني جديدة مع التطبع الجديد الهيئة الاتحادية للبيئةتلح على أساس قناع كائن المتآكلة. رسم المنطقة على بوابة على الخلايا المنضوية عن طريق عرض الصور في وضع بن المختار. في تجاربنا، وضعنا هذه البوابة عند 0.3. واعتبرت الخلايا بنتيجة أقل من 0.3 خلايا سطح الجسيمات متجهة إيجابي.
- أخيرا، للقضاء على الخلايا مع وضع العلامات الخلفية وتحديد النانوية المنضوية محددة أو بكتيريا، تم استخدام عدد بقعة IDEAS ميزة. العد بقعة هي ميزة بحساب عدد عناصر متصلة أو أقنعة صغير في صورة ما. واستخدمت وظائف قناع، بقعة، قمة وكثافة لتحديد المواقع. وأدرجت قناع بقعة يجد تفاصيل مشرق في صورة التي لديها دائرة نصف قطرها المستخدم المحدد، وفوق عتبة الخلفية المحلية، ويتم تكرير قناع من قبل تفكك كثافة عالية في مواضع فردية باستخدام وظيفة الذروة ثم فوق البقع كثافة من 200 تهمة . راجع اخفاء بقعة Amnis دليل لمزيد من المعلومات (الشكل 1E). وتشير إحصائية وإعادة تم إنشاء ميناء قالب من قبل بما في ذلك العديد من الميزات في القائمة تقارير.
- تم حفظ هذا الملف كما هو ليتم استخدامها لتحليل ملف قالب دفعة من جميع الملفات التجريبية.
- في برنامج أفكار، انقر فوق أدوات → دفعة ملفات البيانات وإدخال جميع ملفات الريف. إضافة ملف مصفوفة التعويض (. CTM) وملف قالب (. AST) في الأجزاء المقابلة. يقدم دفعة للمعالجة. بعد خطوة من خطوات التجهيز، ويتم تحليل جميع الملفات. الريف و. يتم إنشاء ملفات DAF لكل من الملفات الخام الفردية. يتم إنشاء ملف التقرير النهائي مع إحصائيات لجميع العينات.
نصائح وملاحظات:
- تم إجراء تحليل الصور باستخدام برنامج الإصدار 4.0 والأفكار المعالج التطبع مع بعض التعديلات. المعالج هو ذاتي مفيدة، ويمكن إنشاء ملف ouptput DAF. عن طريق اتباع التعليمات من المعالج.
7. ممثل النتائج
"> وصور ممثل في الشكل 2 شرح التي يمكن استخدامها للتمييز بين MIFC بنجاح بين المنضوية (يسار لوحة) مقابل سطح محدد (لوحة على اليمين) NP (الشكل 2A) أو السالمونيلا (الشكل 2B). خفضت تدخيل NP والسالمونيلا من قبل كلا الأكتين منع وخفض درجة الحرارة إلى 4 درجات مئوية (الشكل 3A). النسبة المئوية للخلايا إيجابية لسطح ملزمة زيادة NP من ما يقرب من 8٪ عند 37 درجة مئوية إلى أكثر من 35٪ بعد إما مثبط حركة الخلايا-D أو 4 علاج درجة مئوية ( الشكل 3B). وفي المقابل، تم تخفيض النسبة المئوية للخلايا مع السالمونيلا سطح متجهة من 35٪ إلى 15٪ بعد مثبط حركة الخلايا-D علاج. الحضانة من الخلايا 264.7 RAW مع السالمونيلا في 4 درجات مئوية انخفضت الداخلي من دون زيادة واضحة في كمية سطح ملزمة البكتيريا بالمقارنة مع 37 درجة مئوية السيطرة. معا، وهذه البيانات تظهر أن <م والمنضوية> السالمونيلا والتي أرستها عملية الخلوية مماثلة يتطلب الأكتين وتعتمد درجة الحرارة. وعلاوة على ذلك، فإن البيانات تشير إلى أن التعلق المستدام من السالمونيلا إلى الضامة يتطلب الأكتين البلمرة.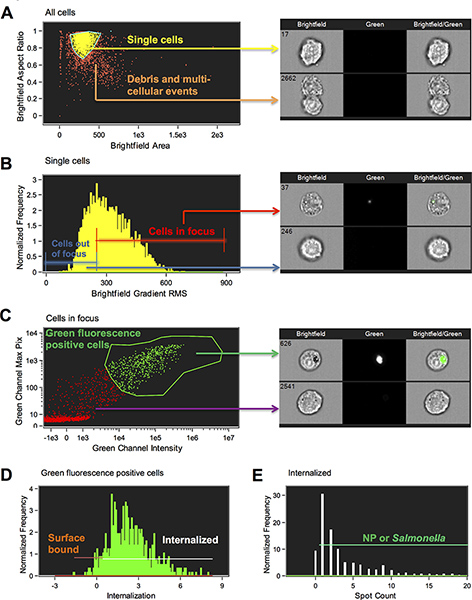
الشكل 1. التخطيطي للاستراتيجية المعزولة المستخدمة لتحديد المنضوية مقابل جزيئات سطح محدد والسالمونيلا. (A) للحد من تحليل للخلايا واحدة، فمن المهم للقضاء على الحطام وأحداث متعددة الخلايا. تم فصل الخلايا وحيدة والحلل من المجاميع المتعددة الخلايا باستخدام منطقة ملامح الأفكار ونسبة الجانب من الصورة brightfield (M01). المجال هو حجم الصورة في ميكرون مربع، ونسبة الارتفاع هو محور قاصر مقسوما على محور رئيسي، وبالتالي قدرا من دائرية (دائرة الكمال سوف يكون لها نسبة الارتفاع من 1؛ الحلل وعادة ما يكون اسبينسب ط م من نحو 0.5 ومجاميع متعددة الخلايا وعادة ما تكون أقل من 0.5). ووضعت المنطقة على بوابة على الأحداث خلية واحدة (الخطوة 6.6). (ب) إلى بوابة على الخلايا في التركيز، أفكار ميزة يتم رسم التدرج RMS من الصورة brightfield في رسم بياني. ميزة RMS التدرج يقيس جودة الحدة من صورة عن طريق الكشف عن التغييرات في قيم البيكسل في الصورة. ارتفاع قيمة RMS التدرج يشير إلى وجود صورة أكثر تركيزا (الخطوة 6.7). (ج) تم اختيار الأخضر الخلايا إيجابية مضان بواسطة تبوب على الخلايا مع ارتفاع قيم بكسل ماكس وكثافة في القناة مضان أخضر (الخطوة 6.8). (D) وقد تم اختيار الخلايا مع NP المنضوية أو السالمونيلا عن طريق اختيار عدد السكان مع الخلية على درجة استيعاب مساوية أو أكبر من 0.3. واعتبرت الخلايا المستقبلة على درجة أقل من 0.3 لتكون سطح ملزمة (الخطوة 6.9). (E) وتميزت كذلك خلايا في بوابة "المنضوية" استنادا إلى عدد من النقاط (NP أو STM) لان ذروكانت بعض الخلايا البريد مع تلوين الخلفية التي كانت محسوبة على المنضوية لكن كان له قيمة بقعة من صفر (الخطوة 6.11). وتعرض صور ممثل عن كل بوابة. انقر هنا لعرض أكبر شخصية .
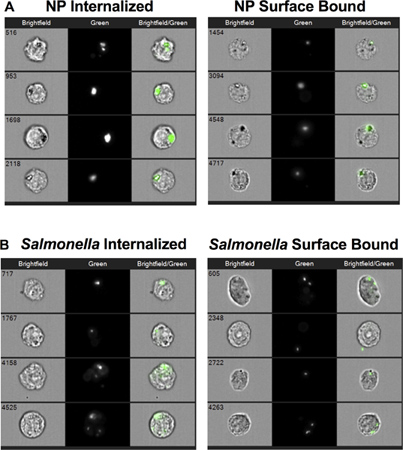
الشكل 2. صور الخلية من جزيئات محددة المنضوية والسطحية (NP) أو السالمونيلا. (A) وصور الممثل من الخلايا الخام 264.7 تلك التي أرستها NP المنضوية (لوحة على اليسار) والخلايا وكان لا بد لسطحها ولكن ليس المنضوية (لوحة على اليمين). (ب) وصور الممثل من الخلايا الخام 264.7 تلك التي السالمونيلا السالمونيلا المنضوية (لوحة على اليسار) والخلايا وكان لا بد لسطحها ولكن ليس المنضوية (لوحة على اليمين).
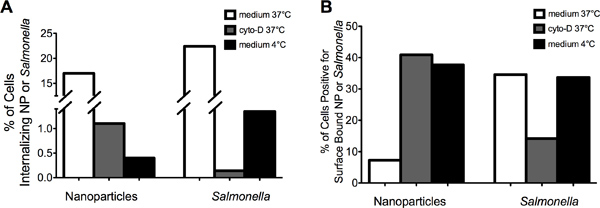
الشكل 3. Cytochalaتحول دون ذنب-D علاج الخلايا استيعاب NP والسالمونيلا. (أ) ما قبل المعالجة من الخلايا 264.7 RAW مع مثبط حركة الخلايا-D أو حضانة في 4 درجات مئوية خفض نسبة حدوث استيعاب NP أو السالمونيلا بالمقارنة مع 264.7 خلايا RAW حضنت على 37 درجة مئوية في المتوسط. وأظهرت الخام 264.7 الخلايا المحتضنة في المتوسط تحتوي على DMSO (أي مركبة مراقبة) مستويات مماثلة لاستيعاب NP والسالمونيلا مقارنة مع المتوسط وحده (لا تظهر البيانات). (ب) زيادة المعالجة المسبقة للخلايا 264.7 RAW مع مثبط حركة الخلايا-D في المئة من الخلايا التي تحتوي على سطح ملزمة NP، بينما تتناقص في المئة من الخلايا التي تحتوي على السالمونيلا سطح محدد.
Discussion
وقد أظهرت الدراسات التي يمكن أن تستخدم جزيئات قابلة للتحلل على أساس بولي حامض اللبنيك، شارك في الجليكوليك ((PLGA) أو polyanhydrides لتقديم المستضدات مغلفة أو المخدرات إلى الخلايا المستهدفة. استيعاب هذه الجسيمات متناهية الصغر من الخلايا البلعمية من المهم بالنسبة لفعاليتها، م...
Disclosures
ويعمل Sherree L. صديق من قبل شركة Amnis، والذي يقوم بتصنيع نظام X ImageStream.
Acknowledgements
فإن الكتاب أود أن أشكر جائزة ONR-موري (NN00014-06-1-1176) والولايات المتحدة للبحوث الطبية للقوات المسلحة والعتاد القيادة (أرقام المنح W81XWH-09-1-0386 وW81XWH-10-1 0806-) للمالية دعم.
Materials
| Name | Company | Catalog Number | Comments |
| RAW 264.7 cell line | American Type Culture Collection (ATCC) | TIB-71 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Cellgro | 10-013-CV | |
| Fetal bovine serum | Atlanta Biologicals | S 11150 | Premium Grade |
| Glutamax | GIBCO, by Life Technologies | 35050-061 | |
| HEPES | GIBCO, by Life Technologies | 15630-080 | |
| 24-well plate | Techno Plastic Products | 92024 | |
| Cell culture Flasks | Techno Plastic Products | 90151 | |
| Cell scraper | Techno Plastic Products | 99002 | 24 cm |
| Salmonella entericaserovar Typhimurium | ATCC | 14028 | |
| BTX ECM630 Electro Cell Manipulator | BTX Technologies | ||
| MOPS | Fisher Scientific | BP308 | |
| Phosphate buffered saline (PBS) | Cellgro | 21-040-CV | |
| Ultrasonic liquid processor | Misonix | S-4000 | |
| Cytochalasin-D | Sigma-Aldrich, | C8273 | |
| Formaldehyde | Polysciences, Inc. | 04018 | |
| Wash buffer | 2% heat inactivated FBS, 0.1% sodium azide in PBS. | ||
| Perm/wash buffer | BD Biosciences | 554714 | |
| Clear-view snap cap microtubes | Sigma-Aldrich | T4816 | |
| Alexa Fluor phalloidin 660 | Invitrogen | A22285 | |
| ImageStreamX | Amnis Corporation | 100200 | Options: 658nm laser, autosampler |
| Sodium azide | Fisher Scientific | S 227I-500 |
References
- Ulery, B. D., Kumar, D., Ramer-Tait, A. E., Metzger, D. W., Wannemuehler, M. J., Narasimhan, B. Design of a protective single-dose intranasal nanoparticle-based vaccine platform for respiratory infectious diseases. PLoS One. 6, e17642 (2011).
- Kasturi, S. P., Skountzou, I., Albrecht, R. A., Koutsonanos, D., Hua, T., Nakaya, H. I., Ravindran, R., Stewart, S., Alam, M., Kwissa, M., Villinger, F., Murthy, N., Steel, J., Jacob, J., Hogan, R. J., García-Sastre, A., Compans, R., Pulendran, B. Programming the magnitude and persistence of antibody responses with innate immunity. Nature. 470, 543-547 (2011).
- Rice-Ficht, A. C., Arenas-Gamboa, A. M., Kahl-McDonagh, M. M., Ficht, T. A. Polymeric particles in vaccine delivery. Curr. Opin. Microbiol. 13, 106-112 (2010).
- Jain, J. P., Chitkara, D., Kumar, N. Polyanhydrides as localized drug delivery carrier: an update. Expert. Opin. Drug. Deliv. 5, 889-907 (2008).
- Pfeifer, B. A., Burdick, J. A., Little, S. R., Langer, R. Poly(ester-anhydride):poly(beta-amino ester) micro- and nanospheres: DNA encapsulation and cellular transfection. Int. J. Pharm. 304, 210-219 (2005).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J. Immunol. Methods. 347, 79-86 (2009).
- Hampton, M. B., Winterbourn, C. C. Methods for quantifying phagocytosis and bacterial killing by human neutrophils. J. Immunol. Methods. 232, 15-22 (1999).
- Rieger, A. M., Hall, B. E., Barreda, D. R. Macrophage activation differentially modulates particle binding, phagocytosis and downstream antimicrobial mechanisms. Dev. Comp. Immunol. 34, 1144-1159 (2010).
- Murphy, K. C., Campellone, K. G. Lambda Red-mediated recombinogenic engineering of enterohemorrhagic and enteropathogenic E. coli. BMC. Mol. Biol. 4, 11 (2003).
- Karsi, A., Lawrence, M. L. Broad host range fluorescence and bioluminescence expression vectors for Gram-negative bacteria. Plasmid. 57, 286-295 (2007).
- Ulery, B. D., Phanse, Y., Sinha, A., Wannemuehler, M. J., Narasimhan, B., Bellaire, B. H. Polymer chemistry influences monocytic uptake of polyanhydride nanospheres. Pharm. Res. 26, 683-690 (2009).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu. Rev. Biochem. 78, 857-902 (2009).
- Vercauteren, D., Vandenbroucke, R. E., Jones, A. T., Rejman, J., Demeester, J., De Smedt, S. C., Sanders, N. N., Braeckmans, K. The use of inhibitors to study endocytic pathways of gene carriers: optimization and pitfalls. Mol. Ther. 18, 561-569 (2010).
- Di Marzio, L., Marianecci, C., Cinque, B., Nazzarri, M., Cimini, A. M., Cristiano, L., Cifone, M. G., Alhaique, F., Carafa, M. pH-sensitive non-phospholipid vesicle and macrophage-like cells: binding, uptake and endocytotic pathway. Biochim. Biophys. Acta. 1778, 2749-2756 (2008).
- Torres, M. P., Vogel, B. M., Narasimhan, B., Mallapragada, S. K. Synthesis and characterization of novel polyanhydrides with tailored erosion mechanisms. J. Biomed. Mater. Res. A. 76, 102-110 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved