このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マルチスペクトルイメージングフローサイトメトリーによるナノ粒子と細菌の細胞内在化を分析する
要約
本稿では、RAW 264.7細胞による無水物ナノ粒子や細菌の内在化を定量化するためにマルチスペクトルイメージングフローサイトメトリーを利用する方法について説明します。
要約
ナノシステムでは、抗原提示細胞へのタンパク質、1-5など、効率的に貨物を提供する能力を介してワクチンデリバリーの貴重なツールとして浮上している。抗原提示細胞によるナノ粒子の内在化(NP)がカプセル化された抗原に対する効果的な免疫応答を生成するための重要なステップです。ナノ粒子製剤の影響関数の中でどのように変更を決定するために、我々は内面化ナノ粒子と同様に細菌を検出すると互換性のある高スループット、定量的な実験的なプロトコルを開発しようとした。現在までに、2つの独立した技術、顕微鏡やフローサイトメトリーでは、ナノ粒子の食作用を研究するために使用されるメソッドでした。フローサイトメトリーのハイスループットな性質は堅牢な統計データを生成します。しかし、低解像度のために、それは正確にセル結合したナノ粒子の対内在化、定量化に失敗しました。顕微鏡は、高空間分解能で画像を生成します。However、それは時間がかかり、小さなサンプルサイズの6-8を伴います。マルチスペクトルイメージングフローサイトメトリー(MIFC)の層コアを介して同時にマルチカラースペクトルの蛍光と明視野イメージングを行う顕微鏡やフローサイトメトリーの両方の側面を組み込んだ新しいテクノロジです。この機能は、蛍光シグナル強度と異なる構造と高速で携帯電話の機能間の空間関係の正確な分析を提供します。
ここで、我々は、無水物ナノ粒子またはサルモネラ血清型Typhimuriumのを内面化した細胞集団を特徴づけるためにMIFCを利用する方法について説明します。我々はまた、ナノ粒子懸濁液、細胞標識、のImageStream Xシステム上で収集やアイデアのアプリケーションを使用してデータの分析の準備について説明します。また、インターナリpを区別するために使用することができる技術の応用を実証するアクチンを介した貪食の阻害剤としてサイトカラシンDを用いてナノ粒子と細菌のathways。
プロトコル
1。 RAW 264.7細胞培養
- 彼らはセルスクレイパーで軽くこすることでコンフルエントに達する彼らのフラスコから収穫RAW 264.7細胞。 0.5 mLの5×10 5細胞/ウェルの密度で24ウェル細胞培養皿にカウントし、プレート、それらを完全にダルベッコ改変イーグル培地(cDMEM、10%熱不活化ウシ胎児血清(FBS)、2mMのグルタミン、および10mM HEPES)、5%CO 2インキュベーターで37°Cで一晩インキュベートする。
2。病原性のサルモネラ血清型Typhimuriumの14028変容と文化
- Sに緑色蛍光タンパク質(GFP)を発現する組換えプラスミドを導入します。エレクトロポレーションによる菌。まず、LBブロスにサルモネラ血清型Typhimuriumの(ATCC 14028)の培養を準備し、通気しながら37℃で一晩インキュベートする。
- 翌日、遠心の最大速度での細菌のペレットを1mL。細胞をfoを洗う( - (N-モルホリノ)プロパンスルホン酸(MOPS)、20%グリセロール緩衝液1 mm 3)を静かにそれぞれの洗浄から9までのピペットでペレットを再懸濁することにより冷MOPS /グリセロール溶液1mLとウル回。最終洗浄後、pAKgfp1またはpAKgfplux1プラスミドDNA 0.5μgを〜を10追加されているにMOPS /グリセロール50μlにペレットを再懸濁します。
- あらかじめ冷やした1ミリメートルギャップエレクトロポレーションキュベットに細胞懸濁液を移し、設定を使用して、エレクトロポ:1800 V、200 W、25μFの。直ちにパルス納品後、LB培地1mLを追加し、新しい15mLのチューブに細胞懸濁液を転送します。細胞は、通気、37℃で回復することができます。 1時間後、残りの上清〜100μLで再懸濁し、遠心分離により細胞を集中しています。
- 最後に、プレートは100μg/ mLのアンピシリンおよび37℃で一晩インキュベート℃を含むLBプレート上で細胞単一のコロニーは、GFP iの抗生物質の選択と表現でrestreakingにより精製されるsは標準的なフルオレセインイソチオシアネート(FITC)フィルターセットと照明によって確認した。
- 安定エクスプレスGFPに変換されたサルモネラの白金耳で25μg/ mLのアンピシリン(または適切な抗生物質)を含むLB培養液10mLを接種する。
- 37℃で一晩、細菌を育てる℃に
- 37℃で5時間インキュベートしアンピシリンを添加した10mlのLB℃を含む新鮮な培養チューブにサルモネラ 1:10に希釈する
- 600 nmでの文化の吸光度を測定し、以前に成長曲線を確立するを使用して、mL当たりのサルモネラの濃度を計算します。
- RAW 264.7細胞あたり100の感染多重度(MOI)を取得するためにcDMEMのサルモネラ (0.5 mLの/ウェル)を希釈します。
3。ナノ粒子懸濁液の調製
- 以前に11の説明に従って、1パーセントFITC-ロードされたナノ粒子を作製する。簡単に言えば、粒子は、無水物で製造されていますポリマーは塩化メチレンに溶解した(4°C 25 mg / mLの濃度で)、ペンタン(:ペンタン比1:200塩化メチレンで-30°C)で沈殿されている抗溶剤ナノカプセル化。真空ろ過によりナノ粒子を回復します。すべての残留溶媒を蒸発させた後、乾燥させた無水物は、紙の重量を量る滅菌を使用してナノ粒子重量を量る。
- 冷リン酸0.5 mLにナノ粒子5mgを追加する生理食塩水1.5 mlのマイクロチューブにPBS(カルシウムおよびマグネシウムを含まない、pH7.4)でバッファリングされ、ナノ粒子はRAW 264.7細胞に添加するまで氷上で保管してください。
- 4から6ジュールで約25秒のためにマイクロチップを装着し、超音波液体プロセッサを使用してナノ粒子懸濁液を(氷上で維持しながら)超音波洗浄します。
4。貪食アッセイ
- 5μg/ mLのサイトカラシン-D培地を吸引による事前のNPまたはサルモネラの導入に1時間とreplでRAW 264.7細胞のサブセットを前処理阻害剤を添加した新鮮なcDMEMでacing。 37℃インキュベーターに文化を返します。
- 阻害剤で1時間インキュベートした後、インキュベーターからプレートを取り外し、渦ナノ粒子懸濁液、および適切なウェルに10μLを追加します。
- 渦サルモネラ 、適切なウェルに細菌を追加することにより、MOI 100でRAW 264.7細胞を感染させる。
- 37℃または4°C(コントロール)を45分間を混合し、インキュベートし、プレートを数回タップします。
- インキュベーターまたは氷上で冷蔵庫や場所からプレートを取り外します。バインドされていない粒子、 サルモネラ 、および死亡またはデタッチされたRAW 264.7細胞を除去するために古い媒体が吸引し、廃棄して、氷冷PBS(のCa 2 +およびMg 2 +なし)で細胞を2回洗浄します。
- 回目の洗浄後のRAW264.7細胞を収穫し、氷冷PBS 250μLを加え、穏やかに井戸を落とす。
- クリアビュースナップキャップ、マイクロピペットに採取した細胞をチューブを遠心し、氷上で保管してください。
- 冷洗浄緩衝液1 mL(2%熱不活性化FBS、PBS中0.1%アジ化ナトリウム)を加えることで細胞を洗浄し、4℃で10分間で250×gで遠心分離
- 上清を捨て、ペーパータオルの上に反転したマイクロ遠心チューブをタップすることで、残った液を取り除きます。静かに試験管ラック全体にマイクロチューブを掻き集めることによって、細胞ペレットを再懸濁します。
- PBS中4%パラホルムアルデヒド(PFA)の100μLを加えることによってRAW 264.7細胞を固定し、細胞を室温(RT)で15分間放置する。
- 4℃で10分間250×gで1パーマ/洗浄緩衝液(BD Biosciences)で遠心を追加することにより、RAW 264.7細胞を洗浄℃に
- 手順4.9を繰り返します。
- RTで15分間。のAlexa Fluor®ファロイジン660(1:150希釈AF 660)を含むパーマ/洗浄バッファー100μlを添加することによりアクチンのRAW 264.7細胞を染色する。手順4.11および4.12を繰り返します。
- 50μlのRAW 264.7細胞を再懸濁しPBSは、取得まで1%PFA、4、暗所に保管°Cを含んでいる。
ヒント&ノート:
- 単色蛍光試料はXのImageStream器をセットアップ中に補正コントロールとして使用されるように、この段階で準備する必要があります。この実験に含まれる補償制御は次のとおりだった:ナノ粒子と共にインキュベートしたRAW 264.7細胞(アクチンのために標識されません) サルモネラと共にインキュベートしたRAW 264.7細胞(アクチンのラベルが付いていません)。アクチンのみ標識されたRAW 264.7細胞。
- 阻害剤の研究のためには、阻害剤を対照として溶解した車両の制御を含めることが重要です。この実験では、サイトカラシンDを100%DMSOに溶解した。我々は、したがって、DMSOを含むcDMEMでインキュベートした細胞としたナノ粒子またはサルモネラの内部を評価した。我々は、メディアグループとDMSOコントロール(データは示さず)の間に有意差を検出しませんでした。
- SAAmnisのウェブサイト(利用可能なmple準備ガイドhttps://www.amnis.com/images/1__Sample_Prep_Guide_3L_-_0418081.pdfは )のImageStream Xと蛍光体の互換性をチェックするための優れたリソースです。このドキュメントにアクセスするには、ユーザーは最初にアミで(無償)を登録する必要があります。
5。のImageStream X上のサンプルの取得
- のImageStream Xと打ち上げINSPIREの電源を投入します。
- フルイディクスを初期化します。このスクリプトSpeedBeadsの終了時に実行する必要があります。
- ファイルメニューで、[既定のテンプレートをロード]を選択します。
- イメージギャラリーの表示メニューで、ALLを選択し、イメージングビーズを開始するためにセットアップを実行を押します。
- 横方向に中央の画像を(必要に応じて)へのコアのトラッキングを調整します。
- 明視野(BF)のチャンネルを選択し、[Set強度をクリックします。
- 流速のCVは一貫してルになるまで待つ0.2%よりもSS。
- 毎日の測定器を校正します。 ASSIST]タブで、キャリブレーションとテストを実行するには、[すべて起動して、すべてが渡されていることを確認]をクリックします。
- 最初のサンプルをロードするためにフラッシュロックと負荷(FLL)を押します。各蛍光色素の蛍光が使用した実験で明るいサンプルをロードします。それはあなたが実験全体のためにそれらを変更しないでください本器の設定を確立するために最初にこのサンプルを実行していることが重要です。
- 実験に用いた各レーザをオンにして、各蛍光色素として散布図で測定された100と4000カウントの間で最大の画素値を持つようにレーザーパワーを設定します。
- 不要なオブジェクトのコレクションを排除するために、セルの分類基準を設定します。唯一のセルからデータを収集するために、50μmまでBFチャネル内のエリアの下限を選択します。 50μm未満の領域を持つオブジェクトが残骸とみなされ、取得されません。収集するチャンネルを選択します。
- ファイル名、インストール先のフォルダ、設定シーケンスを入力します。#1および取得するイベントの数。
- 最初の実験データファイルを収集し、保存するために取得実行]をクリックします。
- FLLをクリックして、次の実験のサンプルを実行します。すべての実験試料が収集されるまで繰り返します。
- コンプの設定(明と散乱レーザーをオフにし、すべてのチャネルのコレクションを有効にする)をクリックして補償行列を開発するための実験では、各蛍光体の各単染色したサンプルから500陽性細胞を収集します。
要約すると、サンプルは次の順序で実行することができます。
- 第一明るいサンプル。
- 残りのテストサンプル。
- 補償は、単一色の蛍光を含む制御します。
ヒント&ノート:
- INSPIREのテンプレートが保存され、インストゥルメントを設定するために、リロードすることができます。一度テンプレートが保存され、オートサンプラは、一つのテンプレートと共同で実験サンプルを実行するには、無人運転のために使用することができますmpensationは、それぞれの単一色の制御のためのテンプレートを使用して制御します。
- これらの実験用のImageStream Xの設定:488と658 nmの励起レーザー、785 nmの散乱レーザー、40X(0.75 NA)客観的な、6チャンネルシステムの標準ISXフィルタスタックを持つ。オートサンプラのオプションは、サンプルの無人取得を可能にするために使用されていました。
- 次の設定は、実験に用いた。ナノ粒子は、10mWのに設定して488 nmのレーザーで撮像された、658 nmのレーザーを50 mWに設定し、785 nmのレーザーは、チャネル1に2 MWとBFに設定されています。 サルモネラに感染した細胞は、20 mWに設定して488 nmのレーザーで撮像した50 mWに設定して658 nmのレーザー、785 nmのレーザーは、2 mWに設定し、チャネル1のBF。補償コントロールはBFと785の非存在下で収集された。少なくとも5000のイベント(すなわち、細胞)を試験サンプルのそれぞれについて撮像した。
6。画像解析
- IDEASを起動し、内部化ウィザードと負荷をダブルクリックします。試験サンプルのe。RIFファイル。
- 手順2で "新しいマトリックス"をクリックして補償行列を作成します。補正ウィザードが起動されます。実験では単一のカラーコントロールのファイルを追加します。補償行列ファイルが保存され、内部化ウィザードのステップ2のボックスにロードされるまで、指示に従ってウィザードを使用して次へ]をクリックします。
- [次へ]をクリックします。DAFのファイルが生成されるまで指示に従ってください。
- 買収時に使用される画像のチャンネルを選択することにより、画像表示のプロパティを設定します。 CH 2(FITC)とCh 5(AF 660)をクリックします。 (BFとSSCが選択されているデフォルト)。
- セルの境界線(CH01)と、ナノ粒子や細菌が収集されたチャンネル(CH02)を作るための画像チャネルを選択します。
- すべてのセルの明アスペクト比対明エリアの散布図が生成されます。シングレットの周りに個々のドットとゲートをクリックして、単一の細胞集団を定義します。単セルのアスペクト比を持っている0.5( 図1A)の周りにラウンド1とダブレット。
- 明勾配ルートのヒストグラムは、明視野画像の広場(RMS)が生成され、イメージギャラリーの人口ビューが選択されたビン( 図1B)に設定されているを意味します。ベストフォーカスの細胞は、ゲートに焦点を当てた細胞への行の領域を開始し、描画する場所を決定するためにビンをクリックします。グラデーションRMS、より焦点をより高い。あなたは上のゲートにしたい他の汚れがない限り、次のステップをスキップします。
- x軸に対して、y軸上のCH2の最大ピクセルのチャンネル2の強度の新たな散布図( 図1C)が生成されます。ドットをクリックすると、ナノ粒子や細菌の陽性である細胞の周囲の領域を描画するための画像を表示します。
- 内在化機能のヒストグラムは、画像( 図1D)を観察することによって調整する必要があります0から始まる領域で生成されます。内部化機能は、の比であるセル全体の強度に細胞内の強度。それは強度の約半分の値が0の時に内側になるようにスケーリングされます。ウィザードでは、細胞表面を見つけるために、ステップ5からセルの画像入力を使用し、4ピクセルで、これを侵食しているマスクをすることによって内部を指定する領域を作成しました。必要なときにこのマスクを手動で異なる種類の細胞のために調整されることに注意してください。この実験では、最初に手動で明視野画像上のオブジェクトのマスクを作成することにより、機能を調整し、4ピクセルで、これを侵食。内在化機能は、この4ピクセル侵食されたオブジェクトのマスクに基づいて算出した。この機能は、私たちは、マスクの境界線( 図2)外部にその蛍光シグナルの過半数を有する表面結合した粒子や細菌から、マスクの境界内にそれらの蛍光シグナルの大部分を持っている内面の粒子や細菌を、区別することができます。
- FEA新しい内在の新しいヒストグラムを作成します。侵食されたオブジェクト·マスクに基づいて、トゥーレ。選択されたビンモードで画像を表示することにより、内在化細胞にゲートに領域を描画します。我々の実験で、我々は、0.3でこのゲートを設定します。 0.3より低いスコアを持つ細胞は、表面結合した粒子陽性細胞と考えられた。
- 最後に、背景標識で細胞を排除するために、特定の内在化ナノ粒子や細菌を識別するために、IDEASスポットカウント機能が使用されています。スポット数は、接続されたコンポーネントまたはイメージ内の小さなマスクの数をカウントする機能です。マスク機能、スポット、ピーク強度はスポットを定義するために使用された。スポットマスクがローカルバックグラウンド上記半径としきい値の指定されたユーザーを持っているイメージの明るい詳細を検出すると、マスクがピーク関数を使用して、個々のスポットに高強度を離れて壊すことによって、洗練された後、200カウントの強度を上記のスポットが含まれていた。詳細については( 図1E)のAmnisスポットマスキングガイドを参照してください。再統計ポートテンプレートは、[レポート]メニューのさまざまな機能を含めることによって生成されました。
- このファイルは、すべての実験ファイルのバッチ分析に使用するテンプレートファイルとして保存されました。
- IDEASソフトウェアでは、[ツール]→[バッチデータファイルをクリックし、入力すべて。RIFファイル。補償行列ファイル(。CTM)とそれに対応するセクションのテンプレートファイル(。AST)を追加します。処理用のバッチを送信します。処理工程の後、すべての。RIFファイルが解析されます。DAFのファイルは、個々の生の各ファイルに対して生成されます。最終報告書ファイルは、すべてのサンプルの統計情報が生成されます。
ヒント&ノート:
- 画像解析は、いくつかの修正とアイデアのソフトウェアバージョン4.0および内部化ウィザードを使用して行った。ウィザードは、自己が有益であるとouptput。DAFのファイルは、ウィザードの指示に従うことで生成することができます。
7。代表的な結果
" 図2>代表的なイメージがそのMIFCが正常に内面(左パネル)を区別するために使用できる実証対表面結合した(右パネル)NP( 図2A)またはサルモネラ ( 図2B)。NPとサルモネラの内部化により減少したを阻害するアクチンと4°C( 図3A)に温度を下げることの両方が。バインドされた表面の陽性細胞の割合はNP(いずれかのサイトカラシン-Dまたは4°C処理した後よりも大きい35%に37℃で約8%から増加した図3B)。これとは対照的に、表面に結合したサルモネラの細胞の割合は、サイトカラシンD処理後の35%から15%に減少した。 サルモネラによるRAW 264.7細胞のインキュベーション4℃で額の中の見かけ上増加させることなく内在化を減少させ37°Cの制御に比べて表面は細菌を結合した。また、これらのデータがあることを実証のサルモネラおよびNPはアクチンを必要とし、温度に依存する類似した細胞のプロセスによって内在化されています。また、データはマクロファージへのサルモネラの持続的な添付ファイルはアクチンの重合を必要とすることを示します。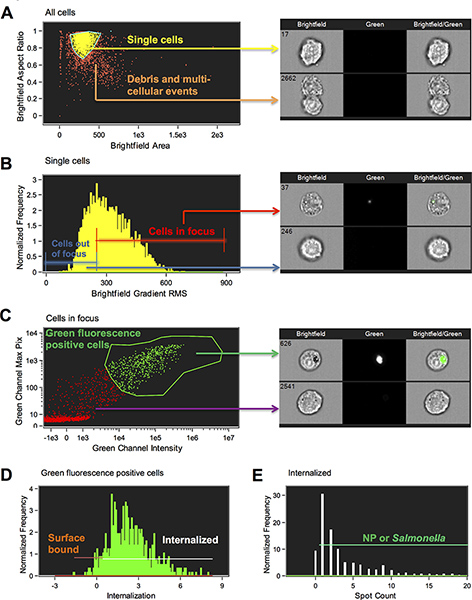
図1。表面結合したナノ粒子とサルモネラ対内在決定するために利用ティング戦略の概略()は、単一の細胞に分析を限定するためには、破片や多細胞イベントを排除することが重要です。単一細胞とダブレットは、IDEASの機能領域と明視野画像(M01) のアスペクト比を使用して多細胞凝集体から分離した。面積は平方ミクロンとアスペクト比の画像のサイズですので、真円度の測定の主要な軸で割った短軸であり、(完全な円は、1のアスペクト比を持っているでしょう。ダブレットは、通常、ASPE持っているCTの約0.5の比と多凝集体は、一般的に0.5未満である)。領域は、単一細胞イベント(ステップ6.6)上にゲートに描かれた。 (B)フォーカスのセルの上にゲートには、明視野画像のアイデア機能グラデーションRMSは、ヒストグラムにプロットされます。グラデーションのRMS機能は、画像の画素値の変化を検出することにより、画像の鮮明さの質を測定します。より高い勾配RMS値はより焦点を絞ったイメージを(ステップ6.7)を示しています。 (C)緑色蛍光陽性細胞は緑色蛍光チャンネル(ステップ6.8)で高い最大のピクセル値と強度を持つ細胞にゲーティングによって選択された。 (D)内面NPまたはサルモネラの細胞は、等しいか、または0.3以上ナリのスコアを持つ細胞集団を選択することにより、選択した。 0.3未満でスコアを受け取った細胞は、(ステップ6.9)バインドされた表面であると考えられた。 (E) "内面"ゲート内の細胞は、さらに熱のための観光スポットの数(NPまたはSTM)に基づいて特徴づけられたeは内在としてカウントがゼロ(ステップ6.11)のスポット値を持っていたバックグラウンド染色といくつかの細胞であった。代表的な画像は、各ゲートのために提示されています。 拡大図を表示するには、ここをクリックしてください 。
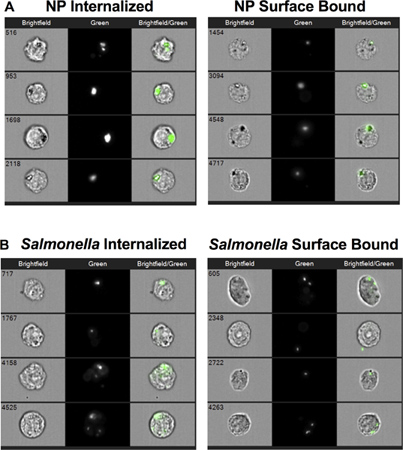
図2。内面と表面結合したナノ粒子(NP)またはサルモネラの細胞像(A)内面NP(左パネル)と、細胞がNPその表面に結合したが、(右パネル)内面化されていないようにすることRAW 264.7細胞の代表的な画像。 (B)内面サルモネラ (左パネル)と細胞はサルモネラ 、その表面に結合したが、(右パネル)内在化されていないようにすることRAW 264.7細胞の代表的なイメージが。
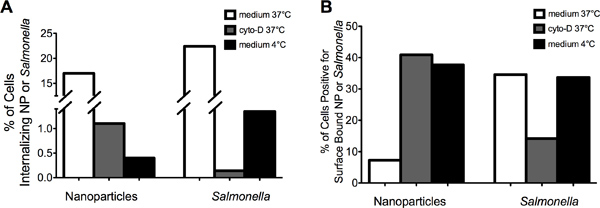
図3。 Cytochala細胞の罪-D治療は、NPおよびサルモネラの内在化を阻害した。サイトカラシンDでRAW 264.7細胞の()前処理 培地で37℃でインキュベートしたRAW 264.7細胞と比較して、または4でインキュベーション°Cは、NPまたはサルモネラ内在化の発生率を減少させた。 DMSO(すなわち、車両制御)を含む培地中でインキュベートRAW 264.7細胞は培地単独(データは示さず)と比較して、NPとサルモネラの類似した内在化レベルを示した。 (B)サイトカラシンDでRAW 264.7細胞の前処理は、表面に結合したサルモネラで細胞の割合を削減しながらNP結合した表面を有する細胞の割合を増加させた。
ディスカッション
研究では、ポリ(乳酸 - コ - グリコール酸(PLGA)または無水物に基づく生分解性ナノ粒子は標的細胞にカプセル化された抗原または薬を届けるために使用することができることが示されている。貪食細胞によるこれらのナノ粒子の取り込みはこのように定量的な作成、その有効性のために重要である。小説ナノ粒子デリバリーシステムを設計する上で重要な内在化の分析は、このメソッドを...
開示事項
Sherree L.の友人は、のImageStream Xシステムを製造してAmnis株式会社で採用されています。
謝辞
著者は金融のためにONR-MURI賞(NN00014-06-1から1176)、米国陸軍医学研究および資材コマンド(グラント番号W81XWH-09-1から0386までとW81XWH-10-1-0806)に感謝したいサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| RAW 264.7細胞株 | アメリカンタイプカルチャーコレクション(ATCC) | TIB-71 | |
| ダルベッコ改変イーグル培地(DMEM) | Cellgro | 10から013-CV | |
| ウシ胎仔血清 | アトランタバイオ | S 11150 | プレミアムグレード |
| グルタミン | ギブコ | 35050-061 | |
| HEPES | ギブコ | 15630-080 | |
| 24ウェルプレート | TPP | 92024 | |
| 細胞培養フラスコ | TPP | 90151 | |
| セルスクレイパー | TPP | 99002 | 24センチメートル |
| サルモネラ血清型Typhimuriumの | ATCC | 14028 | |
| BTX ECM630エレクトロ細胞マニピュレータ | BTXハーバード装置 | ||
| MOPS | フィッシャー·サイエンティフィック | BP308 | |
| リン酸緩衝生理食塩水(PBS) | Cellgro | 21から040-CV | |
| 超音波液体プロセッサ | MISONIX | S-4000 | |
| サイトカラシンD | Sigma-Aldrich社、 | C8273 | |
| ホルムアルデヒド | ポリサイエン | 04018 | |
| 洗浄バッファーを | 2パーセント熱不活性化FBS、PBS中0.1%アジ化ナトリウム。 | ||
| 洗浄バッファーを/パーマ | BDバイオサイエンス | 554714 | |
| スナップキャップのマイクロチューブをクリア表示 | シグマ | T4816 | |
| のAlexa Fluor®ファロイジン660 | インビトロジェン | A22285 | |
| のImageStream X | Amnisコーパスる | 100200 | オプション:658nmレーザー、オートサンプラ |
| アジ化ナトリウム | フィッシャー·サイエンティフィック | S 227I-500 |
参考文献
- Ulery, B. D., Kumar, D., Ramer-Tait, A. E., Metzger, D. W., Wannemuehler, M. J., Narasimhan, B. Design of a protective single-dose intranasal nanoparticle-based vaccine platform for respiratory infectious diseases. PLoS One. 6, e17642 (2011).
- Kasturi, S. P., Skountzou, I., Albrecht, R. A., Koutsonanos, D., Hua, T., Nakaya, H. I., Ravindran, R., Stewart, S., Alam, M., Kwissa, M., Villinger, F., Murthy, N., Steel, J., Jacob, J., Hogan, R. J., García-Sastre, A., Compans, R., Pulendran, B. Programming the magnitude and persistence of antibody responses with innate immunity. Nature. 470, 543-547 (2011).
- Rice-Ficht, A. C., Arenas-Gamboa, A. M., Kahl-McDonagh, M. M., Ficht, T. A. Polymeric particles in vaccine delivery. Curr. Opin. Microbiol. 13, 106-112 (2010).
- Jain, J. P., Chitkara, D., Kumar, N. Polyanhydrides as localized drug delivery carrier: an update. Expert. Opin. Drug. Deliv. 5, 889-907 (2008).
- Pfeifer, B. A., Burdick, J. A., Little, S. R., Langer, R. Poly(ester-anhydride):poly(beta-amino ester) micro- and nanospheres: DNA encapsulation and cellular transfection. Int. J. Pharm. 304, 210-219 (2005).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J. Immunol. Methods. 347, 79-86 (2009).
- Hampton, M. B., Winterbourn, C. C. Methods for quantifying phagocytosis and bacterial killing by human neutrophils. J. Immunol. Methods. 232, 15-22 (1999).
- Rieger, A. M., Hall, B. E., Barreda, D. R. Macrophage activation differentially modulates particle binding, phagocytosis and downstream antimicrobial mechanisms. Dev. Comp. Immunol. 34, 1144-1159 (2010).
- Murphy, K. C., Campellone, K. G. Lambda Red-mediated recombinogenic engineering of enterohemorrhagic and enteropathogenic E. coli. BMC. Mol. Biol. 4, 11 (2003).
- Karsi, A., Lawrence, M. L. Broad host range fluorescence and bioluminescence expression vectors for Gram-negative bacteria. Plasmid. 57, 286-295 (2007).
- Ulery, B. D., Phanse, Y., Sinha, A., Wannemuehler, M. J., Narasimhan, B., Bellaire, B. H. Polymer chemistry influences monocytic uptake of polyanhydride nanospheres. Pharm. Res. 26, 683-690 (2009).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu. Rev. Biochem. 78, 857-902 (2009).
- Vercauteren, D., Vandenbroucke, R. E., Jones, A. T., Rejman, J., Demeester, J., De Smedt, S. C., Sanders, N. N., Braeckmans, K. The use of inhibitors to study endocytic pathways of gene carriers: optimization and pitfalls. Mol. Ther. 18, 561-569 (2010).
- Di Marzio, L., Marianecci, C., Cinque, B., Nazzarri, M., Cimini, A. M., Cristiano, L., Cifone, M. G., Alhaique, F., Carafa, M. pH-sensitive non-phospholipid vesicle and macrophage-like cells: binding, uptake and endocytotic pathway. Biochim. Biophys. Acta. 1778, 2749-2756 (2008).
- Torres, M. P., Vogel, B. M., Narasimhan, B., Mallapragada, S. K. Synthesis and characterization of novel polyanhydrides with tailored erosion mechanisms. J. Biomed. Mater. Res. A. 76, 102-110 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved