Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализируя сотовой Интернализация наночастиц и бактерий нескольких спектральных изображений проточной цитометрии
В этой статье
Резюме
В этой статье мы опишем метод с использованием нескольких спектральных изображений проточной цитометрии для количественного определения интернализации polyanhydride наночастиц или бактерий RAW 264.7 клеток.
Аннотация
Наночастиц системы появились как ценный инструмент в вакцинации благодаря их способности эффективно доставлять грузы, в том числе белков, антиген представляющих клеток 1-5. Интернализация наночастиц (NP) на антиген представляющих клеток является важным шагом в создании эффективного иммунного ответа на антиген инкапсулированные. Чтобы определить, как изменения в функции воздействия наночастиц разработки, мы стремились развивать высокую пропускную способность, количественного экспериментального протокола, совместимое с обнаружением интернализованной наночастиц, а также бактерии. На сегодняшний день два независимых методов микроскопии и проточной цитометрии, были методы, используемые для изучения фагоцитоза наночастиц. Высокая пропускная способность природы проточной цитометрии создает надежные статистические данные. Однако, из-за низкого разрешения, он не точно количественно внутреннюю против клетки связанных наночастиц. Микроскопии генерирует изображения с высоким пространственным разрешением, чowever, это отнимает много времени и включает в себя небольшие размеры образцов 6-8. Multi-спектральных изображений проточной цитометрии (MIFC) является новой технологией, которая включает в себя аспекты как микроскопии и проточной цитометрии, который выполняет многоцветные спектральные флуоресценции и светлого поля изображения одновременно через ламинарный ядра. Эта функция обеспечивает точный анализ интенсивности флуоресцентного сигнала и пространственных отношений между различными структурами и клеточных функций на высокой скорости.
Здесь мы опишем метод с использованием MIFC для характеристики клеточных популяций, которые усвоили polyanhydride наночастиц или Salmonella enterica серовар Typhimurium. Мы также опишем приготовление суспензии наночастиц, мечения клеток, приобретение по системе ImageStream X и анализа данных с использованием идей применения. Мы также продемонстрировать применение метода, который может быть использован для отличать интернализации рathways для наночастиц и бактерий с помощью цитохалазином-D в качестве ингибитора актин-опосредованного фагоцитоза.
протокол
1. RAW 264.7 культуре клеток
- Урожай RAW 264.7 клеток от колб, когда они достигают слияния, очищая их осторожно ячейки скребком. Граф и пластины им в 24-и клеточных культур блюдо с плотностью 5 × 10 5 клеток / лунку в 0,5 мл полного изменения Дульбеко Eagle Средний (cDMEM, 10% тепла инактивированной эмбриональной телячьей сыворотки (FBS), 2 мМ Glutamax, и 10 мМ HEPES) и инкубировать в течение ночи при 37 ° С в 5% СО 2 инкубатора.
2. Патогенные сальмонеллы enterica серовар Typhimurium 14028 трансформации и культуры
- Внедрение рекомбинантных плазмид, выразив зеленый флуоресцентный белок (GFP) в S. Typhimurium путем электропорации. Во-первых, подготовить культуры Salmonella enterica серовар Typhimurium (АТСС 14028) в LB бульоне и инкубировать в течение ночи при 37 ° C с аэрацией.
- На следующий день, гранулы 1 мл бактерий на максимальной скорости в микроцентрифуге. Промойте клетки лУра раза с 1 мл холодной MOPS / глицерин (1 мм 3 - (N-морфолино) пропансульфоновой кислота (MOPS) буфера в 20% глицерина), осторожно ресуспендированием гранул при помощи пипетки между каждой стирки 9. После последней промывки, ресуспендируют осадок в 50 мкл MOPS / глицерин, в котором ~ 0,5 мкг pAKgfp1 или pAKgfplux1 плазмидной ДНК был добавлен 10.
- Передача суспензии клеток в предварительно охлажденный 1 мм кювет электропорации разрыв и electroporate с настройками: 1800 В, 200 Вт, 25 мкФ. Сразу же после импульса доставки, добавить 1 мл LB бульоне и передачи клеточной суспензии в новый 15 мл трубку. Дайте клеткам восстановиться при 37 ° C с аэрацией. Через час, концентрат клеток путем центрифугирования и ресуспендирования в ~ 100 мкл надосадочной остальных.
- Наконец, пластина ячеек на LB пластины, содержащие 100 мкг / мл ампициллина и инкубировать в течение ночи при температуре 37 ° C. Одноместный колонии очищают restreaking с антибиотиком выбора и выражения GFP яс подтверждено при освещении стандартным изотиоцианат флуоресцеина (FITC) набор фильтров.
- Инокулировать 10 мл LB бульоне, содержащем 25 мкг / мл ампициллина (или соответствующий антибиотик) с loopful сальмонеллы, которые были преобразованы в стабильно GFP экспресс.
- Рост бактерий в течение ночи при температуре 37 ° C.
- Развести 1:10 сальмонеллы в новую пробирку культуры, содержащий 10 мл LB дополнить ампициллин и инкубировать в течение 5 ч при температуре 37 ° C.
- Измерить абсорбцию культуры при 600 нм и рассчитать концентрацию сальмонеллы в мл с использованием предварительно установить кривую роста.
- Развести сальмонеллы в cDMEM (0,5 мл / лунку), чтобы получить множественность заражения (МВД) в 100 RAW 264.7 клетки.
3. Подготовка суспензии наночастиц
- Изготовление 1% FITC загруженные наночастицами, как описано выше 11. Короче говоря, частицы сфабриковано polyanhydrideанти-растворителя nanoencapsulation, в котором полимер растворяют в метиленхлориде (4 ° С в концентрации 25 мг / мл) и осаждаются в пентане (-30 ° С в соотношении 1:200 метиленхлорида пентан). Восстановление наночастиц путем вакуумной фильтрации. После испарения остаточного растворителя, взвесить сухой polyanhydride наночастиц использованием стерилизованного вес бумаги.
- Добавить 5 мг наночастиц до 0,5 мл холодной фосфатным буферным раствором (PBS, кальция и магния бесплатно, рН 7,4) в 1,5 мл трубки микроцентрифужных и держать его на льду, пока наночастицы добавлены в RAW 264.7 клеток.
- Разрушать ультразвуком суспензии наночастиц (сохраняя при этом на льду) с использованием ультразвуковой жидкость процессоры оснащены микроострийных примерно 25 с 4 до 6 джоулей.
4. Фагоцитоз Пробирной
- Предварительной обработки подмножество RAW 264.7 клеток с 5 мкг / мл цитохалазином-D 1 час до введения NP или Salmonella по аспирационных среднего и герacing со свежими cDMEM дополнить ингибитором. Вернуться культур до 37 ° C инкубатора.
- После 1 часа инкубации с ингибитором, удалите пластины из инкубатора, вихревые суспензии наночастиц, а также добавить 10 мкл в соответствующие лунки.
- Vortex сальмонеллы и заразить RAW 264.7 клеток с МВД 100 путем добавления бактерий в соответствующие лунки.
- Нажмите на пластине несколько раз перемешать и инкубировать при температуре 37 ° C или 4 ° C (контроль) в течение 45 мин.
- Снимите пластины из инкубатора или холодильник и место на льду. Промойте клетки в два раза с ледяным PBS (без Ca 2 + и Mg 2 +) Инжекционная и отбрасывая старые среднего для удаления несвязанных частиц, сальмонелла, и мертвые или отдельные RAW 264.7 клеток.
- Для уборки RAW 264.7 клеток после второй стирки, добавить 250 мкл ледяной PBS и аккуратно очистить скважин.
- Внесите собранных клеток в ясные вида оснастки крышка микропробирок и держать их на льду.
- Вымойте клеток путем добавления 1 мл холодной промывочного буфера (2% тепла инактивированной FBS, 0,1% азида натрия в PBS) и центрифуги в 250 х г в течение 10 мин при 4 ° C.
- Удалите супернатант и удаления остатков буфера, постукивая перевернутым трубы микроцентрифужных на бумажном полотенце. Ресуспендируют клеточный осадок, аккуратно собрав микроцентрифужных трубы через стойку пробирку.
- Закрепите RAW 264.7 клеток путем добавления 100 мкл 4% параформальдегид (PFA) в PBS и позволяют клеткам стоять в течение 15 мин при комнатной температуре (RT).
- Вымойте RAW 264.7 клеток путем добавления 1 мл Пермь / промывочного буфера (BD Biosciences) и центрифуги в 250 х г в течение 10 мин при 4 ° C.
- Повторите шаг 4.9.
- Пятно RAW 264.7 клеток для актина путем добавления 100 мкл Пермь / Wash буфер, содержащий Alexa Fluor фаллоидином 660 (AF 660, 1:150 разведение) в течение 15 мин при комнатной температуре. Повторите шаги 4.11 и 4.12.
- Ресуспендируйте RAW 264.7 клеток в 50 мклPBS, содержащим 1% PFA и хранить их в темноте при температуре 4 ° С до приобретения.
Советы и замечания:
- Одноместный образцы флуоресценция цвета должны быть подготовлены на этот шаг, который будет использоваться в качестве компенсации управления при настройке прибора ImageStream X. Компенсация контролирует включены в этом эксперименте были: RAW 264.7 клетки (не помечены для актин) инкубировали с наночастицами, RAW 264.7 клетки (не помечены для актин) инкубировали с сальмонеллой, актин только надписью RAW 264.7 клеток.
- Для исследования ингибиторов, важно включить управления транспортным средством, в котором ингибитор был распущен в качестве контроля. В этом эксперименте, цитохалазин-D растворяется в 100% ДМСО. Поэтому мы инкубировали клетки в cDMEM содержащей ДМСО, а затем оценили интернализации наночастиц или Salmonella. Мы не обнаружили существенной разницы между средней группе и ДМСО контроля (данные не представлены).
- Саmple руководство подготовкой на сайте Amnis ( https://www.amnis.com/images/1__Sample_Prep_Guide_3L_-_0418081.pdf ) является хорошим ресурсом для проверки совместимости с флуорофоров ImageStream X. Для доступа к этому документу, пользователи должны сначала зарегистрироваться (бесплатно, оплачивается) с Amis.
5. Примеры приобретения на ImageStream X
- Включите ImageStream X и запуск INSPIRE.
- Инициализация Fluidics. В конце этого сценария SpeedBeads должен быть запущен.
- В меню Файл выберите пункт Загрузить шаблон по умолчанию.
- По мнению меню Галерея изображений, выберите Все и нажмите Запуск программы установки, чтобы начать изображений бисера.
- Настройка основных отслеживания в центре изображения сбоку (при необходимости).
- Выберите Светлое (BF) канал и нажмите кнопку Установить интенсивность.
- Подождите, пока CV скорость потока последовательно лесс, чем 0,2%.
- Калибровка прибора в день. В ASSIST вкладке, нажмите кнопку Пуск все, чтобы выполнить калибровку и испытания, и убедиться, что все прошло.
- Нажмите флеш изготовку (РЛП) для загрузки первого образца. Загрузите ярким образцом в эксперименте, который флуоресцирует с каждым флуорохромом используется. Очень важно, чтобы вы запустить этот образец сначала установить инструмент настройки, а затем не менять их в течение всего эксперимента.
- Включение каждого лазера, используемого в эксперименте и задать мощность лазера, так что каждый флуорохромом имеет значения Макс пикселей между 100 и 4000 пунктов, а измеряется в разброс участков.
- Установить критерии классификации сотового, чтобы исключить коллекции нежелательных объектов. Для сбора данных только из клеток, выберите область Нижний предел в BF канала до 50 мкм. Объекты площадью менее 50 мкм будет считаться мусором и не будет приобретена. Выберите каналы, которые будут собраны.
- Введите имя файла, папку назначения, установить последовательность# 1, а число событий приобрести.
- Нажмите кнопку Выполнить приобретает для сбора и сохранения первого эксперимента файла данных.
- Нажмите FLL и запустить следующий экспериментальный образец. Повторяйте, пока все опытные образцы были собраны.
- Нажмите Comp Settings (выключает светлого и рассеяние лазера и позволяет совокупность всех каналов) и собрать 500 положительных клеток от каждого отдельного окрашенных образцов для каждого флуорофора в эксперименте по разработке компенсации матрицы.
Подводя итог, образцы могут быть запущены в следующем порядке:
- Яркий пример в первую очередь.
- Остальные образцы теста.
- Компенсация контролирует содержащих одну флуоресценция цвета.
Советы и замечания:
- Шаблон INSPIRE может быть сохранен и перезагрузки, чтобы установить настройки прибора. Когда шаблоны будут сохранены, автоматический пробоотборник может быть использован для автоматическом режиме запустить экспериментальные образцы с одним шаблоном и сотрудничестваmpensation контролирует с помощью шаблона для каждого отдельного управления цветом.
- Конфигурация ImageStream X для этих экспериментов: 488 и 658 нм лазеров возбуждения; 785 нм рассеяние лазера, 40X (0.75 NA) цель, 6 канальная система со стандартным ISX фильтр стека. Опция автоматического пробоотборника была использована, чтобы автоматическом приобретении образцов.
- Следующие параметры были использованы для эксперимента. Наночастицы были обследованы с 488 нм лазер установлен в 10 мВт, 658 нм составляет 50 мВт, 785 нм лазер установлен на 2 мВт и BF в канале 1. Salmonella инфицированные клетки, полученную с использованием 488 нм лазер установлен на 20 МВт, 658 нм составляет 50 мВт, 785 нм лазер установлен на 2 мВт, BF в канале 1. Компенсация управления были собраны в отсутствие BF и 785. По крайней мере, 5000 событий (например, клетки) были обследованы для каждого из образцов.
6. Image Analysis
- Запуск идей и дважды щелкните на мастер Интернализация и нагрузку нае образца. Риф файлов.
- Создание матрицы компенсации, нажав на "Новой Матрицы" в шаге 2. Компенсация мастера запуска. Добавить файлы в одном управления цветом в эксперименте. Нажмите кнопку Далее в мастере следующих направлениях, пока файл компенсации матрица сохраняется и загружается в окне в пункте 2 Интернализация мастера.
- Нажмите кнопку Далее и следуйте инструкциям, пока. DAF файл создается.
- Установка свойств отображения изображения, выбрав изображение каналов, используемых в процессе приобретения. Нажмите на Ч. 2 (FITC) и Глава 5 (AF 660). (BF и SSC являются по умолчанию выбрана).
- Выберите изображение, канал для принятия границе ячейки (CH01) и канал, в котором наночастицы или бактерий были собраны (CH02).
- Разброс участок Светлое площадь по сравнению с Светлое пропорции всех клеток образуется. Определите одну популяцию клеток, нажав на отдельных точек и литниковой вокруг майки. Отдельные клетки имеют соотношение сторон1-м раунде и дублеты около 0,5 (рис. 1А).
- Гистограмма корневой градиент светлое Mean Square (RMS) образа светлого создается и населения зрения в галерею изображений устанавливается в выбранный лоток (рис. 1б). Нажмите на бункерах, чтобы определить, где клетки лучший фокус начать и провести линию ворот региона сосредоточены клетки. Чем больше градиент RMS, более целенаправленной. Пропустить и перейти к следующему шагу, если нет других загрязнений вы хотите ворота.
- Новый график разброса интенсивности канала 2 по оси абсцисс против Макса пиксель Ch2 по оси ординат образуется (рис. 1в). Нажмите на точки и просматривать изображения, которые помогут вам сделать область вокруг клеток, которые являются положительными для наночастиц или бактерий.
- Гистограмма Интернализация функция создается с регионом, который начинается с 0, которые должны быть скорректированы путем наблюдения изображения (рис. 1D). Интернализация особенностью является отношениеИнтенсивность внутри клетки от интенсивности всей клетки. Он масштабируется так, что при значении 0 около половины интенсивности внутри. Мастер создал региона назначить внутрь, сделав маску, которую использовал ввод изображения клетки с шага 5, чтобы найти на поверхности клеток и эрозии это на 4 пикселя. Заметим, что эта маска может быть скорректирована вручную для различных типов клеток в случае необходимости. В этом эксперименте мы вручную настроить функцию создания объекта маски на изображение светлого первого и эрозии это на 4 пикселя. Интернализация функция была затем рассчитываются на основе этого 4 пиксельных эродированных маски объекта. Эта функция позволяет различать интернализованной частиц и бактерий, которые имеют большинство их флуоресценции в маске границы, связанные с поверхности частицы и бактерии, которые имеют большинство их флуоресценции за маской границы (рис. 2).
- Создать новую гистограмму с новым Интернализация ВЭДтуры на основе размытой маской объектов. Нарисуйте региона ворота интернализованной клеток при просмотре изображений в выбранном режиме мусорное ведро. В наших экспериментах, мы устанавливаем это ворота на 0,3. Клетки со счетом менее 0,3 считали поверхность связанных частиц-положительных клеток.
- Наконец, чтобы устранить клетки с фоном маркировки и определить конкретные интернализованной наночастиц или бактерии, граф ИДЕИ пятна особенность была использована. Пятно количество является функцией, которая подсчитывает число компонент связности или небольшие маски в изображении. Маска функции, точечный, пик интенсивности и были использованы для определения места. Место маска находит яркие детали изображения, которые пользователь указал радиус и порог, выше местного фона, маски уточняется разваливается высокой интенсивности в отдельных местах использования пик функции, а затем пятна выше интенсивность 200 пунктам были включены . См. Amnis руководство маскировки место для дополнительной информации (рис. 1Е). Статистика повторно Порт шаблон был создан за счет включения различных функций в меню отчетов.
- Этот файл был сохранен в качестве шаблона, который будет использоваться для пакетного анализа всех экспериментальных файлов.
- В программе ИДЕИ, выберите Сервис → Пакетные файлы данных и ввести все. Риф файлов. Добавить файл компенсации матрицы (. СТМ) и файл шаблона (. АСТ) в соответствующих разделах. Подать пакет для обработки. После обработки шаг, все. Риф файлы проанализированы и. DAF файлы создаются для каждого из отдельных исходных файлов. Окончательный файл отчета генерируется статистика для всех образцов.
Советы и замечания:
- Анализ изображений проводили с использованием версии ИДЕИ 4,0 программного обеспечения и интернализации мастера с некоторыми изменениями. Мастер само собой поучительный и ouptput. DAF файл может быть создан, следуя инструкциям мастера.
7. Представитель Результаты
"> Представитель изображения на рисунке 2 показано, что MIFC могут быть использованы для успешного различать интернализованной (слева) в сравнении с поверхности границы (справа) НП (рис. 2A) или Salmonella (рис. 2В). Интернализация NP и сальмонеллы были сокращены как ингибирование актина и понижение температуры до 4 ° С (рис. 3А). процент клеток положительный поверхности связаны NP увеличилась с приблизительно 8% при 37 ° С до более чем 35% после того, как цитохалазином-D и 4 ° C лечение ( Рис 3В). С другой стороны, процент клеток с поверхности связанного сальмонелла была снижена с 35% до 15% после цитохалазином-D лечения. Инкубация RAW 264.7 клетки сальмонеллы при температуре 4 ° C снизился интернализации без явного увеличения количества Поверхность связаны бактерии по сравнению с 37 ° C управления. Вместе взятые, эти данные показывают, что сальмонеллы и NP усваиваются аналогичным клеточный процесс, который требует актина и зависит от температуры. Кроме того, данные показывают, что устойчивое крепление сальмонелл в макрофагах требует полимеризации актина.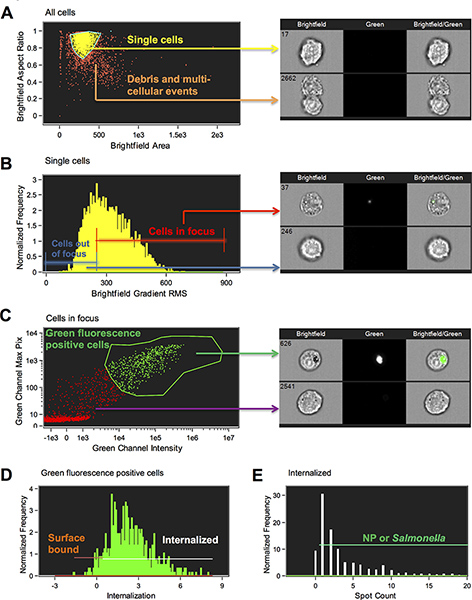
Рисунок 1. Схема стробирования стратегию использовать, чтобы определить внутреннюю поверхность по сравнению связанных наночастиц и сальмонелл. (A) Чтобы ограничить анализ отдельных клеток, важно для устранения мусора и многоклеточных событий. Отдельные клетки и дублеты были отделены от многоклеточные агрегаты использованием области ИДЕИ особенности и пропорции изображения светлого (M01). Район является размер изображения в квадратных микрон и соотношение сторон малой оси, деленной на главной оси и, следовательно, мера округлости (идеальный круг будет иметь соотношение сторон 1; дублетов как правило, имеют AspeКТ отношения около 0,5 и многоклеточные агрегаты, как правило, менее 0,5). Региона было привлечено к воротам на отдельные события ячейки (шаг 6.6). (B) к воротам на клетки в фокусе, идеи имеют градиент RMS образа светлого строится в виде гистограммы. Функция Gradient RMS измеряется острота качество изображения, обнаруживая изменения значений пикселей в изображении. Более высокий градиент RMS значение указывает на более сфокусированного изображения (шаг 6.7). (C) зеленая флуоресценция положительных клеток были выбраны путем стробирования на клетки с высоким разрешением, значения Макс и интенсивность в зеленом канале флуоресценции (шаг 6.8). (D) клетки с интернализованной NP или Salmonella была выбрана путем выбора клеточной популяции с интернализации оценка равна или превышает 0,3. Клетки получают оценку менее 0,3 считались поверхность оценка (шаг 6.9). (E) клеток в "усвоены" ворота были дополнительно характеризуется в зависимости от количества пятен (NP или STM), потому что термоэлектронной некоторые клетки фон окраски, которые считаются интернализованной но имел место нулевое значение (шаг 6.11). Представитель изображения приведены для каждого ворота. Нажмите здесь, чтобы увеличить рисунок .
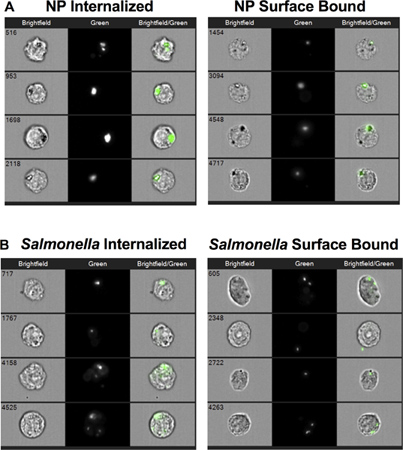
Рисунок 2. Сотовые изображения интернализованной и поверхностных связанных наночастиц (НП) или Salmonella. (А) представитель изображений RAW 264.7 клетки, которые интернализованной NP (слева) и ячейки, к которым НП были связаны с их поверхности, но не интернализованной (правая панель). (B) представитель изображений RAW 264.7 клетки, которые интернализованной Salmonella (слева) и ячейки, к которым сальмонеллы были связаны с их поверхности, но не интернализованной (правая панель).
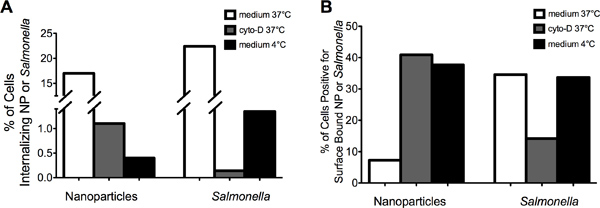
Рисунок 3. Cytochalaгрех-D обработка клеток подавляется интернализации NP и сальмонелл. (А) Предварительная обработка RAW 264.7 клеток цитохалазином-D или инкубации при 4 ° С снижает частоту интернализации NP или Salmonella, по сравнению с RAW 264.7 клетки инкубировали при 37 ° С в среду. RAW 264.7 клетки инкубировали в среде, содержащей ДМСО (например, управления транспортным средством) показали одинаковый уровень интернализации NP и сальмонелл по сравнению со средними в одиночку (данные не представлены). (Б) предварительная обработка RAW 264.7 клеток цитохалазином-D увеличился процент клеток с поверхности связаны NP снижая процент клеток с поверхности связанного сальмонеллы.
Обсуждение
Исследования показали, что биоразлагаемые наночастицы на основе поли (молочной-со-гликолевой кислоты (PLGA) или полиангидриды могут быть использованы для доставки антигенов или инкапсулированных препаратов к клеткам-мишеням. Поглощение этих наночастиц фагоцитирующих клеток имеет важ?...
Раскрытие информации
Sherree Л. Друг работает на Amnis корпорация, которая производит системы ImageStream X.
Благодарности
Авторы хотели бы поблагодарить ОНР-MURI Award (NN00014-06-1-1176) и армии США медицинских исследований и материального Command (Грант номера W81XWH-09-1-0386 и W81XWH-10-1-0806) за финансовую поддержки.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| RAW 264.7 клеточной линии | Американская коллекция типовых культур (АТСС) | TIB-71 | |
| Дульбекко изменения Eagle среднего (DMEM) | CellGro | 10-013-CV | |
| Эмбриональной телячьей сыворотки | Атланты биологические | S 11150 | Премиум класса |
| Glutamax | Гибко | 35050-061 | |
| HEPES | Гибко | 15630-080 | |
| 24-луночного планшета | ТЭС | 92024 | |
| Колбы клеточных культур | ТЭС | 90151 | |
| Сотовые скребок | ТЭС | 99002 | 24 см |
| Сальмонеллы enterica серовар Typhimurium | ATCC | 14028 | |
| BTX ECM630 Electro Манипулятор сотовых | BTX Гарвардского аппарата | ||
| MOPS | Fisher Scientific | BP308 | |
| Фосфатного буфера (PBS) | CellGro | 21-040-CV | |
| Ультразвуковые жидкости процессор | Misоникс | S-4000 | |
| Цитохалазином-D | Sigma-Aldrich, | C8273 | |
| Формальдегид | Polysciences | 04018 | |
| Вымойте буфер | 2% тепла инактивированной FBS, 0,1% азида натрия в PBS. | ||
| Пермский край / промывочный буфер | BD Biosciences | 554714 | |
| Прозрачный колпак микропробирок оснастки | Сигма | T4816 | |
| Alexa Fluor 660 фаллоидином | Invitrogen | A22285 | |
| ImageStream X | Amnis CorporaТион | 100200 | Опции: 658nm лазер, автоматический пробоотборник |
| Азид натрия | Fisher Scientific | S 227I-500 |
Ссылки
- Ulery, B. D., Kumar, D., Ramer-Tait, A. E., Metzger, D. W., Wannemuehler, M. J., Narasimhan, B. Design of a protective single-dose intranasal nanoparticle-based vaccine platform for respiratory infectious diseases. PLoS One. 6, e17642 (2011).
- Kasturi, S. P., Skountzou, I., Albrecht, R. A., Koutsonanos, D., Hua, T., Nakaya, H. I., Ravindran, R., Stewart, S., Alam, M., Kwissa, M., Villinger, F., Murthy, N., Steel, J., Jacob, J., Hogan, R. J., García-Sastre, A., Compans, R., Pulendran, B. Programming the magnitude and persistence of antibody responses with innate immunity. Nature. 470, 543-547 (2011).
- Rice-Ficht, A. C., Arenas-Gamboa, A. M., Kahl-McDonagh, M. M., Ficht, T. A. Polymeric particles in vaccine delivery. Curr. Opin. Microbiol. 13, 106-112 (2010).
- Jain, J. P., Chitkara, D., Kumar, N. Polyanhydrides as localized drug delivery carrier: an update. Expert. Opin. Drug. Deliv. 5, 889-907 (2008).
- Pfeifer, B. A., Burdick, J. A., Little, S. R., Langer, R. Poly(ester-anhydride):poly(beta-amino ester) micro- and nanospheres: DNA encapsulation and cellular transfection. Int. J. Pharm. 304, 210-219 (2005).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J. Immunol. Methods. 347, 79-86 (2009).
- Hampton, M. B., Winterbourn, C. C. Methods for quantifying phagocytosis and bacterial killing by human neutrophils. J. Immunol. Methods. 232, 15-22 (1999).
- Rieger, A. M., Hall, B. E., Barreda, D. R. Macrophage activation differentially modulates particle binding, phagocytosis and downstream antimicrobial mechanisms. Dev. Comp. Immunol. 34, 1144-1159 (2010).
- Murphy, K. C., Campellone, K. G. Lambda Red-mediated recombinogenic engineering of enterohemorrhagic and enteropathogenic E. coli. BMC. Mol. Biol. 4, 11 (2003).
- Karsi, A., Lawrence, M. L. Broad host range fluorescence and bioluminescence expression vectors for Gram-negative bacteria. Plasmid. 57, 286-295 (2007).
- Ulery, B. D., Phanse, Y., Sinha, A., Wannemuehler, M. J., Narasimhan, B., Bellaire, B. H. Polymer chemistry influences monocytic uptake of polyanhydride nanospheres. Pharm. Res. 26, 683-690 (2009).
- Doherty, G. J., McMahon, H. T. Mechanisms of endocytosis. Annu. Rev. Biochem. 78, 857-902 (2009).
- Vercauteren, D., Vandenbroucke, R. E., Jones, A. T., Rejman, J., Demeester, J., De Smedt, S. C., Sanders, N. N., Braeckmans, K. The use of inhibitors to study endocytic pathways of gene carriers: optimization and pitfalls. Mol. Ther. 18, 561-569 (2010).
- Di Marzio, L., Marianecci, C., Cinque, B., Nazzarri, M., Cimini, A. M., Cristiano, L., Cifone, M. G., Alhaique, F., Carafa, M. pH-sensitive non-phospholipid vesicle and macrophage-like cells: binding, uptake and endocytotic pathway. Biochim. Biophys. Acta. 1778, 2749-2756 (2008).
- Torres, M. P., Vogel, B. M., Narasimhan, B., Mallapragada, S. K. Synthesis and characterization of novel polyanhydrides with tailored erosion mechanisms. J. Biomed. Mater. Res. A. 76, 102-110 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены