A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل وتوصيف الخلايا الجذعية والضامة من الأمعاء ماوس
In This Article
Summary
هنا، نحن من التفصيل منهجية لعزل السريع للخلايا فأر الجذعية المعوية (DCS) والضامة. يتم تنفيذ التوصيف المظهري من البلدان النامية في الامعاء والضامة باستخدام متعدد الألوان تدفق تحليل cytometric في حين تستخدم لتخصيب حبة المغناطيسي يليه الفرز الخلية لانتاج السكان نقي جدا للدراسات الفنية.
Abstract
داخل الأمعاء يقيم السكان فريدة من الخلايا المناعية الفطرية والتكيفية التي تشارك في تعزيز التسامح تجاه النباتات commensal ومضادات الطعام في حين تستعد بصورة متزامنة المتبقية لتركيب الاستجابات الالتهابية نحو 1،2 مسببات الأمراض الغازية. الخلايا مستضد تقديم، ولا سيما البلدان النامية والضامة، لعب أدوارا حاسمة في الحفاظ على توازن المناعة في الأمعاء عن طريق قدرتها على الإحساس والاستجابة بشكل مناسب للالجراثيم 3-14. العزلة الفعالة من البلدان النامية في الامعاء والضامة هو خطوة حاسمة في تحديد خصائص النمط الظاهري ووظيفة هذه الخلايا. في حين وصفت وسائل فعالة العديد من عزل خلايا المناعة في الأمعاء، بما في ذلك البلدان النامية والضامة، 6،10،15-24، كثير الاعتماد على الهضم الأوقات الطويلة التي قد تؤثر سلبا على التعبير الخلية المستضد السطحي، بقاء الخلية، و / أو العائد الخلية. هنا، نحن من التفصيل منهجية لعزل السريع لأعداد كبيرة من viablه، ن المعوية والضامة. ويتم توصيف المظهري من البلدان النامية في الامعاء والضامة بها تلطيخ مباشرة الخلايا المعوية المعزولة مع الأجسام المضادة وحيدة النسيلة محددة مضان المسمى لتحليل تدفق متعدد الألوان cytometric. وعلاوة على ذلك، يتم عزل العاصمة نقية للغاية والسكان البلاعم للدراسات الفنية والاستفادة من CD11c CD11b حبات خلية المغناطيسي تنشيط فرز يليه الفرز الخلية.
Protocol
1. تشريح والتفكك من الخلايا الظهارية في الأمعاء
إعداد الكواشف والمعدات:
- دافئ كا 2 + / 2 ملغ + خالية PBS (CMF PBS) إلى درجة حرارة الغرفة.
- كا الحارة 2 + / 2 ملغ + خالية HBSS مع FBS 5٪ (CMF HBSS / FBS) و2MM EDTA إلى درجة حرارة الغرفة.
- المداري الحار شاكر إلى 37 درجة مئوية.
ملاحظة: يجب تنفيذ خطوات 1،1-1،7 في أسرع وقت ممكن للتقليل من حجم موت الخلايا، وتحقيق أقصى عائد الخلية.
- الموت ببطء الفئران في غرفة CO 2 ورذاذ الايثانول 70٪ على البطن والصدر.
- جعل شق صغير الأفقي في منتصف البطن مع مقص وقشر الجلد مرة أخرى لفضح البريتوني.
- والمضي قدما لفصل المعدة من الأمعاء العليا الصغيرة عن طريق قطع في العضلة العاصرة البوابية. ندف بعيدا مساريق مع ملقط وخفض مرة أخرى فيالصمام اللفائفي الأعوري لتحرير كامل الأمعاء الصغيرة من الأمعاء الغليظة. اجراء خفض على حافة الشرج وندف مرة أخرى بصرف النظر عن مساريق حتى الأمعاء الغليظة هو حر.
- خفض فتح القولون باستخدام مقص طوليا ويغسل محتويات البراز والمخاط من لمعة الأمعاء في برنامج تلفزيوني CMF في درجة حرارة الغرفة.
- استخدم مقص وملقط لتشريح ظاهريا من البقع باير على طول سطح المضادة للالمساريقي من الأمعاء الدقيقة وقطع مفتوحة الأمعاء الدقيقة طوليا.
- غسل تجويف الأمعاء الدقيقة من محتويات البراز والمخاط في برنامج تلفزيوني CMF في درجة حرارة الغرفة.
- خفض حدة الأمعاء الدقيقة / كبير الى قطع ما يقرب من 1.5 سم ومكان منفصل في أنابيب مخروطية الشكل التي تحتوي على 50 مل 30 مل من HBSS CMF قبل حرارة / FBS وEDTA 2MM. لا تضيف أكثر من 1 في الأمعاء أنبوب 50 مل مخروطي.
- وضع أفقيا كل أنبوب 50 مل المخروطية الى شاكر المداري ويهز لفي 250 دورة في الدقيقة لمدة 20 دقيقة عند 37 درجة مئوية.
- وضع شبكات سلكية واحدة مصفاة أكثر من دلو النفايات وسكب محتويات كل أنبوب مخروطي 50 مل من خلال لاسترداد القطع الطول 1.5 من الأمعاء ووضعها في أنابيب منفصلة مل 50 مخروطي الشكل تحتوي على 30 مل من قبل حرارة CHBSS / FBS مع 2 ملي EDTA.
- كرر 1.8.
2. الهضم الأنسجة وعزل الخلايا المعوية
الاستعدادات من الكواشف والمعدات:
- كولاجيناز الحل: 1.5 ملغ / مل نوع كولاجيناز الثامن الذائبة في HBSS CMF قبل حرارة / FBS مع 40 ميكروغرام / مل من I. الدناز
- قبل حرارة CMF HBSS / FBS وEDTA 2MM.
- قبل حرارة المدارية شاكر عند 37 درجة مئوية.
- مثلج CMF HBSS / FBS.
- بعد الجولة الثانية من الهز، وسكب محتويات كل أنبوب مخروطي 50 مل من خلال مصفاة ونقل القطع الطول 1.5 من الأمعاء إلى بلاستيكية صغيرة تزن قارب بعد اللمس وسائل الاعلام بعيدا الزائدة باستخدام منشفة ورقية.
- فرم بسرعة 10.5 سم قطعة من الأمعاء مباشرة باستخدام مقص في قارب والوزن وإضافة الأمعاء المفروم إلى 20 مل من محلول كولاجيناز. وضع أفقيا كل أنبوب 50 مل المخروطية الى شاكر المدارية وهضم عند 200 دورة في الدقيقة لمدة 10-20 دقيقة عند 37 درجة مئوية. يرجى الاطلاع أدناه مناقشة بشأن التحسين.
- دوامة لفترة وجيزة لضمان تفكك شامل من الأنسجة المتبقية في الأمعاء وأي مرشح من خلال مصفاة ميكرون 100 خلية مباشرة في أنبوب 50 مل مخروطي.
- أعلى من كل أنبوب مخروطي 50 مل مع HBSS CMF / FBS والطرد المركزي في 1500 دورة في الدقيقة لمدة 5 دقائق في 4 درجات مئوية. إذا لم يتم ملاحظة وجود بيليه صلبة لعينات من القولون بعد الطرد المركزي، ينبغي طرد العينات مرة أخرى لمدة 3.5 دقيقة. كرر هذه الخطوة يغسل مرة أخرى.
- صب قبالة طاف وresuspend لبيليه في الخلية HBSS CMF المثلج / FBS وعينات من مكان على الجليد.
- انتقل إلى القسم 3 لاقتناء نظام مراقبة الأصول الميدانية / تحليل أو القسم (4) لالمغناطيسي حبة التخصيب لsorti خلية عالية السرعةنغ.
3. تلوين الأجسام المضادة لتحليل تدفق متعدد الألوان Cytometric من البلدان النامية والضامة
الاستعدادات من الكواشف والمعدات:
- مثلج CMF برنامج تلفزيوني.
- الجليد الباردة العازلة تلطيخ (CMF PBS + 5٪ FBS).
- إعداد خلية ميتة وصمة عار في برنامج تلفزيوني CMF الجليد الباردة في تخفيف 1:1000 باستخدام لايف / الميت قابل للتثبيت أكوا كيت خلية الميت وصمة عار.
- تحضير كوكتيل تلوين الأجسام المضادة من خلال إضافة ما يلي مضان المسمى الاجسام المضادة (MABS) على الجليد الباردة العازلة تلطيخ: CD45-PerCP، PE-CD103، CD11c آسيا والمحيط الهادئ، MHC-II (IA ب)-اليكسا فلور 700، CD11b eFluor-450، F4/80-PE-Cy7.
- نقل الخلايا في البوليسترين 5 مل أنبوب (FACS) جولة القاع.
- غسل الخلايا مرتين في برنامج تلفزيوني CMF المثلج.
- عينات من احتضان مع خلية ميتة وصمة عار لمدة 15 دقيقة على الجليد في الظلام.
- غسل الخلايا مرتين في برنامج تلفزيوني CMF المثلج.
- كتلة الخلايا مع anti-FcγRIII/II 2.4G2 في الجليد الباردة تلطيخالعازلة لمدة 10 دقيقة على الجليد.
- غسل الخلايا في عازلة تلطيخ المثلج.
- احتضان عينات مع كوكتيل تلوين الأجسام المضادة لمدة 20 دقيقة على الجليد في الظلام.
- غسل الخلايا مع المثلج العازلة تلطيخ مرتين وresuspend العينات في 400 ميكروليتر من الجليد الباردة العازلة تلطيخ وتمر من خلال رسملة 40 ميكرون مرشح في أنابيب نظام مراقبة الأصول الميدانية.
- الحصول على العينات في عداد الكريات LSR الثاني (دينار بحريني) على النحو الذي حددته استراتيجية المعزولة في القسم (5) والشكل رقم 1.
4. تخصيب اليورانيوم من البلدان النامية والضامة من الأمعاء
الاستعدادات من الكواشف والمعدات:
- الجليد الباردة العازلة تلطيخ (CMF PBS + 5٪ FBS).
- احتضان واحد تعليق خلية تم الحصول عليها من الخطوة 2.5 مع CD11b والخرز CD11c MACS وفقا لتعليمات الشركة الصانعة.
- غسل الخلايا مع عازلة تلطيخ المثلج تليها الطرد المركزي.
- تجاهل طاف وresuspend وبيليه خلية في 1 مل العازلة تلطيخ مثلجوتمر من خلال مصفاة ميكرون 100 خلية تليها مصفاة الخلية 40 ميكرومتر.
- إثراء للخلايا حبة المرفقة المغناطيسي عن طريق الانتقاء الإيجابي التي تستخدم أجهزة ماكينتوش LS العمود المغناطيسي.
- كرر الخطوة 4.2 ونبذ طاف.
- احتضان خلايا مع MABS علامة السطح كما هو موضح في الخطوة 3.7.
- غسل المغناطيسي حبة التخصيب الخلايا مرتين مع عازلة تلطيخ المثلج. Resuspend الكريات الخلية في 500 ميكروليتر العازلة تلطيخ الجليد الباردة من دون أزيد الصوديوم، وتمر عبر 40 ميكرومتر مصفاة الخلية في أنبوب نظام مراقبة الأصول الميدانية.
- الشروع في فرز-FACS على فارز ARIA دينار بحريني الخلية الثانية لفرز العاصمة المعوية و / أو مجموعات فرعية بلعم من الاهتمام.
5. استراتيجية النابضة لناقلات الجنود المدرعة ليرة لبنانية
ملاحظة: يرجى ملاحظة أنه يمكن استخدام خلايا الامعاء غير ملوثين كعنصر تحكم السلبية للمساعدة في وضع مناسب من البوابات لفصل السكان الإيجابية والسلبية.
- كما هو مبين في الشكل1، وخلق مؤامرة نقطة واحدة غير والخلايا التي هي ايجابية للخلية ميتة وصمة عار (الشكل 1A)، يليه استبعاد أحداث صدرة (الشكل 1B و C). ثم، بوابة على الخلايا التي تهم وفقا للتوجيه والتشرذم جانب التأكد من استبعاد الحطام (الشكل 1D).
- خلق آخر مؤامرة نقطة وبوابة أخرى على CD45 + ب + IA والخلايا، والتي تتسم ظاهريا ناقلات الجنود المدرعة (الشكل 1E).
- على قطعة نقطة منفصلة، وتحليل لCD11b والتعبير CD11c للتمييز العاصمة محددة وفرعية البلاعم (R1، R2، R3 و؛. الشكل 1F). خلايا R1 هي CD11c + CD11b ممل / - الخلايا. وحددت المنطقة، R2، مثل أن هذه الخلايا لديها مستويات مماثلة من التعبير عن سطح CD11c كما هو الحال في خلايا R1 لكن خلايا R2 CD11b أيضا صريحة. بعد ذلك، تم تعيينه في المنطقة R3 للخلايا التي هي CD11b + وCD11c ممل / -.
- وalyze المناطق R1، R2، R3، وتعبير آخر عن F4/80 وCD103 التفريق بلعم وسكان العاصمة، على التوالي. وCD11c + CD11b ممل / - خلايا مستويات صريحة R1 عالية من إنتغرين αE، CD103، وانخفاض مستويات F4/80 (الشكل 1G). CD11b + + CD11c وتتكون من خلايا R2 كل من البلدان النامية والضامة على أساس التعبير عنها ثنائية التفرع من CD103 وF4/80 (الشكل 1H). وأخيرا، CD11b + CD11c ممل / - خلايا R3 تشكل الضامة استنادا إلى بيان المظهري من F4/80 CD103 + و - (الشكل 1I) 16.
6. ممثل النتائج
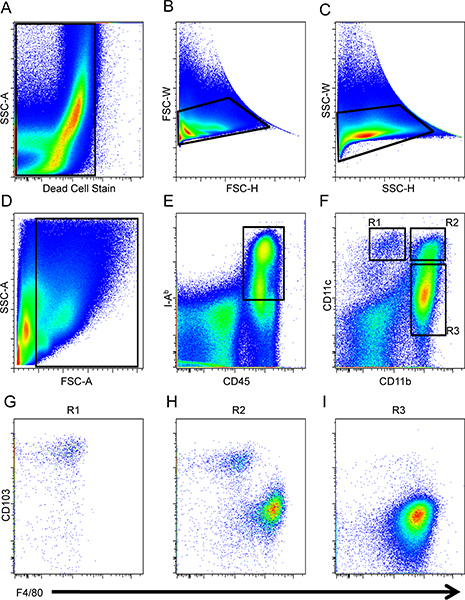
الشكل 1. استبعدت أول استراتيجية النابضة بالنسبة للبلدان النامية في الامعاء والضامة. الخلايا الميتة (A) والحلل (B و C) من التحليل ومن ثم intesti صغيرخلايا نال كانت بوابات وفقا لذلك إلى الأمام والجانب مبعثر (D)، وحددت ناقلات الجنود المدرعة كما CD45 + ب + IA (E). وقد تم تحديد الضامة والبلدان النامية عن طريق التعبير عن CD11b وCD11c (F). وقد تم تحليل CD103 وF4/80 التعبير عن الخلايا ما قبل بوابات على R1 (G)، R2 (ح) و R3 (I) من السكان.
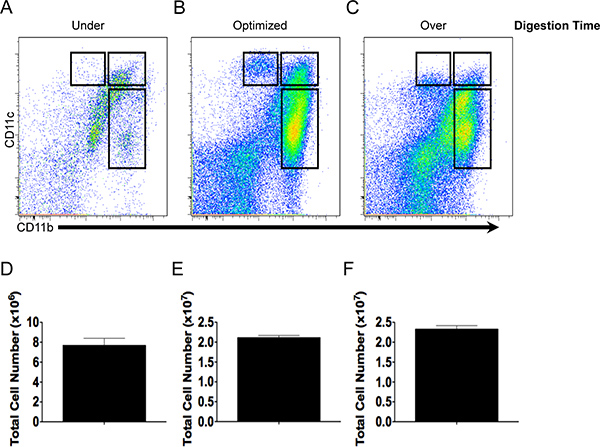
الشكل 2. محصول الخلايا والأجسام المضادة جودة تلطيخ يعتمد على الوقت الهضم. CD11b وCD11c نمط تلطيخ وإجمالي العائد خلية من تحت (أ، د)، على النحو الأمثل، (B، E) أو أكثر من هضمها، (C، F) أنسجة الأمعاء.
تم عزل خلايا الامعاء من الأمعاء صغيرة C57BL / 6 الماوس وحللت البلدان النامية والضامة بواسطة نظام مراقبة الأصول الميدانية على الثاني LSR دينار بحريني. وضعت الجهد والتعويض باستخدام غير ملوثين واحد ملون تألقي الملطخة splenocytes. استبعدت 1 الخلايا الميتة (الشكل 1A) والحلل (الشكل 1B و C) منالتحليل. ثم تم تحليل الخلايا التي تهم وفقا لالأمام والجانب مبعثر (الشكل 1D)، يليه المعزولة عن CD45 + و + IA ب الخلايا (الشكل 1E). بعد ذلك، تم تقييم CD11b والتعبير CD11c بين CD45 + ب + IA الخلايا لتحديد ثلاث مناطق (R1، R2، R3 و؛. الشكل 1F). تم تقييم CD103 والتعبير F4/80 في المناطق الثلاث للتمييز بين البلدان النامية والضامة، على التوالي. وأعرب خلايا R1 مستويات عالية من إنتغرين αE، CD103، وانخفاض مستويات F4/80 (الشكل 1G) - و+ CD11b CD11c / ممل. CD11b + + CD11c كانت تتألف من خلايا R2 كل من البلدان النامية والضامة على أساس التعبير عنها ثنائية التفرع من CD103 وF4/80 (الشكل 1H) في حين CD11b + CD11c ممل / - خلايا R3 تشكل الضامة استنادا إلى بيان المظهري من F4 / 80 + وCD103 - ( الشكل. 1I) 16. الضامة داخل بوابة R2 والضامة في بوابة R3 لديها إلى الأمام مماثلة، وخصائص مبعثر الجانبية ويمكن تمييزها عن طريق التعبير CD11c. الانقسام وظيفي من هذه المجموعات الفرعية لا تزال غير مفهومة تماما.
وتتضح العلاقة بين مدة الهضم الأنسجة على محصول الخلية مجموع والتعبير عن CD11b وCD11c في الشكل 2. أسفرت الأنسجة المعوية التي تم هضمها لمدة 3 دقائق (وكيل الهضم) منخفض عدد الخلايا مجموع (الشكل 2D) والبلدان النامية وبالتالي قلة والضامة المتاحة للتوصيف (الشكل 2A). ينتج الهضم النسيج لمدة 11 دقيقة وهو عائد قوي من الخلايا الحية (الشكل 2E) التي يبلغ عدد سكانها البلدان النامية والضامة التي عبرت عن مستويات عالية من CD11b وCD11c وكانت مميزة ظاهريا (الشكل 2C). في المقابل، أدى الهضم لمدة 50 دقيقة (الإفراط في الهضم) في العائد خلية مماثلة عندما شاركmpared على الهضم الأمثل (2E الشكل وF)، ومع ذلك، أصبح ترسيم السكان الخلية المختلفة باستخدام CD11b وCD11c أكثر غموضا كوسيلة للتعبير عن تناقص CD11c (الشكل 2C) وعدد من الخلايا الميتة زيادة (لا تظهر البيانات).
Discussion
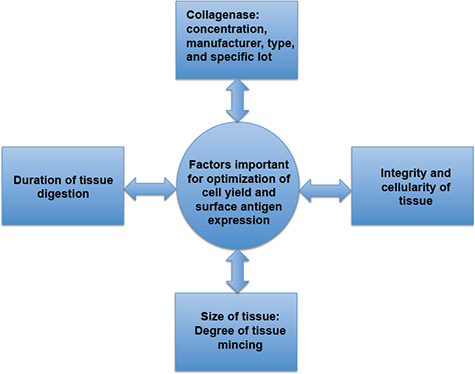
الشكل 3. وتتأثر مباشرة من العوامل الهامة لتعظيم العائد الخلية والتعبير سطح المستضد. العائد خلية والتعبير سطح المستضد من قبل مدة من هضم الأنسجة، والخصائص المميزة للكولاجيناز، ودرجة الأنسجة تنميق، ووجود أو ع?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر هارون راي (جامعة إيموري قسم طب الأطفال ورعاية الاطفال في اتلانتا الأساسية تدفق) للفرز الخلية. وأيد هذا العمل من قبل المعاهد الوطنية للصحة منح AA01787001، على جائزة التطوير المهني من كرون والتهاب القولون مؤسسة من أمريكا، والأطفال، Egleston إيموري في مركز SEED للمنح البحثية لTLD
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليقات |
| 1X PBS، كا 2 + - و 2 ملغ + خالية | |||
| هانك في محلول ملحي متوازن (HBSS) مع الفينول الحمراء | فيشر العلمية | SH3001603 | |
| بيكربونات الصوديوم | سيغما | S6014 | |
| 1M HEPES في كلوريد الصوديوم 0.85٪ | Lonza | 17-737E | |
| الجنين مصل بقري (FBS) | اتلانتا البيولوجية | S11150H | حرارة المعطل |
| 0.5M EDTA (درجة الحموضة 8.0) | Cellgro | 46-034-CI | |
| Collagenasه نوع الثامن | سيغما | C2139 | |
| أنا الدناز | روش | 14785000 | حل الأوراق المالية: 100mg/ml |
| لايف / الميت قابل للتثبيت أكوا كيت خلية الميت اللطخة لإثارة نانومتر 405 | إينفيتروجن | L34957 | استخدم في 1:1000 |
| CD45-PerCP خريطة موقع (30F11) | دينار بحريني | 557235 | استخدم في 1:100 |
| CD103-PE خريطة موقع (M290) | دينار بحريني | 557495 | استخدم في 1:100 |
| FcγRIII / II خريطة موقع (2.4G2) | دينار بحريني | 553141 | استخدم في 1:200 |
| CD11c-APC خريطة موقع (N418) | eBioscience | 17-0114-82 | استخدم في 1:100 |
| MHC-II (I-AB)، فلور 700 خريطة موقع اليكسا | eBioscience | 56-5321-82 | استخدم في 1:100 |
| CD11b eFluor-450خريطة موقع (M1/70) | eBioscience | 48-0112-82 | استخدم في 1:200 |
| F4/80-PE-Cy7 خريطة موقع (BM8) | eBioscience | 25-4801-82 | |
| CD11b microbeads | Miltenyi بيوتيك | 130-049-601 | |
| CD11c microbeads | Miltenyi بيوتيك | 130-052-001 | |
| 50 مل من أنابيب مخروطية | دينار بحريني الصقر | 352098 | |
| وحيد مصفاة سلكية | Chefmate | ||
| قارب صغير يزن | فيشر العلمية | 08-732-116 | |
| 100 مصفاة خلية ميكرومتر | دينار بحريني الصقر | 352360 | |
| 40 مصفاة خلية ميكرومتر | دينار بحريني الصقر | 352340 | |
| 5 مل البوليسترين ذهابا وأسفل الأنابيب | دينار بحريني الصقر | 352235 | استخدم في 1:100 |
| MaxQ 4450 الفوق المدارية شاكر | الحرارية العلمية | ||
| LS MACS عمود | Miltenyi بيوتيك | 130-042-401 | |
| LSR الثاني | دينار بحريني | ||
| FACSAria الثاني | دينار بحريني |
References
- Maloy, K. J., Powrie, F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 474, 298-306 (2011).
- Nagler-Anderson, C., Terhoust, C., Bhan, A. K., Podolsky, D. K. Mucosal antigen presentation and the control of tolerance and immunity. Trends Immunol. 22, 120-122 (2001).
- Abraham, C., Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology. 140, 1729-1737 (2011).
- Macdonald, T. T., Monteleone, I., Fantini, M. C., Monteleone, G. Regula tine. Gastroenterology. 140, 1768-1775 (2011).
- Rescigno, M. Intestinal dendritic cells. Adv. Immunol. 107, 109-138 (2010).
- Platt, A. M., Bain, C. C., Bordon, Y., Sester, D. P., Mowat, A. M. An independent subset of TLR expressing CCR2-dependent macrophages promotes colonic inflammation. J. Immunol. 184, 6843-6854 (2010).
- Coombes, J. L., Powrie, F. Dendritic cells in intestinal immune regulation. Nat. Rev. Immunol. 8, 435-446 (2008).
- Kelsall, B. Recent progress in understanding the phenotype and function of intestinal dendritic cells and macrophages. Mucosal Immunol. 1, 460-469 (2008).
- Pulendran, B., Tang, H., Denning, T. L. Division of labor, plasticity, and crosstalk between dendritic cell subsets. Curr. Opin. Immunol. 20, 61-67 (2008).
- Denning, T. L., Wang, Y. C., Patel, S. R., Williams, I. R., Pulendran, B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol. 8, 1086-1094 (2007).
- Niess, J. H. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science. 307, 254-258 (2005).
- Milling, S. W., Cousins, L., MacPherson, G. G. How do DCs interact with intestinal antigens. Trends Immunol. 26, 349-352 (2005).
- Bilsborough, J., Viney, J. L. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology. 127, 300-309 (2004).
- Stagg, A. J., Hart, A. L., Knight, S. C., Kamm, M. A. The dendritic cell: its role in intestinal inflammation and relationship with gut bacteria. Gut. 52, 1522-1529 (2003).
- Medina-Contreras, O. CX3CR1 regulates intestinal macrophage homeostasis, bacterial translocation, and colitogenic Th17 responses in mice. J. Clin. Invest. 121, 4787-4795 (2011).
- Denning, T. L. Functional Specializations of Intestinal Dendritic Cell and Macrophage Subsets That Control Th17 and Regulatory T Cell Responses Are Dependent on the T Cell/APC Ratio, Source of Mouse Strain, and Regional Localization. J. Immunol. , 187-733 (2011).
- Kim, Y. G. The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes. Immunity. 34, 769-780 (2011).
- Schulz, O. Intestinal CD103+, but not CX3CR1+, antigen sampling cells migrate in lymph and serve classical dendritic cell functions. J. Exp. Med. 206, 3101-3114 (2009).
- Jaensson, E. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J. Exp. Med. 205, 2139-2149 (2008).
- Uematsu, S. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769-776 (2008).
- Schenk, M., Bouchon, A., Seibold, F., Mueller, C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J. Clin. Invest. 117, 3097-3106 (2007).
- Sun, C. M. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J. Exp. Med. 204, 1775-1785 (2007).
- Kamada, N. Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 in response to bacteria. J. Immunol. 175, 6900-6908 (2005).
- Denning, T. L. CD4+ Th cells resembling regulatory T cells that inhibit chronic colitis differentiate in the absence of interactions between CD4 and class II MHC. J. Immunol. 171, 2279-2286 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved