需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
从老鼠肠道树突状细胞和巨噬细胞的分离和表征
摘要
在这里,我们详细介绍了小鼠肠道树突状细胞(DCs)和巨噬细胞的快速分离方法。使用多色流式细胞仪分析细胞分选磁珠富集而被用来产生高纯度的功能研究人口肠道DC和巨噬细胞的表型特征。
摘要
肠道内居住的是参与对共生的植物和食物抗原在促进容忍,而随之而来的剩余准备安装的炎症反应,病原体侵入朝1,2先天免疫和适应性免疫细胞的独特群体。抗原提呈细胞,特别是区议会和巨噬细胞,发挥关键作用,在肠道免疫稳态维持通过自己的能力感和妥善应对微生物3-14。肠道DC和巨噬细胞的高效分离是在描述这些细胞的表型和功能的关键一步。虽然隔离肠道免疫细胞,包括区议会和巨噬细胞,许多有效的方法已6,10,15-24,许多依靠长期的消化时间,可能会产生负面影响细胞表面抗原的表达,细胞活力,和/或细胞产量。在这里,我们详细介绍快速分离的大量viabl的一种方法E,肠区议会和巨噬细胞。肠道DC和巨噬细胞的表型特征进行了直接染色孤立的肠细胞与特定的荧光标记单克隆抗体多色流式细胞仪分析。此外,高纯度的DC和巨噬细胞群体隔离功能的研究,利用CD11c和CD11b的磁激活细胞分选,细胞分选微珠。
研究方案
1。肠上皮细胞的解剖和离解
制备的试剂和设备:
- 温暖的Ca 2 + /镁2 +无PBS(CMF的PBS)的室温。
- 温暖的Ca 2 + / Mg 2 +的免费的HBSS 5%胎牛血清(CMF方案的HBSS / FBS),和2mM EDTA室温。
- 温暖的轨道摇床至37°C。
注:步骤1.1至1.7,必须尽快进行,以尽量减少细胞死亡的程度,并实现最大的细胞产量。
- 安乐死小鼠中的CO 2室及喷到腹部和胸部70%的乙醇。
- 让小剪刀和剥离皮肤暴露腹膜横切口在腹部中间。
- 从小肠上部进行分离胃幽门括约肌切割。戏弄了用钳子肠系膜和再次削减回肠盲肠的阀门释放整个小肠,大肠。使肛门边缘的切割和再次捉弄除了肠系膜,直到大肠是免费的。
- 剖开结肠,纵向用剪刀在CMF的PBS在室温下肠腔内粪便的内容和粘液洗掉。
- 用剪刀和镊子宏观剖析反肠系膜表面沿小肠Peyer氏斑和纵向剖开小肠。
- 在室温下洗小肠管腔粪便的内容和粘液在CMF的PBS。
- 分别含30毫升预热的CMF方案的HBSS /胎牛血清和2mM EDTA单独的50毫升锥形管小/大肠切成约1.5厘米的块和地方。不要添加超过50毫升锥形管的1%的小肠。
- 每50毫升锥形管水平放入轨道摇床和在250转摇在37°C <20分钟/ LI>
- 废物桶置于一个单一的铁丝网过滤,倒入每次50毫升锥形管的内容,通过收回1.5厘米的小肠件,并将其放置在独立50预的温暖CHBSS /胎牛血清30毫升含2毫升锥形管mM的EDTA。
- 重复1.8。
2。组织消化和肠细胞的分离
试剂和设备的准备:
- 胶原酶溶液: 1.5毫克/毫升的类型第八胶原酶溶解在CMF的HBSS中预温/胎牛血清与40微克/毫升的DNase I。
- CMF的HBSS中预温/胎牛血清和2mM EDTA。
- 预热的轨道摇床在37°C
- 冰冷的CMF方案的HBSS / FB的。
- 晃动的第二轮结束后,通过过滤网倒入每次50毫升锥形管的内容和转移1.5厘米的小肠一个小塑料件重量船后,涂抹了多余的介质,使用纸巾。
- 迅速切末1.5厘米小肠件重量船直接用剪刀和胶原酶溶液20毫升加入剁碎的小肠。每50毫升锥形管放入轨道摇床和消化水平在10-20分钟200转37°C. 请参见下面有关优化的讨论。
- 简要涡通过100μm的细胞过滤器,直接到50毫升锥形管,以确保任何剩余的肠道组织和过滤器的彻底分离。
- 关闭每50毫升锥形管的顶端与CMF方案的HBSS / FB和1500转离心5分钟,4°C。如果固体颗粒不离心后观察结肠样品,样品应为3.5分钟再次离心。再次重复此清洗步骤。
- 倒掉上清,重悬细胞沉淀在冰冷的CMF方案的HBSS / FBS和地方样本上冰。
- 进行流式细胞仪采集/分析或磁珠富集高速细胞sorti的第4条第3节纳克。
3。多色流区议会和巨噬细胞的流式细胞仪分析抗体染色
试剂和设备的准备:
- 冰冷CMF的PBS。
- 冰冷的染色缓冲(CMF的PBS + 5%FBS)。
- 准备在1:1000稀释死细胞染色,用活/死可修复水族死细胞染色试剂盒,在冰冷的CMF的PBS。
- 准备加入荧光标记单克隆抗体(mAb)冰冷的染色缓冲抗体染色鸡尾酒:CD45-PerCP,CD103-PE,CD11c的,APC,MHC-Ⅱ(执行机构)的Alexa Fluor 700,CD11b的eFluor 450,F4/80-PE-Cy7。
- 转移到5毫升的聚苯乙烯圆底(流式细胞仪)管细胞。
- 在冰冷的CMF的PBS洗涤细胞两次。
- 染色死细胞孵育15分钟就在黑暗中的冰。
- 在冰冷的CMF的PBS洗涤细胞两次。
- 2.4G2anti-FcγRIII/II座在冰冷的染色细胞在冰上10分钟的缓冲。
- 在冰冷的染色缓冲洗细胞。
- 孵育抗体染色鸡尾酒在黑暗中冰20分钟的样品。
- 与冰冷的染色缓冲洗细胞两次,并悬浮在400μl冰冷的染色缓冲区的样品,并通过流式细胞仪管40微米的过滤器盖。
- 收购上的LSR II流式细胞仪(BD)作为由浇注战略定义,在第5和图1的样品。
4。富集区议会和巨噬细胞从小肠
试剂和设备的准备:
- 冰冷的染色缓冲(CMF的PBS + 5%FBS)。
- 孵育根据制造商的指示,从步骤2.5以CD11b和CD11c磁珠珠获得单细胞悬液。
- 用离心缓冲区冰冷的染色细胞。
- 弃上清,悬浮细胞沉淀用1 mL冰冷的染色缓冲并通过细胞由40微米的细胞过滤过滤100微米。
- 磁珠连接细胞丰富,通过积极选择使用磁珠的LS磁列。
- 重复步骤4.2和弃上清。
- 孵育步骤3.7中所述的表面标记单克隆抗体的细胞。
- 洗两次磁珠富集细胞与冰冷的染色缓冲。重悬细胞沉淀,在500μL冰冷无叠氮化钠染色缓冲,并通过40微米的细胞过滤器传递到流式细胞仪管。
- 进行屋宇署唱腔二,细胞分选,排序肠道DC和/或利益的巨噬细胞亚群流式细胞仪分选。
5。浇注战略为LP装甲运兵车
注 :请注意,未染色的肠细胞可能被利用作为阴性对照,以协助妥善安置门正面和负面的人群分开。
- 如图1,创建一个点图和排除细胞是死细胞染色( 图1A),其次是排斥的双重事件( 图1B和C)呈阳性反应。然后,根据转发侧分散决策一定要排除碎片( 图1D)的利息细胞的大门。
- 创建另一个点的情节和CD45的进一步门+和IA B +细胞,表型特征装甲运兵车( 图1E)。
- 在一个单独的点图,分析CD11b和CD11c的表达来区分特定的DC和巨噬细胞亚群(R1,R2和R3。图1F)。 R1的细胞素CD11c + CD11b的沉闷/ -细胞。地区,R2被划定为CD11c的,这些细胞有R1细胞表面表达水平相似,但R2细胞也表达CD11b的。此后,R3的地区被指定的细胞,细胞CD11b +和CD11c 沉闷/ - 。
- 一个alyze地区R1,R2和R3的进一步F4/80的和CD103表达分化巨噬细胞和DC人群,分别。在素CD11c + CD11b的沉闷/ - αE整合,CD103,F4/80的较低水平( 图1G)R1的快递高水平的细胞。细胞CD11b + CD11c的+ R2的基于二元表达CD103和F4/80的( 图1H)两个区议会和巨噬细胞组成的细胞。最后,细胞CD11b + CD11c的沉闷/ - R3的细胞构成基于表型剖面的F4/80的+和CD103的巨噬细胞- ( 图1I)16。
6。代表结果
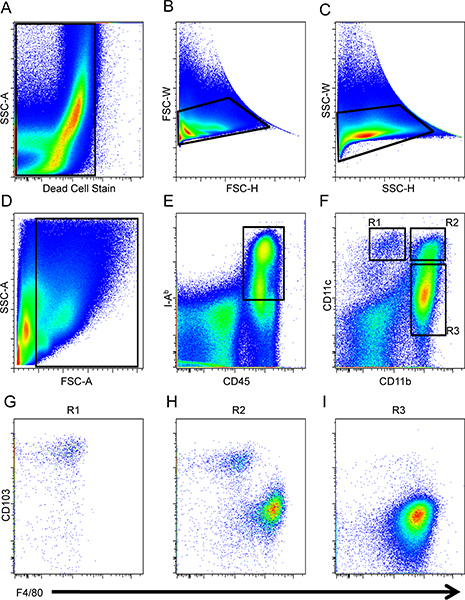
图1。首先从分析中排除浇注战略肠道DC和巨噬细胞,死细胞(A)和双峰(B和C),然后小intestiNAL细胞门相应的转发和侧散射(四),装甲运兵车被定义为CD45的保险业监督B +(E)巨噬细胞和DC的CD11b和CD11c(F)的表达。 CD103细胞预门R1(七),R2(H)和R3(一)人口和F4/80的表达进行了分析。
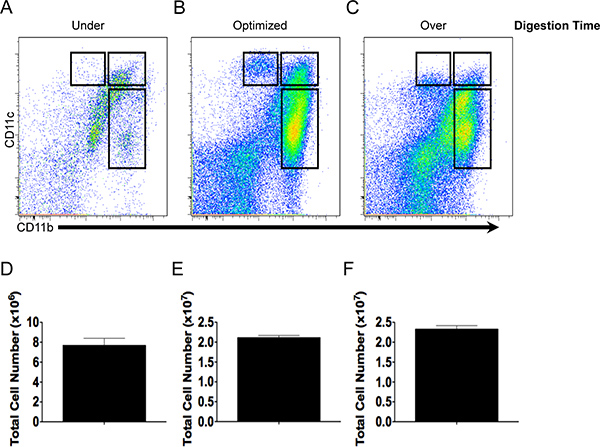
图2。细胞产量和抗体染色的质量取决于消化时间。CD11b和CD11c的染色模式下(D)总细胞产量,最佳(乙,戊类)或过度消化(,F)的肠道组织。
从C57BL / 6小鼠小肠肠细胞的分离和区议会和巨噬细胞上的BD LSR II流式细胞仪分析。使用未染色和荧光染色脾设置电压和补偿。首先排除死细胞( 图1A)和双峰( 图1B和C)分析。感兴趣的细胞,然后根据转发和分析,其次对CD45的门侧散射( 图1D)+和IA B +细胞( 图1E)。此后,CD11b和CD11c的表达评估之间的CD45 +保险业监督B +细胞划定三个区域(R1,R2和R3。图1F)。评估,区议会和巨噬细胞之间的区分,分别在三个区域中CD103和F4/80的表达。在素CD11c + CD11b的沉闷/ - R1细胞表达高水平αE整合,CD103,F4/80的较低水平( 图1G)。细胞CD11b + CD11c的+ R2的细胞组成的基于二元表达CD103和F4/80的( 图1H)两个区议会和巨噬细胞,而细胞CD11b + CD11c的沉闷/ - R3的细胞构成/ F4的表型剖面的基础上的巨噬细胞80 +和CD103 - ( 图。 1I)16。在R2的门的巨噬细胞和巨噬细胞中的R3门也有类似的正向和侧面散射特性和CD11c的表达区分。这些亚群功能的二分法仍然不完全理解。
该组织总细胞产量和细胞CD11b和CD11c表达的消化时间之间的关系如图2所示。 3分钟消化(消化下)肠组织产生了较低的总细胞数( 图2D),因此,很少的区议会和巨噬细胞的特性( 图2A)。组织11分钟的消化产生了强劲的活细胞( 图2E)产量与人口的区议会和巨噬细胞表达高水平的CD11b和CD11c和表型不同( 图2C)。相比之下,在一个类似的细胞产量为50分钟(超过消化)消化导致当合作mpared优化消化( 图2E和F),然而,划定不同的细胞,利用细胞CD11b和CD11c人口成为表达CD11c的减少更晦涩难懂( 图2C)和死细胞数量增加(数据未显示)。
讨论
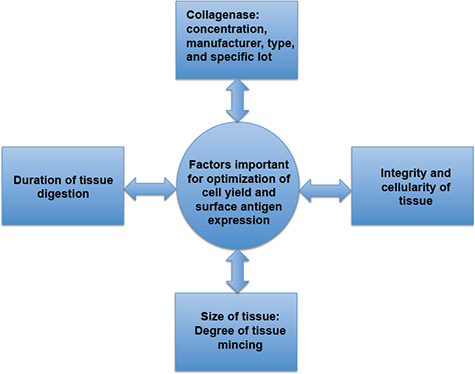
图3。直接组织消化时间的影响因素,重要的细胞产量和表面抗原表达的优化。细胞产量和表面抗原表达,胶原酶的具体特点,组织切碎程度,以及存在或炎症的情况下,这可能会影响组织的完整性和细胞结构。长期组织消化,可能会导致细胞活力下降和表面抗原的表达,同时组织消化不足可能会导致在分析细胞缺乏。
披露声明
没有利益冲突的声明。
致谢
我们感谢亚伦RAE(埃默里大学儿科和儿童医疗亚特兰大流核心),细胞分选。这项工作是由NIH资助AA01787001,从克隆氏病及溃疡性结肠炎美国基金会事业发展奖,和埃默里Egleston儿童研究中心种子批支持到顶级域名(TLD)
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| 1×PBS的Ca 2 + -和Mg 2 +无 | |||
| 汉克的平衡盐溶液(HBSS中)与酚红 | Fisher Scientific则 | SH3001603 | |
| 碳酸氢钠 | 西格玛 | S6014 | |
| 在0.85%的NaCl 1M肝素钠 | 龙沙 | 17-737E | |
| 胎牛血清(FBS), | 亚特兰大生物制品 | S11150H | 热灭活 |
| 0.5M EDTA的(pH值8.0) | cellgro | 46-034-CI | |
| collagenasE型八 | 西格玛 | C2139 | |
| DNA酶I | 罗氏公司 | 14785000 | 联合解决方案:100mg/ml |
| LIVE / DEAD可修复水族死细胞染色试剂盒,为405 nm激发 | Invitrogen公司 | L34957 | 使用1:1000 |
| CD45 - ,PerCP单克隆抗体(30F11) | 屋宇署 | 557235 | 使用1:100 |
| CD103-PE单克隆抗体(M290) | 屋宇署 | 557495 | 使用1:100 |
| FcγRIII/ II抗体(2.4G2) | 屋宇署 | 553141 | 在1:200的使用 |
| CD11c的APC的单克隆抗体(N418) | eBioscience | 17-0114-82 | 使用1:100 |
| MHC-Ⅱ(我-AB)的Alexa Fluor 700单克隆抗体 | eBioscience | 56-5321-82 | 使用1:100 |
| 细胞CD11b-eFluor 450单克隆抗体(M1/70) | eBioscience | 48-0112-82 | 在1:200的使用 |
| F4/80-PE-Cy7单克隆抗体(BM8) | eBioscience | 25-4801-82 | |
| CD11b的微球 | 美天旎生物技术 | 130-049-601 | |
| CD11c的微球 | 美天旎生物技术 | 130-052-001 | |
| 50 ml锥形管 | 屋宇署猎鹰 | 352098 | |
| 单铁丝网过滤 | Chefmate | ||
| 小重量船 | Fisher Scientific则 | 08-732-116 | |
| 100微米的细胞过滤器 | 屋宇署猎鹰 | 352360 | |
| 40微米的细胞过滤器 | 屋宇署猎鹰 | 352340 | |
| 5毫升聚苯乙烯圆底管 | 屋宇署猎鹰 | 352235 | 使用1:100 |
| MAXQ 4450台式轨道摇床 | Thermo Scientific的 | ||
| 的LS磁珠列 | 美天旎生物技术 | 130-042-401 | |
| LSR的二 | 屋宇署 | ||
| FACSAria二 | 屋宇署 |
参考文献
- Maloy, K. J., Powrie, F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 474, 298-306 (2011).
- Nagler-Anderson, C., Terhoust, C., Bhan, A. K., Podolsky, D. K. Mucosal antigen presentation and the control of tolerance and immunity. Trends Immunol. 22, 120-122 (2001).
- Abraham, C., Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology. 140, 1729-1737 (2011).
- Macdonald, T. T., Monteleone, I., Fantini, M. C., Monteleone, G. Regula tine. Gastroenterology. 140, 1768-1775 (2011).
- Rescigno, M. Intestinal dendritic cells. Adv. Immunol. 107, 109-138 (2010).
- Platt, A. M., Bain, C. C., Bordon, Y., Sester, D. P., Mowat, A. M. An independent subset of TLR expressing CCR2-dependent macrophages promotes colonic inflammation. J. Immunol. 184, 6843-6854 (2010).
- Coombes, J. L., Powrie, F. Dendritic cells in intestinal immune regulation. Nat. Rev. Immunol. 8, 435-446 (2008).
- Kelsall, B. Recent progress in understanding the phenotype and function of intestinal dendritic cells and macrophages. Mucosal Immunol. 1, 460-469 (2008).
- Pulendran, B., Tang, H., Denning, T. L. Division of labor, plasticity, and crosstalk between dendritic cell subsets. Curr. Opin. Immunol. 20, 61-67 (2008).
- Denning, T. L., Wang, Y. C., Patel, S. R., Williams, I. R., Pulendran, B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol. 8, 1086-1094 (2007).
- Niess, J. H. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science. 307, 254-258 (2005).
- Milling, S. W., Cousins, L., MacPherson, G. G. How do DCs interact with intestinal antigens. Trends Immunol. 26, 349-352 (2005).
- Bilsborough, J., Viney, J. L. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology. 127, 300-309 (2004).
- Stagg, A. J., Hart, A. L., Knight, S. C., Kamm, M. A. The dendritic cell: its role in intestinal inflammation and relationship with gut bacteria. Gut. 52, 1522-1529 (2003).
- Medina-Contreras, O. CX3CR1 regulates intestinal macrophage homeostasis, bacterial translocation, and colitogenic Th17 responses in mice. J. Clin. Invest. 121, 4787-4795 (2011).
- Denning, T. L. Functional Specializations of Intestinal Dendritic Cell and Macrophage Subsets That Control Th17 and Regulatory T Cell Responses Are Dependent on the T Cell/APC Ratio, Source of Mouse Strain, and Regional Localization. J. Immunol. , 187-733 (2011).
- Kim, Y. G. The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes. Immunity. 34, 769-780 (2011).
- Schulz, O. Intestinal CD103+, but not CX3CR1+, antigen sampling cells migrate in lymph and serve classical dendritic cell functions. J. Exp. Med. 206, 3101-3114 (2009).
- Jaensson, E. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J. Exp. Med. 205, 2139-2149 (2008).
- Uematsu, S. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769-776 (2008).
- Schenk, M., Bouchon, A., Seibold, F., Mueller, C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J. Clin. Invest. 117, 3097-3106 (2007).
- Sun, C. M. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J. Exp. Med. 204, 1775-1785 (2007).
- Kamada, N. Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 in response to bacteria. J. Immunol. 175, 6900-6908 (2005).
- Denning, T. L. CD4+ Th cells resembling regulatory T cells that inhibit chronic colitis differentiate in the absence of interactions between CD4 and class II MHC. J. Immunol. 171, 2279-2286 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。