È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento e caratterizzazione di cellule dendritiche ei macrofagi dall'intestino mouse
In questo articolo
Riepilogo
Qui, dettaglio una metodologia per l'isolamento rapido delle cellule dendritiche di topo intestinali (DCS) e macrofagi. Caratterizzazione fenotipica di DC intestinali e macrofagi viene eseguita utilizzando multi-color analisi citometrica mentre magnetica arricchimento tallone seguita dalla selezione cellulare viene utilizzato per produrre le popolazioni di elevata purezza per gli studi funzionali.
Abstract
All'interno l'intestino risiedono popolazioni uniche di cellule immunitarie innate e adattiva che sono coinvolti nella promozione della tolleranza verso la flora commensale e gli antigeni alimentari, mentre in concomitanza rimanendo in bilico per montare le risposte infiammatorie verso invasive 1,2 patogeni. Cellule presentanti l'antigene, in particolare DCS e macrofagi, giocano un ruolo critico nel mantenimento della omeostasi immunitaria intestinale attraverso la loro capacità di percepire e rispondere adeguatamente al microbiota 3-14. Isolamento efficiente di DC intestinali e macrofagi è un passo fondamentale nel caratterizzare il fenotipo e la funzione di queste cellule. Mentre molti metodi efficaci per isolare cellule immunitarie intestinali, compresi DC e macrofagi, sono stati descritti 6,10,15-24, contare su lunghe molte volte digestioni che possono influenzare negativamente l'espressione sulla superficie cellulare antigene, la vitalità cellulare, e / o quantità di cellule. Qui, si dettaglio una metodologia per l'isolamento rapido di un gran numero di viablelettronici, DCS intestinali e macrofagi. Caratterizzazione fenotipica delle DC intestinali e macrofagi viene effettuata direttamente colorazione cellule intestinali isolate con specifici anticorpi monoclonali marcati a fluorescenza per multi-colore analisi citofluorimetrica. Inoltre, DC altamente puro e popolazioni macrofagi sono isolati per studi funzionali utilizzano CD11c e CD11b magnetico attivati perline di separazione delle cellule seguite da selezione cellulare.
Protocollo
1. Dissezione e la dissociazione di cellule epiteliali intestinali
Preparazione dei reagenti e attrezzature:
- Caldo Ca 2 + / Mg 2 +-libera PBS (CMF PBS) a temperatura ambiente.
- Caldo Ca 2 + / Mg 2 +-libere HBSS con 5% FBS (CMF HBSS / FBS) e 2 mM EDTA a temperatura ambiente.
- Warm Agitatore orbitale a 37 ° C.
Nota: Procedura 1,1 a 1,7 devono essere eseguite più rapidamente possibile per minimizzare l'entità della morte cellulare e per ottenere la massima resa cella.
- Euthanize topi in una camera di CO 2 e l'etanolo al 70% a spruzzo sul addome e torace.
- Effettuare una piccola incisione orizzontale al centro dell'addome con una forbice e staccare la pelle per esporre il peritoneo.
- Procedere per separare lo stomaco dalla parte superiore dell'intestino tenue tagliando alla sfintere pilorico. Tease via il mesentere con una pinza e tagliare di nuovo al'ileo-cecale valvola per liberare l'intero intestino piccolo crasso. Fare un taglio al margine anale e di nuovo prendere in giro oltre il mesentere fino a quando il grosso intestino è gratuito.
- Tagliare i due punti longitudinalmente con le forbici e lavare i contenuti fecali e muco dal lume intestinale in CMF PBS a temperatura ambiente.
- Usare le forbici e pinze a sezionare macroscopicamente le placche di Peyer, lungo la superficie anti-mesenterico dell'intestino tenue e tagliare aperta longitudinalmente l'intestino tenue.
- Lavare il lume dell'intestino tenue di contenuti fecali e muco nelle CMF PBS a temperatura ambiente.
- A parte tagliare il piccolo intestino / grandi dimensioni in pezzi di circa 1,5 cm e mettetela in distinte provette da 50 ml coniche contenenti 30 ml di pre-riscaldato HBSS CMF / FBS e 2 mM EDTA. Non aggiungere più di 1 intestino per tubo da 50 ml.
- Posizionare orizzontalmente ogni tubo da 50 ml conica in un agitatore orbitale ed agitare per a 250 rpm per 20 min a 37 ° C.
- Posizionare un unico filtro di rete metallica su un secchio dei rifiuti e versare il contenuto di ciascuna provetta 50 ml conica attraverso il recupero dei pezzi di 1,5 cm di intestino e metterli in diverse provette da 50 ml coniche contenenti 30 ml di pre-riscaldati CHBSS / FB con 2 mM EDTA.
- Ripetere 1,8.
2. Tissue Digestione e isolamento delle cellule intestinali
Preparazioni a base di reagenti e attrezzature:
- Collagenasi soluzione: 1,5 mg / ml Tipo VIII Collagenasi disciolto in preriscaldata HBSS CMF / FBS con 40 pg / ml di DNasi I.
- Pre-riscaldata HBSS CMF / FBS e 2 mM EDTA.
- Pre-riscaldata agitatore orbitale a 37 ° C.
- Ice-freddo HBSS CMF / FBS.
- Dopo il secondo turno di scuotere, versare il contenuto di ciascuna provetta 50 ml conica attraverso il filtro e trasferire pezzi di 1,5 cm di intestino ad una plastica piccola pesa barca dopo tamponando distanza supporti in eccesso con un tovagliolo di carta.
- Rapidamente tritare il 1.5 Pezzi cm di intestino usando forbici direttamente sulla barca peso e aggiungere intestino macinata a 20 ml di soluzione di collagenasi. Posizionare orizzontalmente ogni tubo da 50 ml conica in un agitatore orbitale e digest a 200 rpm per 10-20 min a 37 ° C. Si prega di consultare la discussione sotto per quanto riguarda l'ottimizzazione.
- Brevemente vortice di assicurare la dissociazione completa di qualsiasi restante tessuto intestinale e filtrare attraverso un colino 100 micron cella direttamente in una provetta da 50 ml.
- Top off ogni provetta conica da 50 ml con HBSS CMF / FBS e centrifugare a 1500 rpm per 5 min a 4 ° C. Se un solido pellet non si osserva per i campioni del colon dopo la centrifugazione, i campioni devono essere centrifugati di nuovo per 3,5 min. Ripetere questa fase di lavaggio, una volta di più.
- Eliminare il sopranatante e risospendere il pellet cellulare in ghiacciato HBSS CMF / FBS e campioni posto sul ghiaccio.
- Procedere alla Sezione 3 per l'acquisizione FACS / analisi o la sezione 4 per magneto-tallone di arricchimento per la cella sorti ad alta velocitàng.
3. Colorazione anticorpo per Multi-Color mediante citometria a flusso delle cellule dendritiche e macrofagi
Preparazioni a base di reagenti e attrezzature:
- Ice-freddo CMF PBS.
- Tampone ghiacciato colorazione (CMF PBS + 5% FBS).
- Preparare cellula morta macchia in ghiacciato CMF PBS alla diluizione 1:1000 utilizzando LIVE / DEAD fissabile Kit Dead Cell Aqua Stain.
- Preparare il cocktail di anticorpi colorazione aggiungendo le seguenti fluorescenza marcati anticorpi monoclonali (mAb) al tampone ghiacciato colorazione: PerCP CD45-, CD103-PE, CD11c-APC, MHC-II (IA b)-Alexa Fluor 700, CD11b eFluor-450, F4/80-PE-Cy7.
- Trasferire le cellule in un polistirene da 5 ml a fondo rotondo (FACS) tubo.
- Lavare le cellule due volte in ghiacciato CMF PBS.
- Incubare campioni con cellule morte colorare per 15 min in ghiaccio al buio.
- Lavare le cellule due volte in ghiacciato CMF PBS.
- Celle a blocchi con 2.4G2 anti-FcγRIII/II in ghiacciato colorazionetampone per 10 min in ghiaccio.
- Lavare le cellule in tampone ghiacciato colorazione.
- Incubare campioni con cocktail colorazione anticorpale per 20 min in ghiaccio al buio.
- Lavare le cellule con tampone ghiacciato colorazione due volte campioni e risospendere in 400 microlitri di tampone ghiacciato colorazione e passare attraverso cap 40 micron filtro sui tubi FACS.
- Acquisire campioni su LSR II citometro (BD), come definiti dalla strategia di gating nella Sezione 5 e nella Figura 1.
4. Arricchimento della DC e dei macrofagi da parte dell'intestino
Preparazioni a base di reagenti e attrezzature:
- Tampone ghiacciato colorazione (CMF PBS + 5% FBS).
- Incubare singola sospensione cellulare ottenuta dal punto 2.5 con CD11b e CD11c perle MACS secondo le istruzioni del produttore.
- Lavare le cellule con tampone ghiacciato colorazione seguita da centrifugazione.
- Gettare il surnatante e risospendere il pellet di cellule in 1 ml di tampone ghiacciato colorazionee passano attraverso un filtro 100 pm cella seguito da un filtro cella 40 um.
- Arricchire per magnetici bead-cellule collegate da una selezione positiva utilizzando MACS colonna magnetica LS.
- Ripetere il passaggio 4.2 e scartare il surnatante.
- Incubare le cellule con anticorpi monoclonali marcatori di superficie come descritto al punto 3.7.
- Lavare magnetici tallone arricchiti di cellule due volte con tampone ghiacciato colorazione. Risospendere pellet cellulari in 500 microlitri tampone ghiacciato colorazione senza azide di sodio, e passare attraverso il filtro 40 micron cellule in una provetta FACS.
- Procedere alla FACS-ordinamento sulla cella BD ARIA Sorter II per ordinare DC intestinale e / o sottoinsiemi dei macrofagi di interesse.
5. Strategia di gating per LP APC
Nota: Si noti che non marcate cellule intestinali può essere utilizzato come controllo negativo per assistere nel posizionamento corretto delle porte per separare popolazioni positive e negative.
- Come mostrato in figura1, creare un grafico punto e escludere le cellule che sono positivi per la cella morti macchia (Fig. 1A) seguita dalla esclusione di eventi doppietto (Fig. 1B e C). Poi, porta sulle cellule di interesse in funzione di trasmettere e disperdere lato fare in modo di escludere i detriti (Fig. 1D).
- Creare un altro dot plot e porta avanti CD45 + b + e IA, che caratterizza le cellule fenotipicamente APC (Fig. 1E).
- Su un diagramma dot separato, per analizzare l'espressione CD11c CD11b e per distinguere DC specifici sottoinsiemi e macrofagi (R1, R2, e R3;. Figura 1F). Cellule di R1 sono CD11c + CD11b spenti / - cellule. La regione, R2, è delineato in modo tale che queste cellule hanno livelli simili di espressione superficie CD11c come in cellule di R1, ma anche cellule di R2 esprimono CD11b. Successivamente, la regione R3 è designato per le celle che sono + CD11b e opaco / CD11c -.
- Unalyze regioni R1, R2, R3 e ulteriore espressione per F4/80 e CD103 differenziare macrofagi e popolazioni CC, rispettivamente. Il CD11c + CD11b opaco / - cellule R1 esprimono alti livelli di integrina αE, CD103, e bassi livelli di F4/80 (Fig. 1G). CD11b + + CD11c cellule di R2 sono composti da entrambi i DC e dei macrofagi in base alla loro espressione dicotomica del CD103 e F4/80 (Fig. 1 H). Infine, CD11b + CD11c opache / - cellule di macrofagi R3 costituiscono in base al profilo di fenotipica F4/80 CD103 + e - (Fig. 1I) 16.
6. Risultati rappresentativi
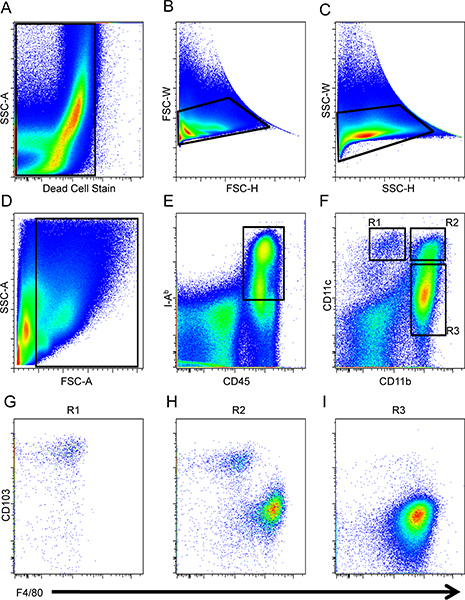
Figura 1. Strategia di gating per DC intestinali e macrofagi. Cellule morte (A) e farsetti (B e C) sono stati esclusi dall'analisi e poi piccolo intestinalenali cellule erano gated conseguenza di trasmettere e lato scatter (D), e APC sono stati definiti come CD45 + IA b + (E). I macrofagi e DC sono stati identificati mediante l'espressione di CD11b e CD11c (F). CD103 e F4/80 espressione per cellule pre-gated su R1 (G), R2 (H) e R3 (I) popolazioni stato analizzato.
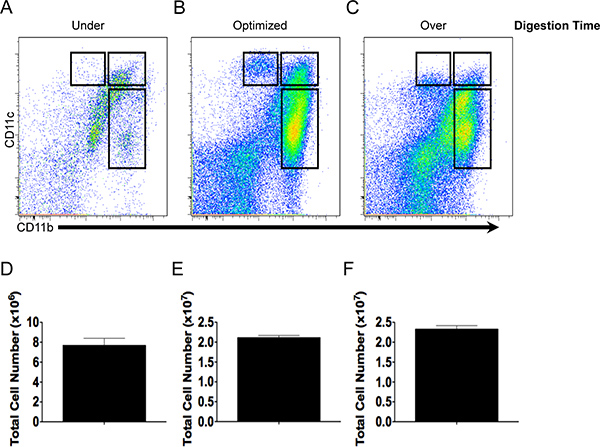
Figura 2. Quantità di cellule e la colorazione di qualità anticorpi dipende dal tempo di digestione. CD11b e pattern di colorazione CD11c e la resa totale delle cellule di sotto-(A, D), in modo ottimale-(B, E) o sopra-digerito (C, F) tessuto intestinale.
Cellule intestinali sono stati isolati da un intestino C57BL / 6 topo piccolo e DC e macrofagi sono stati analizzati mediante FACS sulla LSR BD II. Tensione e compensazione erano state impostate utilizzando solo fluorocromo non colorati e macchiati di splenociti. Le cellule morte (Fig. 1A) e farsetti (Fig. 1B e C) sono stati esclusi dallal'analisi. Le cellule di interesse sono stati poi analizzati secondo di trasmettere e lato scatter (Fig. 1D), seguita da gating sul CD45 + b + IA e cellule (Fig. 1E). Successivamente, CD11b ed espressione CD11c è stata valutata tra il CD45 + b + IA cellule per delineare tre regioni (R1, R2, e R3;. Figura 1F). CD103 e F4/80 espressione nelle tre regioni è stata valutata per distinguere tra DCS e macrofagi, rispettivamente. Il CD11c + CD11b / opaco - cellule R1 espresso alti livelli di integrina αE, CD103, e bassi livelli di F4/80 (Fig. 1G). CD11b + + CD11c cellule R2 erano composti sia DC e dei macrofagi in base alla loro espressione dicotomica del CD103 e F4/80 (Fig. 1 H), mentre CD11b + CD11c spenti / - cellule R3 costituiscono macrofagi in base al profilo fenotipica della F4 / 80 + e CD103 - ( fig. 1I) 16. I macrofagi all'interno del cancello R2 e macrofagi nel cancello R3 in avanti hanno proprietà simili e dispersione laterali e si distinguono per l'espressione CD11c. La dicotomia funzionale di questi sottoinsiemi rimane completamente sconosciuto.
Il rapporto tra la durata di digestione tessutale sulla resa cellulare totale e l'espressione di CD11b e CD11c è illustrato nella figura 2. Tessuto intestinale che è stato digerito per 3 min (sotto-digestione) prodotto a basso numero totale delle cellule (Fig. 2D) e DCS così pochi e macrofagi disponibili per la caratterizzazione (Fig. 2A). La digestione del tessuto per 11 minuti ha prodotto un rendimento affidabile di cellule vive (Fig. 2E) con popolazioni di cellule dendritiche ei macrofagi che esprimono alti livelli di CD11b e CD11c ed erano fenotipicamente distinti (Fig. 2C). Al contrario, la digestione per 50 min (over-digestione) ha comportato una resa simile cella quando compared a digestione ottimizzata (2E Fig. e F), tuttavia, la definizione delle diverse popolazioni cellulari utilizzando CD11b e CD11c divenne più alternativi come l'espressione di diminuita CD11c (Fig. 2C) e il numero di cellule morte aumentata (dati non mostrati).
Discussione
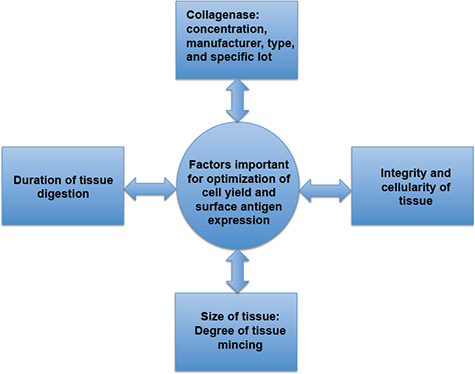
Figura 3. Fattori importanti per l'ottimizzazione della resa delle cellule e l'espressione dell'antigene di superficie. Resa cellulare e l'espressione dell'antigene di superficie sono direttamente interessati dalla durata della digestione dei tessuti, le caratteristiche specifiche del collagenasi, il grado di macinazione dei tessuti e la presenza o l'assenza di infiammazione, che possano pregiudicare l'integ...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Ringraziamo Aaron Rae (Emory University Dipartimento di Pediatria e Healthcare bambini di Core flusso Atlanta) per l'ordinamento delle cellule. Questo lavoro è stato supportato da sovvenzioni NIH AA01787001, un Career Development Award dal morbo di Crohn e Colite Foundation of America, e della ricerca uno Emory-Egleston Children Center di sementi sovvenzione TLD
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Comments |
| 1X PBS, Ca 2 + - 2 + e Mg-free | |||
| Sale di Hank soluzione equilibrata (HBSS) con rosso fenolo | Fisher Scientific | SH3001603 | |
| Bicarbonato di sodio | Sigma | S6014 | |
| HEPES 1M in 0,85% NaCl | Lonza | 17-737E | |
| Siero bovino fetale (FBS) | Atlanta biologici | S11150H | Inattivato al calore |
| 0,5 M EDTA (pH 8,0) | Cellgro | 46-034-CI | |
| Collagenase di tipo VIII | Sigma | C2139 | |
| DNasi I | Roche | 14785000 | Soluzione madre: 100mg/ml |
| LIVE / DEAD fissabile Aqua Kit Dead Cell Stain per 405 nm di eccitazione | Invitrogen | L34957 | Utilizzare a 1:1000 |
| CD45-PerCP mAb (30F11) | BD | 557235 | Utilizzare a 1:100 |
| CD103-PE mAb (M290) | BD | 557495 | Utilizzare a 1:100 |
| FcyRIII / II mAb (2.4G2) | BD | 553141 | Utilizzare a 1:200 |
| CD11c-APC mAb (N418) | eBioscience | 17-0114-82 | Utilizzare a 1:100 |
| MHC-II (I-Ab)-Alexa Fluor 700 mAb | eBioscience | 56-5321-82 | Utilizzare a 1:100 |
| CD11b-eFluor 450mAb (M1/70) | eBioscience | 48-0112-82 | Utilizzare a 1:200 |
| F4/80-PE-Cy7 mAb (BM8) | eBioscience | 25-4801-82 | |
| CD11b microsfere | Miltenyi Biotec | 130-049-601 | |
| CD11c microsfere | Miltenyi Biotec | 130-052-001 | |
| 50 ml provette coniche | BD Falcon | 352098 | |
| Singola mesh filo | Chefmate | ||
| Piccola pesano barca | Fisher Scientific | 08-732-116 | |
| Filtro da 100 micron delle cellule | BD Falcon | 352360 | |
| 40 micron filtro cella | BD Falcon | 352340 | |
| 5 ml in polistirolo a fondo tondo tubi | BD Falcon | 352235 | Utilizzare a 1:100 |
| MaxQ 4450 agitatore orbitale da banco | Thermo Scientific | ||
| LS MACS colonna | Miltenyi Biotec | 130-042-401 | |
| LSR II | BD | ||
| FACSAria II | BD |
Riferimenti
- Maloy, K. J., Powrie, F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 474, 298-306 (2011).
- Nagler-Anderson, C., Terhoust, C., Bhan, A. K., Podolsky, D. K. Mucosal antigen presentation and the control of tolerance and immunity. Trends Immunol. 22, 120-122 (2001).
- Abraham, C., Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology. 140, 1729-1737 (2011).
- Macdonald, T. T., Monteleone, I., Fantini, M. C., Monteleone, G. Regula tine. Gastroenterology. 140, 1768-1775 (2011).
- Rescigno, M. Intestinal dendritic cells. Adv. Immunol. 107, 109-138 (2010).
- Platt, A. M., Bain, C. C., Bordon, Y., Sester, D. P., Mowat, A. M. An independent subset of TLR expressing CCR2-dependent macrophages promotes colonic inflammation. J. Immunol. 184, 6843-6854 (2010).
- Coombes, J. L., Powrie, F. Dendritic cells in intestinal immune regulation. Nat. Rev. Immunol. 8, 435-446 (2008).
- Kelsall, B. Recent progress in understanding the phenotype and function of intestinal dendritic cells and macrophages. Mucosal Immunol. 1, 460-469 (2008).
- Pulendran, B., Tang, H., Denning, T. L. Division of labor, plasticity, and crosstalk between dendritic cell subsets. Curr. Opin. Immunol. 20, 61-67 (2008).
- Denning, T. L., Wang, Y. C., Patel, S. R., Williams, I. R., Pulendran, B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol. 8, 1086-1094 (2007).
- Niess, J. H. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science. 307, 254-258 (2005).
- Milling, S. W., Cousins, L., MacPherson, G. G. How do DCs interact with intestinal antigens. Trends Immunol. 26, 349-352 (2005).
- Bilsborough, J., Viney, J. L. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology. 127, 300-309 (2004).
- Stagg, A. J., Hart, A. L., Knight, S. C., Kamm, M. A. The dendritic cell: its role in intestinal inflammation and relationship with gut bacteria. Gut. 52, 1522-1529 (2003).
- Medina-Contreras, O. CX3CR1 regulates intestinal macrophage homeostasis, bacterial translocation, and colitogenic Th17 responses in mice. J. Clin. Invest. 121, 4787-4795 (2011).
- Denning, T. L. Functional Specializations of Intestinal Dendritic Cell and Macrophage Subsets That Control Th17 and Regulatory T Cell Responses Are Dependent on the T Cell/APC Ratio, Source of Mouse Strain, and Regional Localization. J. Immunol. , 187-733 (2011).
- Kim, Y. G. The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes. Immunity. 34, 769-780 (2011).
- Schulz, O. Intestinal CD103+, but not CX3CR1+, antigen sampling cells migrate in lymph and serve classical dendritic cell functions. J. Exp. Med. 206, 3101-3114 (2009).
- Jaensson, E. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J. Exp. Med. 205, 2139-2149 (2008).
- Uematsu, S. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769-776 (2008).
- Schenk, M., Bouchon, A., Seibold, F., Mueller, C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J. Clin. Invest. 117, 3097-3106 (2007).
- Sun, C. M. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J. Exp. Med. 204, 1775-1785 (2007).
- Kamada, N. Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 in response to bacteria. J. Immunol. 175, 6900-6908 (2005).
- Denning, T. L. CD4+ Th cells resembling regulatory T cells that inhibit chronic colitis differentiate in the absence of interactions between CD4 and class II MHC. J. Immunol. 171, 2279-2286 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon