Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение и характеристика дендритных клеток и макрофагов из кишечника мыши
В этой статье
Резюме
Здесь мы подробно методику для быстрого выделения мышью кишечного дендритные клетки (ДК) и макрофаги. Фенотипические характеристики кишечной домена и макрофагов осуществляется с помощью многоцветной проточной цитометрии в то время как магнитный шарик обогащения следует сортировки клеток используют для получения особо чистых популяций для функциональных исследований.
Аннотация
В кишечнике находятся уникальные популяции врожденных и адаптивных иммунных клеток, которые участвуют в деле поощрения терпимости по отношению к комменсальных флоры и пищевых антигенов в то время как остальные готовы одновременно подключить к воспалительной реакции инвазивных 1,2 патогенов. Антиген представляющих клеток, в частности, домена и макрофагами, играют важную роль в поддержании кишечного иммунного гомеостаза через их способность чувствовать и адекватно реагировать на микробиоты 3-14. Эффективная изоляция кишечного домена и макрофагов является важным шагом в характеризующие фенотип и функцию этих клеток. Хотя многие эффективные методы выделения кишечной клетки иммунной системы, включая контроллеры домена и макрофагов, были описаны 6,10,15-24, многие полагаются на длительное время пищеварения, которые могут отрицательно влиять на клеточной поверхности антиген выражения, жизнеспособность клеток и / или выход ячейки. Здесь мы подробно методику для быстрого выделения больших количеств viablе, кишечные ДК и макрофагов. Фенотипические характеристики кишечной ДК и макрофаги осуществляют непосредственно окрашивание изолированных клеток кишечника с конкретными флуоресценции-меченных моноклональных антител для многоцветной проточной цитометрии. Кроме того, очень чистый DC и макрофагов населения изолированных функциональных исследований с использованием CD11c и CD11b магнитных активированной сортировки клеток бисером следует сортировки клеток.
протокол
1. Вскрытие и диссоциации эпителиальных клетках кишечника
Подготовка реагентов и оборудования:
- Теплый Ca 2 + / Mg 2 + без PBS (CMF PBS) до комнатной температуры.
- Теплый Ca 2 + / Mg 2 + без HBSS с 5% FBS (CMF HBSS / FBS) и на 2 мм ЭДТА до комнатной температуры.
- Теплый Орбитальный шейкер до 37 ° C.
Примечание: Шаги 1.1 до 1.7 должны быть выполнены как можно быстрее, чтобы свести к минимуму степень клеточной смерти и для достижения максимальной доходности клетки.
- Усыпить мышей в CO 2 камеры и спрей 70% этанола на брюшной полости и грудной клетки.
- Сделайте небольшой горизонтальный разрез в середине живота с ножницами и отогните кожи подвергать брюшины.
- Приступить к отделить живот от верхней части тонкой кишки за счет сокращения на пилорический сфинктер. Дразните от брыжейки с пинцетом и сократить раз вподвздошно-слепой кишки клапана, чтобы освободить весь тонкий кишечник из толстой кишки. Сделайте надрез на ануса и снова дразнят друг от друга до брыжейки толстой кишки является бесплатным.
- Разрежьте продольно толстой кишки с помощью ножниц и смыть фекального содержимого и слизи из просвета кишечника в CMF PBS при комнатной температуре.
- Используйте ножницы и щипцы для макроскопически рассекать из патчей Пейера по борьбе с брыжеечной поверхности тонкой кишки и разрезать тонкой кишке продольно.
- Вымойте небольшой просвет кишечника фекальные содержание и слизи в CMF PBS при комнатной температуре.
- Отдельно вырезать небольшие / толстой кишки на 1,5 см кусочки и поместите в отдельную 50 мл конические пробирки, содержащие 30 мл подогретого CMF HBSS / FBS и 2 мМ ЭДТА. Не добавляйте более 1 кишечника на 50 мл коническую трубку.
- Горизонтально разместить по 50 мл коническую трубку в орбитальный шейкер и потрясите для 250 оборотов в минуту в течение 20 мин при 37 ° C.
- Поместите один фильтр сетки над отходами ведро и залейте содержимое по 50 мл коническую трубку, через восстановление части 1,5 см кишечника и поместить их в отдельный 50 мл конические пробирки, содержащие 30 мл подогретого CHBSS / FBS 2 мМ ЭДТА.
- Повторите 1.8.
2. Пищеварение тканей и выделение клеток кишечника
Подготовка реагентов и оборудования:
- Коллагеназы решение: 1,5 мг / мл Тип VIII коллагеназы растворяется в предварительно нагретой CMF HBSS / FBS с 40 мкг / мл ДНКазы I.
- Предварительно нагретый CMF HBSS / FBS и 2 мМ ЭДТА.
- Предварительно нагретый орбитальном шейкере при температуре 37 ° C.
- Ледяной CMF HBSS / FBS.
- После второго тура дрожь, вылейте содержимое по 50 мл коническую трубку через сито и передачи части 1,5 см кишечника в небольших пластиковых вес лодки после вытирать излишки носителя с помощью бумажного полотенца.
- Быстро фарш 10,5 см части кишечника с помощью ножниц прямо на вес лодки и добавить рубленые кишечнике до 20 мл коллагеназы решение. Горизонтально разместить по 50 мл коническую трубку в орбитальном шейкере и дайджест на 200 оборотов в минуту в течение 10-20 минут при температуре 37 ° C. Пожалуйста, см. ниже по оптимизации.
- Кратко вихрь для обеспечения тщательного диссоциации оставшиеся ткани кишечника и процеживают через 100 мкм ячейка фильтр непосредственно в 50 мл коническую трубку.
- Топ с каждым 50 мл коническую трубку с CMF HBSS / FBS и центрифуги в 1500 оборотов в минуту в течение 5 мин при 4 ° C. Если твердый осадок не наблюдается толстой кишки после центрифугирования образца, пробы должны быть снова центрифугировали в течение 3,5 мин. Повторите этот шаг мыть еще раз.
- Слейте надосадочную и ресуспендируют осадок клеток в ледяной CMF HBSS / FBS и место образцы на льду.
- Перейдите к разделу 3 для FACS приобретение / или анализа в разделе 4 магнитных шарика обогащения для высокоскоростного клетки сортировонг.
3. Антитела Окрашивание для многоцветной проточной цитометрии ДК и макрофаги
Подготовка реагентов и оборудования:
- Ледяной PBS CMF.
- Ледяной окрашивания буфера (PBS CMF + 5% FBS).
- Подготовить мертвые клетки пятно в ледяной CMF PBS в разведении 1:1000 использованием LIVE / DEAD Исправимые Аква Dead Cell пятен Kit.
- Подготовка коктейль антител окрашивание, добавив следующие флуоресценции-меченных моноклональных антител (МАТ) к ледяного буфера окрашивание: CD45-PerCP, CD103-PE, CD11c АПК, MHC-II (ИА б) Alexa Fluor +700, CD11b eFluor-450, F4/80-PE-Cy7.
- Передача клеток в 5 мл полистирола с круглым дном (FACS) трубы.
- Промойте клетки дважды в ледяной CMF PBS.
- Инкубируйте образцы мертвых клеток пятно в течение 15 минут на льду в темноте.
- Промойте клетки дважды в ледяной CMF PBS.
- Блок ячеек с 2.4G2 anti-FcγRIII/II в ледяной окрашиваниембуфера в течение 10 минут на льду.
- Вымойте клеток в ледяной окрашиванием буфера.
- Инкубируйте образцы с антителами окрашивания коктейль в течение 20 минут на льду в темноте.
- Промойте клетки с ледяного буфера окрашивания в два раза и образцы ресуспендируют в 400 мкл ледяного буфера окрашивания и проходит через 40 мкм фильтр крышки на трубах FACS.
- Получить образцы на LSR II цитометр (BD), как определено стробирования стратегии в разделе 5 и на рисунке 1.
4. Обогащение ДК и макрофаги из кишечника
Подготовка реагентов и оборудования:
- Ледяной окрашивания буфера (PBS CMF + 5% FBS).
- Инкубируйте суспензии отдельных клеток, полученных из шага 2.5 с CD11b и CD11c MACS бусины в соответствии с инструкциями производителя.
- Промойте клетки с ледяной окрашиванием буфера с последующим центрифугированием.
- Удалить супернатант и ресуспендируют осадок клеток в 1 мл ледяной окрашиванием буфери проходить через ячейки 100 мкм сито следуют ячейки 40 мкм фильтр.
- Расширьте возможности для магнитных шарика подключенных клеток положительной селекции с использованием MACS LS магнитные колонки.
- Повторите шаг 4.2 и отказаться от супернатант.
- Инкубируйте клетки с поверхности маркер МКА, как описано в пункте 3.7.
- Вымойте магнитных шарика обогащенного клетки дважды ледяной окрашиванием буфера. Ресуспендируйте клетки гранулы в 500 мкл ледяной окрашиванием буфера без азид натрия, и пройти через сито 40 мкм клетки в трубку FACS.
- Приступить к FACS-сортировки на BD ARIA II Сотовые Сортировщик для сортировки кишечного постоянного тока и / или макрофагов множества интересов.
5. Память стратегии LP БТР
Примечание: Обратите внимание, что неокрашенные клетки кишечника могут быть использованы в качестве отрицательного контроля для оказания помощи в надлежащий вид ворот к разделению положительных и отрицательных населения.
- Как показано на рисунке1, создайте точку сюжета и исключить клетки, которые являются положительными для мертвых клеток пятна (рис. 1) с последующим исключением дублет событий (рис. 1B и C). Затем ворота на клетки интерес по передней и боковой разброс убедившись, исключить мусор (рис. 1D).
- Создайте еще одну точку сюжета и дальше ворот на CD45 + и И.А. б + клеток, которые фенотипически характеризует БТР (рис. 1д).
- На отдельном участке точка, анализировать для CD11b и CD11c выражение выделить конкретный округ Колумбия, и макрофагов подмножеств (R1, R2 и R3,. Рис 1F). Клетки R1 являются CD11c + CD11b тупой / - клеток. Региона, R2, очерчена так, что эти клетки имеют одинаковый уровень поверхности выражение для CD11c как в клетках R1, но клетки R2 также экспресс CD11b. После этого региона R3 предназначена для клеток, которые CD11b + и CD11c тупой / -.
- alyze регионах R1, R2, R3 и в дальнейшем для F4/80 и CD103 выражение дифференцировать макрофагов и постоянного населения, соответственно. CD11c + CD11b тупой / - клетки R1 экспресс высокого уровня аЕ интегрина, CD103, а также низкий уровень F4/80 (рис. 1Г). CD11b + + CD11c клетки R2 состоит из обоих контроллеров домена и макрофагов на основе их дихотомического выражение CD103 и F4/80 (рис. 1 полугодие). Наконец, CD11b + CD11c тупой / - клетки макрофаги R3 составляют на основе фенотипических профиля F4/80 + и CD103 - (рис. 1I) 16.
6. Представитель Результаты
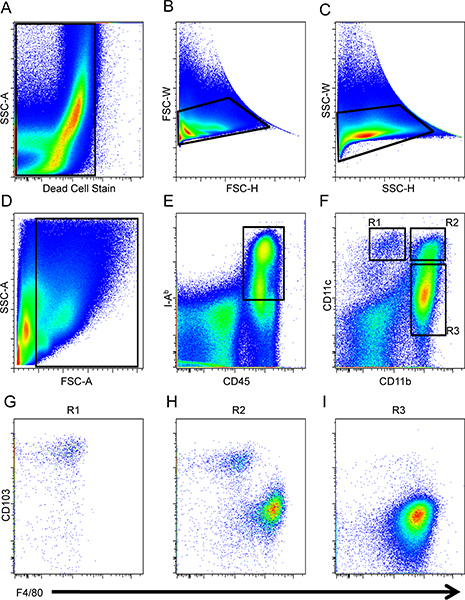
Рисунок 1. Память стратегии кишечного ДК и макрофагов. Мертвые клетки (А) и дублеты (B и C) впервые были исключены из анализа, а затем небольшой intestiNAL клетки закрытого соответственно вперед и стороной рассеяния (D), и БТР были определены как CD45 + B + IA (E). Макрофагов и ДК были определены по выражению CD11b и CD11c (F). CD103 и F4/80 выражение для клетки предварительно закрытый на R1 (G), R2 (H) и R3 (I) населения была проанализирована.
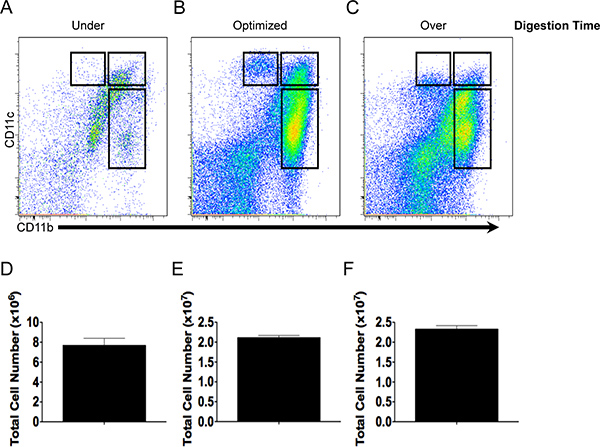
Рисунок 2. Выход клеток и антител, качество окрашивания зависит от пищеварения времени. CD11b и CD11c окрашиванием и общий выход ячейки под-(A, D), оптимально (B, E) или по-перевариваются (C, F) ткани кишечника.
Кишечные клетки были выделены из C57BL / 6 мышей тонкой кишки и ДК и макрофаги были проанализированы FACS на BD LSR II. Напряжения и компенсации были установлены с помощью безупречной и один флуорохромом окрашенных спленоцитов. Мертвые клетки (рис. 1А) и дублеты (рис. 1B и C) впервые были исключены изанализа. Клетки интерес затем анализируются в соответствии с передней и боковой рассеяния (рис. 1D), а затем стробирования на CD45 + и И.А. б + клеток (рис. 1д). После этого CD11b и CD11c выражение оценивается среди CD45 + И.А. б + клеток очертить трех регионах (R1, R2 и R3,. Рис 1F). CD103 и F4/80 выражение в трех регионах была оценена провести различие между ДК и макрофагов, соответственно. CD11c + CD11b тупой / - клетки R1 выразили высокий уровень аЕ интегрина, CD103, а также низкий уровень F4/80 (рис. 1Г). CD11b + + CD11c клетки R2 были составлены как контроллеры домена и макрофагов на основе их дихотомического выражение CD103 и F4/80 (рис. 1 полугодие), а CD11b + CD11c тупой / - клетки макрофаги R3 представляет собой основанный на фенотипические профиля F4 / 80 + и CD103 - ( Рис. 1I) 16. Макрофаги в ворота R2 и макрофагов в ворота R3 имеют аналогичные свойства вперед и стороной разброс и различаются по CD11c выражения. Функциональные дихотомии этих подмножеств остается полностью поняты.
Отношения между продолжительностью ткани пищеварения на общий выход ячейки и выражение CD11b и CD11c показано на рисунке 2. Кишечные ткань, которая переваривается в течение 3 минут (под-пищеварение) дает низкий общего числа клеток (рис. 2) и, следовательно, несколько контроллеров домена и макрофагов для характеристики (рис. 2). Ткань для пищеварения 11 мин производится надежный выход из живых клеток (рис. 2Е) с населением домена и макрофагов, что выражается высоким уровнем CD11b и CD11c и фенотипически различны (рис. 2). В отличие от пищеварения в течение 50 минут (по-пищеварение) в результате аналогичного выход ячейки при сотрудничествеmpared оптимизированной пищеварения (рис. 2Е и F), однако, разграничение различных клеточных популяций использованием CD11b и CD11c стал более темным, как выражение CD11c уменьшение (рис. 2) и число погибших клеток увеличивалось (данные не представлены).
Обсуждение
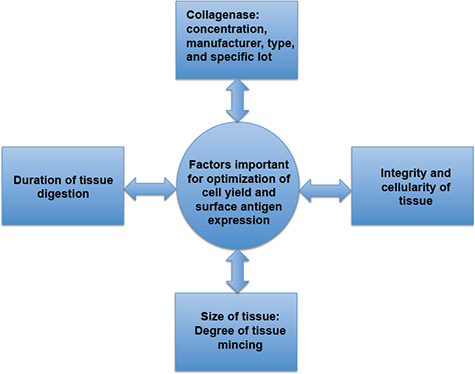
Рисунок 3. Факторы, важные для оптимизации выхода клеток и экспрессия поверхностных антигенов. Выход клеток и экспрессия поверхностных антигенов напрямую зависят от продолжительности ткани пищеварения, специфику коллагеназы, степен?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим Аарон Рей (Университет Эмори кафедры педиатрии и здравоохранения Детский основной поток Атланта) для сортировки клеток. Эта работа была поддержана грантом AA01787001 NIH, премии по развитию карьеры от Крона и колит фонда Америки, и Эмори-Egleston детского исследовательского центра семян грант TLD
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| 1X PBS, Ca 2 + - и Mg 2 + без | |||
| Сбалансированный солевой раствор Хэнкса (HBSS) фенол красный | Fisher Scientific | SH3001603 | |
| Бикарбонат натрия | Сигма | S6014 | |
| 1M HEPES в 0,85% NaCl | Lonza | 17-737E | |
| Эмбриональной телячьей сыворотки (FBS) | Атланты биологических | S11150H | Тепло-инактивированная |
| 0,5 М ЭДТА (рН 8,0) | CellGro | 46-034-ДИ | |
| Collagenasтип электронной VIII | Сигма | C2139 | |
| ДНКазы I | Roche | 14785000 | Маточный раствор: 100мг/мл |
| LIVE / DEAD Исправимые Аква Dead Cell пятен комплект для возбуждения 405 нм | Invitrogen | L34957 | Использование в 1:1000 |
| CD45-PerCP МАБ (30F11) | BD | 557235 | Использование при 1:100 |
| CD103-PE МАБ (M290) | BD | 557495 | Использование при 1:100 |
| FcγRIII / II МАБ (2.4G2) | BD | 553141 | Использование при 1:200 |
| CD11c АПК МАБ (N418) | eBioscience | 17-0114-82 | Использование при 1:100 |
| MHC-II (I-Ab) Alexa Fluor 700 МКА | eBioscience | 56-5321-82 | Использование при 1:100 |
| CD11b-eFluor 450МАБ (M1/70) | eBioscience | 48-0112-82 | Использование при 1:200 |
| F4/80-PE-Cy7 МАБ (BM8) | eBioscience | 25-4801-82 | |
| CD11b микрошарики | Miltenyi Biotec | 130-049-601 | |
| CD11c микрошарики | Miltenyi Biotec | 130-052-001 | |
| 50 мл конические пробирки | BD Сокол | 352098 | |
| Одноместный фильтр сетки | Chefmate | ||
| Малый вес лодки | Fisher Scientific | 08-732-116 | |
| 100 мкм фильтр клетки | BD Сокол | 352360 | |
| 40 мкм фильтр клетки | BD Сокол | 352340 | |
| 5 мл полистирола с круглым дном трубы | BD Сокол | 352235 | Использование при 1:100 |
| MAXQ 4450 настольных орбитальный шейкер | Thermo Scientific | ||
| LS MACS колонка | Miltenyi Biotec | 130-042-401 | |
| LSR II | BD | ||
| FACSAria II | BD |
Ссылки
- Maloy, K. J., Powrie, F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 474, 298-306 (2011).
- Nagler-Anderson, C., Terhoust, C., Bhan, A. K., Podolsky, D. K. Mucosal antigen presentation and the control of tolerance and immunity. Trends Immunol. 22, 120-122 (2001).
- Abraham, C., Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology. 140, 1729-1737 (2011).
- Macdonald, T. T., Monteleone, I., Fantini, M. C., Monteleone, G. Regula tine. Gastroenterology. 140, 1768-1775 (2011).
- Rescigno, M. Intestinal dendritic cells. Adv. Immunol. 107, 109-138 (2010).
- Platt, A. M., Bain, C. C., Bordon, Y., Sester, D. P., Mowat, A. M. An independent subset of TLR expressing CCR2-dependent macrophages promotes colonic inflammation. J. Immunol. 184, 6843-6854 (2010).
- Coombes, J. L., Powrie, F. Dendritic cells in intestinal immune regulation. Nat. Rev. Immunol. 8, 435-446 (2008).
- Kelsall, B. Recent progress in understanding the phenotype and function of intestinal dendritic cells and macrophages. Mucosal Immunol. 1, 460-469 (2008).
- Pulendran, B., Tang, H., Denning, T. L. Division of labor, plasticity, and crosstalk between dendritic cell subsets. Curr. Opin. Immunol. 20, 61-67 (2008).
- Denning, T. L., Wang, Y. C., Patel, S. R., Williams, I. R., Pulendran, B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol. 8, 1086-1094 (2007).
- Niess, J. H. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science. 307, 254-258 (2005).
- Milling, S. W., Cousins, L., MacPherson, G. G. How do DCs interact with intestinal antigens. Trends Immunol. 26, 349-352 (2005).
- Bilsborough, J., Viney, J. L. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology. 127, 300-309 (2004).
- Stagg, A. J., Hart, A. L., Knight, S. C., Kamm, M. A. The dendritic cell: its role in intestinal inflammation and relationship with gut bacteria. Gut. 52, 1522-1529 (2003).
- Medina-Contreras, O. CX3CR1 regulates intestinal macrophage homeostasis, bacterial translocation, and colitogenic Th17 responses in mice. J. Clin. Invest. 121, 4787-4795 (2011).
- Denning, T. L. Functional Specializations of Intestinal Dendritic Cell and Macrophage Subsets That Control Th17 and Regulatory T Cell Responses Are Dependent on the T Cell/APC Ratio, Source of Mouse Strain, and Regional Localization. J. Immunol. , 187-733 (2011).
- Kim, Y. G. The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes. Immunity. 34, 769-780 (2011).
- Schulz, O. Intestinal CD103+, but not CX3CR1+, antigen sampling cells migrate in lymph and serve classical dendritic cell functions. J. Exp. Med. 206, 3101-3114 (2009).
- Jaensson, E. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J. Exp. Med. 205, 2139-2149 (2008).
- Uematsu, S. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769-776 (2008).
- Schenk, M., Bouchon, A., Seibold, F., Mueller, C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J. Clin. Invest. 117, 3097-3106 (2007).
- Sun, C. M. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J. Exp. Med. 204, 1775-1785 (2007).
- Kamada, N. Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 in response to bacteria. J. Immunol. 175, 6900-6908 (2005).
- Denning, T. L. CD4+ Th cells resembling regulatory T cells that inhibit chronic colitis differentiate in the absence of interactions between CD4 and class II MHC. J. Immunol. 171, 2279-2286 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены