このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウスの腸からの樹状細胞およびマクロファージの単離とキャラクタリゼーション
要約
Here, we detail a methodology for the rapid isolation of mouse intestinal dendritic cells (DCs) and macrophages. Phenotypic characterization of intestinal DCs and macrophages is performed using multi-color flow cytometric analysis while magnetic bead enrichment followed by cell sorting is used to yield highly pure populations for functional studies.
要約
腸内に付随して残りの侵襲的な病原体1,2に向かって炎症反応をマウントする態勢を整えながら、共生植物や食物抗原に対する寛容の促進に関与している自然免疫と適応免疫細胞のユニークな集団を常駐します。抗原提示細胞、特に樹状細胞やマクロファージは、感知し、適切に細菌3月14日に応答する能力を介して腸管免疫恒常性を維持する上で重要な役割を果たしている。腸の樹状細胞とマクロファージの効率的な分離は、これらの細胞の表現型と機能を特徴づける重要なステップです。樹状細胞とマクロファージを含む腸管免疫細胞を、単離の多くの効果的な方法は6,10,15-24を説明してきたが、多くは否定的な細胞表面抗原の発現、細胞の生存、および/ または細胞収量に影響を与える可能性がある長い消化時間に依存しています。ここでは、詳細viabl大量の迅速分離するための方法論をE、腸の樹状細胞やマクロファージ。腸の樹状細胞とマクロファージの表現型の特性が直接マルチカラーフローサイトメトリー分析のために特定の蛍光標識モノクローナル抗体を用いて分離された腸の細胞を染色することにより行われる。さらに、高純度のDCおよびマクロファージの集団は細胞選別が続くとCD11b CD11cは磁気活性化細胞選別ビーズを利用した機能性研究のために隔離されています。
プロトコル
1。腸上皮細胞の解離および解離
試薬や機器の調製:
- 室温へのCa 2 + / Mg 2 +のフリーのPBS(CMF PBS)暖かい。
- 5%FBS(CMF HBSS / FBS)と室温に2mMのEDTAと暖かいのCa 2 + / Mg 2 +のフリーのHBSS。
- 37暖かいオービタルシェーカー℃、
注:ステップ1.1から1.7までは、細胞死の程度を最小限に抑え、最大の細胞収率を達成するために、できるだけ早く実行する必要があります。
- 腹部と胸部の上にCO 2チャンバーとスプレー70%エタノールでマウスを安楽死させる。
- バックシザーと皮腹膜を露出する皮膚と腹部の真ん中に小さな水平方向の切開を行います。
- 幽門括約筋で切断して上部小腸から胃を分離するために進んでください。ピンセットで腸間膜を離れていじめると、再びカット大腸から小腸全体を解放するために回腸盲腸弁。肛門縁で切断して、再度大腸が解放されるまで腸間膜を離れていじめる。
- 縦方向にはさみを使用して大腸を開いてカットし、室温でCMF PBSで腸管腔から糞便の内容と粘液を洗い流してください。
- 肉眼的に小腸の抗腸間膜表面に沿ってパイエル板を分析し、長手方向に小腸を開いてカットするはさみや鉗子を使用しています。
- 室温で糞便の内容とCMF、PBS中の粘液の小腸内腔を洗浄します。
- 別々に予め温めておいたCMF HBSS / FBSおよび2mM EDTA 30mlを含む別の50 mlコニカルチューブに約1.5cmの部分と所定の位置に大きい/小さい腸を切った。 50 mlコニカルチューブあたり1以上の腸を追加しないでください。
- 水平オービタルシェーカーに各50 mlコニカルチューブを配置し、℃、<37℃で20分間、250 rpmで振とう/ LI>
- 廃棄物のバケットを介して単一のメッシュワイヤーストレーナーを配置し、腸の1.5cmの部分を回復することを介して各50 mlコニカルチューブの内容物を注ぐと2で予め温めておいたCHBSS / FBSの30ミリリットルを含む別の50 mlコニカルチューブに置くmMのEDTA。
- 1.8を繰り返します。
2。組織の消化と腸細胞の単離
試薬や機器の準備:
- コラゲナーゼ溶液: のDNase Iの40μg/ mlのであらかじめ温めておいたCMF HBSS / FBSに溶解した1.5 mg / mlのタイプVIIIのコラゲナーゼ
- 予め温めておいたCMF HBSS / FBSおよび2mM EDTA。
- 37℃で予め温めておいたオービタルシェーカー℃、
- 氷冷CMF HBSS / FBS。
- 揺れの第二ラウンドの後、ストレーナーを介して各50 mlコニカルチューブの内容物を注ぎ、小さなプラスチックに腸の1.5cmの部分を転送するペーパータオルを使用して、過剰なメディアを離れてたたく後、ボートの重量を量る。
- 急速に1をミンチ腸の0.5センチメートル部分は重量のボートで直接はさみを使用して、コラゲナーゼ溶液20mlにミンチ腸を追加します。水平方向に37℃で10〜20分間、200 rpmでオービタルシェーカーとダイジェストに各50 mlコニカルチューブを配置℃で最適化に関する以下の説明を参照してください。
- 50mlコニカルチューブに直接100μmのセルストレーナーを介して任意の残りの腸組織、フィルタの徹底した解離を確保するために簡単にボルテックスします。
- CMF HBSS / FBSおよび4℃で5分間1500rpmで遠心分離℃でそれぞれ50 mlコニカルチューブオフトップ固体ペレットを遠心分離の後にコロンのサンプルで観察されていない場合、サンプルは3.5分間再度遠心分離する必要があります。もう一度、この洗浄ステップを繰り返します。
- 上清を捨て、氷の上に氷冷CMF HBSS / FBSと場所をサンプル中の細胞ペレットを再懸濁します。
- 高速セルsorti用の磁気ビーズ濃縮のためのFACS収集/分析または第4項については、セクション3に進みますNG。
3。樹状細胞とマクロファージのマルチカラーフローサイトメトリー分析のための抗体染色
試薬や機器の準備:
- 氷冷PBS CMF。
- 氷冷染色緩衝液(CMF PBS + 5%FBS)。
- LIVE / DEAD修正可能アクア死細胞染色キットを使用して、1:1000希釈で氷冷CMF PBSで染色死細胞を準備します。
- CD45-PerCPで、CD103-PEは、CD11c-APC、MHC-II(IA B)のAlexa Fluor 700、CD11bを以下の蛍光標識モノクローナル抗体(mAb)の氷冷染色バッファーに追加することによって、抗体染色カクテルを準備します。 -eFluor 450 F4/80-PE-Cy7。
- 5 mlのポリスチレン丸底(FACS)チューブに細胞を移す。
- 氷冷CMF PBSで2回細胞を洗浄します。
- 死んだ細胞とインキュベートしたサンプルは、暗所で氷上で15分間染色する。
- 氷冷CMF PBSで2回細胞を洗浄します。
- 氷冷染色で2.4G2anti-FcγRIII/IIで細胞をブロックする氷上で10分間バッファ。
- 氷冷染色緩衝液で細胞を洗浄します。
- 暗闇の中で氷上で20分間、抗体染色のカクテルでサンプルをインキュベートします。
- 回氷冷染色緩衝液で細胞を洗浄し、氷冷染色バッファー400μlのサンプルを再懸濁し、FACSチューブに40μmのフィルターキャップを通過します。
- 第5節、 図1にゲート戦略で定義されているLSR IIフローサイトメーター(BD)のサンプルを取得します。
4。腸からの樹状細胞とマクロファージの濃縮
試薬や機器の準備:
- 氷冷染色緩衝液(CMF PBS + 5%FBS)。
- 製造元の指示に従って、CD11bをおよびCD11c MACSビーズでステップ2.5から得られた単一細胞懸濁液をインキュベートします。
- 遠心分離に続いて氷冷染色緩衝液で細胞を洗浄します。
- 上清を捨て、1mlの氷冷染色バッファーで細胞ペレットを再懸濁40μmのセルストレーナーに続いて100μmのセルストレーナーを通過します。
- MACS LS磁気カラムを用いて、ポジティブセレクションにより磁気ビーズ付着細胞を濃縮。
- ステップ4.2を繰り返し、上清を捨てる。
- 、ステップ3.7で説明表面マーカーモノクローナル抗体で細胞をインキュベートします。
- 氷冷染色緩衝液で2回磁気ビーズ濃縮細胞を洗浄します。アジ化ナトリウムをせずに500μLの氷冷染色バッファーで細胞ペレットを再懸濁し、そしてFACSチューブに40μmのセルストレーナーを通過します。
- 腸のDCおよび/または興味のあるマクロファージサブセットをソートするためにBD ARIA IIセルソーターでソーティングFACSに進みます。
5。 LP APCのためのゲーティング戦略
注 :染色腸の細胞は、正と負の集団を分離するためにゲートの適切な配置を支援するために、ネガティブコントロールとして利用することができるのでご注意ください。
- 図に示すように、1、ドットプロットを作成し、二重のイベントの除外( 図1BおよびC)に続いて染色死細胞( 図1A)のために陽性の細胞を除外します。その後、前方および側方散乱は( 図1D)の残骸を除外することを確認することに応じて目的の細胞のゲート。
- CD45上の別のドットプロットし、さらにゲートを作成して+とIA B +細胞は、表現型APCを特徴づける( 図1E)。
- 独立したドットプロットで、特定のDCおよびマクロファージサブセット(;図1F R1、R2、およびR3)を区別するために、CD11bをおよびCD11c発現について分析します。 R1の細胞は、CD11cはある+ CD11bを鈍い/ -細胞。地域、R2はまた、CD11bを発現し、R1がR2の細胞の細胞のように、これらの細胞はCD11cの表面発現の同様のレベルを持っていることをそのような線引きされています。 -その後、R3領域はCD11bの+と/鈍いのCD11cているセルに指定されています。
- 不定冠詞領域R1、R2、およびそれぞれ、マクロファージやDC集団を区別するために、F4/80とCD103発現のためにR3をさらにalyze。のCD11c + CD11bを鈍い/ - R1急行αEインテグリン高レベルのCD103とF4/80の低レベル( 図1G)の細胞。 CD11bを+のCD11c + R2の細胞がCD103とF4/80( 図1H)彼らの二分式に基づいて樹状細胞やマクロファージの両方で構成されています。最後に、CD11bを+ CD11cは鈍い/ - R3の細胞は、F4/80 +とCD103の表現型のプロファイルに基づいてマクロファージを構成する- ( 図1I)16。
6。代表的な結果
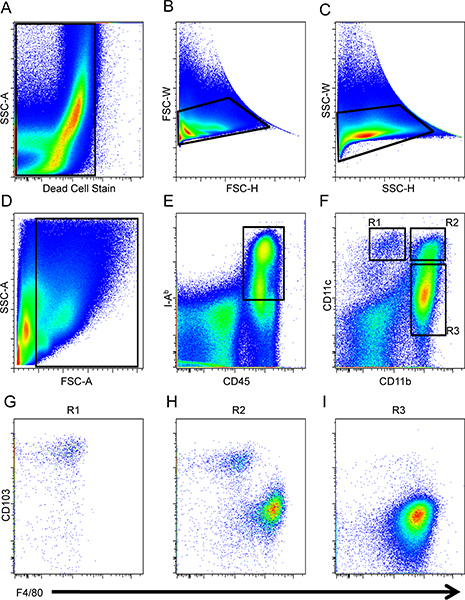
図1。腸の樹状細胞やマクロファージのゲーティング戦略。死細胞(A)とダブレット(BおよびC)は、最初の分析から除外して、小さなintestiた内部の細胞は、転送することがそれに応じてゲートされ、側方散乱(D)と、APCはCD45のように定義されたIA + B +(E)。マクロファージや樹状細胞はCD11bをおよびCD11c(F)の発現により同定した。 R1(G)、R2(H)とR3(I)個体群の事前ゲートセルのCD103とF4/80の発現を解析した。
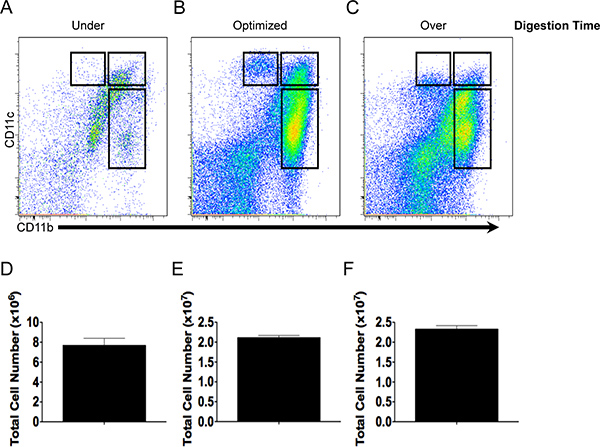
図2。細胞収率と抗体染色の質は消化時間に依存します。CD11bをおよびCD11c染色パターンと下の(A、D)の全細胞収量、最適な-(B、E)以上消化し ます(C、F)腸組織。
腸の細胞は、BD LSR IIのFACSにより分析したC57BL / 6マウス小腸および樹状細胞やマクロファージから単離した。電圧と補償は染色、単一の蛍光色素で染色した脾細胞を使用して設定された。死んだ細胞( 図1A)とダブレットた( 図1BおよびC)は最初から除外された分析。興味のある細胞は、その後に転送するようによると、側方散乱( 図1D)CD45ゲーティングに続いて+とIA B +細胞( 図1E)を分析した。その後、CD11bをおよびCD11cの発現がCD45の間で評価されたIA + bの 3つの領域を(R1、R2、およびR3。図1F)線引きする+細胞。 3地域におけるCD103とF4/80の発現は、それぞれ、樹状細胞やマクロファージを区別するために評価した。のCD11c + CD11bを鈍い/ - R1の細胞は、インテグリンαE、CD103、およびF4/80の低レベル( 図1G)の高いレベルを表明した。 CD11bを+のCD11c + CD11bを+のCD11c /鈍いながらR2の細胞は、CD103とF4/80( 図1H)彼らの二分式に基づいて樹状細胞やマクロファージの両方で構成されていた- R3の細胞はF4 /の表現型プロファイルに基づいてマクロファージを構成する80 +とCD103 - ( 図。 1I)16。 R3ゲートにR2ゲートとマクロファージ内マクロファージは、同様の前方および側方散乱特性を持っているおよびCD11c発現により区別できます。これらのサブセットの機能的な二分法は、完全には理解のままです。
全細胞収量およびCD11bおよびCD11cの発現に及ぼす組織の消化時間の関係を図2に示されています。 3分(下の消化)のために消化し た腸組織は、低総細胞数( 図2D)を得たと特性( 図2A)のために利用できるため、いくつかの樹状細胞やマクロファージ。 11分のための組織消化では、CD11bをおよびCD11cの高レベルで発現した( 図2C)表現型が異なっていた樹状細胞とマクロファージの集団で生きている細胞( 図2E)の堅牢な収量を生産した。対照的に、50分(以上消化)の消化は、同様の細胞収率をもたらした時のCO最適化された消化( 図2E及びF)にmparedしかしながら、CD11bをおよびCD11cを使用して異なる細胞集団の描写( 図2C)CD11cは減少の発現など、よりあいまいになり、死んだ細胞の数は、(データは示さず)増加しました。
ディスカッション
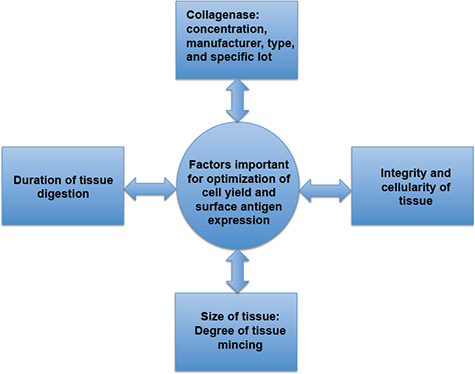
図3。細胞収率と表面抗原の発現を最適化するための重要な要素。細胞収率と表面抗原の発現を直接組織消化の期間に影響される、コラゲナーゼの固有の特性、ミンチ組織の程度、炎症の有無、これは、組織の整合性と細胞性に影響を与える可能性があります。不十分な組織の消化は、分析のための細胞の不足につながるかもしれ?...
開示事項
利害の衝突が宣言されません。
謝辞
We thank Aaron Rae (Emory University Department of Pediatrics and Children's Healthcare of Atlanta Flow Core) for cell sorting. This work was supported by NIH grant AA01787001, a Career Development Award from the Crohn's and Colitis Foundation of America, and an Emory-Egleston Children's Research Center seed grant to T.L.D.
資料
| Name | Company | Catalog Number | Comments |
| 1X PBS, Ca2+- and Mg2+-free | |||
| Hank's balanced salt solution (HBSS) with phenol red | Fisher Scientific | SH3001603 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| 1M HEPES in 0.85% NaCl | Lonza Inc. | 17-737E | |
| Fetal bovine serum (FBS) | Atlanta Biologicals | S11150H | Heat-inactivated |
| 0.5M EDTA (pH 8.0) | Cellgro | 46-034-CI | |
| Collagenase type VIII | Sigma-Aldrich | C2139 | |
| DNase I | Roche Group | 14785000 | Stock solution: 100mg/ml |
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit for 405 nm excitation | Invitrogen | L34957 | Use at 1:1000 |
| CD45-PerCP mAb (30F11) | BD Biosciences | 557235 | Use at 1:100 |
| CD103-PE mAb (M290) | BD Biosciences | 557495 | Use at 1:100 |
| FcγRIII/II mAb (2.4G2) | BD Biosciences | 553141 | Use at 1:200 |
| CD11c-APC mAb (N418) | eBioscience | 17-0114-82 | Use at 1:100 |
| MHC-II (I-Ab)-Alexa Fluor 700 mAb | eBioscience | 56-5321-82 | Use at 1:100 |
| CD11b-eFluor 450 mAb (M1/70) | eBioscience | 48-0112-82 | Use at 1:200 |
| F4/80-PE-Cy7 mAb (BM8) | eBioscience | 25-4801-82 | |
| CD11b microbeads | Miltenyi Biotec | 130-049-601 | |
| CD11c microbeads | Miltenyi Biotec | 130-052-001 | |
| 50 mL conical tubes | BD Biosciences | 352098 | |
| Single mesh wire strainer | Chefmate | ||
| Small weigh boat | Fisher Scientific | 08-732-116 | |
| 100 μm cell strainer | BD Biosciences | 352360 | |
| 40 μm cell strainer | BD Biosciences | 352340 | |
| 5 mL polystyrene round-bottom tubes | BD Biosciences | 352235 | Use at 1:100 |
| MaxQ 4450 benchtop orbital shaker | Thermo Fisher Scientific, Inc. | ||
| LS MACS column | Miltenyi Biotec | 130-042-401 | |
| LSR II | BD Biosciences | ||
| FACSAria II | BD Biosciences |
参考文献
- Maloy, K. J., Powrie, F. Intestinal homeostasis and its breakdown in inflammatory bowel disease. Nature. 474, 298-306 (2011).
- Nagler-Anderson, C., Terhoust, C., Bhan, A. K., Podolsky, D. K. Mucosal antigen presentation and the control of tolerance and immunity. Trends Immunol. 22, 120-122 (2001).
- Abraham, C., Medzhitov, R. Interactions between the host innate immune system and microbes in inflammatory bowel disease. Gastroenterology. 140, 1729-1737 (2011).
- Macdonald, T. T., Monteleone, I., Fantini, M. C., Monteleone, G. Regula tine. Gastroenterology. 140, 1768-1775 (2011).
- Rescigno, M. Intestinal dendritic cells. Adv. Immunol. 107, 109-138 (2010).
- Platt, A. M., Bain, C. C., Bordon, Y., Sester, D. P., Mowat, A. M. An independent subset of TLR expressing CCR2-dependent macrophages promotes colonic inflammation. J. Immunol. 184, 6843-6854 (2010).
- Coombes, J. L., Powrie, F. Dendritic cells in intestinal immune regulation. Nat. Rev. Immunol. 8, 435-446 (2008).
- Kelsall, B. Recent progress in understanding the phenotype and function of intestinal dendritic cells and macrophages. Mucosal Immunol. 1, 460-469 (2008).
- Pulendran, B., Tang, H., Denning, T. L. Division of labor, plasticity, and crosstalk between dendritic cell subsets. Curr. Opin. Immunol. 20, 61-67 (2008).
- Denning, T. L., Wang, Y. C., Patel, S. R., Williams, I. R., Pulendran, B. Lamina propria macrophages and dendritic cells differentially induce regulatory and interleukin 17-producing T cell responses. Nat. Immunol. 8, 1086-1094 (2007).
- Niess, J. H. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science. 307, 254-258 (2005).
- Milling, S. W., Cousins, L., MacPherson, G. G. How do DCs interact with intestinal antigens. Trends Immunol. 26, 349-352 (2005).
- Bilsborough, J., Viney, J. L. Gastrointestinal dendritic cells play a role in immunity, tolerance, and disease. Gastroenterology. 127, 300-309 (2004).
- Stagg, A. J., Hart, A. L., Knight, S. C., Kamm, M. A. The dendritic cell: its role in intestinal inflammation and relationship with gut bacteria. Gut. 52, 1522-1529 (2003).
- Medina-Contreras, O. CX3CR1 regulates intestinal macrophage homeostasis, bacterial translocation, and colitogenic Th17 responses in mice. J. Clin. Invest. 121, 4787-4795 (2011).
- Denning, T. L. Functional Specializations of Intestinal Dendritic Cell and Macrophage Subsets That Control Th17 and Regulatory T Cell Responses Are Dependent on the T Cell/APC Ratio, Source of Mouse Strain, and Regional Localization. J. Immunol. , 187-733 (2011).
- Kim, Y. G. The Nod2 sensor promotes intestinal pathogen eradication via the chemokine CCL2-dependent recruitment of inflammatory monocytes. Immunity. 34, 769-780 (2011).
- Schulz, O. Intestinal CD103+, but not CX3CR1+, antigen sampling cells migrate in lymph and serve classical dendritic cell functions. J. Exp. Med. 206, 3101-3114 (2009).
- Jaensson, E. Small intestinal CD103+ dendritic cells display unique functional properties that are conserved between mice and humans. J. Exp. Med. 205, 2139-2149 (2008).
- Uematsu, S. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5. Nat. Immunol. 9, 769-776 (2008).
- Schenk, M., Bouchon, A., Seibold, F., Mueller, C. TREM-1--expressing intestinal macrophages crucially amplify chronic inflammation in experimental colitis and inflammatory bowel diseases. J. Clin. Invest. 117, 3097-3106 (2007).
- Sun, C. M. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J. Exp. Med. 204, 1775-1785 (2007).
- Kamada, N. Abnormally differentiated subsets of intestinal macrophage play a key role in Th1-dominant chronic colitis through excess production of IL-12 and IL-23 in response to bacteria. J. Immunol. 175, 6900-6908 (2005).
- Denning, T. L. CD4+ Th cells resembling regulatory T cells that inhibit chronic colitis differentiate in the absence of interactions between CD4 and class II MHC. J. Immunol. 171, 2279-2286 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved