Method Article
عالية الإنتاجية تنقية تقارب الموسومة البروتينات المؤتلف
In This Article
Summary
وصفنا طريقة لتنقية تقارب الموسومة البروتينات المؤتلف باستخدام السائل التعامل مع الروبوتات. هذه الطريقة تنطبق بصورة عامة على تنقية الصغيرة من البروتينات القابلة للذوبان صاحب الموسومة في شكل عالية الإنتاجية.
Abstract
البلورات بالأشعة السينية هو الطريقة المفضلة للحصول على عرض تفصيلي لبنية البروتينات. مثل هذه الدراسات تحتاج إلى أن تستكمل التحليلات الكيميائية الحيوية للحصول على مزيد من الأفكار التفصيلية في هيكل / وظيفة العلاقات. التقدم في تكنولوجيا توليف الجينات وقليل النوكليوتيد جعل استراتيجيات الطفرات واسعة النطاق من الممكن أكثر فأكثر، بما في ذلك استبدال بقايا الهدف من جميع الأحماض الأمينية الأخرى 19. مكسب أو خسارة، من بين الظواهر الدالة تسمح ثم لابد من استخلاص استنتاجات منهجية، مثل مساهمة خاصة لمخلفات النشاط التحفيزي الاستقرار البروتين، و / أو البروتين البروتين خصوصية التفاعل.
من أجل أن تنسب الظواهر المختلفة لطبيعة الطفرة - بدلا من تقلب الظروف التجريبية - من المهم جدا لتنقية وتحليل البروتينات بطريقة يمكن التحكم بها وقابلة للتكرار. عالية الإنتاجية واستراتيجيات أتمتة البروتوكولات دليل علىخلقت الروبوتية معالجة السائل منصات الفرص لتنفيذ هذه الإجراءات المعقدة الجزيئية البيولوجية مع تدخل بشري قليلا ومعدلات الخطأ الحد الأدنى من 1-5.
هنا، نقدم طريقة عامة لتنقية البروتينات المؤتلف صاحب الموسومة بطريقة عالية الإنتاجية. في دراسة حديثة، طبقنا هذا الأسلوب لتحقيق هيكل الوظائف مفصلة من TFIIB، وهو مكون من آلات النسخ القاعدية. أمر لا غنى عنه لTFIIB النسخ المروج-الموجهة في المختبر، كما أنها ضرورية لتوظيف بوليميراز RNA إلى مجمع preinitiation 6-8. TFIIB يحتوي على رابط مجال المرنة التي تخترق موقع نشط شق من بوليميريز RNA 9-11. يمنح هذا المجال رابط نشاطين قابلة للقياس الكمي كيميائيا على TFIIB، أي (أنا) وتحفيز للنشاط الحفاز خلال المرحلة 'فاشلة' من بدء النص، و (الثاني) مساهمة إضافية إلىمحددة بوليميريز RNA توظيف في preinitiation معقدة 4،5،12. نحن استغلال طريقة تنقية عالية الإنتاجية لتوليد واحدة، استبدال مزدوجة وثلاثية والحذف الطفرات داخل رابط TFIIB وتحليل في وقت لاحق لهم في المقايسات الفنية للتأثير على تحفيز النشاط التحفيزي للبوليميراز RNA 4. تماما، ونحن ولدت، وتنقية وتحليل طفرات 381 - وهي مهمة كان يمكن أن يكون وقتا طويلا وشاقة لأداء يدويا. أنتجنا ويعاير البروتينات في multiplicates التي سمحت لنا أن نقدر أي اختلافات التجريبية وقدم لنا فكرة واضحة عن تكرار نتائجنا.
هذه الطريقة بمثابة بروتوكول عام لتنقية البروتينات، وصاحب الموسومة وقد استخدم بنجاح لتنقية البروتينات المؤتلف أخرى. هو الأمثل حاليا هو لتنقية البروتينات من 24 ولكن يمكن تكييفها لتنقية البروتينات تصل إلى 96.
Protocol
PART A: عالي الإنتاجية نمو الثقافات البكتيرية.
1. تنمو البكتيريا بين عشية وضحاها في 2 مل من متوسطة Autoinduction باستخدام 24 لوحات جيدة
- Sterilise لوحات 24 جيد من قبل الميكروويف.
- تطعيم 1.5 مل من المتوسط autoinduction (بين عشية وضحاها اكسبرس متوسطة) مع المستعمرات البكتيرية نمت حديثا أو الجلسرين الأسهم المجمدة. ونحن عادة تطعيم ثلاثة آبار في المستعمرات الفردية متحولة مع 3 المستنسخة. الاحتياطي ستة آبار لعناصر إيجابية وسلبية. لعناصر إيجابية نكبر استنساخ wildtype الثلاثة وللضوابط السلبية نحن في استنساخ بنسبة 2 التي تم تحويلها مع البلازميد غير التعبير عن. تحقق من وجود التعقيم الكافي لوحة من ترك واحدة فارغة تماما لسيطرة المتوسطة فقط.
- تنمو الخلايا لمدة 18 ساعة عند 37 درجة مئوية وتهتز في 250 دورة في الدقيقة. نستخدم لاك محرض BL21 (DE3) رشيد 2 الخلايا. Autoinduction المتوسطة يحتوي على خليط من الجلوكوز واللاكتوز. البكتيريا في البدايةتتغذى على السكر ومن ثم البدء في استخدام اللاكتوز، والذي يدفع أيضا التعبير عن البروتينات المؤتلف.
- إزالة الغطاء ووضع لوحة على منصة الروبوتية.
B PART: تنقية البروتينات المؤتلف من الروبوتية.
2. إعداد منهاج الروبوتية
تشكل العازلة يغسل ملي تتكون من إيميدازول 20، 0.1٪ تريتون X-100، 0.5 M كلوريد الصوديوم، و 20 ملي تريس، خلات، ودرجة الحموضة 7.9، 10 ملي MgOAc 2، 0.7 مم ZnOAc 2، الجلسرين 10٪، وشطف العازلة التي تتكون من الاميدازول M 0.5، 0.1٪ تريتون X-100، 0.5 M كلوريد الصوديوم، و 20 ملي تريس، خلات، ودرجة الحموضة 7.9، 10 ملي MgOAc 2، 0.7 مم ZnOAc 2، الجلسرين 10٪. وسوف تستخدم هذه المخازن المؤقتة لغسل حبات بعد أن تم ملزمة البروتينات الموسومة لهم، أو أزل إلى البروتينات من الخرز، على التوالي.
- تشكل مخفف البكتيرية (100 مل ماء مقطر مع 15 ميكرولتر كاشف مضاد الرغوة). وسيتم استخدام هذا الحللجعل التخفيفات الثقافات البكتيرية ليلة وضحاها لكثافة بصرية (A600) القياسات. وجود مضاد الرغوة في مخفف يمنع تشكيل فقاعات الهواء التي من شأنها أن تتداخل مع قارئ لوحة القياسات.
- تشكل الحل يتكون من تحلل كاشف FastBreak 10X، 2 ميكرولتر لكل عينة lysonase و15 مم MgOAc 2. FastBreak يحتوي على مزيج من المنظفات والأملاح التي كسر جدران الخلايا البكتيرية وتسهيل الإفراج عن البروتينات داخل الخلايا. Lysonase هي مزيج من الملكية والليزوزيم نوكلياز أ. الليزوزيم يساعد في تعطيل جدار الخلية ويساعد على هضم نوكلياز صدر الأحماض النووية البكتيرية.
- اختياري: مستحضرات لمدة 6 هيدروكلوريد الجوانيدين M الحل. بعض البروتينات المؤتلف تميل إلى التمسك الإبر تفلون المغلفة pipetting. الحل هيدروكلوريد الجوانيدين يبدل طبيعة البروتينات ويغسل لهم قبالة على نحو أكثر فعالية من الماء الذي يستخدم بشكل روتيني لشطف قابل للغسل الروبوتية نصائح pipetting بعد كل شارعالجيش الشعبي.
- إعداد الكميات BCA البروتين (حمض bicinchoninic) كاشف عن طريق خلط محلول حمض bicinchoninic (كاشف A) والحل كبريتات النحاس (كاشف B): السندات الببتيد النحاس 2 + تقليل من العنصر 4 كبريتات النحاس الموجودة في الكاشف BCA إلى النحاس حيث 1 + كمية النحاس 1 + يتناسب مع عدد من السندات الببتيد موجودة في الحل. في الخطوة الثانية، اثنين من جزيئات حمض bicinchoninic كلاب النحاس 1 + مما أدى إلى تحول الامتصاصية نانومتر إلى 562، مما أدى إلى اللون الأرجواني. رد الفعل هو اللون المعتمدة على الزمن ويحتاج عادة إلى عدة ساعات تكون نهائية. بعد أن لون ثابت لمدة عدة ساعات.
- ملء أحواض أو لوحات من الحجم الصحيح ووضعها في مواضعها المخصصة مسبقا على منصة الروبوتية.
- مكان واحد 24 لوحة جيدا للنفايات هيدروكلوريد الجوانيدين، واثنين من لوحات واضحة بشكل جيد ل96-OD 600 و قياسات الامتصاصية واحدة زرقاء 96-جيدا لوحة اله تنقية البروتينات على مواقعهم على المنصة. مكان واحد 96-deepwell لوحة على الوقوف المغناطيسي.
- تمييع MagneHis ني جزيئات البروتينات التي تربط عن طريق تشكيل يخلب به مع صاحب-5-بهم أضعاف في الماء المقطر وملئها في وحدة حبة التحريك. تبديل النمام على الحفاظ على حبات في التعليق.
- التبديل على منصة الروبوتية ومسح الإبر pipetting لعدة دقائق لإزالة فقاعات الهواء التي قد تعترض مع دقة pipetting. يتم مسح الإبر pipetting إعادة استخدامها في الخطوات بين pipetting الفردية. وبدلا من ذلك، يمكن أن تستخدم نصائح التخلص منها. يتم تنفيذ جميع الخطوات اللاحقة من آليا. بروتوكول الروبوتية عند الطلب.
3. يتم فحص نمو الخلايا عن طريق قياس OD600
- يتم تخفيف 10 ميكرولتر من الثقافة بين عشية وضحاها في 90 ميكرولتر من محلول مخفف.
- قياس OD 600 إلى التأكد من أن البكتيريا قد نمت لكثافة مماثلة(الشكل 1).
4. يتم تقسيم الخلايا حتى حرر البروتينات والسماح لحبة ملزم
- وتوزيع 100 ميكرولتر من التعليق المغناطيسي ني حبة في كل بئر من لوحة جيدا 24 ثانية.
- يتم نقل 900 ميكرولتر من كل ثقافة على نطاق صغير في لوحة البكتيرية 24 جيد يحتوي على الخرز. إضافة 100 ميكرولتر من مزيج FastBreak / lysonase 10X.
- يتم نقل 24 لوحة جيدا إلى منصة تهتز لزعزعة السريع (800 دورة في الدقيقة) لمدة 30 دقيقة في درجة حرارة الغرفة. تتعطل جدران الخلايا البكتيرية من خلال مزيج من القوات الميكانيكية والكيميائية والعمل يتم الإفراج عن البروتينات المنتجة recombinantly إلى الحل. مع تقارب به على الفور أنها تربط حبات النيكل ممغطس مخلبية.
5. تغسل حبات
- يتم نقل الخلايا التي تحتوي على الخرز لست] معلق المغناطيسي لوحة 96-deepwell التي يتم وضع على حامل مع مagnetic قضبان تلك الشريحة بين الآبار. لوحات 96-جيدا قد حصلت على مربع مخروطية الشكل السفلي والذي يسمح أسهل إزالة طاف. يمكن للآبار عقد كميات تصل إلى 2.1 مل ولكن تمتلئ أحجام أصغر بكثير. هذا يمكننا من أداء قوي يهز الخطوات دون عينة عبر تلوث الرش.
- تغسل نصائح ماصة بين الفرد الخطوات pipetting مع 6 M الجوانيدين، حمض الهيدروكلوريك. هذه الخطوة هو أمر حاسم لتنقية TFIIB و "مثبت" البروتينات الأخرى لتجنب انتقال التلوث. مع بروتينات أخرى قد تكون كافية لشطف بالماء على نطاق واسع الإبر بين الخطوات pipetting.
- قضبان المغناطيسي للموقف المغناطيسي جذب الخرز ممغطس، وسحب بها بعيدا عن مراكز الآبار والسماح للالإبر pipetting حرية الوصول إلى طاف. يتم تجاهل طاف.
- يضاف 500 الأولى ميكرولتر من العازلة غسل لوحة 24 جيدا ونقل فيما بعد إلى لوحة 96-جيدا لهnsure نقل كامل من الخرز. تتم إزالة لوحة 24 أيضا من شاكر.
- يضاف آخر ميكرولتر 500 من العازلة يغسل مباشرة إلى اللوحة 96-حسنا، يتم نقل لوحة إلى شاكر واهتزت بقوة لمدة 1 دقيقة. تم نقل لوحة إلى موقف المغناطيسي وتجاهل العازلة يغسل.
- ويتكرر هذه الخطوة مرتين وانتهاء الإجراء عن طريق إزالة أي غسل بقايا من لوحة العازلة.
6. أزل البروتينات في الاحتياطي شطف
- وإضافة 100 ميكرولتر من العازلة للشطف الخرز، ويتم نقل لوحة إلى شاكر واهتزت بقوة لمدة 30 دقيقة في درجة حرارة الغرفة.
- تم نقل لوحة إلى شاكر وشطافة، والتي تحتوي على البروتين المنقى المؤتلف، يتم نقلها إلى لوحة جديدة.
7. قياس تركيزات البروتينات تنقية
- يتم نقل 190 ميكرولتر من مزيج كاشف BCA إلى لوحة 96-جيدا واضحة و10 ميكرولتر من برووأضاف TEIN الحل.
- بعد عدة ساعات من الحضانة (5-6 عادة أو بين عشية وضحاها)، وقياس الامتصاصية وذلك لمقارنة المعايير BSA لتحديد تركيزات كل من البروتين النقي التحضيرات (الشكل 2).
- ويمكن الآن لتنقية البروتينات يمكن استخدامها لتطبيقات المصب في تركيزات المناسب (الشكل 3).
8. ممثل النتائج
بروتوكول تنقية يقدم مرحلتين مراقبة الجودة، والأمثلة التي تظهر. ونحن قادرون على تحديد وتوثيق المشاكل المحتملة في مرحلة نمو البكتيريا (الشكل 1) في وقت لاحق وعلى تقييم عوائد من البروتينات المطهرون (الشكل 2). نحن تنقية البروتينات عادة واختبارها في ثلاث نسخ. هذا، جنبا الى جنب مع الخطوات مراقبة الجودة اثنين، يعطينا الثقة في أن أي تغيير لاحظنا في المقايسات الفنية لدينا هي نتيجة لphenotyp متحولةه (الشكل 3) وليس بسبب الاختلافات التجريبية أو التنقيات الفاشلة. الحصول على عوائد تتراوح عادة 50 حتي 200 ميكروغرام وأكثر من كافية لفحوصات الفنية المختلفة.

الشكل 1. الرسم البياني القياسات OD من 24 لوحة جيدا مع الثقافات بين عشية وضحاها. قد نمت الحيوانات المستنسخة ثلاثة من المتغيرات 6 متحولة TFIIB وكذلك من TFIIB wildtype. استنساخ اثنين من يحمل البلازميد غير التعبير عن وبئر مع المتوسط إلا أن تكون بمثابة الضوابط السلبية. القياسات OD تبين أن هناك اختلافات صغيرة في معدلات النمو بين الثقافات الفردية.
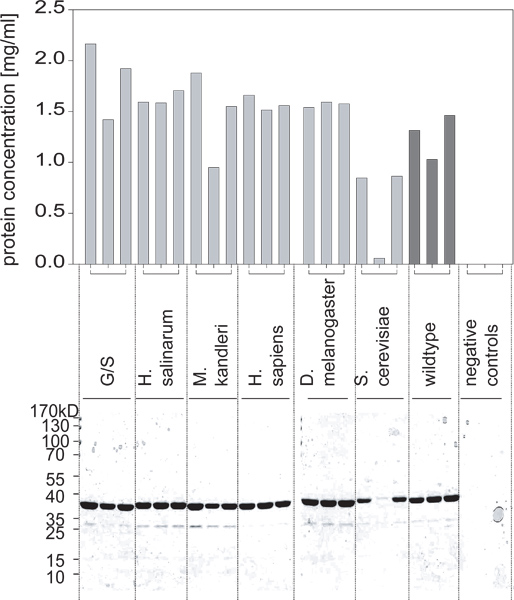
الشكل 2. غلة البروتين الحصول عليها من هذه الثقافات على النحو الذي يحدده الفحص BCA وأكدته PAGE SDS. لا يتم التعبير عن واحدة من المتغيرات عند مستويات مرتفعة. كوم فيbination مع الشكل 1، يمكننا أن نستنتج أن هذا لم يكن بسبب نمو الخلايا الفرق ولكن نظرا لعدم التعبير البروتين الناجم بشكل صحيح.

الشكل 3. نتيجة ممثلا لفحص النسخ. قمنا بقياس نشاط التحفيز من المتغيرات TFIIB على إنتاج النصوص فاشلة صغيرة من RNAP. هنا، تظهر آثار تحفيز مكتبة كاملة من الأحماض الأمينية واحد من بدائل بقايا TFIIB K87. وأكد على درجة عالية من تكرار الخطأ بنسب صغيرة. ويصور A جل عينة تبين أداء ثلاث طفرات بالمقارنة مع الضوابط wildtype، (WT) السلبية (NC) وشطف العازلة لا يسيطر سوى على تحتها.
Discussion
وتنقية البروتين المؤتلف الآلي الطريقة الموضحة هنا يسمح للإنتاج وتنقية لعدد كبير من البروتينات الطافرة في شكل صغير الحجم للغاية في ظل ظروف استنساخه مع الحد الأدنى من التدخل البشري. الشكلان 1 و 2 من النتائج عرض منهجية ضوابط الجودة وأمثلة من تنقية البروتينات. الشكل 3 يبين أن عوامل النسخ تنقية المستخدمة في هذا المثال تنفيذ استنساخه بطريقة غاية في المقايسات الفنية.
على الرغم من وضعت إجراءات لتنقية TFIIB archaeal، فإنه ينطبق على نطاق واسع لتنقية البروتينات تقارب الموسومة. فإن استخدام مثل هذه البروتوكولات تنقية الآلي مما يسهل كثيرا من التحليل الكيميائية الحيوية للبروتينات المؤتلف وسيعزز بالتالي من فهمنا للبروتين البروتين التفاعلات على نطاق ويصعب تحقيق يدويا.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل على منحة المشروع ويلكوم (078043/Z/05/Z) لROJW
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | التعليقات (اختياري) |
| بين عشية وضحاها اكسبرس متوسطة TB الفوري | ميرك كيماويات المحدودة | 71491-4 | |
| FastBreak | Promega المحدودة | V8573 | |
| Lysonase الكاشف التجهيز البيولوجي / 1 مل | ميرك كيماويات المحدودة | 71230 | |
| مضاد الرغوة 204 | سيغما الدريخ المحدودة | A6426 | |
| MagneHis ني الجسيمات | Promega | V8565 | |
| إيميدازول | سيغما الدريخ المحدودة | 56750 | |
| Trizma قاعدة | سيغما الدريخ شركاتأي المحدودة | 93362 | |
| كلوريد الصوديوم | VWR | 27810.295 | |
| Bicinchoninic تقرير حمض البروتين | سيغما الدريخ المحدودة | BCA1-1KT | |
| بئر عميقة لوحة 2،2 مل ساحة ويلز PP pk10 | Anachem المحدودة | 1810-1800 | |
| صفيحة ميكروسكوبية MicroWell 96 البوليسترين مسطحة القاع جيدا لم يعالج 12 كم من لوحات واضحة 5 0.4 مم 128 مل حجم 86 ملم X جيدا الحرارية العلمية نونك | فيشر العلمية المحدودة | DIS-984-090M | |
| صفيحة ميكروسكوبية الأزرق | VWR | NUNC367001 | |
| 24-RB حسنا كتل (24) | QIAGEN | 19583 | |
| الجوانيدين هيدروكلوريد | VWR | ALFAA13543.0B | |
| قابل للغسل إبرة لTheOnyx | Aviso شركة محدودة | 8152-317001 | |
| الرف كاشف لالخرز المغناطيسي | Aviso شركة محدودة | 8152-035003 | |
| لوحة قارئ التآزر HT | بيوتيك | 4200-000043 | |
| الروبوتية منهاج TheOnyx 44OH/150/100 | Aviso شركة محدودة | 8145-050046 | |
| صفيحة ميكروسكوبية شاكر Variomag Teleshaker | Inheco | 3800047 | |
| 96-A جيدا نوع المغناطيس | QIAGEN | 36915 |
References
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40(2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , Forthcoming (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved