Method Article
High-throughput Reinigung von Affinity-markierter rekombinanter Proteine
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Verfahren zur affinitätsmarkiert Reinigung von rekombinanten Proteinen unter Verwendung Probenbehandlungstafel Robotik. Dieses Verfahren ist allgemein anwendbar auf die kleinteilige Reinigung von löslichen Proteinen mit His-Tag in einem Hochdurchsatz-Format.
Zusammenfassung
Röntgenkristallographie ist das Verfahren der Wahl, um eine detaillierte Ansicht der Struktur der Proteine. Solche Studien müssen durch weitere biochemische Analysen ergänzt werden, um detaillierte Einblicke in Struktur / Wirkungs-Beziehungen zu erhalten. Advances in Oligonukleotid-und Gen-Synthese-Technologie macht großen Mutagenesestrategien zunehmend möglich, einschließlich der Substitution von Ziel-Rückstände von allen 19 anderen Aminosäuren. Gewinn-oder Verlust-of-function Phänotypen dann erlauben systematische Schlussfolgerungen gezogen werden, wie der Beitrag von besonderer Rückstände katalytische Aktivität, Stabilität des Proteins und / oder Protein-Protein-Wechselwirkung Spezifität.
Um die unterschiedlichen Phänotypen der Natur der Mutation zuschreiben - anstatt auf schwankende Versuchsbedingungen - es unerlässlich ist, zu reinigen und zu analysieren, die Proteine in einer kontrollierten und reproduzierbaren Weise. High-throughput-Strategien und die Automatisierung von manuellen Protokolle aufRoboter-Liquid-Handling-Plattformen Möglichkeiten, solche komplexen molekularbiologischen Verfahren mit wenig menschliches Eingreifen und minimale Fehlerraten 1-5 durchzuführen erstellt.
Wir beschreiben hier ein allgemeines Verfahren für die Reinigung von His-markierten rekombinanten Proteinen in einem High-Throughput Weise. In einer neueren Studie, verwendeten wir diese Methode, um eine detaillierte Struktur-Funktions-Untersuchung TFIIB, eine Komponente der basalen Transkription Maschinen. TFIIB für Promotor-gerichtete Transkription in vitro unverzichtbar und ist essentiell für die Rekrutierung der RNA-Polymerase in eine Präinitiationskomplexes 6-8. TFIIB enthält einen flexiblen Linker-Domäne, die die aktive Stelle von RNA-Polymerase 9-11 Spalt eindringt. Diese Linker-Domäne verleiht zwei biochemisch quantifizierbare Aktivitäten auf TFIIB, nämlich (i) die Stimulation der katalytischen Aktivität während der "gescheiterten" Stadium der Niederschrift Initiation, und (ii) ein zusätzlicher Beitrag zurspezifische Rekrutierung der RNA-Polymerase in den Präinitiationskomplexes 4,5,12. Wir nutzten die High-Throughput-Reinigungsverfahren, um Einzel-, Doppel-und Dreifach-Substitution und Löschungen Mutationen innerhalb des TFIIB Linker zu erzeugen und anschließend analysiert werden können in funktionellen Assays für ihre Reizwirkung auf die katalytische Aktivität der RNA-Polymerase 4. Insgesamt erzeugt wir, gereinigt und analysiert 381 Mutanten - eine Aufgabe, die schon zeitaufwendig und mühsam manuell durchzuführen hätte. Wir produziert und untersucht die Proteine in multiplicates, die uns irgendwelche experimentellen Variationen schätzen dürfen und gab uns eine klare Vorstellung von der Reproduzierbarkeit der Ergebnisse.
Diese Methode dient als generisches Protokoll für die Reinigung von His-markierten Proteinen und wurde erfolgreich verwendet, um andere rekombinante Proteine zu reinigen. Es wird derzeit für die Reinigung von Proteinen optimiert 24 kann aber angepasst ist, um bis zu 96 Proteine zu reinigen.
Protokoll
TEIL A: High-throughput Wachstum von Bakterienkulturen.
Ein. Bakterien wachsen Übernachtung in 2 ml Autoinduktion Medium mit 24-well Platten
- Sterilisieren die 24-Well-Platten durch Mikrowelle.
- Beimpfen 1,5 ml Autoinduktion Medium (Overnight Express Medium) mit frisch gewachsenen Bakterienkolonien oder gefroren Glycerin Aktien. Wir normalerweise impfen drei Vertiefungen pro Mutante mit drei einzelnen geklonten Kolonien. Reserve sechs Vertiefungen für positive und negative Kontrollen. Für den positiven Kontrollen wir aufwachsen drei Wildtyp-Klonen und für den negativen Kontrollen wir aufwachsen 2 Klone, die mit einem nicht-exprimierenden Plasmid transformiert wurden. Achten Sie auf ausreichende Sterilisation der Platte, indem Sie ein gut Zuschnitt für die mittel-only Kontrolle.
- Wachsen die Zellen für 18 Stunden bei 37 ° C und unter Schütteln bei 250 Upm. Wir verwenden lac-induzierbaren BL21 (DE3) Rosetta 2-Zellen. Autoinduktion Medium eine Mischung aus Glucose und Lactose. Die Bakterien zunächsternähren Glukose und dann beginnen, Laktose, die auch induziert die Expression der rekombinanten Proteine zu verwenden.
- Entfernen Sie den Deckel und legen Sie die Platte auf der Roboter-Plattform.
TEIL B: Robotic Aufreinigung von rekombinanten Proteinen.
2. Bereiten Sie die Robotic Platform
Bilden die Waschpuffer, bestehend aus 20 mM Imidazol, 0.1% Triton X-100, 0,5 M NaCl, 20 mM Tris-Acetat, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, 10% Glycerin, und der Elutionspuffer, bestehend 0,5 M Imidazol, 0.1% Triton X-100, 0,5 M NaCl, 20 mM Tris-Acetat, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, 10% Glycerol. Diese Puffer wird verwendet, um die Perlen zu waschen, nachdem die markierten Proteine, um sie gebunden worden sein, oder, um die Proteine von den Kügelchen eluiert bzw. werden.
- Make-up die bakterielle Verdünnungsmittel (100 ml destilliertem Wasser mit 15 ul Entschäumer Reagenz). Diese Lösung wird verwendetVerdünnungen der bakteriellen Übernacht-Kulturen für die optische Dichte (A600) Messungen durchzuführen. Die Anwesenheit von Antischaummittel in dem Verdünnungsmittel verhindert die Bildung von Luftblasen, die mit den Plattenleser Messungen stören würde.
- Make-up die Lyse-Lösung, bestehend aus 10x FastBreak Reagenz, 2 ul lysonase pro Probe und 15 mM MgOAc 2. FastBreak enthält eine Mischung aus Reinigungsmittel und Salze, die die bakterielle Zellwände brechen und erleichtern die Freisetzung von intrazellulären Proteinen. Lysonase ist eine proprietäre Mischung aus Lysozym und einer Nuclease. Lysozym hilft bei Aufbrechen der Zellwand und der Nuklease verdaut die Freigabe bakteriellen Nukleinsäuren.
- Optional: Stellen Sie eine 6 M Guanidin-Hydrochlorid-Lösung. Einige rekombinante Proteine neigen dazu, den Teflon-beschichteten Pipettiernadeln kleben. Die Guanidin-Hydrochlorid-Lösung denaturiert Proteine und wäscht sie ab effektiver als Wasser, die routinemäßig verwendet wird, um die waschbare Roboter Pipettenspitzen gründlich nach jeder Rundeep.
- Vorbereiten des BCA (Bicinchoninsäure) Proteinquantifizierung Reagenz durch Mischen Bicinchoninsäure Lösung (Reaktionsmittel A) und dem Kupfersulfatlösung (Reagenz B): Peptid-Bindungen zu reduzieren Cu 2 + von dem CuSO 4 Komponente in dem BCA-Reagens zu Cu 1 + wobei die Menge an Cu 1 + ist proportional der Zahl der Peptidbindungen in der Lösung vorliegen. In einem zweiten Schritt, zwei Moleküle Bicinchoninsäure Chelat Cu 1 +, was zu einer Verschiebung Absorption bis 562 nm, was eine violette Farbe. Die Farbreaktion ist zeitabhängig und muss in der Regel mehrere Stunden, um endgültig. Danach ist die Farbe für mehrere Stunden stabil.
- Füllen Mulden oder Platten in der richtigen Größe und legen Sie sie in ihrer vorab zugewiesene Positionen auf der Roboter-Plattform.
- Stellen Sie einen 24-Well-Platte für die Guanidinhydrochlorid Abfälle zwei klaren 96-Well-Platten für OD 600 und Extinktionsmessungen und einem blauen 96-Well-Platte für the gereinigte Proteine auf ihren Positionen auf der Plattform. Legen Sie eine 96-Deepwell Platte auf dem Magnetfuß.
- Verdünnte MagneHis Ni-Teilchen, die durch Bilden Proteine binden Chelate mit ihren His-Tags 5-fach mit destilliertem Wasser und füllt sie in die Wulst-Rührwerk. Schalten Sie den Rührer auf die Perlen in der Schwebe zu halten.
- Schalten Sie den Roboter-Plattform und bündig die Pipettiernadeln für einige Minuten, um Luftblasen, die sonst mit dem Pipettiergenauigkeit stören würden entfernen. Die wieder verwendbaren Pipettieren Nadeln zwischen einzelnen Pipettierschritte gespült. Alternativ könnte Einwegpipetten verwendet werden. Alle weiteren Schritte werden maschinell durchgeführt. Die Roboter-Protokoll ist auf Anfrage erhältlich.
3. Zellwachstum durch Messung der OD600 überprüft
- 10 ul-Nacht-Kultur wird in 90 ul Verdünnungsmittel verdünnt.
- Messung der OD 600 um sicherzustellen, dass die Bakterien auf ähnliche Dichten herangewachsen(Abbildung 1).
4. Die Zellen werden die Proteine lösen und auf Zulassen gebrochener Wulst-binding
- 100 ul magnetischen Ni-Kügelchen-Suspension wird in jede Vertiefung einer zweiten Platte mit 24 Vertiefungen verteilt.
- 900 ul jeder kleinräumige Bakterienkultur wird in die 24-Well-Platte mit den Kügelchen überführt. Fügen Sie 100 ul der 10x FastBreak / lysonase Mix.
- Die 24-Well-Platte ist an der Schüttelplattform für schnelle Schütteln (800 UpM) für 30 Minuten bei Raumtemperatur überführt. Bakterielle Zellwände werden durch eine Kombination von mechanischen Kräften und chemische Wirkung und die rekombinant hergestellten Proteine werden in die Lösung freigesetzt gestört. Mit ihrer Affinitätstags sie sofort binden die paramagnetische Chelat Nickel Perlen.
5. Die Beads werden gewaschen
- Die Zell-Lysate mit den resuspendierten magnetischen Kügelchen werden auf eine 96-Deepwell Platte, die auf einem Ständer mit m positioniert übertragenagnetische Stangen, die Folie zwischen den Brunnen. Die 96-well-Platten haben eine quadratische kegelförmigen Boden aufweist leichtere Entfernung des Überstandes erlaubt. Die Brunnen können Volumina von bis zu 2,1 ml zu halten, aber mit viel kleineren Volumen gefüllt. Dies ermöglicht uns, kräftiges Schütteln Schritte ohne Probe Kreuzkontamination durch Spritzwasser durchzuführen.
- Die Pipettenspitzen werden zwischen einzelnen Pipettierschritte mit 6 M Guanidin-HCl gewaschen. Dieser Schritt ist entscheidend für die Reinigung von TFIIB und andere "sticky"-Proteine, um eine Kreuzkontamination zu vermeiden. Mit anderen Proteinen kann es ausreichend sein, um die Nadeln ausgiebig mit Wasser abspülen zwischen den Pipettierschritte.
- Die magnetischen Stäben des magnetischen Stand locken die paramagnetische Kügelchen, ziehen sie weg von den Zentren der Brunnen und ermöglichen dem Pipettiernadeln freien Zugang zu den Überstand. Der Überstand wird verworfen.
- 500 ul Waschpuffer wird zuerst auf die 24-Well-Platte gegeben und anschließend an den 96-Well-Platte überführt, um ENsure die vollständige Übertragung der Kügelchen. Die 24-Well-Platte ist aus der Schüttler entfernt.
- Weitere 500 ul Waschpuffer direkt mit dem 96-Well-Platte zugesetzt, wird die Platte auf dem Schüttler überführt und für 1 min kräftig geschüttelt. Die Platte wird zurück in den magnetischen Ständer bewegt und der Waschpuffer verworfen.
- Dieser Schritt wird zweimal wiederholt und das Waschvorgang wird durch Entfernen keine Puffer Überbleibsel aus der Platte fertig.
6. Eluieren die Proteine in Elutionspuffer
- 100 ul Elutionspuffer zu den Kügelchen zugegeben wird, wird die Platte auf dem Schüttler bewegt und kräftig für 30 min bei Raumtemperatur geschüttelt.
- Die Platte zurück zu dem Schüttler und das Eluat bewegt, die das gereinigte rekombinante Protein, wird in eine neue Platte übertragen.
7. Messung der Konzentrationen des gereinigten Proteinen
- 190 ul der BCA Reagenzienmix wird zu einer deutlichen 96-well-Platte transferiert und 10 ul der ProProtein-Lösung zugegeben.
- Nach mehreren Stunden Inkubation (typischerweise 5-6 oder über Nacht), die Extinktion und vergleicht sie mit BSA-Standards, um die Konzentrationen von jedem der gereinigten Protein Zubereitungen (Abbildung 2) zu bestimmen.
- Die gereinigten Proteine können nun für Downstream-Anwendungen in den entsprechenden Konzentrationen (Abbildung 3) verwendet werden.
8. Repräsentative Ergebnisse
Die Reinigung Protokoll bietet zwei Qualitätskontrolle Stufen, von denen Beispiele gezeigt. Wir sind in der Lage zu erkennen und zu dokumentieren mögliche Probleme bei der bakteriellen Wachstumsphase (Abbildung 1) und später auf die Beurteilung der Erträge des gereinigten Proteinen (Abbildung 2). Wir in der Regel zu reinigen Proteine und testen sie in dreifacher Ausfertigung. Dies, in Kombination mit den beiden Qualitätskontrolle Schritte, gibt uns Vertrauen, dass jegliche Variation in unserem funktionellen Assays beobachtet aufgrund des mutierten Phänotyp sinde (Abbildung 3) und nicht durch experimentelle Variationen oder fehlgeschlagene Reinigungen verursacht. Die Ausbeuten liegen typischerweise im Bereich von 50 bis 200 ug und sind mehr als ausreichend für verschiedene funktionelle Assays.

Abbildung 1. Histogramm der OD Messungen eines 24-Well-Platte mit Übernachtkulturen. Drei Klone sechs TFIIB mutierten Varianten sowie des Wildtyp TFIIB angezogen worden sind. Zwei Klone Durchführung einer nicht-exprimierenden Plasmid und ein gut mit Medium nur als negative Kontrollen dienen. Die OD-Messungen zeigen, dass es kleine Abweichungen in den Wachstumsraten zwischen den einzelnen Kulturen.
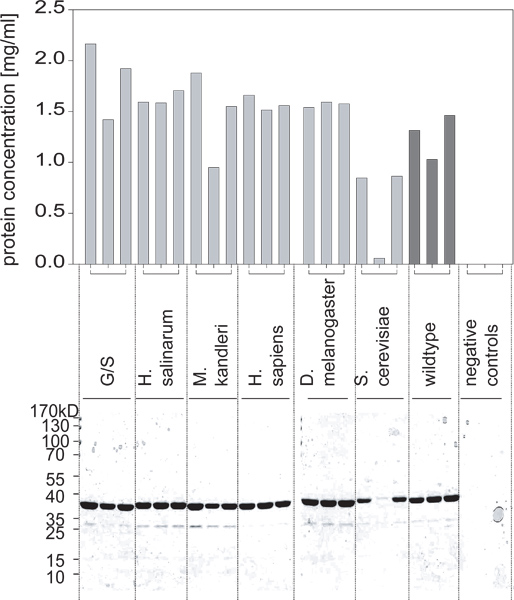
Abbildung 2. Proteinausbeuten aus diesen Kulturen erhalten, wie durch einen BCA-Test bestimmt und bestätigt durch SDS-PAGE. Eine der Varianten ist nicht auf hohem Niveau exprimiert. In comKombination mit Abbildung 1, können wir schließen, dass dies nicht durch einen differenziellen Zellwachstum aber aufgrund Proteinexpression nicht ordnungsgemäß induziert.

Abbildung 3. Repräsentatives Ergebnis einer Transkription Assay. Wir maßen die Stimulation Aktivität TFIIB Varianten auf die Produktion von kleinen abortive Transkripte durch RNAP. Hier werden die Reizwirkungen einer vollständigen Sammlung von ein Aminosäuresubstitutionen TFIIB Rückstände K87 gezeigt. Die hohe Reproduzierbarkeit wird durch kleine Fehlerrate bestätigt. Eine Probe Gel der die Leistung von drei Mutanten zu Wildtyp (wt), Negativkontrollen (NC) und Elutionspuffer Vergleich steuert nur unterhalb dargestellt.
Diskussion
Das automatisierte rekombinanten Proteinreinigung hier beschriebene Verfahren erlaubt die Herstellung und Reinigung einer Vielzahl von mutierten Proteinen in einer kleinen Format unter hoch reproduzierbaren Bedingungen mit minimaler menschlicher Eingriff. Abbildungen 1 und 2 zeigen die Ergebnisse systematischer Qualität-Steuerelemente und Beispiele für die gereinigte Proteine. Abbildung 3 zeigt, dass die gereinigten Transkriptionsfaktoren in diesem Beispiel verwendet in einem hoch reproduzierbar in funktionellen Assays durchzuführen.
Auch wenn das Verfahren zur Reinigung von archaealen TFIIB entwickelt wurde, ist es allgemein anwendbar zur Reinigung von Affinitäts-markierten Proteinen. Die Verwendung eines solchen automatisierten Aufreinigungsprotokolle wird also wesentlich erleichtert die biochemische Analyse von rekombinanten Proteinen und wird somit unser Verständnis von Protein-Protein-Wechselwirkungen auf einer Skala, die schwierig zu erreichen ist manuell.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde durch ein Wellcome Project Grant (078043/Z/05/Z) an ROJW unterstützt
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Overnight Express Sofortige TB Medium | Merck Chemicals Ltd | 71491-4 | |
| Fastbreak | Promega GmbH | V8573 | |
| Lysonase Bioprocessing Reagent / 1 ml | Merck Chemicals Ltd | 71230 | |
| Antifoam 204 | Sigma-Aldrich Company Ltd | A6426 | |
| MagneHis Ni-Partikel | Promega | V8565 | |
| Imidazol | Sigma-Aldrich Company Ltd | 56750 | |
| Trizma Basis | Sigma-Aldrich Compjede Ltd | 93362 | |
| NaCl | VWR | 27810.295 | |
| Bicinchoninsäure Proteinbestimmung | Sigma-Aldrich Company Ltd | BCA1-1KT | |
| Deep Well Platte 2,2 ml Platz Wells PP PK10 | Anachem Ltd | 1810-00 | |
| Microplate MicroWell 96 well Flachboden Polystyrol nicht 12 Hülsen von 5 Platten klar 0,4 ml Wellvolumen 128 mm x 86 mm Thermo Scientific Nunc behandelt | Fisher Scientific Ltd | DIS-984-090M | |
| Microplate Blau | VWR | NUNC367001 | |
| 24-Well Blocks RB (24) | Qiagen | 19583 | |
| Guanidinhydrochlorid | VWR | ALFAA13543.0B | |
| Waschbar Nadel für TheOnyx | Aviso GmbH | 8152-317001 | |
| Reagent Rack für Magnetic Beads | Aviso GmbH | 8152-035003 | |
| Plate Reader Synergy HT | BioTek | 4200-000043 | |
| Robotic Platform TheOnyx 44OH/150/100 | Aviso GmbH | 8145-050046 | |
| Microplate Shaker Variomag Teleshaker | INHECO | 3800047 | |
| 96-well Magnet Typ A | Qiagen | 36915 |
Referenzen
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40 (2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten