Method Article
À haut débit Affinity Purification de protéines recombinantes-étiquette
Dans cet article
Résumé
Nous décrivons une méthode pour la purification par affinité marquée de protéines recombinantes utilisant la robotique de manipulation des liquides. Cette méthode est généralement applicable à la purification à petite échelle de l'solubles dans l'His-protéines marquées dans un format à haut débit.
Résumé
Cristallographie aux rayons X est la méthode de choix pour obtenir une vue détaillée de la structure des protéines. Ces études doivent être complétées par d'autres analyses biochimiques pour obtenir un aperçu détaillé en relations structure / fonction. Les progrès de la technologie de synthèse d'oligonucléotides et de gènes faire des stratégies de mutagenèse à grande échelle de plus en plus réalistes, y compris la substitution de résidus cibles par les 19 autres acides aminés. Gain ou de la perte de fonction des phénotypes alors permettre des conclusions systématiques à tirer, tels que la contribution de résidus particuliers à la stabilité activité de la protéine catalytique, et / ou la spécificité d'interaction protéine-protéine.
Afin d'attribuer les différents phénotypes de la nature de la mutation - plutôt que de la fluctuation des conditions expérimentales - il est essentiel de purifier et analyser les protéines d'une manière contrôlée et reproductible. À haut débit stratégies et l'automatisation des protocoles manuels surrobotiques de manipulation des liquides plates-formes ont créé des opportunités pour réaliser de telles procédures complexes moléculaires biologiques avec peu d'intervention humaine et les taux d'erreur minimum de 1-5.
Ici, nous présentons une méthode générale pour la purification de l'His-tag protéines recombinantes de façon à haut débit. Dans une étude récente, nous avons appliqué cette méthode à une structure détaillée-fonction d'enquête de TFIIB, un composant de la machinerie de transcription basale. TFIIB est indispensable pour le promoteur de la transcription dirigée in vitro et est essentiel pour le recrutement de l'ARN polymérase dans un complexe 6-8 préinitiation. TFIIB contient un domaine de liaison flexible qui pénètre dans la fente du site actif de l'ARN polymérase 9-11. Ce domaine de liaison confère deux biochimiquement activités quantifiables sur TFIIB, à savoir (i) la stimulation de l'activité catalytique lors de la "avortée" stade de l'initiation transcription, et (ii) une contribution supplémentaire à l'recrutement spécifique de l'ARN polymérase dans le complexe préinitiation 4,5,12. Nous avons exploité le procédé de purification à haut débit afin de générer unique, double ou triple substitution et mutations des délétions au sein du groupe de liaison TFIIB et de les analyser par la suite dans des tests fonctionnels pour leur effet de stimulation de l'activité catalytique de la polymérase d'ARN 4. Au total, nous avons généré, purifié et analysé 381 mutants - une tâche qui aurait été fastidieux et laborieux à effectuer manuellement. Nous avons produit et testé les protéines dans multiplicates qui nous a permis d'apprécier les variations expérimentales et nous a donné une idée claire de la reproductibilité de nos résultats.
Cette méthode sert de protocole générique pour la purification de protéines His-tag et a été utilisé avec succès pour purifier autres protéines recombinantes. Il est optimisé pour la purification de protéines 24 mais peut être adaptée à purifier jusqu'à 96 protéines.
Protocole
PARTIE A: haut débit croissance des cultures bactériennes.
1. Les bactéries se développer nuit dans 2 ml de milieu d'auto-induction utilisant des plaques 24 puits
- Stériliser les plaques à 24 puits par micro-ondes.
- Inoculer 1,5 ml de milieu d'auto-induction (Nuit Moyen Express) fraîchement cultivés colonies bactériennes ou des stocks de glycérol congelés. Normalement, nous inoculer trois puits par mutant avec trois différentes colonies clonées. Réserve six puits pour les contrôles positifs et négatifs. Pour les contrôles positifs nous grandissons trois clones de type sauvage et pour les contrôles négatifs nous grandissons 2 clones qui ont été transformées avec un plasmide exprimant non. Vérifier la stérilisation suffisante de la plaque en laissant une ébauche et pour la commande à moyen seulement.
- Cultiver les cellules pendant 18 heures à 37 ° C et sous agitation à 250 rpm. Nous utilisons lac inductible par BL21 (DE3) Rosetta 2 cellules. Moyen d'auto-induction contient un mélange de glucose et de lactose. Les bactéries initialementse nourrissent de glucose et ensuite commencer à utiliser le lactose, ce qui induit également l'expression des protéines recombinantes.
- Retirez le couvercle et placez la plaque sur la plate-forme robotique.
PARTIE B: Robotic purification de protéines recombinantes.
2. Préparer la plate-forme robotique
Compenser le tampon de lavage constitué de 20 mM d'imidazole, 0,1% de Triton X-100, 0,5 M NaCl, 20 mM Tris-acétate, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, glycérol 10%, et le tampon d'élution constitué par de 0,5 M d'imidazole, 0,1% de Triton X-100, 0,5 M NaCl, 20 mM Tris-acétate, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, glycérol 10%. Ces tampons seront utilisés pour laver les billes après que les protéines marquées ont été liés à eux, ou pour éluer les protéines à partir des billes, respectivement.
- Maquillage du diluant bactérienne (100 ml d'eau distillée avec 15 ul de réactif anti-mousse). Cette solution sera utiliséepour faire des dilutions des cultures bactériennes nuit de la densité optique (A600) mesures. La présence d'anti-mousse dans le diluant d'éviter la formation de bulles d'air qui pourraient interférer avec les mesures de lecteur de plaques.
- Faire remonter la solution de lyse composée de réactif FastBreak 10x, 2 lysonase pi par échantillon et 15 mM MgOAc 2. FastBreak contient un mélange de détergents et de sels qui dégradent les parois cellulaires des bactéries et de faciliter la libération des protéines intracellulaires. Lysonase est un mélange exclusif de lysozyme et une nucléase. Le lysozyme aide à perturber la paroi cellulaire et la nucléase digère les acides nucléiques bactériens libérés.
- Facultatif: Préparez une solution 6 M de chlorhydrate de guanidine. Certaines protéines recombinantes ont tendance à coller aux aiguilles revêtus de téflon de pipetage. Les guanidine hydrochloride dénature les protéines et les solutions se lave plus efficacement que l'eau qui est couramment utilisée pour rincer les conseils de pipetage robotique lavables après chaque mep.
- Préparer la BCA (acide bicinchoninique) réactif quantification des protéines par une solution d'acide bicinchoninique mélange (réactif A) et la solution de sulfate de cuivre (réactif B): réduire les liaisons peptidiques Cu 2 + à partir du CuSO 4 composant présent dans le réactif BCA de Cu 1 + lequel la quantité de Cu 1 + est proportionnelle au nombre de liaisons peptidiques présentes dans la solution. Dans une deuxième étape, deux molécules d'acide bicinchoninique chélate Cu 1 + résultant en un changement d'absorbance à 562 nm, ce qui entraîne une coloration pourpre. La réaction colorée est dépendante du temps et nécessite souvent plusieurs heures pour être définitive. Après que la couleur est stable pendant plusieurs heures.
- Remplissez auges ou des plaques de la bonne taille et les placer dans leurs positions pré-affectées sur la plate-forme robotique.
- Placer une plaque de 24 puits pour les déchets chlorhydrate de guanidine, deux claires plaques à 96 puits pour l'OD 600 et les mesures d'absorbance et un bleu plaque de 96 puits pour ee protéines purifiées sur leurs positions sur la plate-forme. Placer une plaque 96-puits profonds sur le support magnétique.
- Diluer MagneHis Ni-particules qui se lient les protéines en formant des chélates avec leurs Ses mots-5-plis dans l'eau distillée et de les remplir dans l'unité de perles d'agitation. Mettez l'agitateur pour maintenir les billes en suspension.
- Mettez la plate-forme robotique et rincer les aiguilles de pipetage pour plusieurs minutes pour éliminer les bulles d'air qui seraient autrement interférer avec la précision de pipetage. Les aiguilles de pipetage réutilisables sont rincés entre les étapes de pipetage individuels. Alternativement, embouts jetables peuvent être utilisés. Toutes les étapes suivantes sont réalisées par robot. Le protocole robotique est disponible sur demande.
3. La croissance cellulaire est vérifiée en mesurant la DO600
- 10 pl de culture d'une nuit est dilué dans 90 ul de solution de diluant.
- Mesurer la densité optique 600 afin de s'assurer que les bactéries sont cultivées à des densités similaires(Figure 1).
4. Les cellules sont Cassé vers le haut pour libérer les protéines et l'autorisation de perle contraignant
- 100 pl de suspension Ni-bille magnétique est distribué dans chaque puits d'une seconde plaque de 24 puits.
- 900 pi de chaque culture à petite échelle bactérienne est transférée dans la plaque de 24 puits contenant les billes. Ajouter 100 ul de la FastBreak 10x / lysonase mélange.
- La plaque 24-puits est transférée à la table d'agitation pour agitation rapide (800 rpm) pendant 30 min à température ambiante. Les parois des cellules bactériennes sont perturbés par une combinaison de forces mécaniques et aux agents chimiques et les protéines produites par recombinaison sont libérés dans la solution. Avec leurs étiquettes d'affinité ils ont immédiatement lier les billes paramagnétiques nickel chélateurs.
5. Les billes sont lavées
- Les lysats cellulaires contenant les billes magnétiques sont remises en suspension transférés dans une plaque 96-puits profonds, qui est disposée sur un support avec mtiges agnétique qui glissent entre les puits. Les plaques à 96 puits ont obtenu une place en forme de cône inférieur qui facilite l'élimination du surnageant. Les puits peut contenir des volumes allant jusqu'à 2,1 ml, mais sont remplis avec des volumes beaucoup plus faibles. Cela nous permet d'effectuer des mesures vigoureuses secousses, sans contamination croisée par les éclaboussures.
- Les pointes de pipette sont lavés entre chaque étapes de pipetage avec 6 M de guanidine-HCl. Cette étape est cruciale pour la purification de TFIIB et autres "collantes" protéines pour éviter la contamination croisée. Avec d'autres protéines, il peut être suffisant de rincer abondamment les aiguilles avec de l'eau entre les étapes de pipetage.
- Les tiges magnétiques du support magnétique d'attirer les billes paramagnétiques, les tirant à l'écart des centres des puits et permettre aux aiguilles de pipetage libre accès au surnageant. Le surnageant est éliminé.
- 500 pi de tampon de lavage est d'abord ajouté à la plaque de 24 puits, puis transférée à la plaque de 96 puits à eNsure le transfert complet des billes. La plaque 24-puits est éliminé de l'agitateur.
- Un autre ul 500 de tampon de lavage est ajouté directement à la plaque de 96 puits, la plaque est transférée à l'shaker et agiter vigoureusement pendant 1 min. La plaque est déplacée vers le support magnétique et le tampon de lavage mis au rebut.
- Cette étape est répétée deux fois, et la procédure de lavage est terminé par l'élimination de tous les restes de la plaque de tampon.
6. Éluer les protéines dans le tampon d'élution
- 100 pi de tampon d'élution est ajouté aux billes, la plaque est déplacée vers le shaker et agiter vigoureusement pendant 30 min à température ambiante.
- La plaque est déplacée en arrière de l'agitateur et l'éluat, contenant la protéine recombinante purifiée, est transférée à un nouveau cliché.
7. Mesurer les concentrations des protéines purifiées
- 190 ul de mélange réactif BCA est transféré à une claire plaque de 96 puits et 10 ul de la protéines solution ajoutée.
- Après plusieurs heures d'incubation (en général 5-6 ou toute la nuit), mesurer l'absorbance et la comparer aux normes BSA pour déterminer les concentrations de chacune des préparations de protéines purifiées (figure 2).
- Les protéines purifiées peuvent maintenant être utilisés pour des applications en aval aux concentrations appropriées (Figure 3).
8. Les résultats représentatifs
Le protocole de purification offre deux étapes de contrôle de qualité, dont des exemples sont présentés. Nous sommes en mesure d'identifier et de documenter les problèmes potentiels à l'étape de la croissance bactérienne (Figure 1) et plus tard lors de l'évaluation des rendements des protéines purifiées (figure 2). En général, nous purifier des protéines et de les tester en trois exemplaires. Ceci, en combinaison avec les deux étapes de contrôle de qualité, nous donne confiance que toute variation, nous avons observé dans nos tests fonctionnels sont dus à la phenotyp mutante (figure 3) et non causées par les variations expérimentales ou purifications ont échoué. Les rendements obtenus varient généralement de 50 à 200 ug et sont plus que suffisants pour divers tests fonctionnels.

Figure 1. Histogramme des mesures de DO d'une plaque de 24 puits avec des cultures durant la nuit. Trois clones de six variantes mutantes TFIIB ainsi que de la TFIIB type sauvage ont été cultivés. Deux clones portant un plasmide non-expression et un puits avec un milieu ne servent de témoins négatifs. Les mesures de DO montrent qu'il existe de petites variations dans les taux de croissance entre les différentes cultures.
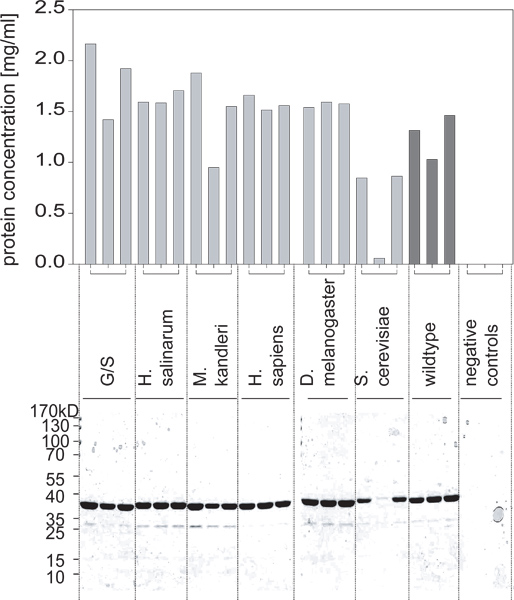
Figure 2. Rendements protéiques obtenus à partir de ces cultures tel que déterminé par un dosage BCA et confirmée par SDS-PAGE. L'une des variantes n'est pas exprimé à des niveaux élevés. En comcombinaison avec la figure 1, on peut conclure que ce n'était pas à cause de la croissance cellulaire différencié, mais en raison de l'expression de protéines ne sont pas induits correctement.

Figure 3. Représentant résultat d'un essai de transcription. Nous avons mesuré l'activité de stimulation des variantes TFIIB sur la production de petits transcrits abortifs par ARNP. Ici, les effets de stimulation d'une bibliothèque complète de simples substitutions d'acides aminés de résidus TFIIB K87 sont affichés. Le degré élevé de reproductibilité est confirmée par les taux d'erreur de petite taille. Un gel de l'échantillon montrant la performance de trois mutants par rapport aux type sauvage (wt), les contrôles négatifs (NC) et le tampon d'élution contrôle seulement est représenté en dessous.
Discussion
La méthode automatisée de purification des protéines recombinantes décrit ici permet la production et la purification d'un grand nombre de protéines mutantes dans un format à petite échelle dans des conditions hautement reproductibles avec une intervention humaine minimale. Figures 1 et 2 montrent les résultats de contrôles systématiques de qualité-et des exemples de la protéines purifiées. Figure 3 montre que les facteurs de transcription purifiés utilisés dans cet exemple effectuer d'une manière hautement reproductible dans des tests fonctionnels.
Même si la procédure a été développé pour la purification de l'archaea TFIIB, il est largement applicable pour la purification des protéines par affinité marqués. L'utilisation de ces protocoles de purification automatiques seront ainsi considérablement faciliter l'analyse biochimique des protéines recombinantes et ainsi améliorer notre compréhension des interactions protéine-protéine à une échelle qui est difficile à réaliser manuellement.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par une subvention de projet Wellcome (078043/Z/05/Z) à ROJW
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Nuit Moyen express tuberculose instantanée | Merck Chemicals Ltd | 71491-4 | |
| FastBreak | Promega Ltd | V8573 | |
| Réactif bioprocédés Lysonase / 1 ml | Merck Chemicals Ltd | 71230 | |
| Antimousse 204 | Sigma-Aldrich Company Ltd | A6426 | |
| MagneHis Ni-Particules | Promega | V8565 | |
| Imidazole | Sigma-Aldrich Company Ltd | 56750 | |
| Trizma de base | Sigma-Aldrich Comptout Ltd | 93362 | |
| NaCl | VWR | 27810.295 | |
| Bicinchoninic détermination de la protéine acide | Sigma-Aldrich Company Ltd | BCA1-1KT | |
| Plaque Deep Well 2,2 ml Place Wells PP PK10 | Anachem Ltd | 1810-1800 | |
| Polystyrène microplaques MicroWell 96 puits à fond plat non traité 12 manches de 5 plaques clair 0,4 volume ml et 128 mm x 86 mm Thermo Scientific Nunc | Fisher Scientific Ltd | DIS-984-090M | |
| Microplaques Bleu | VWR | NUNC367001 | |
| 24-RB Eh bien Blocs (24) | Qiagen | 19583 | |
| Chlorhydrate de guanidine | VWR | ALFAA13543.0B | |
| Aiguille lavable pour TheOnyx | Aviso GmbH | 8152-317001 | |
| Réactif pour rack billes magnétiques | Aviso GmbH | 8152-035003 | |
| Lecteur de plaque Synergy HT | BioTek | 4200-000043 | |
| Plate-forme robotique TheOnyx 44OH/150/100 | Aviso GmbH | 8145-050046 | |
| Microplaques Agitateur Variomag Teleshaker | Inheco | 3800047 | |
| 96-A et Type d'aimant | Qiagen | 36915 |
Références
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40 (2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon