Method Article
Высокая пропускная способность очистки Affinity с метками рекомбинантных белков
В этой статье
Резюме
Мы описываем метод сродство с метками очистки рекомбинантных белков с использованием жидкого обработки робототехники. Этот метод обычно применяется к мелким очистки растворимые His-меченных белков в высокой пропускной способности формате.
Аннотация
X-ray crystallography is the method of choice for obtaining a detailed view of the structure of proteins. Such studies need to be complemented by further biochemical analyses to obtain detailed insights into structure/function relationships. Advances in oligonucleotide- and gene synthesis technology make large-scale mutagenesis strategies increasingly feasible, including the substitution of target residues by all 19 other amino acids. Gain- or loss-of-function phenotypes then allow systematic conclusions to be drawn, such as the contribution of particular residues to catalytic activity, protein stability and/or protein-protein interaction specificity.
In order to attribute the different phenotypes to the nature of the mutation - rather than to fluctuating experimental conditions - it is vital to purify and analyse the proteins in a controlled and reproducible manner. High-throughput strategies and the automation of manual protocols on robotic liquid-handling platforms have created opportunities to perform such complex molecular biological procedures with little human intervention and minimal error rates1-5.
Here, we present a general method for the purification of His-tagged recombinant proteins in a high-throughput manner. In a recent study, we applied this method to a detailed structure-function investigation of TFIIB, a component of the basal transcription machinery. TFIIB is indispensable for promoter-directed transcription in vitro and is essential for the recruitment of RNA polymerase into a preinitiation complex6-8. TFIIB contains a flexible linker domain that penetrates the active site cleft of RNA polymerase9-11. This linker domain confers two biochemically quantifiable activities on TFIIB, namely (i) the stimulation of the catalytic activity during the 'abortive' stage of transcript initiation, and (ii) an additional contribution to the specific recruitment of RNA polymerase into the preinitiation complex4,5,12 . We exploited the high-throughput purification method to generate single, double and triple substitution and deletions mutations within the TFIIB linker and to subsequently analyse them in functional assays for their stimulation effect on the catalytic activity of RNA polymerase4. Altogether, we generated, purified and analysed 381 mutants - a task which would have been time-consuming and laborious to perform manually. We produced and assayed the proteins in multiplicates which allowed us to appreciate any experimental variations and gave us a clear idea of the reproducibility of our results.
This method serves as a generic protocol for the purification of His-tagged proteins and has been successfully used to purify other recombinant proteins. It is currently optimised for the purification of 24 proteins but can be adapted to purify up to 96 proteins.
протокол
ЧАСТЬ: Высокая пропускная рост бактериальных культур.
1. Вырастить бактерии Ночевка в 2 мл Autoinduction среды с использованием 24-луночных планшетах
- Стерилизуйте 24-луночные планшеты в микроволновую печь.
- Инокулировать 1,5 мл autoinduction среды (Overnight Средний Express) с недавно выросли колонии бактерий или замороженных запасов глицерина. Мы обычно прививают трех скважин на мутанта с тремя отдельными клонированных колоний. Резервный шесть скважин для положительного и отрицательного контролей. Для положительного контроля мы растем три клона дикого типа и для отрицательных контролей мы растем 2 клона, которые были трансформированы без выражения плазмиды. Проверьте, достаточно ли стерилизация пластины, оставив одну скважину пустой на среднесрочную только контроль.
- Рост клеток в течение 18 часов при температуре 37 ° C и встряхивании при 250 оборотах в минуту. Мы используем лак-индуцируемых BL21 (DE3) Rosetta 2 клетки. Autoinduction среда содержит смесь глюкозы и лактозы. Бактерии изначальнопитаются глюкозой, а затем начать использовать лактозу, который также индуцирует экспрессию рекомбинантных белков.
- Снимите крышку и поместите пластину на роботизированной платформе.
Часть B: Robotic очистки рекомбинантных белков.
2. Подготовка роботизированной платформы
Макияж промывочный буфер, состоящий из 20 мМ имидазола, 0,1% Тритон Х-100, 0,5 М NaCl, 20 мМ Трис-ацетат, рН 7,9, 10 мМ MgOAc 2, 0,7 мМ ZnOAc 2, 10% глицерина, и элюции буфера, состоящего 0,5 М имидазола, 0,1% Тритон Х-100, 0,5 М NaCl, 20 мМ Трис-ацетат, рН 7,9, 10 мМ MgOAc 2, 0,7 мМ ZnOAc 2, 10% глицерина. Эти буферы будут использоваться для мытья шариков после отмеченных белки были связаны с ними, или для элюции белков из бисера, соответственно.
- Макияж бактериальной разбавителя (100 мл дистиллированной воды, 15 мкл реагента пеногаситель). Это решение будет использоватьсясделать разведение бактериальных культур для ночлега оптической плотности (A600) измерений. Наличие пеногаситель в разбавителем предотвращает образование пузырьков воздуха, которые будут мешать измерениям ридер.
- Макияж лизиса раствор, состоящий из 10х реагента FastBreak, 2 мкл lysonase на образец и 15 мМ MgOAc 2. FastBreak содержит смесь синтетических моющих средств и солей, которые нарушают стенки бактериальных клеток и способствовать освобождению внутриклеточных белков. Lysonase является собственностью смесь лизоцима и нуклеазы. Лизоцим оказывает помощь в срыве клеточной стенки и нуклеазы сборники выпущены бактериальных нуклеиновых кислот.
- Дополнительно: Макияж 6 М гуанидина гидрохлорида раствор. Некоторые рекомбинантные белки, как правило, придерживаются тефлоновым покрытием пипетки иглы. Гуанидингидрохлорида решение денатурации белков и моет их, более эффективно, чем вода, которая обычно используется для промывки моющиеся роботов пипетки советов после каждого йEP.
- Подготовка BCA (bicinchoninic кислоту) белок количественный реагентов путем смешивания bicinchoninic кислоты (реагента) и раствор сульфата меди (реагент B): пептидных связей снижения Cu 2 + из CuSO 4 компонента, присутствующего в BCA реагентов для Cu 1 + которому количество Cu 1 + пропорционально количеству пептидных связей, присутствующих в растворе. На втором этапе, две молекулы кислоты bicinchoninic хелатных Cu 1 + в результате поглощения сдвиг до 562 нм, в результате фиолетового цвета. Цветной реакции зависит от времени и обычно требуется несколько часов, чтобы быть окончательным. После этого цвет стабильны в течение нескольких часов.
- Заполните впадины или пластины нужного размера и поместить их в предварительно выделены позиции на роботизированной платформе.
- Поместите один 24-луночный планшет для отходов гуанидингидрохлорида, два четких 96-луночные планшеты для OD 600 и поглощения измерений и одна синяя 96-луночный планшет для гоэлектронной очищенных белков по их позициям на платформе. Поместите один 96-Deepwell табличка на магнитной подставке.
- Развести MagneHis Ni-частиц, которые связываются белками, образуя хелаты с Его-теги 5-кратное в дистиллированной воде и залить их в шарик перемешивания устройство. Включите мешалку на хранить бусины в виде суспензии.
- Переключитесь на роботизированной платформе и промойте пипетки иглы в течение нескольких минут, чтобы удалить пузырьки воздуха, которые иначе влияют на точность пипетки. Многоразовые иглы пипетирования сбрасываются между отдельными шагами пипетирования. Кроме того, одноразовые наконечники могут быть использованы. Все последующие шаги осуществляются робота. Робота протокола предоставляется по запросу.
3. Рост клеток проверяют, измеряя OD600
- 10 мкл ночной культуры разводят в 90 мкл разбавителя решение.
- Измерьте OD 600 для того, чтобы бактерии выросли по похожей плотности(Рис. 1).
4. Клетки разрушаются, чтобы освободить Белки и Разрешить бисера-связывающий
- 100 мкл магнитных Ni-шарик подвески распределяется в каждую лунку второй 24-луночный планшет.
- 900 мкл каждого мелкого бактериальной культуры переносят в 24-луночный планшет, содержащий бисера. Добавить 100 мкл 10x FastBreak / lysonase смеси.
- 24-луночный планшет передается сотрясение платформу для быстрого встряхивании (800 оборотов в минуту) в течение 30 мин при комнатной температуре. Бактериальные клеточные стенки разрушаются сочетание механических сил и действием химических и рекомбинантных белков выпущен в раствор. С их теги сродство они сразу же связываются парамагнитного бисером хелатирующие никеля.
5. Бисер промывали
- Клеточных лизатов содержащие ресуспендированных магнитных шариков переданы в 96-Deepwell пластины, которая расположена на стенде с мagnetic стержней, которые скользят между скважинами. 96-луночные получили квадратные конусообразной нижней части, который позволяет упростить удаление супернатанта. Скважины может содержать объемом до 2,1 мл, но наполнены гораздо меньших объемах. Это позволяет нам выполнять энергичного встряхивания шаги без образца перекрестного загрязнения от брызг.
- Наконечники моют между отдельными пипетками шаги с 6 М гуанидин-HCl. Этот шаг является решающим для очистки TFIIB и другие "липкие" белки, чтобы избежать перекрестного загрязнения. С другими белками может быть достаточным для промывки иглы большим количеством воды между пипеткой шаги.
- Магнитные стержни магнитной подставкой привлечь парамагнитного бисера, вытягивая их от центра скважины и позволяет пипетки иглы свободного доступа к супернатант. Супернатант отбрасывают.
- 500 мкл промывочного буфера сначала добавляют в 24-луночный планшет, а затем переведен в 96-луночный планшет на еNsure полной передачи бисера. 24-луночный планшет будет удален из шейкера.
- Еще 500 мкл промывочного буфера добавляют непосредственно в 96-луночный планшет, пластины передается в шейкер и энергично встряхивают в течение 1 мин. Пластина вернулся в магнитном стенде и промывочного буфера отбрасываются.
- Этот шаг повторяется дважды, и процедуру промывания закончен, удалив все остатки буфера от пластины.
6. Элюируйте Белки в буфера для элюции
- 100 мкл буфера элюирования добавляют в гранулы, пластины перемещается в шейкер и энергично встряхивают в течение 30 мин при комнатной температуре.
- Пластина вернулся в шейкере и элюата, содержащего очищенный рекомбинантный белок, переносится в новую пластинку.
7. Измерения концентрации очищенных белков
- 190 мкл смеси реагентов BCA передается четко 96-луночный планшет и 10 мкл пробелка раствор добавляли.
- После нескольких часов инкубации (обычно 5-6 или на ночь), измерить оптическую плотность и сравнить его с BSA стандартов для определения концентрации каждого из очищенных белковых препаратов (рис. 2).
- Очищенных белков теперь могут быть использованы для последующего применения в соответствующей концентрации (рис. 3).
8. Представитель Результаты
Очистка протокол предлагает две стадии контроля качества, примеры которых приведены. Мы можем выявить и документировать возможные проблемы на бактериальную стадию роста (рис. 1), а позже при оценке доходности очищенных белков (рис. 2). Как правило, мы очистить белками и проверять их в трех экземплярах. Это, в сочетании с двух шагов контроля качества, дает нам уверенность, что любые изменения мы наблюдали в наших функциональных анализов в связи с мутантным phenotypе (рис. 3), а не вызваны экспериментальные вариации или неудачные очищения. Выходы, полученные обычно составляет от 50-200 мкг и более чем достаточно для различного функционального анализа.

Рисунок 1. Гистограмма измерений ОП 24-луночный планшет с ночевкой культур. Три клоны шести TFIIB мутантных вариантов, а также дикого типа TFIIB были выращены. Два клона проведение без выражения плазмиды и хорошо со средним служить лишь в качестве отрицательного контроля. OD измерения показывают, что есть небольшие вариации в темпах роста между отдельными культурами.
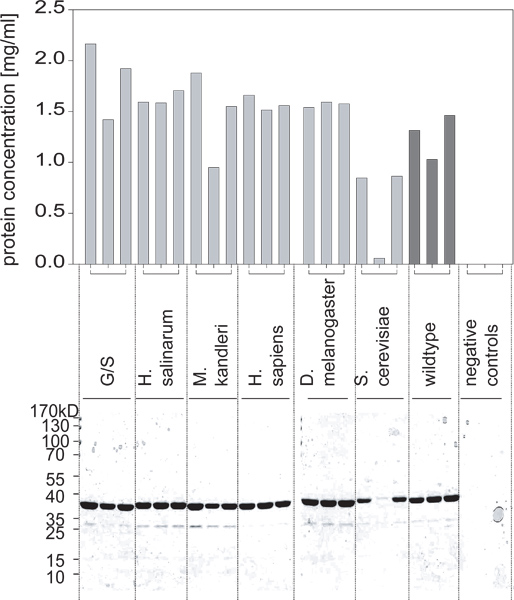
Рисунок 2. Белки выходы, полученные из этих культур определяется анализом BCA и подтверждено PAGE SDS. Один из вариантов не выражается на высоких уровнях. В комкомбинации с рисунка 1, мы можем заключить, что это не было связано с дифференциальным роста клеток, но из-за экспрессии белка не индуцированные правильно.

Рисунок 3. Представитель результате транскрипции анализа. Мы измерили стимуляции активности TFIIB варианта на производстве небольших неудачных протоколов по РНКП. Здесь, стимуляция последствий полную библиотеку одной аминокислотные замены TFIIB остаток K87 показано. Высокая степень воспроизводимости подтверждается небольшой процент ошибок. Образца геля, демонстрирующий работу трех мутантов по сравнению с дикого типа (WT), отрицательного контроля (НК) и элюции буфером только контролирует изображен внизу.
Обсуждение
Автоматизированные рекомбинантного метода очистки белков описано здесь позволяющий производства и очистки большого количества мутантных белков в небольшом масштабе формате при весьма воспроизводимых условиях с минимальным вмешательством человека. Рисунки 1 и 2 показывают результаты систематического контроля качества и примеры очищенных белков. 3 видно, что очищенная транскрипционных факторов, используемых в этом примере выполняет в высшей степени воспроизводимым образом в функциональном анализе.
Хотя процедура была разработана для очистки архейных TFIIB, он широко применяется для очистки сродство-меченных белков. Использование таких автоматизированных протоколы очистки, таким образом, значительно облегчит биохимический анализ рекомбинантных белков и таким образом углубить наше понимание белок-белковых взаимодействий в масштабах, которые трудно достичь вручную.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Wellcome гранта (078043/Z/05/Z), чтобы ROJW
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (по желанию) |
| Ночевка Экспресс мгновенных Средний ТБ | Merck Chemicals Ltd | 71491-4 | |
| FastBreak | Promega ООО | V8573 | |
| Lysonase реагентов Bioprocessing / 1 мл | Merck Chemicals Ltd | 71230 | |
| Antifoam 204 | Sigma-Aldrich Company Ltd | A6426 | |
| MagneHis Ni-частицы | Promega | V8565 | |
| Имидазол | Sigma-Aldrich Company Ltd | 56750 | |
| Trizma базы | Sigma-Aldrich Compлюбая ООО | 93362 | |
| NaCl | VWR | 27810.295 | |
| Bicinchoninic определения белка кислота | Sigma-Aldrich Company Ltd | BCA1-1KT | |
| Планшета с глубокими ячейками 2,2 мл площади Wells PP PK10 | Anachem Ltd | 1810-00 | |
| Микропланшетов микролуночные 96 лунок с плоским дном полистирол не лечится 12 рукава из 5 пластин ясным 0,4 мл и объеме 128 мм х 86 мм Thermo Scientific Nunc | Fisher Scientific ООО | DIS-984-090M | |
| Микропланшетов синий | VWR | NUNC367001 | |
| 24-Ну блоки RB (24) | Qiagen | 19583 | |
| Гуанидингидрохлорида | VWR | ALFAA13543.0B | |
| Моющиеся иглы для TheOnyx | Aviso GmbH | 8152-317001 | |
| Реагент Стойка для магнитных шариков | Aviso GmbH | 8152-035003 | |
| Ридер Synergy HT | BioTek | 4200-000043 | |
| Роботизированная платформа TheOnyx 44OH/150/100 | Aviso GmbH | 8145-050046 | |
| Шейкер для микропланшетов Variomag Teleshaker | Inheco | 3800047 | |
| 96-а Тип магнита | Qiagen | 36915 |
Ссылки
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40(2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , Forthcoming (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены