Method Article
High-throughput Purificazione di affinità-tagged proteine ricombinanti
In questo articolo
Riepilogo
Si descrive un metodo per la purificazione per affinità-tag di proteine ricombinanti utilizzando liquido movimentazione robotica. Questo metodo è generalmente applicabile alla piccola scala purificazione di solubili His-tagged proteine in una high-throughput formato.
Abstract
Cristallografia a raggi X è il metodo di scelta per ottenere una vista dettagliata della struttura delle proteine. Tali studi devono essere integrate da ulteriori analisi biochimiche di acquisire le conoscenze dettagliate in relazioni struttura / funzione. Advances in oligonucleotide-gene e tecnologia di sintesi rendono grandi strategie mutagenesi sempre possibili, compresa la sostituzione dei residui bersaglio da tutti e 19 altri amminoacidi. Guadagno o perdita di funzione fenotipi quindi consentire sistematici conclusioni da trarre, come il contributo di residui particolari per l'attività catalitica, la stabilità della proteina e / o proteina-proteina specificità dell'interazione.
Al fine di assegnare diversi fenotipi alla natura della mutazione - anziché fluttuanti condizioni sperimentali - è vitale per purificare e analizzare le proteine in modo controllato e riproducibile. High-throughput strategie e l'automazione di protocolli manuali surobotici liquido di gestione piattaforme hanno creato opportunità di eseguire tali complesse procedure di biologia molecolare, con poco intervento umano ei tassi di errore minimo 1-5.
Qui, presentiamo un metodo generale per la purificazione di His-tag proteine ricombinanti in un modo ad alta produttività. In un recente studio, abbiamo applicato questo metodo per una dettagliata struttura-funzione di indagine TFIIB, un componente della macchina trascrizione basale. TFIIB è indispensabile per promotore-diretta trascrizione in vitro ed è essenziale per l'assunzione di RNA polimerasi in un complesso preinitiation 6-8. TFIIB contiene un dominio linker flessibile che penetra il sito attivo fessura di RNA polimerasi 9-11. Questo dominio linker conferisce due attività biochimicamente quantificabili TFIIB, vale a dire (i) la stimolazione dell'attività catalitica durante la fase di 'fallita' di inizio trascrizione, e (ii) un ulteriore contributo allaassunzione specifica di RNA polimerasi nella preinitiation complesso 4,5,12. Abbiamo sfruttato l'alta produttività metodo di purificazione per generare singola, doppia sostituzione e triple mutazioni e delezioni nel linker TFIIB e successivamente analizzarli in saggi funzionali per il loro effetto sulla stimolazione dell'attività catalitica della polimerasi RNA 4. Complessivamente, abbiamo generato, purificati ed analizzati 381 mutanti - compito che sarebbe stato lungo e laborioso effettuare manualmente. Abbiamo prodotto e analizzato le proteine in multiplicates che ci ha permesso di apprezzare le variazioni sperimentali e ci ha dato una chiara idea della riproducibilità dei nostri risultati.
Questo metodo serve da protocollo generico per la purificazione di His-tag proteine ed è stato usato con successo per purificare altre proteine ricombinanti. Attualmente è ottimizzato per la purificazione di proteine di 24, ma può essere adattato per purificare fino a 96 proteine.
Protocollo
A PARTE: High-throughput crescita di colture batteriche.
1. Crescere batteri Pernottamento in 2 ml di terreno autoinduzione Utilizzando piastre da 24 pozzetti
- Sterilizzare le piastre da 24 pozzetti da microonde.
- Inoculare 1,5 ml di mezzo di autoinduzione (Overnight Medio Express) con appena cresciute colonie batteriche o stock glicerolo congelati. Di solito inoculare tre pozzi per mutante con tre singole colonie clonati. Riserva sei pozzetti per i controlli positivi e negativi. Per i controlli positivi si cresce tre cloni di tipo selvatico e per i controlli negativi si cresce 2 cloni che sono state trasformate con un plasmide che esprime non. Controllare per la sterilizzazione sufficiente della piastra lasciando un pozzetto vuoto per il medio-solo il controllo.
- Crescere le cellule per 18 ore a 37 ° C e agitazione a 250 rpm. Usiamo lac-inducibile BL21 (DE3) Rosetta 2 celle. Medie autoinduzione contiene una miscela di glucosio e lattosio. I batteri inizialmentenutrono di glucosio e quindi iniziare ad utilizzare il lattosio, che induce anche l'espressione delle proteine ricombinanti.
- Togliere il coperchio e posizionare la piastra sulla piattaforma robotica.
PARTE B: Robotic purificazione di proteine ricombinanti.
2. Preparare la piattaforma robotica
Compongono il tampone costituito da 20 mM imidazolo, 0,1% Triton X-100, 0,5 M NaCl, 20 mM Tris-acetato, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, 10% glicerolo, e il tampone di eluizione costituito di 0,5 M imidazolo, 0,1% Triton X-100, 0,5 M NaCl, 20 mM Tris-acetato, pH 7,9, 10 mM MgOAc 2, 0,7 mM ZnOAc 2, 10% glicerolo. Questi buffer verrà utilizzato per lavare le perle dopo le proteine marcate sono stati legati a loro, o per eluire le proteine dalle perline, rispettivamente.
- Portare il diluente batterico (100 ml di acqua distillata con 15 microlitri di reagente antischiuma). Questa soluzione sarà utilizzataeffettuare delle diluizioni delle colture batteriche durante la notte per la densità ottica (A600) misurazioni. La presenza di antischiuma nel diluente previene la formazione di bolle d'aria che potrebbero interferire con le misurazioni lettore a piastra.
- Portare la soluzione di lisi composto da reagente contropiede 10x, 2 lysonase microlitri per ogni campione e 15 mM MgOAc 2. Fastbreak contiene una miscela di detergenti e sali che rompono le pareti cellulari batteriche e facilitare il rilascio di proteine intracellulari. Lysonase è una miscela brevettata di lisozima e una nucleasi. Lisozima aiuta a distruggere la parete cellulare e la nucleasi digerisce le Liberatoria acidi nucleici batterici.
- Opzionale: Fare una M 6 soluzione cloridrato di guanidina. Alcune proteine ricombinanti tendono ad attaccarsi agli aghi di pipettaggio rivestiti in teflon. Il cloridrato di guanidina soluzione denatura le proteine e si lava di dosso più efficacemente di acqua che viene solitamente usata per sciacquare i lavabili suggerimenti robotici pipettaggio dopo ogni step.
- Preparare la (acido bicinconinico) BCA reagente quantificazione delle proteine miscelando una soluzione di acido bicinconinico (reagente A) e la soluzione di solfato di rame (reagente B): legami peptidici ridurre Cu 2 + dal componente 4 CuSO presente nel reagente BCA di Cu 1 + cui la quantità di Cu 1 + è proporzionale al numero di legami peptidici presenti nella soluzione. In una seconda fase, due molecole di acido bicinconinico chelato Cu 1 + conseguente cambiamento di assorbanza a 562 nm, risultante in un colore viola. La reazione del colore è dipendente dal tempo e ha bisogno di solito diverse ore per essere definitivo. Dopo che il colore è stabile per diverse ore.
- Riempire abbeveratoi o piatti della giusta misura e metterli nelle loro posizioni pre-assegnati sulla piattaforma robotica.
- Posizionare una piastra a 24 pozzetti per i rifiuti guanidina cloridrato, due lastre trasparenti a 96 pozzetti per OD 600 e misurazioni di assorbanza e una blu piastra a 96 pozzetti per the proteine purificate sulle loro posizioni sulla piattaforma. Posizionare un 96-Deepwell piastra sul supporto magnetico.
- Diluire MagneHis Ni-particelle che si legano le proteine formando chelati con i loro suo-tag 5 volte in acqua distillata e riempirli nel tallone-agitazione unità. Accendere l'agitatore a mantenere le microsfere in sospensione.
- Accendere la piattaforma robotica e lavare gli aghi di dispensazione per alcuni minuti per eliminare le bolle d'aria che altrimenti interferire con la precisione di pipettaggio. Gli aghi riutilizzabili pipettaggio sono lavata tra le fasi di pipettamento individuali. In alternativa, puntali monouso potrebbe essere utilizzato. Tutte le fasi successive sono eseguite robot. Il protocollo robot è disponibile su richiesta.
3. La crescita cellulare è verificato misurando la OD600
- 10 pl di coltura durante la notte è diluito in 90 ml di soluzione diluente.
- Misurare la OD 600 per garantire che i batteri sono cresciuti a densità simili(Figura 1).
4. Le cellule sono rotto fino a rilasciare le proteine e per consentire Bead-binding
- 100 pl di sospensione magnetica Ni-bead è distribuito in ciascun pozzetto di una seconda piastra a 24 pozzetti.
- 900 microlitri di ogni piccola coltura batterica è trasferito nella piastra a 24 pozzetti contenenti le perline. Aggiungere 100 microlitri della 10x contropiede / lysonase mix.
- Il 24-pozzetti viene trasferito alla piattaforma agitazione per scuotimento rapido (800 rpm) per 30 minuti a temperatura ambiente. Pareti cellulari batteriche sono interrotti da una combinazione di forze meccaniche e agli agenti chimici e le proteine ricombinanti prodotte vengono rilasciati in soluzione. Con i loro tag di affinità che legano immediatamente le perline chelanti nichel paramagnetiche.
5. Le perline vengono lavati
- Gli lisati cellulari contenenti le microsfere in sospensione magnetici sono trasferiti ad un 96-Deepwell Plate che è posizionato su un supporto con maste agnetica che scorrono tra i pozzetti. Le piastre a 96 pozzetti hanno ottenuto un quadrato forma conica del fondo, che facilita la rimozione del supernatante. I pozzetti possono contenere volumi fino a 2,1 ml, ma sono pieni di volumi molto piccoli. Questo ci permette di effettuare misure vigorose stringono senza campione di cross-contaminazione da spruzzi.
- I puntali vengono lavati tra le singole fasi di pipettamento con 6 M guanidina-HCl. Questo passaggio è fondamentale per la purificazione di TFIIB e altri "sticky" proteine per evitare la contaminazione incrociata. Con altre proteine può essere sufficiente per risciacquare gli aghi estensivamente con acqua tra le fasi di pipettamento.
- Le barre magnetiche del supporto magnetico attirare le perline paramagnetiche, strappandoli i centri della pozzetti e lasciare gli aghi pipettaggio libero accesso al supernatante. Il supernatante viene scartato.
- 500 pl di tampone di lavaggio prima aggiunta al 24-pozzetti e successivamente trasferito alla piastra a 96 pozzetti a eNsure il completo trasferimento delle perle. Il 24-pozzetti viene rimosso dal shaker.
- Altri 500 pl di tampone di lavaggio viene aggiunto direttamente alla piastra a 96 pozzetti, la piastra viene trasferito shaker e agitare vigorosamente per 1 min. La piastra viene riportato al supporto magnetico e il tampone di lavaggio scartato.
- Questo passaggio viene ripetuto due volte e la procedura di lavaggio è finito rimuovendo eventuali residui tampone dalla piastra.
6. Eluire le proteine in tampone di eluizione
- 100 pl di tampone di eluizione viene aggiunto ai talloni, la piastra viene spostato shaker e agitare vigorosamente per 30 min a temperatura ambiente.
- La piastra viene riportato l'agitatore e l'eluato, contenente la proteina ricombinante purificata, viene trasferito in una nuova piastra.
7. Misurare le concentrazioni di proteine purificate
- 190 pl di miscela di reagente BCA viene trasferito ad una chiara piastra da 96 pozzetti e 10 pl della proproteina soluzione aggiunta.
- Dopo diverse ore di incubazione (tipicamente 5-6 o durante la notte), misurare l'assorbanza e confrontarlo con standard BSA per determinare le concentrazioni di ciascuna delle preparazioni proteina purificata (Figura 2).
- Le proteine purificate possono essere utilizzati per applicazioni a valle, alle concentrazioni appropriate (Figura 3).
8. Risultati rappresentativi
Il protocollo di purificazione offre due fasi di controllo di qualità, esempi delle quali sono mostrate. Siamo in grado di identificare e documentare potenziali problemi in fase di crescita batterica (Figura 1) e successivamente su di valutare il tenore di proteine purificate (Figura 2). Noi di solito purificare proteine e testarli in triplice copia. Questo, in combinazione con le due fasi di controllo di qualità, ci dà fiducia che qualsiasi variazione abbiamo osservato nei nostri saggi funzionali sono dovute al phenotyp mutantee (Figura 3) e non causata da variazioni sperimentali o purificazioni falliti. Le rese ottenute variano tipicamente 50-200 mcg e sono più che sufficienti per vari saggi funzionali.

Figura 1. Istogramma delle misurazioni di OD di una piastra a 24 pozzetti con culture overnight. Tre cloni di sei varianti TFIIB mutanti nonché del TFIIB tipo selvatico sono state coltivate. Due cloni non trasportano un plasmide esprimente e un pozzo con mezzo servono solo come controlli negativi. Le misurazioni OD mostrano che ci sono piccole variazioni nei tassi di crescita tra le culture individuali.
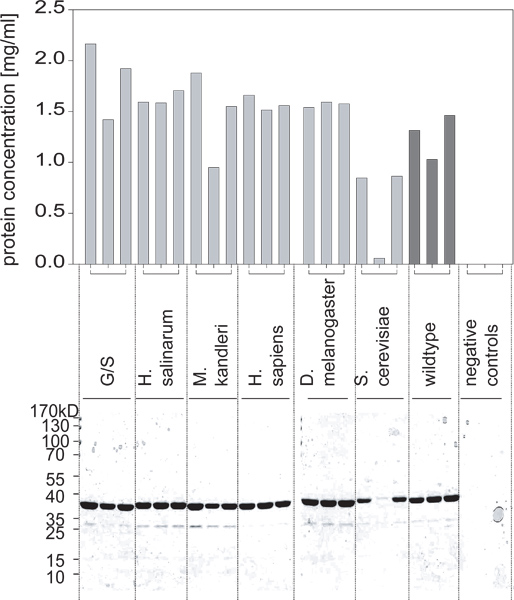
Figura 2. Rese proteici ottenuti da queste colture come determinato mediante un saggio BCA e confermata mediante SDS PAGE. Una delle varianti non è espressa a livelli elevati. In comcombinazione con la figura 1, possiamo concludere che ciò non è dovuto alla crescita delle cellule differenziale ma a causa di espressione della proteina non essere indotti in modo corretto.

Figura 3. Risultato rappresentativo di un saggio di trascrizione. Abbiamo misurato l'attività di stimolazione varianti TFIIB sulla produzione di piccoli trascritti da RNAP abortivi. Qui, gli effetti di stimolazione di una libreria piena di singole sostituzioni aminoacidiche di residui TFIIB K87 sono mostrati. L'alto grado di riproducibilità è confermata dal piccolo errore. Un gel di esempio che mostra le prestazioni di tre mutanti rispetto al tipo selvatico (in peso), controlli negativi (NC) e tampone di eluizione controlla solo è raffigurato sotto.
Discussione
Il metodo automatizzato purificazione della proteina ricombinante qui descritto consente la produzione e purificazione di un gran numero di proteine mutanti in una piccola formato in condizioni altamente riproducibili con minimo intervento umano. Figure 1 e 2 mostrano i risultati di sistematiche qualità-controlli ed esempi del proteine purificate. Figura 3 mostra che i fattori di trascrizione purificati utilizzati in questo esempio effettuare in un modo altamente riproducibile in saggi funzionali.
Anche se la procedura è stata sviluppata per la purificazione di archaeal TFIIB, è ampiamente applicabile per la purificazione di proteine affinità-etichetta. L'uso di tali protocolli di purificazione automatizzati così notevolmente facilitare l'analisi biochimica delle proteine ricombinanti e, quindi, ulteriormente la nostra comprensione di interazioni proteina-proteina su una scala che è difficile da ottenere manualmente.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto da un progetto Wellcome Grant (078043/Z/05/Z) a ROJW
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Overnight Express Media TB istantanea | VWR International srl | 71491-4 | |
| Contropiede | Promega Ltd. | V8573 | |
| Lysonase Reagente Bioprocessing / 1 ml | VWR International srl | 71230 | |
| Antischiuma 204 | Sigma-Aldrich Company Ltd | A6426 | |
| MagneHis Ni-particelle | Promega | V8565 | |
| Imidazolo | Sigma-Aldrich Company Ltd | 56750 | |
| Trizma di base | Sigma-Aldrich Compqualsiasi Ltd. | 93362 | |
| NaCl | VWR | 27810.295 | |
| Bicinconinico Acid determinazione delle proteine | Sigma-Aldrich Company Ltd | BCA1-1KT | |
| Deep Well Tavola 2.2 ml Piazza Wells PP PK10 | Anachem Ltd | 1810-1800 | |
| Polistirene fondo Micropiastra MicroWell 96 pozzetti piatto non trattata 12 bussole su 5 piastre chiaro il volume di 0.4 ml e 128 millimetri x 86 mm Thermo Scientific Nunc | Fisher Scientific Ltd. | DIS-984-090M | |
| Micropiastre Blu | VWR | NUNC367001 | |
| 24 Well Blocchi RB (24) | Qiagen | 19583 | |
| Guanidina cloridrato | VWR | ALFAA13543.0B | |
| Ago lavabile per TheOnyx | Aviso GmbH | 8152-317001 | |
| Rack Reagente per sfere magnetiche | Aviso GmbH | 8152-035003 | |
| Piatto Reader Synergy HT | BioTek | 4200-000043 | |
| Robotic Platform TheOnyx 44OH/150/100 | Aviso GmbH | 8145-050046 | |
| Shaker per micropiastre Variomag Teleshaker | Inheco | 3800047 | |
| 96 pozzetti Tipo di magnete A | Qiagen | 36915 |
Riferimenti
- Weinzierl, R. O. The nucleotide addition cycle of RNA polymerase is controlled by two molecular hinges in the Bridge Helix domain. BMC Biol. 8, 1741-7007 (2010).
- Nottebaum, S., Tan, L., Trzaska, D., Carney, H. C., Weinzierl, R. O. The RNA polymerase factory: a robotic in vitro assembly platform for high-throughput production of recombinant protein complexes. Nucleic Acids Res. 36, 245-252 (2008).
- Tan, L., Wiesler, S., Trzaska, D., Carney, H. C., Weinzierl, R. O. Bridge helix and trigger loop perturbations generate superactive RNA polymerases. J. Biol. 7, 40(2008).
- Wiesler, S. C., Weinzierl, R. O. The linker domain of basal transcription factor TFIIB controls distinct recruitment and transcription stimulation functions. Nucleic Acids Res. 39, 464-474 (2011).
- Weinzierl, R. O., Wiesler, S. C. Revealing the Function of TFIIB. Transcription. , Forthcoming (2011).
- Bell, S. D., Magill, C. P., Jackson, S. P. Basal and regulated transcription in Archaea. Biochemical Society transactions. 29, 392-395 (2001).
- Parvin, J. D., Sharp, P. A. DNA topology and a minimal set of basal factors for transcription by RNA polymerase II. Cell. 73, 533-540 (1993).
- Tyree, C. M. Identification of a minimal set of proteins that is sufficient for accurate initiation of transcription by RNA polymerase II. Genes. 7, 1254-1265 (1993).
- Batada, N. N., Westover, K. D., Bushnell, D. A., Levitt, M., Kornberg, R. D. Diffusion of nucleoside triphosphates and role of the entry site to the RNA polymerase II active center. Proceedings of the National Academy of Sciences of the United States of America. 101, 17361-17364 (2004).
- Liu, X., Bushnell, D. A., Wang, D., Calero, G., Kornberg, R. D. Structure of an RNA Polymerase II-TFIIB Complex and the Transcription Initiation Mechanism. Science (New York, N.Y). 327, 206-209 (2010).
- Kostrewa, D. RNA polymerase II-TFIIB structure and mechanism of transcription initiation. Nature. 462, 323-330 (2010).
- Werner, F., Weinzierl, R. O. Direct modulation of RNA polymerase core functions by basal transcription factors. Molecular and cellular biology. 25, 8344-8355 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon