A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العزلة والثقافة من الخلايا العصبية كريست من الأنبوبة العصبية الجنينية الفئران
In This Article
Summary
العزلة من قمة العصبية الجنينية من الأنبوب العصبي يسهل استخدام في المختبر طرق لدراسة الهجرة، وتجديد الذات، وmultipotency من قمة العصبية.
Abstract
والجنينية العرف العصبي (NC) هو عدد السكان سلف multipotent الذي ينشأ في الجانب الظهري في الأنبوب العصبي، يخضع 1 الظهارية للانتقال الوسيطة (EMT)، وتنتقل في مختلف أنحاء جنين، مما أدى إلى مختلف أنواع الخلايا 1-3. NC أيضا لديه قدرة فريدة على التأثير على التمايز والنضج من الأعضاء المستهدفة 4-6. عندما explanted في المختبر، الأسلاف NC الخضوع الذاتي تجديد، والهجرة تفرق في مجموعة متنوعة من أنواع الأنسجة بما في ذلك الخلايا العصبية، والدبق، وخلايا العضلات الملساء، والغضاريف والعظام.
وكان أول وصف NC multipotency من explants من الأنبوب العصبي الطيور 7-9. في عزلة في المختبر من خلايا NC يسهل دراسة ديناميات NC بما في ذلك انتشار الأسلحة النووية، والهجرة، وmultipotency. مزيد من العمل في أنظمة الطيور والفئران أظهرت أن الخلايا explanted NC الاحتفاظ إمكاناتهم NC عندما زرعها مرة أخرى في جنين 10-13. لأن الحفاظ على هذه الخصائص الكامنة الخلوية في الأسلاف NC explanted، ويزدرع الأنبوب العصبي فحص يوفر خيارا جذابا لدراسة نورث كارولاينا في المختبر.
من أجل التوصل إلى فهم أفضل للNC الثدييات، وقد استخدمت العديد من الأساليب لعزل سكان نورث كارولاينا. يمكن زرعها NC المستمدة من الأسلاف من ما بعد الهجرة مواقع في كل من جنين وتعليم الكبار لدراسة ديناميات الأسلاف نورث كارولاينا في مرحلة ما بعد الهجرة 11،14-20، ولكن بمعزل عن الأسلاف نورث كارولاينا حيث يهاجر من الأنبوب العصبي يوفر الحفاظ الأمثل لل NC الخلية المحتملة، والخصائص الكثيرة 13،21،22. بعض البروتوكولات توظيف مضان الفرز الخلية تفعيلها (FACS) لعزل السكان NC المخصب لأسلاف خاصة 11،13،14،17. ومع ذلك، عندما تبدأ الأجنة مرحلة مبكرة، وأرقام الخلية كافية لتحليل ويصعب الحصول على مع نظام مراقبة الأصول الميدانية، مما يعقد من عزلة populatio نورث كارولاينا في وقت مبكرنانوثانية من أجنة الفردية. هنا، نحن تصف النهج الذي لا يعتمد على نظام مراقبة الأصول الميدانية والنتائج في عدد السكان ما يقرب من 96٪ NC محض على أساس مراسل Wnt1، لجنة المساواة العرقية نسب المنشط 23.
ويتم تكييف الطريقة المعروضة هنا من البروتوكولات الأمثل لثقافة NC الفئران 11،13. من مزايا هذا البروتوكول بالمقارنة مع الطرق السابقة هي أن 1) لا نمت الخلايا على طبقة التغذية، 2) نظام مراقبة الأصول الميدانية ليست مطلوبة للحصول على سكان NC نقي نسبيا، 3) يتم عزل الخلايا premigratory NC و 4) النتائج بسهولة كميا. وعلاوة على ذلك، يمكن استخدام هذا البروتوكول لعزل NC من أي نموذج الفأر الطافر، وتسهيل دراسة الخصائص NC مع التلاعب الجيني مختلفة. الحد من هذا النهج هو أن تتم إزالة NC من سياق جنين، والذي يعرف للتأثير على البقاء على قيد الحياة، والهجرة، والتمايز في نورث كارولاينا 2،24-28.
Protocol
1. إعداد لوحات
- استخدام تقنية معقمة في كل الأوقات.
- إعداد فبرونيكتين (الجبهة الوطنية) من خلال تمييع 100 ميكرولتر من الإنسان مخزون FN البلازما إلى حجم نهائي قدره 3.3 مل في برنامج تلفزيوني في Dulbecco (dPBS). التركيز النهائي هو 30 ميكروغرام / مل ويمكن تخزين هذا في درجة مئوية 4 ل 1 الاسبوع.
- تغطية الجزء السفلي من كل بئر من لوحة النسيج عقيمة 4 ثقافة بشكل جيد مع حل الجبهة الوطنية والسماح للجلوس لمدة 15 دقيقة. تأكد من يتم تغطية كامل السطح. جعل وسائل الإعلام خلال هذه الفترة (الخطوات 2 و 3).
- إزالة الجبهة الوطنية حل والسماح لوحات لتجف. شطف الآبار بلطف مع 500 DMEM ميكرولتر، وإزالة DMEM، وإضافة 500 ميكرولتر من التجديد الذاتي (ريال) المتوسط (انظر أدناه). احتضان في 37 درجة مئوية في حاضنة مرطب يحتوي على 5٪ CO 2. إكمال هذه ساعة واحدة تقريبا قبل تشريح بحيث لوحات وسوف تكون جافة قبل الاستخدام.
2. يستعد ريال متوسطة
- لثقافة NC المبهم والجذع10 من الأجنة (حوالي لتر واحد، اعتمادا على خلفية وراثية من خط الماوس)، وإعداد 25 مل من وسط ريال. الجمع بين 12.5 مل منخفض DMEM الجلوكوز، 7.5 مل متوسطة Neurobasal، 25 حمض الريتينويك ميكرولتر (117 ميكرومتر تركيز النهائي)، و 25 ميكرولتر 2-المركابتويثانول (50 ملي تركيز النهائي). تخلط جيدا.
- إضافة 3.75 مل استخراج أجنة الدجاج، 250 ميكرولتر N الملحق ملح 2، 500 ميكرولتر ملحق B27 و 250 ميكرولتر البنسلين، الستربتومايسين (تركيز النهائي 1٪). تصفية المتوسطة من خلال مرشح 0.22 ميكرون.
- إضافة 10 IGF1 عقيمة ميكروليتر (20 ميكروغرام / مل تركيز النهائي) و 20 ميكرولتر bFGF عقيم (20 ميكروغرام / مل تركيز نهائي). مزيج من قلب. تخزن في درجة مئوية 4
3. إعداد متوسطة غسيل
- لنحو 10 الأجنة تحضير 50 مل من المتوسط غسيل. الجمع بين 50 ملغ جيش صرب البوسنة مع 35 مل DMEM انخفاض الجلوكوز، 15 مل متوسطة Neurobasal، و 500 ميكرولتر البنسلين، الستربتومايسين (1٪ تركيز النهائي). معقم فلتر مع 0.22ميكرون فلتر.
4. إعداد كولاجيناز / dispase
- إضافة 50 ميكرولتر من dPBS مل 100 ملغ / مل كولاجيناز / dispase إلى 5. تخلط جيدا.
- مرشح المحاقن مع 0.2 ميكرون تصفية وإضافة 1.5 مل في كل من ثلاثة آبار من 12 لوحة جيدا. ماصة غسل ما يقرب من 1 مل المتوسطة في الآبار المتبقية. لوحة تخزين كامل على الجليد حتى على استعداد لهضم الأنسجة تشريح.
- قطع نصائح من طرف ماصة P20 و P1000 مرشح بشفرة حلاقة معقمة. قص أسفل حافة مشطوف من غيض. وسيتم استخدام القطع قبالة P1000 لنقل الجنين كامل في حين سيتم استخدام P20 لنقل قطع من الأنسجة المعزولة.
5. عزل المبهم والأنبوبة العصبية الجذع من أجنة DPC 9.5
- في حالات الحمل توقيتها، وتعتبر السدود مع المكونات المهبلية 0،5 DPC ظهرا من صباح اليوم لوحظ المكونات. تضحية وإزالة الرحم في DPC 9.5.
- إزالة الساقط من رحم وبلطف صemove الجنين من الساقط. شهدت مرة واحدة مع هذا البروتوكول، عزل 3-4 9.5 الأجنة DPC في وقت واحد في dPBS العقيمة. استخدام تقنية معقمة وأدوات تشريح للتعقيم. يمكن تعقيم أدوات التعقيم بواسطة جهاز الأوتوكليف الحرارة، أو عن طريق حضانة في الايثانول.
- لNC المبهمي الأمامي: استخدام إبر الأنسولين، وقطع الأنبوب العصبي في اللوحاء في منتصف أذني. قطع مرة أخرى على حافة الخلفي من الجسيدة 4 ال. تقليم الأنسجة بطني إلى الأنبوب العصبي لإزالة الأقواس البلعومية والقلب.
- لNC الجذع: استخدام إبر الأنسولين، وإزالة جزء من الأنبوب العصبي بين somites 16-22 (أو الجسيدة مشاركة إذا الأجنة تنمويا في وقت سابق من مرحلة الجسيدة 22).
- ابقاء الكيس المحي وأي نوع من الأنسجة الجنينية المتبقية لالتنميط الجيني.
6. إزالة غير الأديم الظاهر العصبي والأديم المتوسط
- وضع الأنبوب العصبي التي تحتوي على شرائح في كولاجيناز / dispase في درجة حرارة الغرفة لمدة 10 دقيقةق. يغسل فورا في المتوسط غسيل.
- عودة إلى الأنسجة dPBS العقيمة. استخدام إبر الأنسولين العقيمة، وإزالة بلطف الأديم الظاهر غير عصبية من الأنسجة وفصل و somites بعيدا عن الأنبوب العصبي. ويمكن إزالة الأجزاء آخر ما تبقى من الطبقة الجرثومية الوسطى من الأنسجة الجسيدة بواسطة triturating بلطف باستخدام قطع أسفل P20 طرف. كن حذرا حتى لا تضر الأنبوب العصبي. مراقبة ذلك عن كثب خلال سحن.
- وضع أنبوب معزولة العصبية من خلال غسل الثانية والثالثة 30 ثانية من غسل المتوسطة.
- يغسل مرة واحدة في وسط ريال، ووضع أنبوب معزولة العصبية في مركز بئر FN المغلفة التي أعدت من قبل (الخطوة 1.3). ترطيب الغرفة نقص الأكسجة مع طبق من الماء المعقم. وضع طبق في غرفة نقص الأكسجة وتدفق الغاز مع غرفة مختلطة إلى 3٪ O 2 (استخدام دبابة تحتوي على خليط من 1٪ O 2، 6٪ CO 2، 93٪ N 2).
- تعامل دائما الغرفة بعناية فائقة لضمان ثاexplants تي هي دون عائق، والبقاء في مركز للآبار.
- احتضان عند 37 درجة مئوية. ويظهر ملخص للخطوات 5-6 في الشكل 1.
7. إزالة الأنبوب العصبي
- بعد 24 ساعة من الحضانة، وإزالة الأنبوب العصبي بواسطة إغاظة بلطف حافة الأنبوب العصبي بعيدا عن الخلايا المهاجرة باستخدام إبرة الأنسولين العقيمة. إزالة والتخلص من الأنبوب العصبي من المتوسط باستخدام قطع P20 العقيمة كما في الخطوة 6.2 و استبدال المتوسطة مع المتوسطة ريال الطازجة (الشكل 2). هو الأكثر بسهولة القيام بذلك باستخدام مجهر مقلوب.
8. ممثل النتائج
بعد 24 ساعة من الحضانة عند 37 درجة مئوية في ظروف نقص الأوكسجين، والخلايا NC هاجروا بعيدا عن الأنبوب العصبي في عدد سكانها ما يقرب من محض (الشكل 3A). في بعض الأحيان، وهذا اقل مما الثقافات المثالي لا تسفر عن الامتداد القوي. على سبيل المثال، فمن الممكن أن بعد 24 ساعة تيسيكون قد كرة لولبية كان الأنبوب العصبي حتى على نفسها، ونورث كارولاينا لن تهاجر بعيدا عن الأنبوب العصبي (الشكل 3B). في بعض الأحيان فإن الأنبوب العصبي لا نعلق على لوحات والمغلفة فبرونيكتين.
في تجربتنا، يمكن دون المستوى الأمثل NC الهجرة أو مشاكل مع المرفقات في الأنبوب العصبي تتأثر سلبا ظروف normoxia أو تركيز فبرونيكتين، على التوالي. ولا بد من تعديل النشاط الأنزيمي من كولاجيناز / dispase يختلف قليلا عن طريق دفعة والوقت مناسب الهضم، ومع ذلك، لا هضم الأنسجة وقتا أطول من 15 دقيقة. وسوف Overdigestion في الأنبوب العصبي التي تحتوي على نسج في كولاجيناز / dispase يؤدي أيضا إلى الامتداد ناقص. إذا لم يتم الأنسجة الجسيدة إزالتها بسهولة من الأنبوب العصبي بعد حضانة في كولاجيناز / dispase، يمكن تحضين الأنبوب العصبي لمدة تزيد عن عشر دقائق. في بعض الأحيان فإن الأنبوب العصبي لا نعلق على الركيزة. إذا كان هذا هو الحال، انقر نقرا مزدوجا التحقق من fibronecتركيز القصدير وظروف نقص الأكسجة.
بينما يمكن استخدام الظروف normoxic إلى ثقافة البرية من نوع نورث كارولاينا، وظروف نقص الأوكسجين بشكل وثيق في بيئة تحاكي فيفو 29،30. في تجربتنا، وأصبحت الظروف الحرجة عندما ميتة زراعة متحولة NC. على سبيل المثال، كان NC جذع عندما تم زرعها Foxd3 متحولة NC في ظروف normoxic، وهو ثمرة خلية تقلص إلى حد كبير بالمقارنة مع الضوابط. تمت إزالة هذا التفاوت في حجم ثمرة عندما تم زرعها في explants في ظروف نقص الأوكسجين (الشكل 4). وعلاوة على ذلك، كان عدد كاسباس إيجابية الخلايا عندما تم زرعها من النوع البري explants الأنبوب العصبي في normoxia، ثم أن من أكبر explants مماثل زرعها في نقص الأكسجة (لا تظهر البيانات). من خلال الحفاظ على كل ثقافة نورث كارولاينا في نقص الأكسجين، ويمكن بسهولة أن يتم إجراء مقارنات بين ديناميات سيطرة وثقافات متحولة.
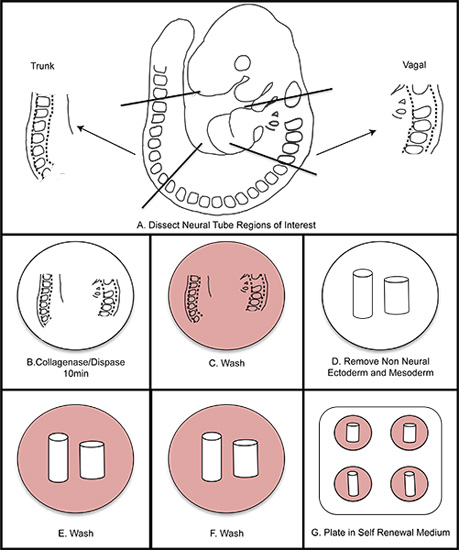
> الشكل 1. التخطيطي بشكل عام من العزلة NC. A) تشريح المناطق ذات الاهتمام من الجنين. B) chester ملخص الأنبوب العصبي في كولاجيناز / dispase لمدة عشر دقائق (لا تتجاوز 15 دقيقة). C) في غسل الغسيل المتوسطة. D) تشريح بعيدا في الأديم الظاهر غير العصبية والأديم المتوسط. EF) غسل مرتين في المتوسط غسيل. G) لوحة في المتوسط تجديد الذات. احتضان في 37 درجة مئوية في 3٪ O 2 ظروف نقص الأوكسجين.
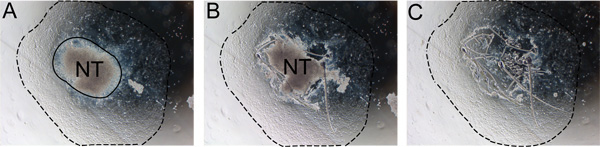
الشكل 2. إزالة شكل خطوات من الأنبوب العصبي من ازدراع. ويجب إزالة الأنبوب العصبي بعد 24-48 ساعة لمنع التلوث مع المنظمات غير NC الخلايا. أ) لاحظ الحدود بين الأنبوب العصبي، وثمرة NC (الخط المتصل). ب) قطع على طول حافة الأنبوب العصبي مع إبرة الأنسولين. C) تجاهل الأنبوب العصبي واستبدال المتوسطة مع الطازجة النفس المتوسطة تجديد. خط متقطع يشير مدى ما آل إليه. الاختصار: NT، الأنبوب العصبي.
> 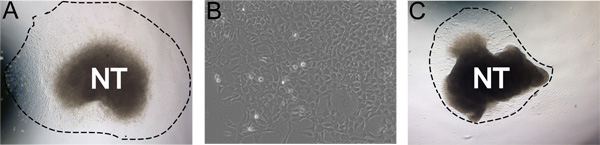
الشكل 3. أمثلة من نتائج ممثل. A) ثمرة يزدرع النموذجية بعد حضانة 24 ساعة في المتوسط تجديد النفس في ظروف نقص الأوكسجين (خط متقطع يشير مدى ما آل إليه). B) مكبر نظرا لنمو NC بعد 48 ساعة في الثقافة. ج) الثقافة أقل مثالية مع محصول ثمرة منخفضة. تم زرعها ألف وجيم في ظل نفس الظروف. الصور تظهر مدى متانة الطبيعية في الثقافة. يمكن أن تتأثر بذلك عن طريق كفاءة من العزلة الأنبوب العصبي، وتركيز الجبهة الوطنية، وظروف نقص الأوكسجين، والوقت في كولاجيناز / dispase الهضم.
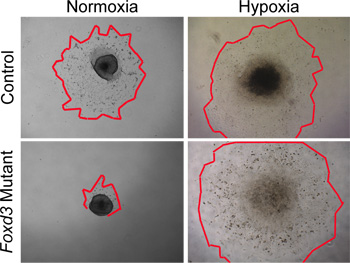
الشكل 4. في التحليلات المختبرية للثقافات يزدرع NC normoxia في مقابل نقص الأكسجة. السيطرة (نوع البرية) خلايا NC هاجروا من explants الأنبوب العصبي بعد 48 ساعة في ظروف ثقافة normoxic. في المقابل، Foxd3 متحولةقد تقلص إلى حد كبير NC الامتداد خلية في normoxia (حواف حمراء علامة الخطوط العريضة للالامتداد NC). نما Foxd3 متحولة explants NC عندما كانت تزرع explants مشابه في ظل ظروف نقص الأوكسجين، نسبيا لضوابط، مما يسمح للتحليلات لاحقة. علما أن هذا السلوك يرتبط بشكل جيد مع سلوك Foxd3 متحولة NC في الجسم الحي.
Discussion
وينبغي إيلاء الاهتمام الدقيق لمرحلة التطوير من الجنين لضمان نجاح هذا النهج. عد somites من أجنة الفئران في وقت مبكر أمر بالغ الأهمية سواء بالنسبة للمرحلة مطابقة الأجنة داخل القمامة وتحديد المناطق الصحيح من الأنبوب العصبي للعزلة. وهناك تباين في واحد أو اثنين somites بين الأج...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
نود أن نعترف مارك زنياك للحصول على المساعدة فيديو. ونود أيضا أن نعترف شون موريسون في جنوب غرب التحرير للبروتوكول الأصلي لزراعة خلايا الفئران نورث كارولاينا. وأيد هذا العمل فاندربيلت المركز الطبي لجامعة لدعم البرنامج الأكاديمي، وكان من المنح المقدمة من المعاهد الوطنية للصحة (HD36720 وHD036720-11S109) و11GRNT7690040 AHA على بال، والزمالات predoctoral من AHA (0615209B)، والمعاهد الوطنية للصحة (NS065604) لحركة عدم الانحياز، وتخطيط موارد المؤسسات بدعم من T32HD007502 تدريب منحة المعاهد الوطنية للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | شركة | فهرس العدد | تعليقات |
| DMEM (انخفاض الجلوكوز) | Gibco / إينفيتروجن | 11885 | |
| Neurobasal متوسطة | Gibco | 21103 | |
| جيش صرب البوسنة | سيغما | A3912-10G | |
| dPBS | Gibco | 14190-144 | |
| IGF1 | العلوم البيولوجية دينار بحريني | 354037 | متجر في aliquots ميكروغرام / 50 مل عند درجة حرارة -20 درجة مئوية. |
| bFGF | العلوم البيولوجية دينار بحريني | 354060 | متجر في aliquots ميكروغرام / 25 مل عند درجة حرارة -20 درجة مئوية. |
| فبرونيكتين | Gibco | 33016-015 | المخزنة في حي 1mg/mLiquots عند درجة حرارة -20 درجة مئوية. |
| حمض الريتينويك | سيغما | R2625 | متجر في aliquots ميكروغرام / مل 35 بعد إعادة تشكيلها في الإيثانول عند درجة حرارة -20 درجة مئوية. |
| 2-المركابتويثانول | سيغما | D-5637 | |
| N 2 الملحق | Gibco | 17502-048 | |
| B27 الملحق | Gibco | 17504-044 | |
| مرشحات Steriflip 0.22 ميكرون | ميليبور | SCGP00525 | |
| البنسلين، الستربتومايسين | إينفيتروجن | 15140122 | |
| 0.20 ميكرون مرشحات | كورنينج | 431219 | |
| المحاقن (لترشيح) | العلوم البيولوجية دينار بحريني | 301604 | |
| أربع لوحات جيدة | الحرارية فيشر العلمية | 176740 | |
| كولاجيناز / Dispase | روش | 269 638 | النشاط يختلف من دفعة واحدة. متجر في aliquots ملغ / 100 مل عند درجة حرارة -20 درجة مئوية. |
| الأنسولين الإبر (29 ½ غيج) | بيكتون ديكسون | 309306 | |
| نقص الأكسجة غرفة | بيلوبس-روتنبرج | ||
| محلل الأكسجين | بيلوبس-روتنبرج | ||
| ملقط # 5 | أدوات العلم غرامة | لإزالة الرحم والساقط. | |
| التربسين-EDTA (0.25٪) | Gibco | 25200 |
References
- Le Douarin, N., Kalcheim, C. . The neural crest. , (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -. P. . Neural crest induction and differentiation. , (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e. Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved