このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
胎児マウス神経管から神経堤細胞の単離および培養
要約
神経管から胚の神経堤の分離の使用を容易に in vitroで移行、自己再生し、神経堤の多能性を研究するための方法。
要約
胚の神経堤(NC)は、神経管の背側面に由来する多能性前駆細胞集団である間葉移行(EMT)に上皮を受け、多様な細胞の種類1-3に上昇を与えて、胚全体に移行します。 NCはまた、標的器官4-6の分化と成熟に影響を与えるユニークな能力を持っています。 in vitroで外植する場合は、NC前駆細胞が自己再生を受けて、移行し、神経細胞、グリア細胞、平滑筋細胞、軟骨および骨を含む組織、さまざまな種類の細胞に分化する。
NCの多能性は、最初の鳥の神経管7-9の外植片から記述されていた。NC細胞の in vitro での分離では増殖、移行、および多能含むNCダイナミクスの研究を容易にします。胚10に戻って移植時に植NC細胞は、そのNCの可能性を保持することを明らかに鳥とネズミシステムの更なる作業-13。これらの固有の細胞の特性が植NC前駆細胞に保持されているため、神経管植アッセイは、in vitroでの NCを研究するための魅力的なオプションを提供しています。
哺乳類のNCのより良い理解を達成するために、多くのメソッドは、NC集団を分離するために採用されています。 NC-由来の前駆細胞がポスト渡り鳥NC前駆11,14-20のダイナミクスを研究するための胚と成人の両方で、ポスト渡り鳥の場所から培養することができる、しかし、彼らは神経管からの移住としてNC前駆細胞の分離は、最適な保全を提供していますNCの潜在的な細胞や渡り鳥プロパティ13,21,22。いくつかのプロトコルは、特定の前駆細胞11,13,14,17を濃縮NC人口を分離するために蛍光活性化細胞選別(FACS)を採用しています。しかし、初期段階の胚から始まるときは、分析のための十分な細胞数は初期のNC populatioの分離を複雑にし、FACSを得ることが困難である個々の胚からNS。ここでは、Wnt1-Creリコンビナーゼ活性化系レポーター23に基づいて約96%純粋なNC集団のFACS、その結果に依存しないアプローチを説明します。
ここで紹介する方法は、ラットNC 11,13の培養に最適化されたプロトコルから構成されている。このプロトコルは、従来の方法に比べての利点は、1)細胞はFACS))は、比較的純粋なNCの人口、3を取得する必要はありませんpremigratory NC細胞が分離されている、4)フィーダー層2上に成長されていない結果が簡単にあることです。定量化した。さらに、このプロトコルは、異なる遺伝的操作とNC特性の研究を促進し、任意の変異マウスモデルからNCの分離に使用することができます。このアプローチの制限は、NCはNC 2,24-28の生存、遊走、分化に影響を及ぼすことが知られている胚のコンテキストから削除されていることです。
プロトコル
1。プレートの準備
- すべての回で無菌テクニックを使用しています。
- ダルベッコPBS(DPBS)3.3 mLの最終容量にヒト血漿FNの株式の100μLを希釈することによってフィブロネクチン(FN)を準備します。最終濃度は30μg/ mLであり、これは1週間に4℃で保存することができます。
- FN溶液を滅菌組織培養4ウェルプレートの各ウェルの底をカバーし、15分間放置します。表面全体が覆われていることを確認してください。この時間(手順2および3)の間にメディアを作成します。
- ソリューションを、FN、プレートを乾燥することができます削除します。静かに500μLDMEM、削除DMEMでウェルを洗浄し、自己再生(SR)培地(下記参照)の500μLを追加します。 CO 2 5%を含む加湿インキュベーター中で37℃でインキュベートします。プレートは使用前に乾燥されるように解剖する前に、この約1時間を完了します。
2。 SRメディアの準備
- 迷走神経とトランクNCの培養10胚(約1リットル、マウスラインの遺伝的背景に依存します)から、SR培地の25mLを準備します。 12.5 mLの低グルコースDMEM、7.5 mLのNeurobasal中、25μLレチノイン酸(117μM最終濃度)、25μLの2 - メルカプトエタノール(50mMの最終濃度)を兼ね備えています。よく混ぜる。
- 3.75 mLの鶏胚エキス、250μLN 2塩サプリメント、500μLB27サプリメント、250μLペニシリン-ストレプトマイシン(1%最終濃度)を追加します。 0.22μmのフィルターを介してメディアをフィルタリングします。
- 10μLの滅菌IGF1(20μg/ mLの最終濃度)及び20μlの滅菌のbFGF(20μg/ mLの最終濃度)を追加します。転倒混和する。 4℃で保管してください
3。洗浄媒体の準備
- 約10胚は洗浄培地の50mLを準備します。 35 mLの低グルコースDMEM、15 mLのNeurobasal Medium、および500μLペニシリン - ストレプトマイシン(1%最終濃度)で50mgのBSAを兼ね備えています。 0.22の滅菌フィルターμmのフィルター。
4。コラゲナーゼ/ディスパーゼを準備する
- 5 mLのDPBS〜100 mg / mLのコラゲナーゼ/ディスパーゼの50μLを追加します。よく混ぜる。
- シリンジは、0.2μmのフィルターとフィルターと12ウェルプレートの3つのウェルの各々に1.5 mLを加える。残りのウェルにピペットで約1 mLの洗浄媒体。解剖組織を消化する準備が整うまで、氷上にプレート全体を格納します。
- 滅菌したカミソリの刃とP20とP1000ピペットフィルターチップの先端をカットします。ちょうど先端の斜めのエッジの下にカットします。 P20は、孤立した組織片を転送するために使用されている間P1000のカットオフは、全胚を転送するために使用されます。
5。 9.5 DPCの胚から単離する迷走神経およびトランクの神経管
- タイミング妊娠のために、膣栓とダムは、プラグが観察された朝昼で0.5 DPCと見なされます。 9.5 DPCで子宮を犠牲にして削除します。
- 子宮から脱落膜を除去し、やさしくR脱落膜から胚を残したまま削除する。一度、このプロトコルで経験、滅菌DPBSの時間で3〜4 9.5 DPCの胚を分離します。無菌操作と滅菌解剖器具を使用しています。インスツルメンツは、オートクレーブ、加熱殺菌するか、またはエタノール中でのインキュベーションによって滅菌することができる。
- 前迷走神経のNCの場合:インスリン針を使用して、半ばに耳プラコードで神経管を切った。 4 番目の体節の後縁で再びカットします。咽頭弓と心臓を削除するには、神経管の腹側組織をトリミングします。
- トランクNCの場合:インスリン針を使用して、体節16から22(または胚以前の22体節期より発達であれば最後の体節)間の神経管の一部を削除します。
- 卵黄嚢とジェノタイピングのために残りの胚組織を保持します。
6。非神経外胚葉と中胚葉の除去
- 10分間室温でコラゲナーゼ/ディスパーゼにセグメントを含む神経管を配置だ。直ちに洗浄培地で洗ってください。
- 滅菌DPBSに組織を返します。無菌のインスリン針を使用して、静かに組織からの非神経外胚葉を除去し、離れて神経管から体節を分離します。体節中胚葉組織からの最後の残りの部分はカットダウンP20チップを用いて穏やかに摩砕することによって削除できます。神経管を損傷しないように注意してください。粉砕中に密接にこれを守ってください。
- 洗浄媒体の2番目と3番目の30秒の洗浄によって分離された神経管を配置します。
- SR培地で一度洗浄し、(ステップ1.3)以前に調製したFN-コートしたウェルの中央に孤立した神経管を配置します。滅菌水の入ったお皿で低酸素室を加湿。低酸素室に皿を置き、3%混合ガスとO 2をチャンバーをフラッシュ(1%O 2、6%CO 2、93%N 2の混合物を含有するタンクを使用します)。
- 常に股関節を確保するために非常に慎重にチャンバーを扱うtの外植片を邪魔されずにおり、井戸の中心に残っています。
- 37℃で手順5-6の概要を図1に示されています。
7。神経管の除去
- 24時間のインキュベーションの後、穏やかに滅菌インスリン注射針を使用して移行細胞から神経管の端をからかうことで神経管を削除します。削除し、ステップ6.2のように無菌P20のカットを使用して媒体から神経管を破棄し、新鮮なSR培地( 図2)で培地を交換してください。これは最も簡単に倒立顕微鏡を使用して行われます。
8。代表的な結果
低酸素状態で°C、NC細胞はほぼ純粋な集団( 図3a)は神経管から移行した37℃で24時間のインキュベーションに続いて。時には、理想的な文化未満は、堅牢なoutgrowthsが得られません。たとえば、その24時間後にトンが可能です彼神経管は、それ自体に丸くなっているだろうとNCは神経管( 図3b)から移行されません。時折神経管は、フィブロネクチンでコートしたプレートに取り付けられません。
我々の経験では、サブ最適なNCの移行や神経管の添付ファイル付きの問題が悪影響をそれぞれ、正常酸素条件またはフィブロネクチンの濃度によって影響を受けることができます。コラゲナーゼ/ディスパーゼの酵素活性を適切に調整する必要がありますバッチと消化時間によって若干異なりますが、しかし、15分以上の組織を消化していません。コラゲナーゼ/ディスパーゼの組織を含む神経管のOverdigestionも欠損outgrowthsになります。体節組織は簡単にコラゲナーゼ/ディスパーゼでインキュベートした後、神経管から削除されていない場合は、神経管は10分以上インキュベートすることができます。時には神経管は、基板に取り付けられません。このような場合は、fibronecをダブルチェックスズ濃度と低酸素条件。
正常酸素条件が文化野生型NCに使用できますが、低酸素状態は、より密接に生体内環境29,30で模倣する。我々の経験では、低酸素条件が培養するとき変異NC危険な状態になりました。たとえば、Foxd3変異NCは正常酸素条件下で培養した場合、トランクNCは、コントロールに比べて大幅に減少し、細胞伸長しました。植が低酸素状態( 図4)で培養したときに突起の大きさのこの格差は削除されました。さらに、野生型の神経管の外植片は、正常酸素状態で培養した場合、カスパーゼ陽性細胞の数(データは示されていない)低酸素状態で培養された類似した外植片のことをして大きかった。低酸素状態にあるすべてのNCの文化を維持することによって、比較がより容易に制御および変異体の文化のダイナミクスとの間で行うことができます。
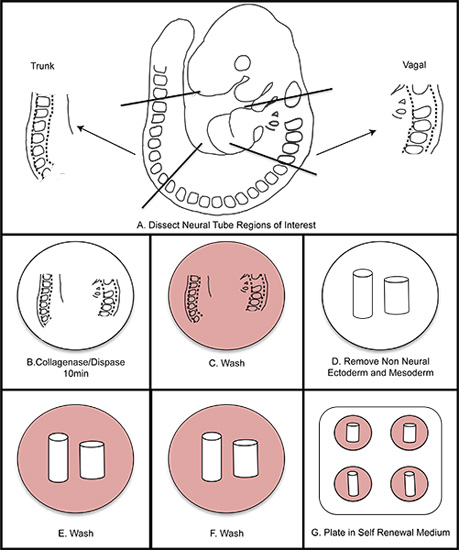
図1。NC分離の全体的な概略図。 A)胚から関心領域を解剖。 B)(15分を超えない)10分間コラゲナーゼ/ディスパーゼで神経管のダイジェスト。 C)洗浄培地で洗浄します。 D)非神経外胚葉と中胚葉の距離を解剖。 EF)は洗浄培地で2回洗浄する。自己再生培地中のG)プレート。 3パーセントO 2低酸素条件で37℃でインキュベートします。
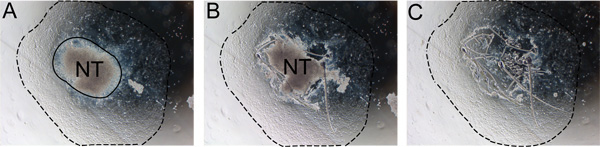
図2片からの神経管の段階的除去。神経管は、非NCの細胞の混入を防ぐために、24〜48時間後に削除する必要があります。 A)神経管とNCの伸長(実線)との境界に注目してください。 B)インスリン注射針で神経管の端に沿って切り取ります。 C)神経管を破棄し、新鮮な自己再生培地で培地を交換してください。破線は、伸長の度合いを示します。略称:NT、神経管。
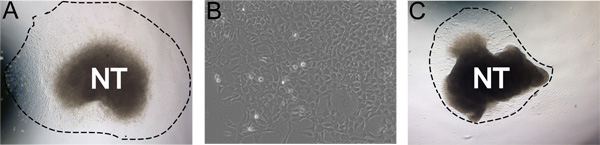
図3代表的な結果の例。低酸素条件下で自己再生培地中で24時間インキュベートした後A)典型的な片の伸長は、(破線)は、伸長の度合いを示します。 B)培養48時間後にNC伸長のビューを拡大。低伸長の収率でC)少ない理想的な文化。とCは同じ条件下で培養した。画像は文化の堅牢性で自然な範囲を示しています。これは、神経管の分離、FNの濃度、低酸素状態、およびコラゲナーゼ/ディスパーゼ消化の時間効率によって影響を受けることができます。
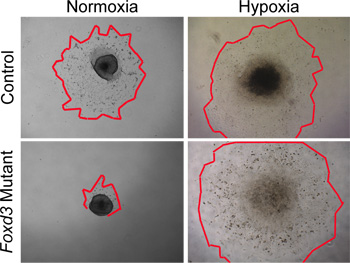
図4:正常酸素に対する低酸素症におけるNC植培養のin vitroでの解析。コントロール(野生型)NC細胞は、正常酸素培養条件下で48時間後に神経管の外植片から移行した。対照的に、Foxd3変異体NCが大幅に正常酸素の細胞outgrowthsを(NCのoutgrowthsの赤いアウトラインマークエッジ)減少した。同等の外植片は、低酸素条件下で栽培した場合は、Foxd3変異NC植は、その後の分析を可能にする、コントロールと同等になりました。 (注)、この動作は、in vivoでの変異体Foxd3 NCの動作とよく相関した。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
細心の注意は、このアプローチの成功を確実にするために胚の発達段階に支払わなければなりません。マウス初期胚の体節を数えると、ごみの中に胚を照合し、絶縁のための神経管の適切な領域を決定する段階の両方が重要です。胚の間に1つまたは2つの体節のバリエーションが行った実験の解像度に応じて、発生のタイミングの合理的な範囲内である。 9と9.5の間に胚は、DPCは17〜25体節が?...
Access restricted. Please log in or start a trial to view this content.
開示事項
我々は、開示することは何もありません。
謝辞
我々は、ビデオ援助をマークウォズニアックを承認したいと思います。また、培養ラットNC細胞の元のプロトコルのためのUTの南西で、ショーン·モリソンを承認したいと思います。この作品は、ヴァンダービルト大学医療センターアカデミックプログラムのサポートを支持し、NIH(HD36720とHD036720-11S109)とPALにAHA 11GRNT7690040、NAMにAHA(0615209B)とNIH(NS065604)から博士号を取得する前の奨学金と、ERPからの補助金によってであったNIH訓練助成金T32HD007502によってサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ番号 | コメント |
| DMEM(低グルコース) | GIBCO / Invitrogen社 | 11885 | |
| Neurobasal中 | ギブコ | 21103 | |
| BSA | シグマ | A3912-10G | |
| DPBS | ギブコ | 14190-144 | |
| IGF1 | BDバイオサイエンス | 354037 | -20℃で50μg/ mLのアリコートでストア |
| bFGFの | BDバイオサイエンス | 354060 | -20℃で25μg/ mLのアリコートでストア |
| フィブロネクチン | ギブコ | 33016-015 | 1mg/mLらに格納されている-20℃でiquots |
| レチノイン酸 | シグマ | R2625 | -20℃でエタノールに再溶解後35μg/ mlのアリコートでストア |
| 2 - メルカプトエタノール | シグマ | D-5637 | |
| N 2の補足 | ギブコ | 17502-048 | |
| B27のサプリメント | ギブコ | 17504-044 | |
| Steriflip0.22μmのフィルター | ミリポア | SCGP00525 | |
| ペニシリン - ストレプトマイシン | インビトロジェン | 15140122 | |
| 0.20μmのフィルター | コーニング | 431219 | |
| シリンジ(ろ過用) | BDバイオサイエンス | 301604 | |
| 四ウェルプレート | サーモフィッシャーサイエンティフィック | 176740 | |
| コラゲナーゼ/ディスパーゼ | ロシュ社 | 269 638 | 活動は、バッチによって異なります。 -20℃で100 mg / mLのアリコートでストア |
| インスリンの針 (29½ゲージ) | ベクトン·ディクソン | 309306 | |
| 低酸素チャンバー | ビラップス - ローゼンバーグ | ||
| 酸素分析装置 | ビラップス - ローゼンバーグ | ||
| 鉗子#5 | ファイン科学ツール | 子宮脱落膜とを除去するために。 | |
| トリプシン-EDTA(0.25%) | ギブコ | 25200 |
参考文献
- Le Douarin, N., Kalcheim, C. The neural crest. , 2nd edn, Cambridge University Press. (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -P. Neural crest induction and differentiation. , Springer Science+Business Media, Landes Bioscience/Eurekah.com. (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved