Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung und Kultivierung von Zellen der Neuralleiste aus embryonalen murinen Neuralrohr
In diesem Artikel
Zusammenfassung
Isolierung von embryonalen Neuralleiste vom Neuralrohr erleichtert die Verwendung von In-vitro- Methoden zur Untersuchung von Migration, Selbsterneuerung und Multipotenz der Neuralleiste.
Zusammenfassung
Die embryonalen Neuralleiste (NC) ist ein multipotenten Vorläufer-Population, die an der dorsalen Seite des Neuralrohrs stammt, erfährt eine epitheliale zu mesenchymale Transition (EMT) und wandert während des Embryos, was zu diversen Zelltypen 1-3. NC hat auch die einzigartige Fähigkeit, die Differenzierung und Reifung von Zielorganen 6.4 zu beeinflussen. Wenn es in vitro explantiert, NC Vorläuferzellen Selbsterneuerung durchlaufen, Migration und Differenzierung in eine Vielzahl von Gewebetypen einschließlich Neuronen, Gliazellen, glatten Muskelzellen, Knorpel und Knochen.
NC Multipotenz wurde zum ersten Mal aus Explantaten der Vogelgrippe Neuralrohr 7-9 beschrieben. In-vitro-Isolierung von NC-Zellen erleichtert die Untersuchung der Dynamik NC einschließlich Proliferation, Migration, und Multipotenz. Weitere Arbeiten in den Vogel-und Ratten-Systemen gezeigt, dass explantierten NC-Zellen ihre NC-Potenzial zu behalten, wenn wieder in den Embryo verpflanzt 10-13. Da diese inhärenten zellulären Eigenschaften in explantierten NC Vorfahren bewahrt werden, bietet das Neuralrohr Explantat Assay eine attraktive Option für das Studium der NC in vitro.
Um ein besseres Verständnis der Säuger NC zu erreichen, wurden viele Verfahren verwendet worden, um NC-Populationen zu isolieren. NC-abgeleitete Vorläuferzellen aus der Post-wandernde Standorten können sowohl im Embryo und Erwachsenen, die Dynamik des Post-NC wandernden Vorläuferzellen 11,14-20 studieren kultiviert werden, jedoch Isolierung von NC-Vorläuferzellen, wie sie aus dem Neuralrohr auswandern sorgt für eine optimale Erhaltung der NC-Zellen-Potenzial und wandernde Eigenschaften 13,21,22. Einige Protokolle verwenden fluorescence activated cell sorting (FACS), einen NC Bevölkerung für bestimmte Vorläuferzellen 11,13,14,17 bereichert zu isolieren. Allerdings, wenn beginnend mit frühen Embryonen, sind ausreichende Zellzahlen für die Analysen nur schwer mit FACS erhalten, erschwert die Isolierung des frühen NC populations aus einzelnen Embryonen. Hier beschreiben wir einen Ansatz, der nicht auf FACS Ergebnisse angewiesen ist und in einer etwa 96% reines NC Bevölkerung auf einem Wnt1-Cre-Reporter aktivierte Linie 23 basiert.
Das hier vorgestellte Verfahren ist von Protokollen für die Kultur von Ratten-NC 11,13 optimiert angepasst. Die Vorteile dieses Protokoll im Vergleich zu früheren Verfahren sind, daß 1) die Zellen nicht auf einer Feeder-Schicht, 2 gezüchtet) FACS ist nicht erforderlich, eine relativ reine NC Bevölkerung, 3 zu erhalten) premigratory NC Zellen isoliert und 4) Ergebnisse sind leicht quantifiziert. Darüber hinaus ist dieses Protokoll für die Isolierung von NC von jedem mutante Maus-Modell verwendet, die die Untersuchung der NC-Eigenschaften mit unterschiedlichen genetischen Manipulationen. Die Einschränkung dieses Ansatzes ist, dass die NC aus dem Kontext des Embryos, von denen bekannt ist, um das Überleben, Migration und Differenzierung der NC 2,24-28 zu beeinflussen, wird entfernt.
Protokoll
1. Vorbereiten von Platten
- Verwenden steriler Technik zu jeder Zeit.
- Planen Fibronektin (FN) durch Verdünnen von 100 ul Blutplasma FN Brühe in einem Endvolumen von 3,3 ml in Dulbeccos PBS (DPBS). Endkonzentration 30 ug / ml, und dies kann bei 4 ° C für 1 Woche aufbewahrt werden.
- Titelbild Boden jeder Vertiefung einer sterilen Gewebekultur vier Well-Platte mit FN-Lösung und lassen Sie sich für 15 Minuten. Sicherstellen, dass die gesamte Oberfläche bedeckt ist. Machen Medien während dieser Zeit (die Schritte 2 und 3).
- Entfernen Sie FN-Lösung und erlauben Platten zum Trocknen auf. Vorsichtig spülen Wells mit 500 ul DMEM, DMEM entfernen, und fügen Sie 500 ul der Selbsterneuerung (SR) Medium (siehe unten). Bei 37 ° C in einem befeuchteten Inkubator mit 5 Prozent CO 2. Füllen Sie dieses etwa eine Stunde vor ihrer Zerlegung, so dass die Platten werden vor Gebrauch trocknen.
2. Vorbereiten SR Medium
- Für die Kultur des Vagus und des Rumpfes NCaus zehn Embryonen (etwa ein Wurf, je nach genetischem Hintergrund der Mauslinie), bereiten Sie 25 ml Medium SR. Kombinieren 12,5 ml niedrige Glukose-DMEM, 7,5 ml Neurobasalmedium, 25 ul Retinsäure (117 uM Endkonzentration) und 25 ul 2-Mercaptoethanol (50 mM Endkonzentration). Gut mischen.
- In 3,75 ml Hühnerembryo-Extrakt, 250 ul N 2 Salz Ergänzung, 500 ul B27 Ergänzung und 250 ul Penicillin-Streptomycin (1% Endkonzentration). Filtern Sie das Medium durch ein 0,22 um-Filter.
- Fügen Sie 10 ul sterilem IGF1 (20 ug / ml Endkonzentration) und 20 ul sterilem bFGF (20 ug / ml Endkonzentration). Mischen durch Invertieren. Lagerung bei 4 ° C.
3. Vorbereiten Waschmedium
- Für etwa 10 Embryonen vorzubereiten 50 ml Waschmedium. Kombinieren Sie 50 mg BSA mit 35 ml niedrige Glukose-DMEM, 15 ml Neurobasalmedium, und 500 ul Penicillin-Streptomycin (1% Endkonzentration). Sterilfilter mit einem 0,22um-Filter.
4. Vorbereiten Kollagenase / Dispase
- Dann werden 50 ul 100 mg / ml Collagenase / Dispase bis 5 ml DPBS. Gut mischen.
- Spritze mit Filter einen 0,2 um Filter und 1,5 mL in jedes der drei Vertiefungen einer zwölf Well-Platte. Pipette ca. 1 ml Wasch-mittel in den restlichen Brunnen. Bewahren gesamte Platte auf Eis, bis bereit, seziert Gewebe zu verdauen.
- Schneiden Sie Tipps eines P20 und P1000 Pipettenfilter Spitze mit einer sterilen Rasierklinge. Kurz unterhalb der abgeschrägten Kante der Spitze. Die abgeschnittenen P1000 wird verwendet, um den ganzen Embryo zu übertragen, während die p20 wird verwendet, um Stücke von isoliertem Gewebe übertragen werden kann.
5. Isolating Vagale und Trunk Neuralrohrs aus 9,5 DPC Embryonen
- Für zeitgesteuerte Schwangerschaften, sind Dämme mit einer vaginalen Stecker 0,5 DPC mittags als der Morgen der Stecker wird beobachtet. Opfern und entfernen die Gebärmutter bei 9,5 DPC.
- Entfernen Sie die Decidua von Gebärmutter und sanft rntfernen den Embryo aus der Decidua. Wenn mit diesem Protokoll erfahren, zu isolieren 3-4 9,5 dpc Embryonen zu einem Zeitpunkt in sterilem dPBS. Verwenden steriler Technik und sterilisiert Dissektionsinstrumente. Instrumente können durch Autoklavieren, Hitzesterilisation oder durch Inkubation in Ethanol sterilisiert werden.
- Für Front-vagalen NC: mit Insulin Nadeln, schneiden Sie das Neuralrohr in der Mitte Ohrplakode. Schneiden Sie wieder an der hinteren Kante des 4. Somiten. Trim Gewebe ventral des Neuralrohrs, die Schlundbögen und Herz zu entfernen.
- Für Stamm NC: mit Insulin Nadeln, entfernen Sie den Teil des Neuralrohrs zwischen Somiten 16-22 (oder der letzte Somiten, wenn Embryonen sind entwicklungsgeschichtlich älter als die 22 Somiten-Stadium).
- Halten Sie den Dottersack und alle verbleibenden embryonalem Gewebe für die Genotypisierung.
6. Entfernung von nicht-neuronalen Ektoderm und Mesoderm
- Legen Neuralrohr, die Segmente in Collagenase / Dispase bei Raumtemperatur für 10 Minutens. Unmittelbar in Waschmedium zu waschen.
- Zurück zur sterilen Gewebe dPBS. Mit einer sterilen Insulin-Nadeln, entfernen Sie vorsichtig die nicht-neuronalen Ektoderm aus dem Gewebe und trennen Sie die Somiten vom Neuralrohr. Die letzten Teile des Mesoderm von Somiten Gewebe kann durch Verreiben sanft mit einem Cut-down p20 Spitze entfernt werden. Seien Sie vorsichtig, um nicht zur Beschädigung des Neuralrohrs. Beachten Sie dies beim Zerreiben eng.
- Platzieren Sie die isolierten neuronalen Rohr durch einen zweiten und dritten 30 Sekunden Waschgang Waschmedium.
- Waschen einmal SR Medium, und legen die isolierten neuronalen Rohr in der Mitte eines FN-beschichteten, die zuvor hergestellt wurde (Schritt 1.3). Befeuchten die Hypoxie Kammer mit einem Gericht aus sterilem Wasser. Anschließend wird die Schale in die Kammer Hypoxie und spülen Sie die Kammer mit Mischgas bis 3% O 2 (verwenden Sie einen Tank mit einer Mischung aus 1% O 2, 6% CO 2, 93% N 2).
- Behandeln Sie die Kammer extrem vorsichtig zu gewährleisten that Explantate sind ungestört und bleiben in der Mitte der Brunnen.
- Bei 37 ° C. Zusammenfassung der Schritte 5-6 wird in 1 gezeigt.
7. Die Entfernung von Neuralrohrdefekten
- Nach 24 Stunden Inkubation, entfernen das Neuralrohr durch leichtes necken den Rand des Neuralrohr von den wandernden Zellen unter Verwendung einer sterilen Nadel Insulin. Entfernen und Entsorgen der Neuralrohr aus dem Medium mit einer sterilen p20 Schnitt wie in Schritt 6,2 und ersetzen Sie das Medium durch frisches Medium SR (Abbildung 2). Dies geschieht am einfachsten mit einem inversen Mikroskop.
8. Repräsentative Ergebnisse
Nach 24 Stunden Inkubation bei 37 ° C in hypoxischen Bedingungen, NC-Zellen haben sich von dem Neuralrohr in einer nahezu reinen Population (Abbildung 3a) migriert. Manchmal wird als ideal Kulturen nicht nachgeben robust Auswüchse. Zum Beispiel ist es möglich, dass nach 24 Stunden ter Neuralrohr wird auf sich selbst zusammengerollt haben und der NC wird nicht wandern weg von der Neuralrohrdefekte (Abbildung 3b). Gelegentlich wird das Neuralrohr nicht auf die mit Fibronectin beschichteten Platten zu befestigen.
Nach unserer Erfahrung können suboptimale NC Migration oder Probleme mit der Befestigung des Neuralrohrs negativ durch Normoxie Bedingungen oder Konzentration des Fibronektin betroffen sein, jeweils. Die enzymatische Aktivität der Kollagenase / Dispase variiert leicht von Batch-und Verdauung Zeit entsprechend angepasst werden müssen, jedoch nicht verdauen das Gewebe länger als 15 Minuten. Overdigestion des neuronalen Gewebes in Röhrchen mit Collagenase / Dispase auch zu einer mangelhaften Auswüchse führen. Wenn Somiten Gewebe nicht leicht von dem Neuralrohr nach Inkubation in Collagenase / Dispase entfernt wird, kann das Neuralrohr länger als zehn Minuten lang inkubiert werden. Manchmal das Neuralrohr nicht an dem Substrat. Wenn dies der Fall, überprüfen Sie die fibronecZinn-Konzentration und die Hypoxie Bedingungen.
Während normoxischen Bedingungen zur Kultur Wildtyp-NC verwendet werden können, hypoxischen Bedingungen genauer nachahmen die in vivo-Umgebung 29,30. Nach unserer Erfahrung wurde hypoxischen Bedingungen kritisch, wenn die Kultivierung Mutanten NC. Zum Beispiel, wenn Foxd3 Mutante NC in normoxischen Bedingungen kultiviert wurden, hatten Stamm NC eine stark reduzierte Zelle Auswachsen im Vergleich zu Kontrollen. Dieses Missverhältnis in Auswuchs Größe wurde entfernt, wenn die Explantate in hypoxischen Bedingungen (Abbildung 4) kultiviert wurden. Darüber hinaus, wenn Wildtyp-Neuralrohr Explantaten in Normoxie kultiviert wurden, war die Anzahl der Caspase-positiven Zellen größer als die ähnlicher Explantaten in Hypoxie kultiviert (Daten nicht gezeigt). Durch die Beibehaltung aller NC-Kultur in Hypoxie, können Vergleiche zwischen einfacher Steuerung und Dynamik der mutierten Kulturen durchgeführt werden.
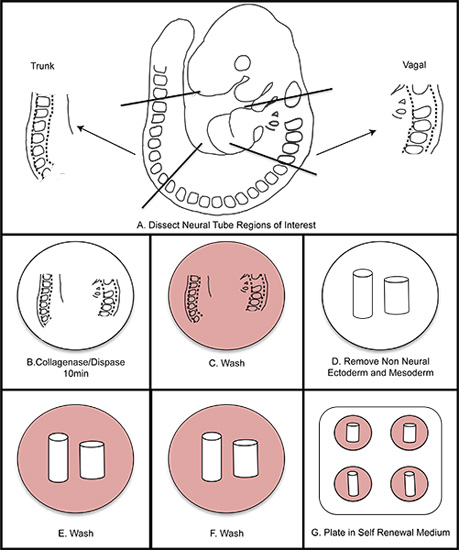
Abbildung 1. Insgesamt schematische von NC-Isolation. A) Dissect Regions of Interest aus dem Embryo. B) Digest Neuralrohr in Kollagenase / Dispase für 10 Minuten (nicht mehr als 15 Minuten). C) in Wasch-mittel waschen. D) Dissect weg die nicht-neuronalen Ektoderm und Mesoderm. EF) zweimal Waschen in Wasch-mittel. G) Platte in Selbsterneuerung Medium. Bei 37 ° C in 3% O 2 hypoxischen Bedingungen.
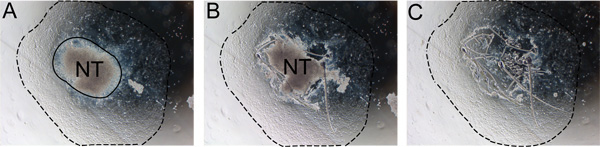
Abbildung 2. Schrittweise Entfernung von Neuralrohrdefekten aus Explantat. Das Neuralrohr muss nach 24-48 Stunden entfernt werden, um eine Kontamination mit nicht-NC-Zellen zu verhindern. A) Man beachte die Grenze zwischen dem Neuralrohr und der NC-Auswuchs (durchgezogene Linie). B) Schneiden Sie entlang der Kante des Neuralrohrs mit einer Insulin-Nadel. C) Entsorgen Sie das Neuralrohr und ersetzen Medium durch frisches Medium selbst zu erneuern. Eine gestrichelte Linie zeigt an, inwieweit der Auswuchs. Abkürzung: NT, Neuralrohr.
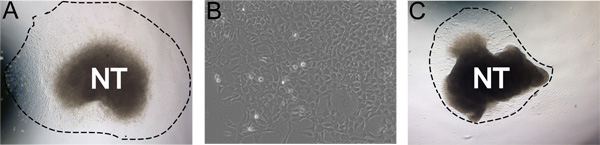
Abbildung 3. Beispiele für repräsentative Ergebnisse. A) Typische Explantat Auswachsen nach 24 Stunden Inkubation in Selbsterneuerung Medium in hypoxischen Bedingungen (gestrichelte Linie gibt Ausmaß der Auswuchs). B) Vergrößerte Ansicht von NC Auswuchs nach 48 Stunden in der Kultur. C) Weniger ideal Kultur mit geringer Ausbeute Auswuchs. A und C wurden unter den gleichen Bedingungen kultiviert wird. Bilder zeigen den natürlichen Verbreitungsgebieten in Kultur Robustheit. Dies kann durch die Effizienz des Neuralrohrs Isolation, Konzentration der FN, hypoxischen Bedingungen, und die Zeit in Kollagenase / Dispase Verdauung beeinträchtigt werden.
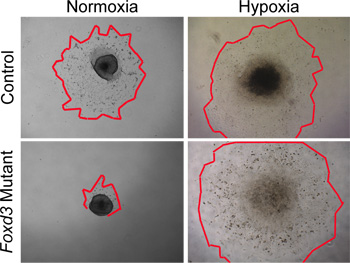
Abbildung 4. In-vitro-Analysen von NC Explantatkulturen in Normoxie gegenüber Hypoxie. Control (Wildtyp) NC-Zellen von Neuralrohr-Explantaten nach 48 Stunden in normoxischen Kulturbedingungen migriert. Im Gegensatz dazu Foxd3 MutanteNC war stark Zelle Auswüchse in Normoxie (rote Konturen Marke Kanten der NC Auswüchse) reduziert. Als vergleichbar Explantate unter hypoxischen Bedingungen angebaut wurden, wuchs Foxd3 mutierten NC-Explantate vergleichsweise zu den Kontrollen, so dass spätere Analysen. Beachten Sie, dieses Verhalten auch mit dem Verhalten der Foxd3 Mutante NC in vivo korreliert.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Besondere Aufmerksamkeit sollte auf die Entwicklungsstufe des Embryos zu zahlen, um den Erfolg dieses Ansatzes zu gewährleisten. Zählen von Somiten frühe Mausembryonen ist sowohl für die Bühne passend Embryonen innerhalb eines Wurfes und der Bestimmung der richtigen Regionen des Neuralrohrs für die Isolierung von entscheidender Bedeutung. Eine Variation von ein oder zwei Somiten zwischen Embryonen ist innerhalb einer angemessenen Palette von der zeitlichen Entwicklung, abhängig von der Auflösung des Experiments ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir möchten Marc Wozniak für Video-Hilfe anzuerkennen. Wir möchten auch Sean Morrison an der UT Southwestern anerkennen für das Original-Protokoll zur Kultivierung von Ratten-NC-Zellen. Diese Arbeit wurde Vanderbilt University Medical Center Academic Program-Support unterstützt und durch Zuschüsse der NIH (HD36720 und HD036720-11S109) und der AHA 11GRNT7690040 zu PAL, Chemiefonds Stipendien von der AHA (0615209B) und NIH (NS065604) zu NAM und ERP war unterstützt durch ein NIH Ausbildungsförderung T32HD007502.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagens | Firma | Katalog-Nummer | Kommentare |
| DMEM (low Glukose) | Gibco / Invitrogen | 11885 | |
| Neurobasalmedium | Gibco | 21103 | |
| BSA | Sigma | A3912-10G | |
| dPBS | Gibco | 14190-144 | |
| IGF1 | BD Biosciences | 354037 | Shop in 50 mu g / ml Aliquots bei -20 ° C. |
| bFGF | BD Biosciences | 354060 | Shop in 25 ug / ml Aliquots bei -20 ° C. |
| Fibronektin | Gibco | 33016-015 | Gespeichert in 1mg/ml aliquots bei -20 ° C |
| Retinsäure | Sigma | R2625 | Shop in 35 mu g / ml Aliquots nach Rekonstitution in Ethanol bei -20 ° C |
| 2-Mercaptoethanol | Sigma | D-5637 | |
| N 2 Ergänzung | Gibco | 17502-048 | |
| B27 Ergänzung | Gibco | 17504-044 | |
| Steriflip 0,22 um Filter | Millipore | SCGP00525 | |
| Penicillin-Streptomycin | Invitrogen | 15140122 | |
| 0,20 um-Filter | Corning | 431219 | |
| Spritzen (für die Filtration) | BD Biosciences | 301604 | |
| Vier-Well-Platten | Thermo Fisher Scientific | 176740 | |
| Collagenase / Dispase | Roche | 269 638 | Aktivität variiert je nach Charge. Shop in 100 mg / ml Aliquots bei -20 ° C. |
| Insulin Nadeln (29 ½ Gage) | Becton Dickson | 309306 | |
| Hypoxie-Kammer | Billups-Rothenberg | ||
| Sauerstoff-Analysator | Billups-Rothenberg | ||
| Pinzetten # 5 | Fine Science Tools | Zur Entfernung von Gebärmutter und Decidua. | |
| Trypsin-EDTA (0,25%) | Gibco | 25200 |
Referenzen
- Le Douarin, N., Kalcheim, C. The neural crest. , 2nd edn, Cambridge University Press. (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -P. Neural crest induction and differentiation. , Springer Science+Business Media, Landes Bioscience/Eurekah.com. (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten