È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento e la coltura delle cellule della cresta neurale da Embryonic Murine tubo neurale
In questo articolo
Riepilogo
Isolamento di embrionale cresta neurale dal tubo neurale facilita l'uso di In vitro Metodi per lo studio della migrazione, self-renewal, e multipotenza di cresta neurale.
Abstract
Il embrionale cresta neurale (NC) è una popolazione di cellule progenitrici multipotenti che si origina nel lato dorsale del tubo neurale, subisce un epitelio di transizione mesenchimale (EMT) e migra in tutta l'embrione, dando luogo a diversi tipi di cellule 1-3. NC ha anche la capacità unica di influenzare la differenziazione e la maturazione degli organi bersaglio 4-6. Quando espiantato in vitro, progenitori NC sottoposti a self-renewal, migrare e differenziarsi in una varietà di tipi di tessuto compresi i neuroni, glia, cellule muscolari lisce, cartilagine e osso.
Multipotenza NC è stata descritta da espianti del tubo neurale aviaria 7-9. In isolamento in vitro di cellule NC facilita lo studio delle dinamiche NC, compresa la proliferazione, la migrazione e multipotenza. Ulteriori attività nei sistemi di aviaria e nel ratto hanno dimostrato che le cellule espiantati NC mantengono il loro potenziale NC, quando trapiantati in embrione 10-13. Poiché queste proprietà intrinseche cellulari sono conservati in espiantati progenitori NC, il saggio di espianto del tubo neurale fornisce un'opzione interessante per lo studio della NC in vitro.
Per ottenere una migliore comprensione del mammifero NC, molti metodi sono stati impiegati per isolare popolazioni NC. NC-derivati progenitori può essere coltivato da posizioni post-migratori, sia l'embrione e adulti per studiare la dinamica di post-migratori progenitori NC 11,14-20, tuttavia l'isolamento di cellule progenitrici NC in quanto emigrano dal tubo neurale fornisce la migliore conservazione dei NC potenzialità e le proprietà delle cellule migratorie 13,21,22. Alcuni protocolli impiegano fluorescenza selezione delle cellule attivate (FACS) per isolare una popolazione NC arricchito per progenitori particolari 11,13,14,17. Tuttavia, quando a partire da embrioni in fase iniziale, il numero di cellule sufficienti per le analisi sono difficili da ottenere con FACS, complicando l'isolamento dei primi NC populations da embrioni individuali. Qui, descriviamo un approccio che non si basa su FACS ed i risultati in una popolazione di circa il 96% NC puro basato su un Wnt1 Cre-giornalista attivato lignaggio 23.
Il metodo presentato qui è l'adattamento di protocolli ottimizzati per la cultura di ratto NC 11,13. I vantaggi di questo protocollo rispetto ai precedenti metodi che sono 1) le cellule non sono cresciute su uno strato alimentatore, 2) FACS non è necessaria per ottenere una popolazione relativamente puro NC, 3) NC premigratory cellule vengono isolate e 4) risultati sono facilmente quantificato. Inoltre, questo protocollo può essere utilizzato per l'isolamento di NC da qualsiasi modello di topo mutante, facilitando lo studio delle caratteristiche NC con diverse manipolazioni genetiche. Il limite di questo approccio è che il NC viene rimosso dal contesto dell'embrione, che è noto per influenzare la, migrazione sopravvivenza e la differenziazione del NC 2,24-28.
Protocollo
1. Preparazione Piastre
- Utilizzare la tecnica sterile in ogni momento.
- Preparare fibronectina (FN) diluendo 100 pl di plasma umano archivio di FN in un volume finale di 3,3 ml in PBS di Dulbecco (DPBS). Concentrazione finale è di 30 ug / ml e questo può essere conservato a 4 ° C per 1 settimana.
- Coprire fondo di ciascun pozzetto di una sterile coltura tissutale quattro piastre con soluzione FN e lasciate riposare per 15 minuti. Assicurarsi che l'intera superficie è coperta. Assicurarsi che il supporto durante questo periodo (punti 2 e 3).
- Rimuovere FN soluzione e consentire piastre asciugare. Lavare delicatamente i pozzetti con 500 microlitri DMEM, rimuovere DMEM, e aggiungere 500 microlitri di auto-rinnovamento (SR) medio (vedi sotto). Incubare a 37 ° C in un incubatore umidificato contenente il 5 percento CO 2. Completa questo circa un'ora prima della dissezione in modo che le piastre saranno asciutti prima dell'uso.
2. Preparazione Medio SR
- Per la cultura della vagale e del tronco NCda dieci embrioni (circa una cucciolata, a seconda del background genetico della linea di mouse), preparare 25 mL di mezzo di SR. Combina 12,5 mL bassa di glucosio DMEM, 7,5 ml di mezzo Neurobasal, 25 microlitri di acido retinoico (117 uM concentrazione finale), e 25 pl 2-mercaptoetanolo (50 mM di concentrazione finale). Mescolare bene.
- Aggiungere 3,75 ml di estratto di Chick Embryo, 250 microlitri N 2 supplemento di sale, 500 microlitri B27 supplemento e 250 microlitri di penicillina-streptomicina (1% concentrazione finale). Filtrare il mezzo attraverso un filtro 0,22 micron.
- Aggiungere 10 L IGF1 sterile (20 ug / ml concentrazione finale) e 20 pl bFGF sterile (20 ug / ml concentrazione finale). Miscelare per inversione. Conservare a 4 ° C.
3. Preparazione Media Wash
- Per circa 10 embrioni preparare 50 ml di mezzo di lavaggio. Combinare 50 mg BSA con 35 mL di glucosio DMEM bassa, 15 ml di mezzo Neurobasal, e 500 pl penicillina-streptomicina (1% concentrazione finale). Filtro sterile con 0,22Filtro um.
4. Preparazione Collagenasi / dispasi
- Aggiungere 50 pl di 100 mg / ml di collagenasi / dispasi a 5 ml DPBS. Mescolare bene.
- Siringa filtro da 0,2 um filtrare e aggiungere 1,5 ml in ciascuna delle tre pozzetti di una piastra ben dodici. Pipettare circa 1 ml di mezzo di lavaggio nei pozzetti rimanenti. Conservare intera piastra sul ghiaccio fino al momento di digerire il tessuto sezionato.
- Tagliare punte di una punta P20 e P1000 pipetta filtro con una lama di rasoio sterile. Tagliare appena sotto il bordo smussato della punta. Il cut off p1000 saranno utilizzati per trasferire l'embrione, mentre tutta la p20 verrà utilizzato per trasferire i pezzi di tessuto isolato.
5. Isolamento vagale e Tube Trunk Neural da 9,5 embrioni DPC
- Per le gravidanze temporizzati, dighe con un tappo vaginale sono considerati 0,5 dpc a mezzogiorno del mattino la spina si osserva. Sacrificio e rimuovere l'utero a 9,5 DPC.
- Rimuovere la decidua dall'utero e delicatamente rTogliete l'embrione dalla decidua. Una volta sperimentato con questo protocollo, isolare 3-4 9.5 embrioni DPC in un momento in DPBS sterili. Utilizzare la tecnica sterile e strumenti di dissezione sterilizzati. Gli strumenti possono essere sterilizzati in autoclave, sterilizzazione a calore o di incubazione in etanolo.
- Per vagale anteriore NC: usando aghi da insulina, tagliare il tubo neurale alla placode metà otic. Tagliare di nuovo al margine posteriore del somite 4 °. Tagliare il tessuto ventrale del tubo neurale per rimuovere gli archi faringei e il cuore.
- Per NC tronco: usando aghi da insulina, rimuovere la parte del tubo neurale tra 16-22 somiti (o l'ultimo somite, se gli embrioni sono evolutivamente anteriore a quella fase di 22 somite).
- Tenere il sacco vitellino e qualsiasi tessuto embrionale residuo per la genotipizzazione.
6. Rimozione di non-neurale ectoderma e mesoderma
- Porre tubo neurale contenente segmenti in collagenasi / dispasi a temperatura ambiente per 10 minutis. Lavare immediatamente in mezzo lavaggio.
- Ritorna tessuto DPBS sterili. Utilizzo di aghi da insulina sterile, rimuovere delicatamente il non-neurale ectoderma dal tessuto e separare i somiti lontano dal tubo neurale. Le parti restanti del ultime mesoderma dal tessuto somite può essere rimosso triturando delicatamente con un cut-down p20 punta. Fare attenzione a non danneggiare il tubo neurale. Osservare attentamente la situazione durante la triturazione.
- Posizionare il tubo neurale attraverso isolato un secondo e il terzo lavaggio a 30 secondo di media lavaggio.
- Risciacquare una volta in mezzo SR, e posizionare il tubo isolato neurale nel centro di un FN rivestita bene che è stato preparato precedentemente (Fase 1,3). Umidificare la camera di ipossia con un piatto di acqua sterile. Porre la capsula nella camera di ipossia e lavare la camera con gas miscelato al 3% O 2 (utilizzare un serbatoio contenente una miscela di 1% O 2, 6% CO 2, 93% N 2).
- Maneggiare sempre la camera con estrema attenzione per garantire that espianti sono indisturbati e rimangono nel centro dei pozzetti.
- Incubare a 37 ° C. Sintesi dei passaggi 5-6 è mostrato in Figura 1.
7. La rimozione del tubo neurale
- Dopo 24 ore di incubazione, rimuovere il tubo neurale delicatamente stuzzicando il bordo del tubo neurale lontano dalle cellule migranti usando un ago sterile di insulina. Rimuovere e gettare il tubo neurale dal mezzo mediante taglio sterile p20 come nel passaggio 6,2 e sostituire il mezzo con mezzo fresco SR (Figura 2). Questo viene fatto più facilmente utilizzando un microscopio invertito.
8. Risultati rappresentativi
Dopo 24 ore di incubazione a 37 ° C in condizioni di ipossia, celle NC siano trasferite dal tubo neurale in una popolazione quasi puro (Figura 3a). A volte, meno di culture, ideali non produrrà escrescenze robuste. Ad esempio, è possibile che dopo 24 ore tegli tubo neurale avrà arrotolato su se stessa e il CN non si allontanino dal tubo neurale (Figura 3b). Di tanto in tanto il tubo neurale non si attaccano alle piastre rivestite fibronectina.
Nella nostra esperienza, sub-ottimale la migrazione NC o problemi con il collegamento del tubo neurale può essere influenzato negativamente da condizioni normossia o concentrazione della fibronectina, rispettivamente. L'attività enzimatica della collagenasi / dispasi varia leggermente per partita e tempo di digestione deve essere opportunamente regolata, tuttavia, non digerire il tessuto più di quindici minuti. Overdigestion del tubo neurale in tessuto contenente collagenasi / dispasi comporterà anche escrescenze carenti. Se il tessuto somite non viene facilmente rimosso dal tubo neurale dopo incubazione in collagenasi / dispasi, il tubo neurale può essere incubate per più di dieci minuti. Talvolta il tubo neurale non collegare al substrato. Se questo è il caso, controllare la fibronecstagno di concentrazione e le condizioni di ipossia.
Mentre condizioni di normossia può essere utilizzato per coltura di tipo selvatico NC, condizioni di ipossia imitare maggiormente l'ambiente in vivo 29,30. Nella nostra esperienza, condizioni di ipossia si critica quando la coltura mutante NC. Per esempio, quando Foxd3 mutante NC sono stati coltivati in condizioni di normossia, tronco NC aveva una escrescenza cella notevolmente ridotto rispetto ai controlli. Questa disparità di dimensioni escrescenza stato rimosso quando gli espianti sono stati coltivati in condizioni di ipossia (Figura 4). Inoltre, quando wild-type espianti tubo neurale sono state coltivate in normossia, il numero di caspasi-cellule positive era maggiore di quella di analoghi espianti coltivati in ipossia (dati non mostrati). Mantenendo tutta la cultura NC in ipossia, i confronti possono più facilmente essere fatta tra le dinamiche di controllo e culture mutanti.
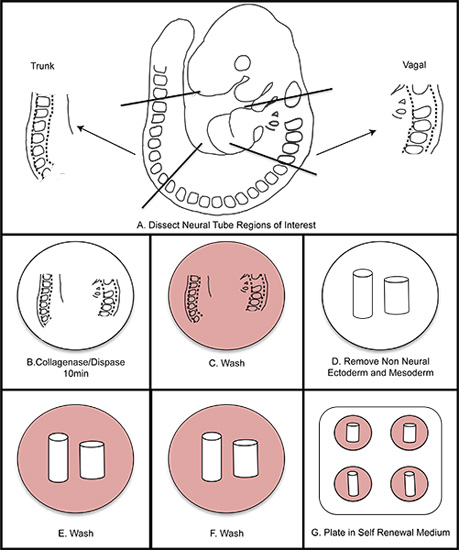
Figura 1. Schematica complessiva di isolamento NC. A) Dissect regioni di interesse dall'embrione. B) Digest del tubo neurale in collagenasi / dispasi per dieci minuti (non superiore a quindici minuti). C) Lavare in mezzo di lavaggio. D) Dissect via il non-neurale ectoderma e mesoderma. EF) Lavare due volte in mezzo di lavaggio. G) Piatto in media rinnovamento di noi stessi. Incubare a 37 ° C in 3% O 2 condizioni di ipossia.
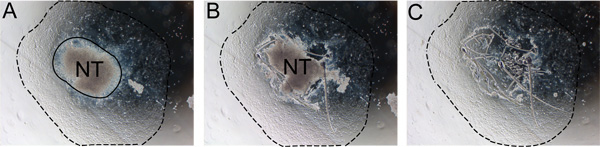
Figura 2. La rimozione graduale del tubo neurale di espianto. Il tubo neurale deve essere rimosso dopo 24-48 ore per evitare la contaminazione con cellule non-NC. A) Si noti il confine tra il tubo neurale e la conseguenza NC (linea continua). B) Tagliare lungo il bordo del tubo neurale con un ago da insulina. C) Eliminare il tubo neurale e sostituire media con terreno fresco rinnovamento di noi stessi. Linea tratteggiata indica la conseguenza della misura. Abbreviazione: NT, del tubo neurale.
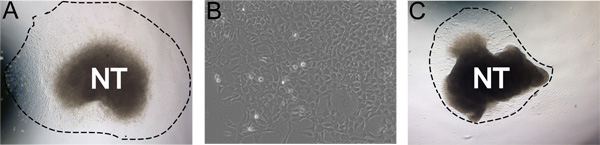
Figura 3. Esempi rappresentativi di risultati. A) escrescenza espianto tipica dopo 24 ore di incubazione in terreno di rinnovamento di noi stessi in condizioni di ipossia (linea tratteggiata indica la conseguenza della misura). B) Visualizzazione ingrandita della crescita degli NC dopo 48 ore di coltura. C) cultura meno ideale, con bassa resa escrescenza. A e C sono state coltivate nelle stesse condizioni. Le immagini mostrano la gamma naturale robustezza cultura. Questo può essere influenzata da efficienza di isolamento tubo neurale, la concentrazione di FN, condizioni di ipossia, e il tempo in collagenasi / dispasi digestioni.
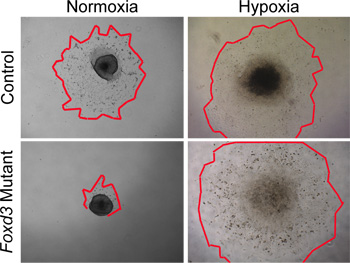
Figura 4. Nelle analisi in vitro di culture espianti NC in normossia contro l'ipossia. Di controllo (tipo selvatico), le cellule migrate NC da espianti del tubo neurale dopo 48 ore in condizioni di coltura normossia. Al contrario, Foxd3 mutanteNC si era notevolmente ridotto escrescenze cellulari in normossia (bordi rossi contorni marchio delle escrescenze NC). Quando espianti comparabili sono state coltivate in condizioni di ipossia, Foxd3 mutanti espianti NC è cresciuta relativamente ai controlli, consentendo analisi successive. Nota, questo comportamento correlava bene con il comportamento di Foxd3 mutante NC in vivo.
Access restricted. Please log in or start a trial to view this content.
Discussione
Particolare attenzione dovrebbe essere prestata alla fase di sviluppo dell'embrione per assicurare il successo di questo approccio. Contando somiti di embrioni di topo primi è fondamentale sia per la fase di adattamento embrioni all'interno di una cucciolata e la determinazione delle regioni corrette di tubo neurale per l'isolamento. Una variazione di uno o due somiti tra embrioni è entro una gamma ragionevole di temporizzazione di sviluppo, a seconda della risoluzione dell'esperimento condotto. Un emb...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Vorremmo riconoscere Marc Wozniak per l'assistenza video. Vorremmo inoltre ringraziare Sean Morrison del Southwestern per il protocollo originale per la coltura di cellule di ratto NC. Questo lavoro è stato supportato Vanderbilt University Medical Support programma Academic Center e da sovvenzioni da parte del NIH (HD36720 e HD036720-11S109) e il 11GRNT7690040 AHA a PAL, borse predoctoral della AHA (0615209B) e NIH (NS065604) a NAM, e ERP è stato sostenuta da una sovvenzione del NIH di formazione T32HD007502.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente | Azienda | Numero di catalogo | Comments |
| DMEM (glucosio basso) | Gibco / Invitrogen | 11885 | |
| Media Neurobasal | Gibco | 21103 | |
| BSA | Sigma | A3912-10G | |
| DPBS | Gibco | 14190-144 | |
| IGF1 | BD Biosciences | 354037 | Conservare in 50 ug / mL aliquote a -20 ° C. |
| bFGF | BD Biosciences | 354060 | Conservare in 25 ug / ml aliquote a -20 ° C. |
| Fibronectina | Gibco | 33016-015 | Conservata nella 1mg/mL aliquots a -20 ° C. |
| L'acido retinoico | Sigma | R2625 | Conservare a 35 mcg / ml aliquote dopo ricostituzione in etanolo a -20 ° C. |
| 2-mercaptoetanolo | Sigma | D-5637 | |
| N 2 integratore | Gibco | 17502-048 | |
| B27 supplemento | Gibco | 17504-044 | |
| Steriflip 0,22 micron filtri | Millipore | SCGP00525 | |
| Penicillina-streptomicina | Invitrogen | 15140122 | |
| 0,20 micron filtri | Corning | 431219 | |
| Siringhe (per filtrazione) | BD Biosciences | 301604 | |
| Quattro pozzetti | Thermo Fisher Scientific | 176740 | |
| Collagenasi / dispasi | Roche | 269 638 | Attività varia a seconda del lotto. Conservare in 100 mg / mL aliquote a -20 ° C. |
| Insulina aghi (Calibro 29 ½) | Becton Dickson | 309306 | |
| Camera di ipossia | Billups-Rothenberg | ||
| Oxygen Analyzer | Billups-Rothenberg | ||
| Pinza # 5 | Strumenti di Scienze Belle | Per la rimozione di utero e decidua. | |
| Tripsina-EDTA (0,25%) | Gibco | 25200 |
Riferimenti
- Le Douarin, N., Kalcheim, C. The neural crest. , 2nd edn, Cambridge University Press. (1999).
- Kulesa, P. M., Gammill, L. S. Neural crest migration: patterns, phases and signals. Developmental biology. 344, 566-568 (2010).
- Saint-Jeannet, J. -P. Neural crest induction and differentiation. , Springer Science+Business Media, Landes Bioscience/Eurekah.com. (2006).
- Plank, J. L. Influence and timing of arrival of murine neural crest on pancreatic beta cell development and maturation. Developmental biology. 349, 321-330 (2011).
- Nekrep, N., Wang, J., Miyatsuka, T., German, M. S. Signals from the neural crest regulate beta-cell mass in the pancreas. Development. 135, 2151-2160 (2008).
- Freem, L. J. The intrinsic innervation of the lung is derived from neural crest cells as shown by optical projection tomography in Wnt1-Cre;YFP reporter mice. J. Anat. 217, 651-664 (2010).
- Cohen, A. M., Konigsberg, I. R. A clonal approach to the problem of neural crest determination. Developmental biology. 46, 262-280 (1975).
- Sieber-Blum, M., Cohen, A. M. Clonal analysis of quail neural crest cells: they are pluripotent and differentiate in vitro in the absence of noncrest cells. Developmental biology. 80, 96-106 (1980).
- Baroffio, A., Dupin, E., Douarin, N. M. L. e Common precursors for neural and mesectodermal derivatives in the cephalic neural crest. Development. 112, 301-305 (1991).
- White, P. M. Neural crest stem cells undergo cell-intrinsic developmental changes in sensitivity to instructive differentiation signals. Neuron. 29, 57-71 (2001).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Bronner-Fraser, M., Sieber-Blum, M., Cohen, A. M. Clonal analysis of the avian neural crest: migration and maturation of mixed neural crest clones injected into host chicken embryos. J. Comp. Neurol. 193, 423-434 (1980).
- Stemple, D. L., Anderson, D. J. Isolation of a stem cell for neurons and glia from the mammalian neural crest. Cell. 71, 973-985 (1992).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Biernaskie, J. A., McKenzie, I. A., Toma, J. G., Miller, F. D. Isolation of skin-derived precursors (SKPs) and differentiation and enrichment of their Schwann cell progeny. Nat. Protoc. 1, 2803-2812 (2006).
- Chung, I. H. Stem cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development. Stem Cells. 27, 866-877 (2009).
- Biernaskie, J. SKPs derive from hair follicle precursors and exhibit properties of adult dermal stem cells. Cell Stem Cell. 5, 610-623 (2009).
- Hagedorn, L., Suter, U., Sommer, L. P0 and PMP22 mark a multipotent neural crest-derived cell type that displays community effects in response to TGF-beta family factors. Development. , 126-3781 (1999).
- Heanue, T. A., Pachnis, V. Prospective identification and isolation of enteric nervous system progenitors using Sox2. Stem Cells. 29, 128-140 (2011).
- Morrison, S. J. Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells. J. Neurosci. 20, 7370-7376 (2000).
- Ito, K., Morita, T., Sieber-Blum, M. In vitro clonal analysis of mouse neural crest development. Developmental biology. 157, 517-525 (1993).
- Etchevers, H. Primary culture of chick, mouse or human neural crest cells. Nat. Protoc. 6, 1568-1577 (2011).
- Mundell, N. A., Labosky, P. A. Neural crest stem cell multipotency requires Foxd3 to maintain neural potential and repress mesenchymal fates. Development. 138, 641-652 (2011).
- Gammill, L. S., Gonzalez, C., Gu, C., Bronner-Fraser, M. Guidance of trunk neural crest migration requires neuropilin 2/semaphorin 3F signaling. Development. 133, 99-106 (2006).
- Gammill, L. S., Gonzalez, C., Bronner-Fraser, M. Neuropilin 2/semaphorin 3F signaling is essential for cranial neural crest migration and trigeminal ganglion condensation. Dev. Neurobiol. 67, 47-56 (2007).
- Kasemeier-Kulesa, J. C., Bradley, R., Pasquale, E. B., Lefcort, F., Kulesa, P. M. Eph/ephrins and N-cadherin coordinate to control the pattern of sympathetic ganglia. Development. 133, 4839-4847 (2006).
- Osborne, N. J., Begbie, J., Chilton, J. K., Schmidt, H., Eickholt, B. J. Semaphorin/neuropilin signaling influences the positioning of migratory neural crest cells within the hindbrain region of the the chick. Dev. Dyn. 232, 939-949 (2005).
- Schwarz, Q., Maden, C. H., Vieira, J. M., Ruhrberg, C. Neuropilin 1 signaling guides neural crest cells to coordinate pathway choice with cell specification. Proc. Natl. Acad. Sci. U.S.A. 106, 6164-6169 (2009).
- Simon, M. C., Keith, B. The role of oxygen availability in embryonic development and stem cell function. Nat. Rev. Mol. Cell Biol. 9, 285-296 (2008).
- Ivanovic, Z. Hypoxia or in situ normoxia: The stem cell paradigm. J. Cell Physiol. 219, 271-275 (2009).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon