A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التلاعب الجيني للمخيخي الحبيبة الخلايا العصبية
In This Article
Summary
التشكل العصبية والهجرة هي الأحداث الحاسمة الكامنة وراء نمو الدماغ السليم. هنا، نحن تصف أساليب التلاعب وراثيا مثقف الخلايا العصبية الحبيبية للدماغ والمخيخ النامية لتقييم التشكل وخصائص المهاجرة من الخلايا العصبية.
Abstract
الأحداث التنموية في الدماغ بما في ذلك التشكل العصبية والهجرة ومدبرة للغاية العمليات. في المختبر والمجراة تحليلات تسمح لتوصيف متعمقة لتحديد مسارات المشاركة في هذه الأحداث. الخلايا العصبية الحبيبية للدماغ (CGNs) التي هي مستمدة من المخيخ النامية هي نظام النموذج المثالي الذي يسمح للالتحليلات المورفولوجية. هنا، نحن تصف طريقة لكيفية التلاعب وراثيا CGNs وكيفية دراسة axono وdendritogenesis من الخلايا العصبية الفردية. مع هذا الأسلوب آثار تدخل الحمض النووي الريبي، من overexpression أو جزيئات صغيرة يمكن مقارنة للسيطرة على الخلايا العصبية. بالإضافة إلى ذلك، القشرة القوارض المخيخ هو الوصول إليها بسهولة في نظام الجسم الحي بسبب تطوره بعد الولادة الغالبة. كما نقدم لفي الجسم الحي تقنية التثقيب الكهربائي للتلاعب وراثيا في مخيخات النامية ووصف المخيخ لاحقة يحلل لتقييم مورفولوجيا الخلايا العصبية والثانية الهجرة.
Introduction
المخيخ هو نظام ممتاز لدراسة آليات النمو محوار والهجرة. وكان المخيخ موضوع الدراسات التشريحية منذ فجر علم الأعصاب 1. المجهري الحديثة والتقنيات المناعى توسعت بشكل كبير والمكرر الاكتشافات الأولية من قبل سانتياغو رامون، وكاجال 2-4. علم الوراثة الجزيئي الماوس والدراسات كشفت عوامل النمو والنسخ أساسيا في السيطرة على التنمية المخيخ، مما أدى إلى فهم أكبر من الأحداث الحاسمة اللازمة لالأسلاك المناسبة من أنواع مختلفة من الخلايا العصبية بما في ذلك الخلايا العصبية الحبيبية للدماغ (CGNs) 5-7.
المخيخ هو مشتق من قسيم معيني 1 من الدماغ المؤخر النامية 8. الشفة المعينية، الذي هو جزء من سقف البطين 4 الجاري، يثير المخيخ الأسلاف الحبيبية الخلايا العصبية، والتي سوف تشكل معظم سكان العديد من الخلايا العصبية فيالمخيخ الكبار 9. بعد الهجرة منقاري، يحلون في بدأة المخيخ. هنا، الانقسام السلائف الحبيبية الخلايا العصبية يؤدي إلى التوسع الهائل في الطبقة الحبيبية الخارجية (EGL)، الذي يقام بعد الولادة في القوارض. من EGL، الخلايا العصبية تبدأ الهجرة إلى الداخل من خلال طبقة الجزيئية (ML)، في الماضي طبقة الخلايا العصبية لتأخذ في نهاية المطاف الإقامة في الطبقة الحبيبية الداخلية (IGL 2). أثناء هذه العملية المهاجرة، ويكتسبون شكل ثنائي القطب مع اثنين من محاور عصبية تمتد إلى ML. وبعد مزيد من الهجرة، وجسم الخلية يهاجر بعيدا عن المحاور والعمليتين تلتحم لتشكل واحدة من شقين، على شكل حرف T محوار 10. في وقت لاحق، وهذه المحاور fasciculate ويشار إلى ألياف متوازية كما. بعد أن استقر في IGL، CGNs تنمو التشعبات، والتي تشكل مخالب شجيري لإنشاء نقاط الاشتباك العصبي مع ألياف المطحلب. لدراسة العمليات الأساسية في المخيخ النامية، مجتمعة في المختبر والمجراة في approacح يسمح لنتائج واستنتاجات موثوقة.
CGNs ليست فقط الخلايا العصبية الأكثر عددا من المخيخ ولكن من الدماغ كله، ويمكن أن يكون مثقف لدرجة عالية من النقاوة 11-13. في الثقافة، تصبح هذه الخلايا العصبية السكان متجانسة للغاية تالية للتفتل بسرعة ويكتسب التشكل القطبي مع المحاور التي يسهل التعرف عليها والتشعبات. وقد أثبتت CGNs مثقف أن يكون مفيدا للغاية لدراسة مختلف جوانب التنمية بما في ذلك انتشار العصبية السلف، والتمايز، محور عصبي والتنمية التغصنات، هجرة الخلايا العصبية، الخلايا والخصائص الكهربية (14-19 وغيرها كثير). استخدام التلاعب الجيني توسعت براعة CGNs مثقف وسمح لمزيد من التبصر الآلية في الأحداث سالفة الذكر. ترنسفكأيشن من الخلايا العصبية مثقف باستخدام فوسفات الكالسيوم وانخفاض الكفاءة أو طرق محبة للدهون يليه مناعية مع علامات قطبية أو المدعومة من برامج التحليل faciliتيتس تقييم مثل مورفولوجيا الخلايا العصبية الفردية في ثقافة العصبية الكثيفة. مع هذا النهج، يمكن دراسة دور البروتينات من الاهتمام في محور عصبي أو التغصنات النمو 20-25،26-28. ولكن هذا النظام هو أقل ثقافة من المفيد تحليل الهجرة العصبية كما الهجرة محدودة جدا في الثقافات عالية الكثافة وسيتطلب cocultures. تحليل في المختبر من محور عصبي والنمو التغصنات يسمح أيضا لفحص البروتينات المترابطة لمسار الإشارات باستخدام مزيج من تدخل الحمض النووي الريبي (ط)، والإفراط في التعبير أو جزيئات صغيرة.
لتحديد أهمية البروتين من الفائدة في محور عصبي وتنظيم نمو التغصنات أو هجرة الخلايا العصبية، وفي electroporation فيفو (IVE) الأسلوب يسمح للتحليل في القشرة المخيخ النامية. نظرا لحقيقة أن التنمية في المخيخ القوارض يمتد الطريق إلى أول أسبوعين بعد الولادة، المخيخ يمثل accessibلو بنية الدماغ للتلاعب الجيني لدراسة تطوير محاور عصبية والتشعبات، والهجرة العصبية synaptogenesis، وموت الخلايا المبرمج و20-24،29،30،26،27،31-34. بالإضافة إلى ذلك، هذا النظام نموذج مفيد أيضا لجوانب أخرى للتنمية الخلايا العصبية التي تتطلب قشرة دماغ سليمة مثل محوار الاستطلاعية، والأسلاك والتواصل بين الخلايا العصبية والتفاعلات العصبية، الدبقية مجتمعة، ويوفر هذا البروتوكول في المختبر والمجراة في تقنيات لمعالجة اتباع نهج متكامل بشأن التشكل العصبية والهجرة.
Protocol
CGNs يمكن إعداد إما من يوم ما بعد الولادة (P) 5 الجراء الماوس أو الفئران الوليدة P6. ونحن نتابع بروتوكول، التي وصفها Bilimoria والزملاء، والذي يستخدم لتحديد مثبط الإنقسامية لCGNs تالية للتفتل 13.
بيان الأخلاق:
وقد أجريت جميع التجارب التي تنطوي على الحيوانات الحية وفقا لبروتوكول الحيوانية التي وافقت عليها "Verbraucherschutz اوند Lebensmittelsicherheit" من ولاية سكسونيا السفلى، ألمانيا.
في مقايسة المختبر:
1. إعداد الحمض النووي البلازميد، وسائل الإعلام، والمخازن المؤقتة للفوسفات الكالسيوم ترنسفكأيشن الطريقة
- حل الحمض النووي البلازميد في معقمة وخالية من الذيفان الداخلي المياه؛ DMEM (الجلوكوز عالية)، وجعل 2.5 M و CaCl 2، وجعل 2X HBSS (حل 4 ز كلوريد الصوديوم، 0.1775 ز بوكل، 0.095 ز نا 2 هبو 4 • 7H 2 O، 0.675 غرام جلوكوز و2.5 غرام في 250 مل HEPES الماء عالى النقاء وضبط درجة الحموضة إلى 7.05، 7.08، 7.11 و). ملاحظة: عند إعدادالحل 2X HBSS، الاختبار الذي يعطي أفضل النتائج فيما يتعلق الحموضة كفاءة ترنسفكأيشن من تركيبة معينة من البلازميدات.
2. ترنسفكأيشن من الخلايا العصبية مثقف
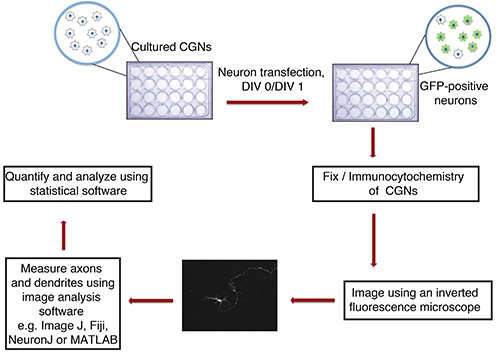
الشكل 1. انسيابي من محوار في المختبر والتغصنات النمو الفحص. و transfected مثقف CGNs (24 لوحة جيدا مع coverslips الزجاج)، معزولة عن الفئران الوليدة P6، في DIV 0 أو 1 مع راسب الحمض النووي التي تحتوي على علامة ترنسفكأيشن الفلورسنت (مثل GFP). بعد تثبيت وكيمياء سيتولوجية مناعية، يتم تصوير الخلايا العصبية بطريقة أعمى. يتم استيراد الصور إلى يماغيج ويتم قياس العمليات. ثم تتم معالجة القياسات باستخدام البرنامج الإحصائي.
- CGNs البذور (20 × 10 6 في 24 لوحة جيدا؛ BME، و 10٪ مصل العجل، 2 مم البنسلين-Streptomycin-الجلوتامين (باريس سان جيرمان)، و 25 ملي بوكل) على النيتريك حمض غسلها، المغلفة polyornithine 12 مم coverslips الزجاج في 24 لوحة جيدا مع 500 ميكرولتر من وسائل الإعلام لكل بئر.
- في يوم في المختبر (DIV) 0 (لا يقل عن 8 ساعة بعد الطلاء) أو 1 DIV، وجمع وسائل الإعلام والحفاظ على النمو عند 37 درجة مئوية. غسل الخلايا العصبية مرتين مع 500 ميكرولتر من prewarmed DMEM وإضافة 500 ميكرولتر من DMEM.
- مكان الخلايا العصبية في الحاضنة (37 درجة مئوية، 5٪ CO 2) لمدة 45 دقيقة.
- إعداد 40 ميكرولتر الحمض النووي يعجل لكل بئر عن طريق خلط: الحمض النووي (2-2.5 ميكروغرام / جيد، يجب أن تكون 10٪ من مجموع الحمض النووي لترنسفكأيشن علامة مثل GFP لتصور الخلايا العصبية transfected) والماء (تصل إلى 18 ميكرولتر)، إضافة 2 ميكرولتر من 2.5 M و CaCl 2، وتخلط جيدا وإضافة 20 ميكرولتر من 2X HBSS.
- احتضان راسب الحمض النووي لمدة 5 دقائق على RT.
- إضافة راسب الحمض النووي إلى كل بئر واحتضان الخلايا العصبية لمدة 18 دقيقة في الحاضنة.
- إزالة مزيج DMEM / الحمض النووي وغسل الخلايا العصبية مرتين مع 500 ميكرولتر من prewarmed DMEM.
- إضافة وسائط تم جمعها من الخطوة 2.2 إلى الخلايا العصبية. إذا الخلايا العصبية سيكون في الثقافة لأكثر من 3 أيام، وسائل الإعلام الملحق مع 25 ملي الجلوكوز في DIV 3 لتجديد مصدر الكربون.
- بعد 1-5 أيام، الخلايا العصبية تخضع لكيمياء سيتولوجية مناعية باستخدام الأجسام المضادة GFP.
- الصورة لا يقل عن 30 حالة في الخلايا العصبية الفردية بطريقة أعمى باستخدام المجهر الفلورسنت.
3. قياس محاور عصبية والتشعبات مع NeuronJ، والمعاهد الوطنية للصحة يماغيج المساعد
المهم: تأكد من أن الصور يتم تحجيم correctluy باستخدام بكسل المناسبة: نسبة ميكرون اعتمادا على التكبير والقرار من الصورة.
- تحويل الصور إلى 8 بت مع يماغيج: صورة فتح، اختر 'صورة' -> 'نوع' -> '8 بت '->' حفظ 'الصورة.
- تشغيل NeuronJ المساعد وفتح الصورة 8 بت.
- استخدام الخيار "إضافة اقتفاء أثر" لتعقب محوار: CLإك على زر الماوس الأيسر مرة واحدة في بداية محور عصبي وتحريك الماوس على طول العملية. انقر مرتين على غيض من محوار إذا تتبع مباريات شكل محور عصبي.
ملاحظة: يجب أن تتبع اقترح تختلف عن شكل محور عصبي، انقر مرة واحدة على محور عصبي لترسيخ عملية التتبع، ثم انقر نقرا مزدوجا على غيض من محور عصبي. - انقر على 'اقتفاء أثر قياس'، اختر 'عرض تتبع القياسات' الخيار واضغط على "تشغيل". يتم عرض جميع القياسات محوار في نافذة جديدة. لالتشعبات، واختيار 'الخيار قياسات عرض مجموعة' ثم اضغط على 'تشغيل'.
يتم عرض كافة القياسات مجموع التغصنات في نافذة جديدة. حفظها كملف منفصل يمكن فتحه في أي برنامج جداول البيانات. - بدلا من ذلك لتتبع الدليل، استخدام البرمجيات فيجي: انقر بزر الماوس الأيمن على اله خيار "خط مستقيم"، اختر "خط حر '،
الحفاظ على الضغط على زر الماوس الأيسر ويدويا تتبع العملية، اضغط على "السيطرة + M 'لقياس. - حساب متوسط طول محور عصبي شجيري / في حالة استخدام واختبار الإحصائية المناسبة.
في الجسم الحي electroporation:
1. المعدات وإعداد الكواشف
- تحتاج الإبر 30 G، هل (1-2 ملم)، حقنة، المخفض حجم القتلى (DVR)، electroporator، وtweezertrodes، وسادة التدفئة أو مصباح الأشعة تحت الحمراء الحرارة، مصباح معقوفة وisoflurane و.
- وضع DVR في إبرة، ثم إرفاق الإبرة إلى الحقنة، وأخيرا وضع فاصل على إبرة (الشكل 2).
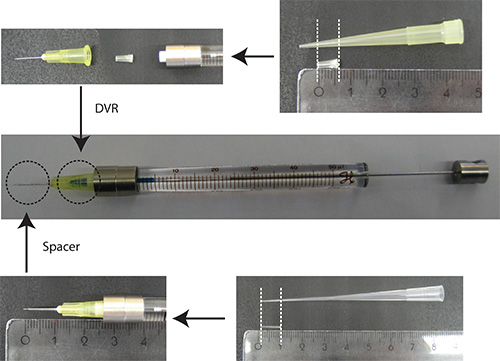
شخصية 2. يتم قطع إعداد الإبرة. DVR من طرف ماصة 200 ميكرولتر ووضعها في الإبرة للحد من حجم القتلى. مشتق هل من تلميح 200 ميكرولتر التحميل ويتم وضعها على نهاية إبرة لتنظيم عمق الاختراق في المخيخ إلى حوالي 2 مم. وحدات الحاكم: سم - حل الحمض النووي في PBS/0.03٪ الأخضر سريعة. ملاحظة: كما علامة ترنسفكأيشن، فإنه من المفيد لاستخدام بروتين فلوري الذي هو تحت المروج الخلايا العصبية محددة (على سبيل المثال Synapsin) لتصور الخلايا العصبية فقط. يجب أن يكون 25٪ من إجمالي كمية البلازميد البلازميد ترميز علامة ترنسفكأيشن.
- جعل الايثانول 70٪.
- خلط كميات متساوية من أكتوبر و 30٪ سكروز المذاب في برنامج تلفزيوني.
- ملء المحاقن مع 4 ميكرولتر من الحمض النووي (4 ميكروغرام / ميكرولتر من الحمض النووي البلازميد في PBS/0.03٪ سريعة الأخضر).
2. IVE من الجرذ الجراء
انسيابي من IVE: انظر الشكل 3
صفحة = "دائما"> 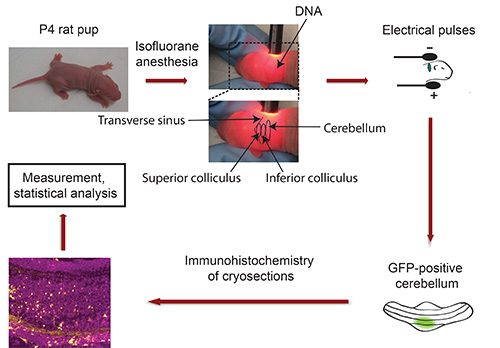
الرقم 3. ومخدرة من مخطط في electroporation فيفو. الفئران الوليدة P4 مع isoflurane ووDNA البلازميد ترميز علامة ترنسفكأيشن الفلورسنت (مثل GFP) يتم حقنها في المخيخ، يليه التعرض ل5 النبضات الكهربائية. بعد خمسة أيام، ومقطوع معزولة GFP إيجابية مخيخات وتعرضوا لالمناعية. يتم التقاط الصور باستخدام المجهر متحد البؤر وتحليلها باستخدام برامج Imaris. تتم معالجة البيانات مع البرنامج الإحصائي.
- استخدام الفئران الوليدة P4 من سلالة البيضاء (يستار أو طويل ايفانز).
- تخدير الجراء (واحدة تلو الأخرى) مع isoflurane وفي مربع صغير (مثل P1000 ماصة غيض مربع) مع 200 ميكرولتر من isoflurane و(غارقة في الأنسجة) لمدة 1-2 دقائق حتى الجرو لم يعد يتحرك. الحرص على أن الجراء لا تحصل على اتصال ثإيث Iiquid isoflurane و. رصد الوقت عن كثب كما الجراء الفردية تستجيب بشكل مختلف للتخدير.
- تعقيم الخلفي من الرأس الجرو مع الايثانول 70٪.
- إصلاح رئيس الجرو بين الإبهام والسبابة واستخدام مصباح معقوفة لتحديد المخيخ من الجرو البيضاء. الجيب عرضية ترسم بشكل حاد الدماغ المتوسط (أكيمة متفوقة وأدنى) من نصفي الكرة الأرضية القشرية (الشكل 3). يقع المخيخ الدماغ المتوسط المجاورة لويظهر في أغمق. استخدام علامة دائمة للإشارة إلى المخيخ مع نقطة. المهم: حافظ على الجرو في موقف ثابت! ملاحظة: يجب أن يزول التخدير أثناء هذا الإجراء، تعرض الجرو لisoflurane وقبل حقن الحمض النووي.
- إدراج إبرة (الشكل 3) وحقن ببطء 3 ميكرولتر من الحمض النووي في المخيخ.
- السماح للمحلول الحمض النووي منتشر لمدة 30-60 ثانية.
- وضع رئيس الجرو بين tweezertrodes بحيث القطب ناقص يجعل الاتصال مع الجزء الخلفي من الرأس (مخيخاتالمنطقة ص) وأن اتصالات القطب بالإضافة إلى الجانب الآخر من الرأس (الشكل 3).
- الموضوع الجرو إلى 5 النبضات الكهربائية. ضبط الجهد لوزن الجراء لضمان كفاءة التثقيب الكهربائي جيدة دون المساس بقائهم على قيد الحياة (الجدول 1).
الجدول 1. التثقيب الكهربائي من الفئران الوليدة P4.الوزن الجهد نبض فاصل 8-9 ز 160 V 50 ميللي ثانية 950 ميللي ثانية 9-10 ز 165 V 50 ميللي ثانية 950 ميللي ثانية > 10 ز 170 V 50 ميللي ثانية 950 ميللي ثانية - دعونا الجراء على استعادة سادة ساخنة أو تحت مصباح الأشعة تحت الحمراء. العودة إلى الجراء السد. المهم: تأكد من أن مصدر التدفئة لا تسبب أي حروق.
- التضحية الجراء بعد 5 أيام التثقيب الكهربائي عن طريق وضعها في CO 2 تليها قطع الرأس.
- عزل مخيخات وشاشة لتلك GFP إيجابية مخيخات باستخدام المجهر الفلورسنت.
- إصلاح مخيخات في PFA 4٪ O / N عند 4 درجة مئوية، ثم في احتضان 30٪ سكروز في 4 درجات مئوية حتى بالوعة مخيخات إلى أسفل الأنبوب.
- تضمين مخيخات في OCT/30٪ سكروز وقطع 40 ميكرومتر المقاطع الاكليلية باستخدام ناظم البرد. ملاحظة: القسم كل المخيخ بطريقة أعمى.
- أقسام رهنا المناعية باستخدام الأجسام المضادة GFP. مباين مع صبغة النووي (دابي أو هويشت 33258) وتحديد توطين ما لا يقل عن 200 الخلايا العصبية transfected لكل حيوان.
- لإجراء تحليل متعمق، تقسم الى نصفين IGL، مما أدى إلى IGL العلوي التي تواجه ML وIGL أقل تواجه المادة البيضاء وتعول الخلايا العصبية GFP إيجابية المقيمين في كل شوط. ملاحظة: عدد الخلايا العصبية GFP إيجابية من كل قسم بطريقة أعمى.
3. قياس طول تغصن، اكتساب الصور من القسم في خ، ذ، ض الطائرة باستخدام مجهر متحد البؤر
ملاحظة: على سبيل المثال، استخدم 40 صور للقسم 40 ميكرون مع ض stwp من 1 ميكرون.
- سلسلة مفتوحة الصورة في البرنامج، Imaris، لتوليد صورة 3D من التشعبات.
- انقر على 'فق' واسطة لعرض الخلايا العصبية في 3D.
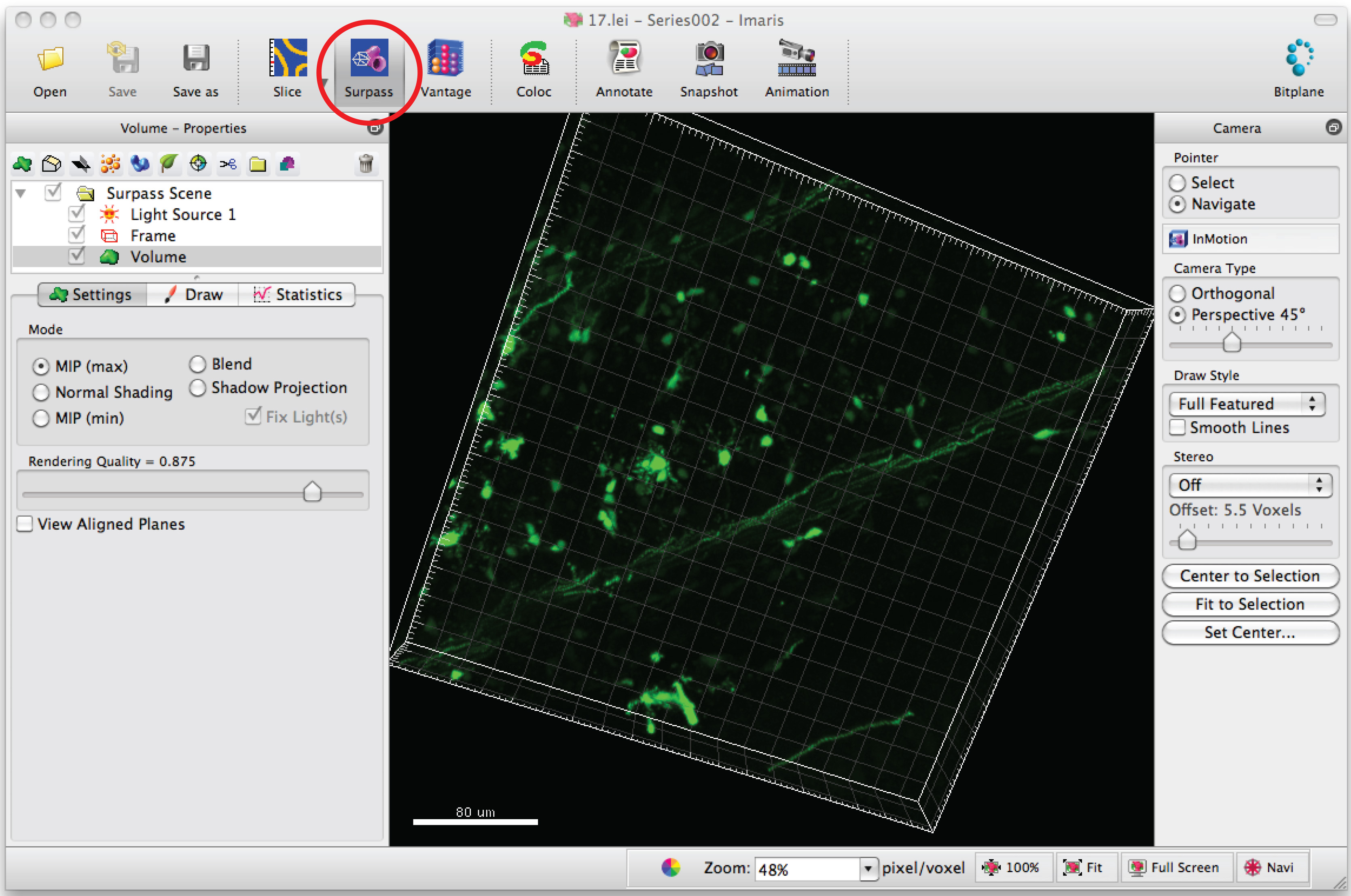
- اختر 'إضافة خيوط جديدة' وانقر فوق 'تخطي إنشاء التلقائي' لبدء البحث عن المفقودين نصف أوتوماتيكية.

ملاحظة: تحليل كل صورة 3D بطريقة أعمى - حدد علامة التبويب "رسم" و "أرجية مستقلية المنشأ".
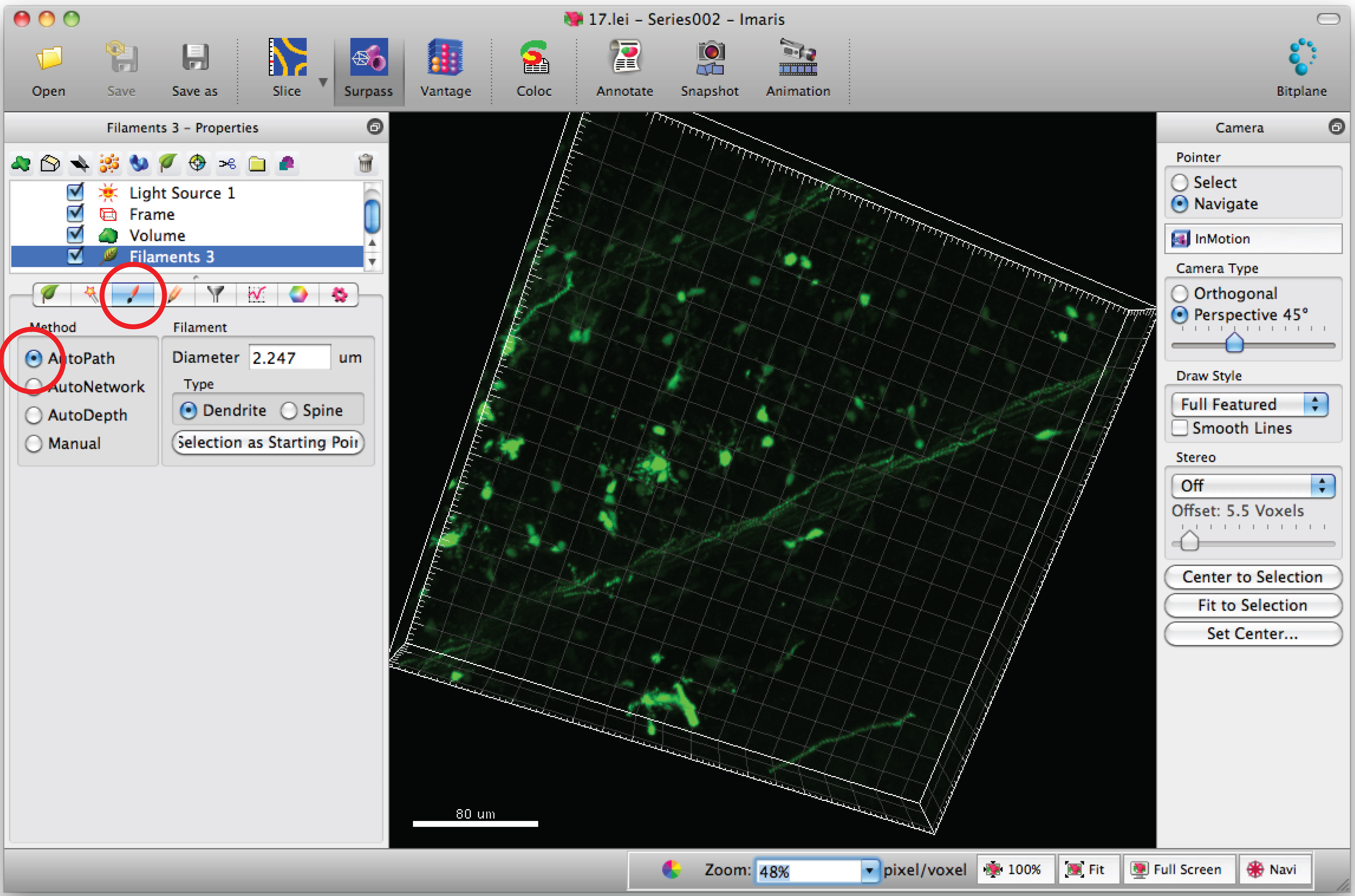
- تحريك مؤشر الماوس على جالجسم الذراع والتحول + الماوس انقر بزر الماوس الأيمن لتحديد خلايا الجسم. ملاحظة: Autocalculation من قبل البرامج قد تتطلب بضع دقائق.

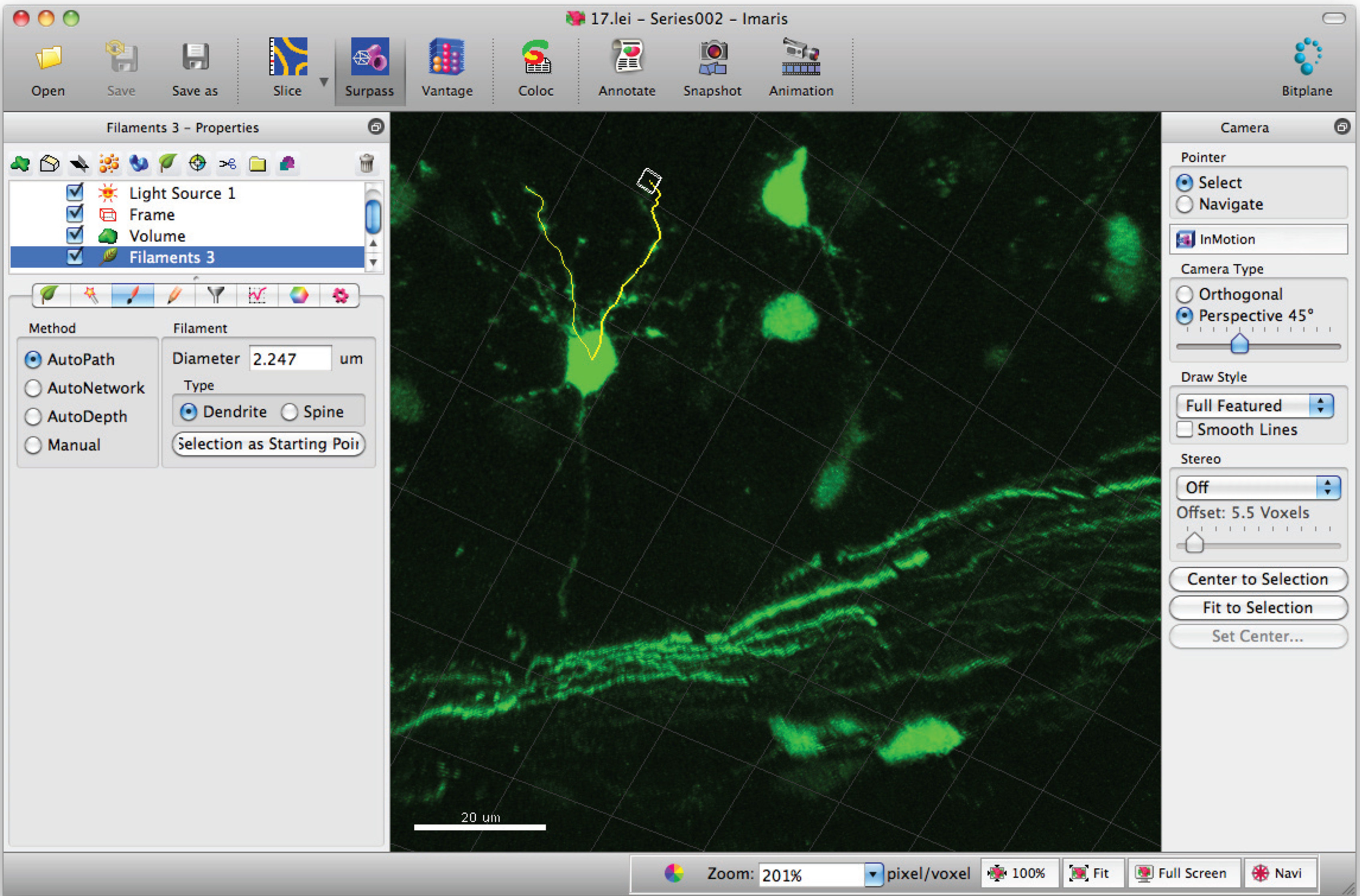
- إضافة مسارات إلى خيوط (التغصنات) باستخدام التحول + زر الماوس الأيسر. ملاحظة: مسارات يمكن تصور في الوقت الحقيقي.
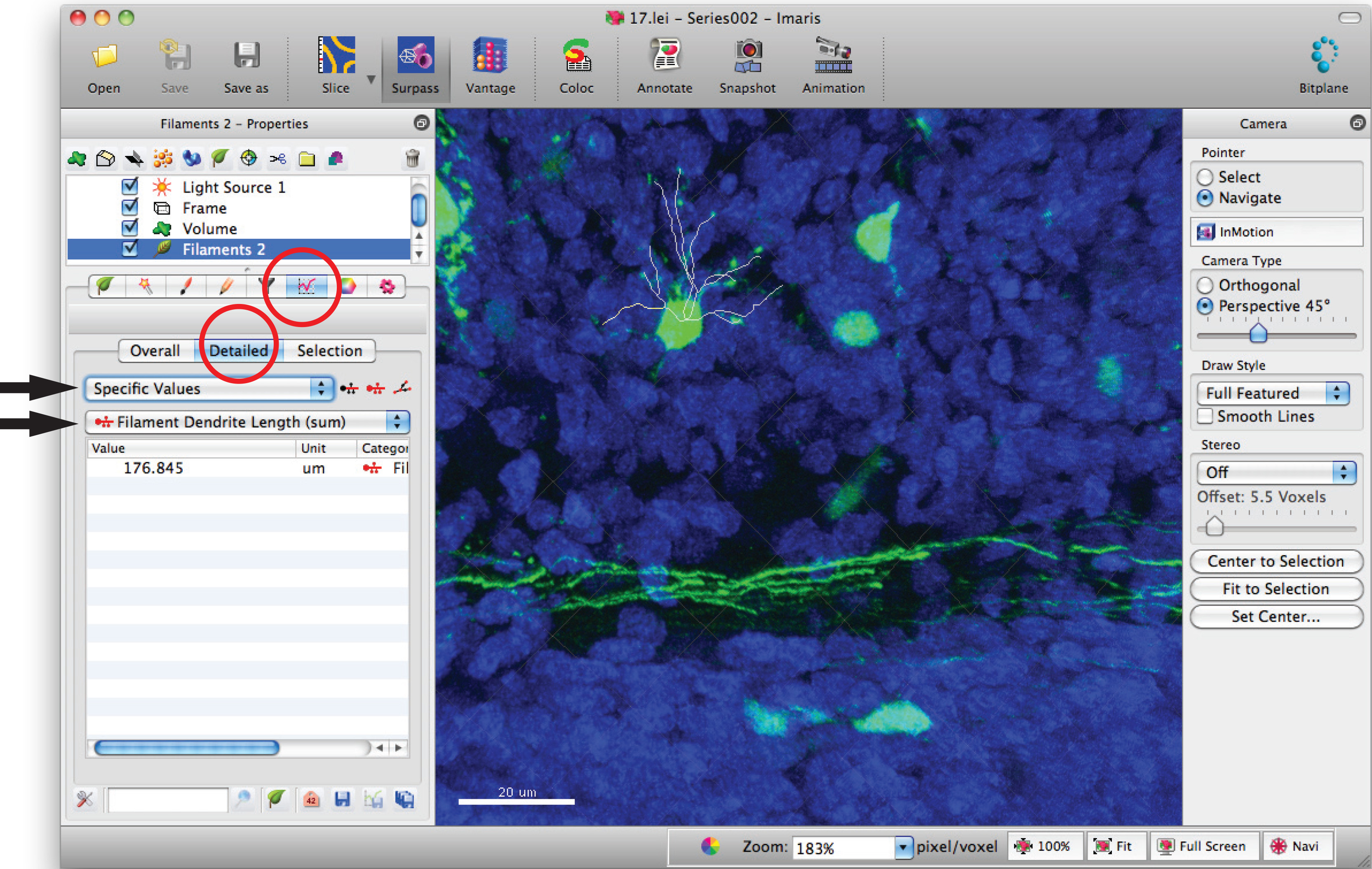
- انتقل إلى نافذة إحصاءات خيوط وانقر على 'مفصل'، 'القيم المحددة "و" طول الشعيرة التغصنات (مجموع)' لمجموع الطول الكلي التغصنات.
- استخدام الاختبارات الإحصائية المناسبة لتحليل البيانات.
النتائج
لتحليل مورفولوجية CGNs استجابة لظروف زراعة مختلفة، ونحن transfected الخلايا العصبية على DIV 0 كما هو موضح أعلاه. بعد ترنسفكأيشن، وضعنا مجموعة واحدة من الخلايا العصبية في متوسطة كاملة (BME، و 10٪ مصل العجل، باريس سان جيرمان 2 مم، 25 مم بوكل) ومجموعة أخرى في الحد الأدنى من المتوس?...
Discussion
مزايا والقيود المفروضة على وصفها في المختبر والمجراة في أساليب:
وبنفس القدر مناسبة تماما CGNs مثقف من الماوس والفئران للالتحليلات المورفولوجية. نظرا لحجم أكبر من المخيخ الفئران، العائد من CNGs من الفئران الوليدة يفوق عدد الجرا...
Disclosures
الكتاب تعلن أي المصالح المالية المتنافسة.
Acknowledgements
نشكر N. Schwedhelm-Domeyer للحصول على مساعدة فنية ممتازة، C. المطرقة وS. Papiol للمساعدة في التحليلات الإحصائية. ويتم تمويل عملنا من قبل جمعية ماكس بلانك، جمعية الألمانية للبحوث، ومركز النانو المجهرية، وعلم وظائف الأعضاء الجزيئية من الدماغ (CNMPB)، غوتنغن، ألمانيا والتي GGNB جديد المجموعة الراتب من جامعة غوتنغن.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
References
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved