Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Serebellar Granül Nöronlar Genetik Manipülasyon
Bu Makalede
Özet
Nöronal morfogenezine ve göç doğru beyin gelişimi altında yatan çok önemli olaylardır. Burada, genetik olarak kültürlenmiş nöronlar ve serebellar granül morfolojisi ve nöronların göç özelliklerinin değerlendirilmesi için gelişmekte olan beyincik işlemek için yöntemleri tarif eder.
Özet
Nöronal morfolojilerinden ve göç de dahil olmak üzere beyinde gelişimsel olaylar son derece In vitro. Süreçlerini yönetti ve in vivo bu olaylara karışan yolları belirlemek için derinlemesine bir nitelemeye imkan analiz edilmektedir. Gelişen beyincikte türetilen serebellar nöronlar granül (CGNs) morfolojik analiz için ideal bir model sağlayan bir sistemi vardır. Burada, bir genetik CGNs işlemek için bir yöntem ve ne kadar bireysel nöronların axono ve dendritogenesis çalışma açıklar. Bu yöntemle RNA girişim, aşırı ifadesi ya da küçük moleküllerin etkileri nöronlar kontrol ile karşılaştırılabilir. Buna ek olarak, kemirgen serebellar korteks baskın sonrası gelişim sayesinde vivo sistemde kolay erişilebilir. Ayrıca, genetik olarak gelişen cerebella işlemek ve daha sonra serebellar tanımlamak için bir in vivo elektroporasyon tekniği mevcut nöronal morfoloji değerlendirmek için analiznd göç.
Giriş
Beyincik akson büyüme ve göç mekanizmaları incelemek için mükemmel bir sistemdir. Beyincik nörobilim 1 çağlarından itibaren anatomik çalışmaların konusu olmuştur. Modern mikroskobu ve immunohistokimyasal teknikler önemli ölçüde genişletilmiş ve Santiago, Ramon ve üreter, 2-4 ile ilk keşifler rafine var. Fare genetik ve moleküler çalışmalar serebellar granül nöronların (CGNs) 5-7 gibi nöronlar farklı düzgün kablolama için gerekli önemli olayların daha iyi anlaşılmasına yol açan, serebellar gelişme kontrolünde temel büyüme ve transkripsiyon faktörlerini ortaya çıkardı.
Beyincik gelişmekte olan arka beyin 8 rhombomere 1 bir türevidir. 4. ventrikül çatı parçası olan eşkenar paralel dudak, en çok nöron popülasyonu oluşturacak serebellar granül nöron progenitörlerinin, yol açaryetişkin beyincik 9. Rostral göç, onlar serebellar anlage yerleşmek. Burada, granül nöron öncülerin mitoz kemirgenlerde doğumdan yer alan granüler tabaka, dış (EGL), dramatik genişlemesine yol açar. EGL itibaren, nöronlar Purkinje hücre tabakası sonuçta iç granüler tabaka (IGL 2) ikamet almak için geçmiş, moleküler tabakası (ML) ile içe göç başlar. Bu göç işlemi sırasında iki aksonlar ML içine uzanan iki kutuplu bir şekil kazanır. Ayrıca geçiş üzerine, hücre gövdesi uzakta aksonlardan göç ve iki işlem, bir çatallı, T-şekilli bir akson 10 oluşturmak için sigorta. Daha sonra, bu bölümler halinde ve akson olarak paralel lifler adlandırılır. IGL yerleşince, CGNs yosunlu lifleri ile sinaps kurmak dendritik pençeleri oluşturur dendrit, büyür. , Gelişen beyincikte temel süreçleri incelemek için, bir in vitro ve in vivo yaklaşımların bir arayah güvenilir sonuçlar ve sonuçlar sağlar.
CGNs sadece beyincik ancak tüm beynin en çok nöronlardır ve yüksek saflıkta 11-13 için kültürlenebilir. Kültürde, bu son derece homojen nöronal nüfusu hızla postmitotic olur ve kolayca tanımlanabilir akson ve dendritler ile bir polar morfoloji kazanır. Kültürlü CGNs progenitör çoğalma, farklılaşma, akson ve dendrit gelişim, nöronal göç, apoptoz ve elektrofizyolojik özellikleri (14-19 ve diğerleri) içeren sinirsel gelişimin çeşitli yönlerini incelemek için son derece yararlı olduğu kanıtlanmıştır. Genetik manipülasyon kullanımı kültürlü CGNs çok yönlülüğünü genişletilmiş ve yukarıda belirtilen olayların içine daha fazla mekanik içgörü için izin verdi. Verimliliği düşük kalsiyum fosfat veya kutup işaretleri veya yazılım destekli analiz olanakları ile immünsitokimya ardından lipofilik yöntemleri kullanarak kültürlü nöronların transfeksivonuyoğun bir nöronal kültüründe bireysel nöronların örneğin morfolojisinin değerlendirilmesi tates. Bu yaklaşımla, akson ve dentrit büyümesi ilgi konusu olan proteinlerin rolü 20-25,26-28 incelenebilir. Bu kültür sistemi, bununla birlikte göç çok yüksek yoğunluklu kültürde sınırlı olduğu nöronal göç analiz etmek için daha az yararlıdır ve alt kültürleri olarak gerektirir. Akson ve dentrit büyümesi in vitro analiz, RNA girişim (i) kombinasyonlarını kullanarak bir sinyal yolunun bağlantılı proteinlerin inceleme sağlar, fazla sentezlenme ya da küçük moleküller.
Akson ve dentrit büyümesi düzenleme ya da nöronal göç ilgilenilen proteinin ilişkisini kurmak için, in vivo elektroporasyon (İVE) tekniği gelişmekte serebellar korteks analizi sağlar. Kemirgenlerde serebellar gelişme ilk iki doğum sonrası haftalara şekilde uzanan gerçeği nedeniyle, beyincik bir accessib temsil ederakson ve dendrit, nöronal göç, sinaptogenez ve apoptoz 20-24,29,30,26,27,31-34 gelişmekte incelemek için genetik manipülasyonlar le beyin yapısı. Buna ek olarak, bu model sistemi, aynı zamanda, akson yol bulma, kablo ve Birlikte alındığında nöronlar ve nöron-glia etkileşimlerinin bağlantısı gibi sağlam serebellar korteks gerektiren nöronal gelişimin diğer yönleri için faydalıdır, bu protokol, in vitro ve in vivo teknikler mücadele sağladığı nöronal morfolojilerinden ve göç konusunda tamamlayıcı bir yaklaşım.
Protokol
CGNs ya da doğum sonrası gün (P) 5 fare yavrular ya da P6 sıçan yavrularından hazırlanabilir. Biz postmitotic CGNs 13 seçmek için bir mitoz inhibitörü kullanan Bilimoria ve meslektaşları tarafından açıklanan bir protokol, izleyin.
Etik beyanı:
Canlı hayvanlar içeren tüm deneyler Aşağı Saksonya, Almanya "Verbraucherschutz und Lebensmittelsicherheit" tarafından onaylanan hayvan protokole göre yapılmıştır.
Vitro tahlilde:
1.. Örneğin kalsiyum fosfat transfeksiyonu için yöntem Plazmid DNA, medya ve Tamponlar hazırlanması
- Steril, endotoksin içermeyen su içinde plasmid DNA içinde çözündürülür, DMEM (yüksek glukoz), 2.5 M CaCI2 yapmak, 2x HBSS (4 g NaCl, 0,1775 g KCI, 0.095 g 2 HPO 4 • 7H 2 O, 0.675 g glikoz Na çözülür yapmak ve 2.5 g 250 ml ultra saf su içinde HEPES ve 7.05, 7.08 ve 7,11) pH ayarlanır. Not: hazırlarken2x HBSS çözeltisi ile, verilen plazmidlerin kombinasyonunun transfeksiyon verimi ile ilgili olarak en iyi sonuçları verir testi.
2. Kültür Nöronlar transfeksivonu
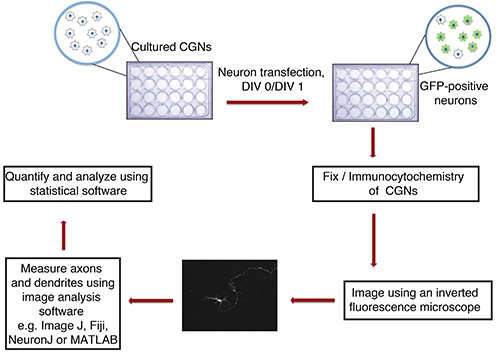
Şekil 1. In vitro akson ve dentrit büyümesi tahlilinin akış şeması. Kültürlü CGNs P6 sıçan yavrularından izole edilmiş (cam kapak slipleri ile 24-çukurlu plaka), bir fluoresan işaretleyici transfeksiyon (örneğin GFP) ihtiva eden bir çökelti ile DIV DNA, 0 ya da 1 ile transfekte edilir. Tespit ve İmmünositokimya sonra, nöronlar kör bir şekilde görüntülenmiş. Görüntüler ImageJ içine alınır ve işlemler ölçülür. Ölçümler, daha sonra bir istatistik programı kullanılarak işlenir.
- Tohum CGNs (20 x 10 6 24-çukurlu plaka başına, BME,% 10 dana serumu, 2 mM Penisilin-Streptomycin-Glutamin (PSG), 25 mM KCl) ortam 500 ul, 24 oyuklu bir plaka içerisinde nitrik asitle yıkanmış, poliornitin-kaplanmış 12 mm cam lameller üzerinde oyuk başına.
- In vitro olarak günde (DIV) 0 (en az 8 saat sonra kaplama) ya da DIV 1, büyüme ortamı toplamak ve 37 ° C de tutmak Önceden ısıtılmış 500 ul DMEM içinde iki kere yıkayın nöronlar ve DMEM içinde 500 ul ekleyin.
- Kuluçka makinesi içinde yer nöronlar (37 ° C,% 5 CO2) 45 dakika boyunca karıştırılır.
- Karıştırılarak her bir oyuk için 40 ul DNA çökeltisinin hazırlanması: DNA (2-2.5 ug / gözenek, toplam DNA itibarıyla% 10 transfekte nöronlar görselleştirmek için bir transfeksiyon işaretleyici, örneğin GFP olmalıdır), su (18 ul kadar), 2 ul ilave edin 2.5 M CaCl2, iyice karıştırın ve 2x HBSS 20 ul ekle.
- Oda sıcaklığında 5 dakika boyunca DNA çökeltisi inkübe edin.
- Her bir oyuğa DNA çökeltisi ekleme ve kuluçka makinesi içinde 18 dakika boyunca inkübe nöronlar.
- DMEM / DNA karışımı çıkarın ve önceden ısıtılmış DM 500 ul ile iki kez yıkayın nöronlarEM.
- Nöronlara geri adım 2.2 den toplanan ortam ekleyin. Nöronlar fazla 3 gün, karbon kaynağı doldurmak DIV 3 25 mM glükoz ile ek ortam kültür içinde olacaksa.
- 1-5 gün sonra, GFP antikor immünsitokimya tabi nöronları kullanarak.
- Bir floresan mikroskop kullanılarak kör yöntemle durumun başına Görüntü en az 30 bireysel nöronlar.
3. NeuronJ, bir NIH ImageJ tapa ile ölçün Aksonlar ve Dendritler
Önemli: um oran büyütme ve görüntü çözünürlüğüne bağlı: Görüntüler uygun piksel kullanılarak correctluy ölçekli emin olun.
- ImageJ ile 8-bit görüntüleri dönüştürün: Açık görüntü, 'resim' seçin -> 'Tür' -> '8-bit '->' Kaydet 'görüntü.
- NeuronJ eklentisi çalıştırmak ve 8-bit görüntü açın.
- Cl: akson izlemek için 'Ekle iz' seçeneğini kullanınakson başında bir kez sol fare düğmesi ick ve süreç boyunca fareyi hareket ettirin. Akson ucunda çift tıklama iz akson şekli eşleşirse.
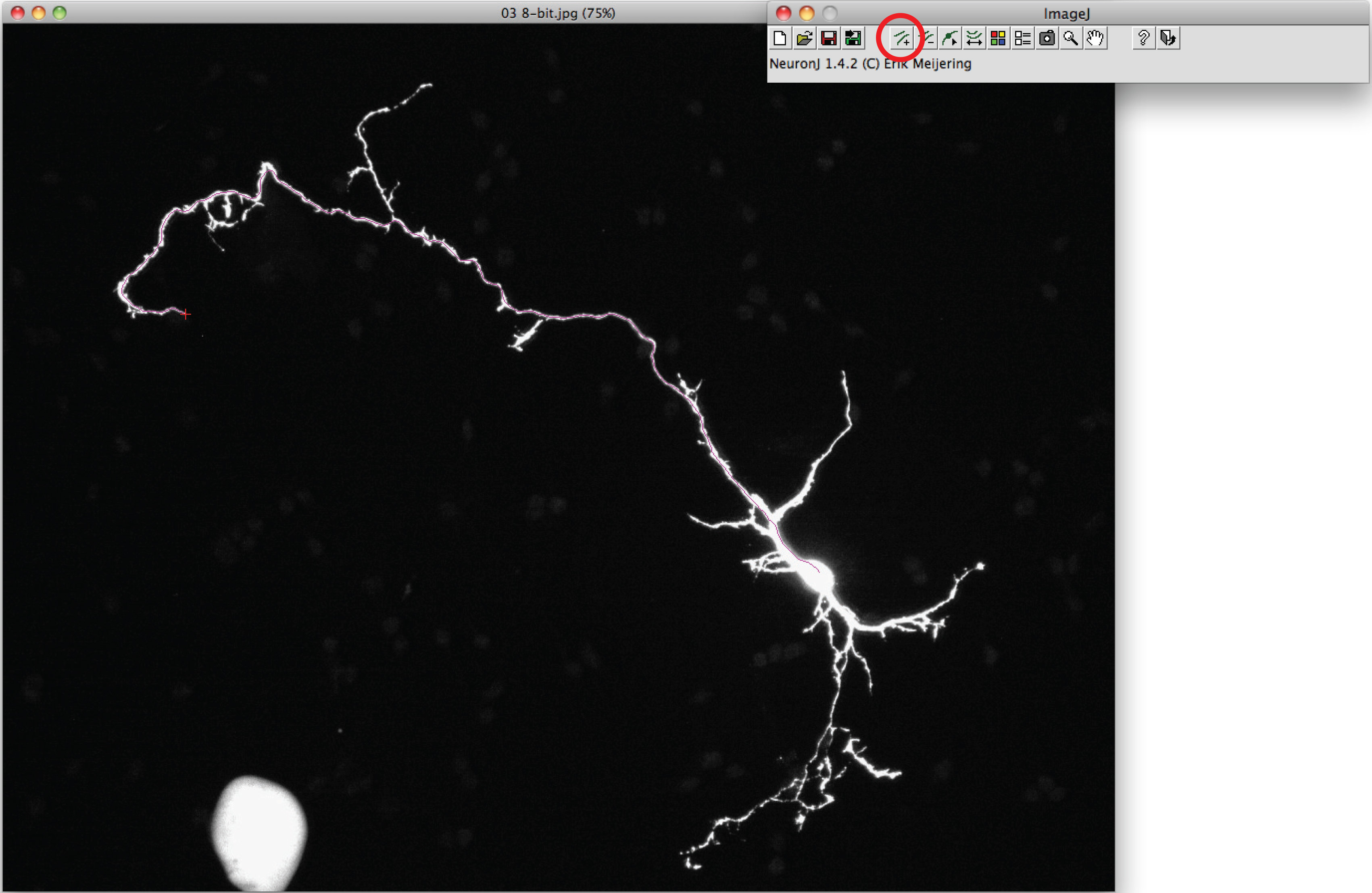
Not: Önerilen iz akson şekli farklı,, akson ucunda sonra çift tıklayın iz demirlemek için aksonal süreci üzerinde bir kez tıklayın. - Seçeneğini basın 'Çalıştır' 'Görüntü izleme ölçümleri' seçin, 'Ölçü trasların' üzerine tıklayın. Akson ölçümleri her yeni bir pencerede görüntülenir. Dendritlerin için, 'Görüntü grup ölçümleri seçeneğini' basın 'Çalıştır' seçeneğini seçin.
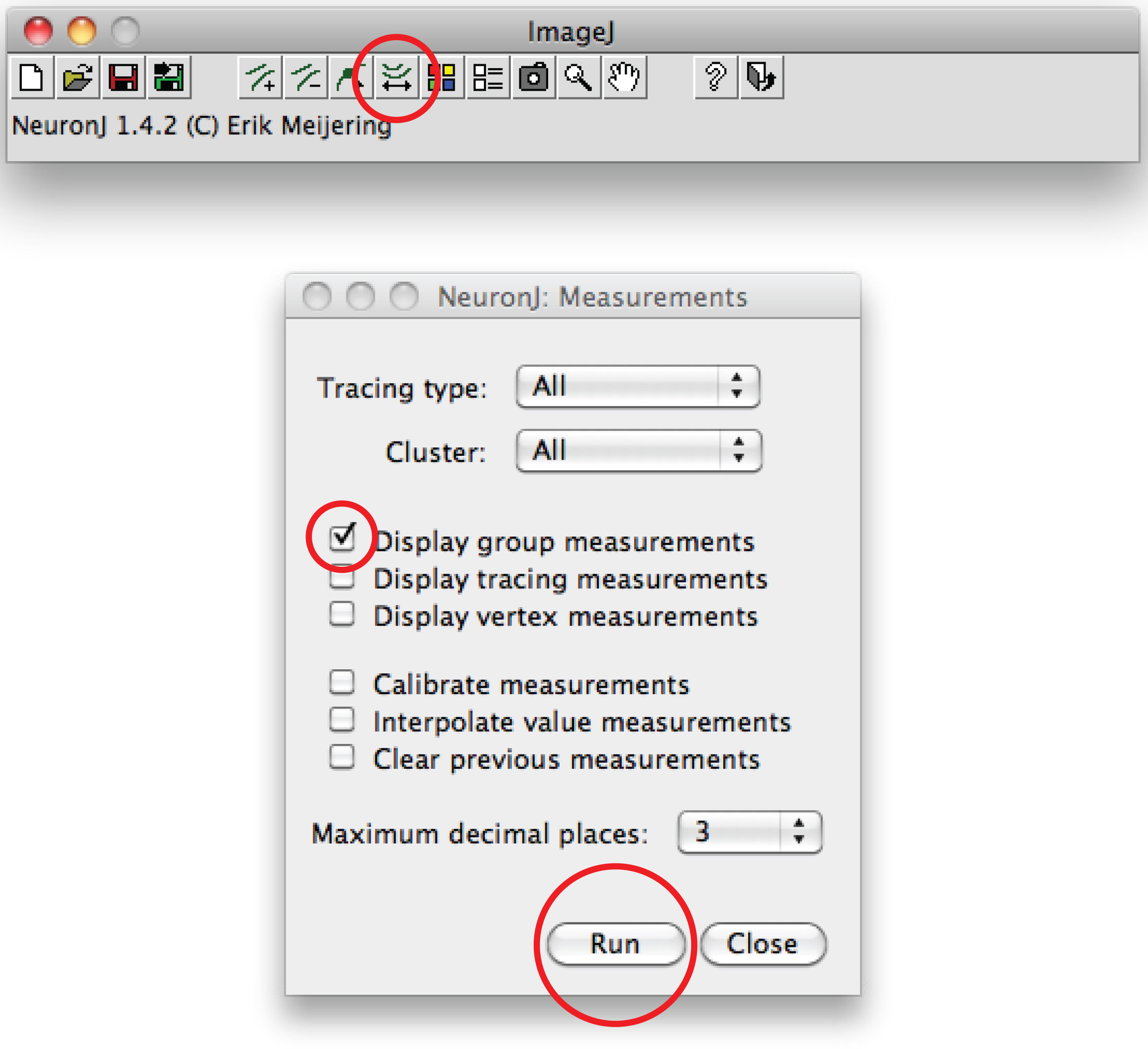
Toplam dendrit ölçümleri tüm yeni bir pencerede görüntülenir. Herhangi bir elektronik tablo programı açılabilir ayrı bir dosya olarak kaydedebilirsiniz. - Alternatif manuel izleme için, Fiji yazılımı kullanın: Sağ inci tıklayınE 'Düz çizgi' seçeneği, 'Freehand çizgi' seçin,
basılı sol fare düğmesi tutmak ve elle sürecini izlemek, basın 'Ctrl + M' ölçmek için. - Durum başına ortalama akson / dendritik uzunluğunu hesaplamak ve uygun istatistiksel testi kullanın.
Vivo elektroporasyon:
1.. Ekipman ve Reaktifler hazırlanması
- 30 G iğne, boşluk (1-2 mm), şırınga, ölü hacim düşürücü (DVR), elektrogözenekleme ve tweezertrodes, ısıtma pedi veya kızılötesi ısı lambası, boynu lamba ve izofluran gerekir.
- Iğne içine DVR koymak, sonra şırıngaya iğne takılır, ve nihayet (Şekil 2) iğne üzerine boşluk koymak.
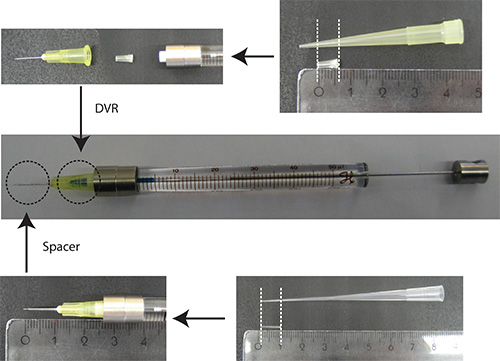
Rakam2. Iğne. DVR hazırlanması 200 ul pipet kesti ve ölü hacmini azaltmak için iğne yerleştirilir. Spacer 200 ul yükleme ucundan elde edilen ve yaklaşık olarak 2 mm beyincik içine nüfuz derinliğini düzenleyen iğnenin ucuna yerleştirilir. Cetvel birimleri: cm - PBS/0.03% Hızlı Green DNA çözülür. Not: Bir transfeksiyon bir işaretleyici olarak, sadece nöronlar görselleştirmek için bir nörona özgü promoter (ör synapsin) altında olan bir floresan proteini kullanmak avantajlıdır. Toplam plazmid miktarın% 25'i transfeksiyon işaretleyicisini kodlayan plazmid olmalıdır.
- % 70 etanol olun.
- Ekim eşit hacimleri ve PBS içinde çözülmüş% 30 sukroz karıştırın.
- DNA (PBS/0.03% Fast Green plazmid DNA'nın 4 ug / ul), 4 ul şırınga doldurun.
2. Sıçan Yavrularının ive
İVE Akış Şeması: Şekil 3'e bakın
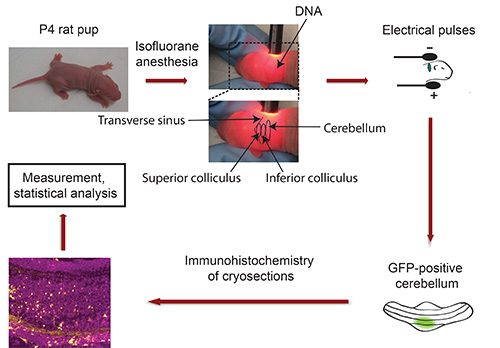
Şekil 3,. In vivo elektroporasyon. P4 sıçan yavrularının Akış Şeması beyincik içine enjekte edilir 5 elektrik sinyalleri maruz bırakılarak, ardından, izofluran ve bir fluoresan işaretleyici transfeksiyon (örneğin GFP) kodlayan plasmid DNA ile anestezi edilmiştir. Beş gün sonra, izole edilmiş GFP-pozitif cerebella kesitli ve immünohistokimya tabi tutulur. Görüntüler bir konfokal mikroskop kullanılarak yakalandı ve Imaris yazılımı kullanılarak analiz edilmiştir. Veriler istatistiksel program ile işlenir.
- Albino suşu (Wistar veya Long Evans) P4 sıçan yavrular kullanın.
- Yavru hareketli artık kadar 1-2 dakika boyunca izofluran (doku içinde ıslatılmış) 200 ul küçük kutu (örn. P1000 pipet ucu kutusu) izofluran ile yavrular (birbiri ardına) anestezisi. Yavrular w temas alamadım dikkat edinith isofluranın sıvı duyarlılık. Bireysel yavrular anestezi farklı yanıt olarak yakından zaman izleyin.
- % 70 etanol ile geri yavrunun kafası sterilize.
- Başparmak ve işaret parmağı arasında yavru başını düzeltmek ve albino yavru beyincik bulmak için boynu lamba kullanabilirsiniz. Transvers sinüs keskin kortikal hemisferden Ortabeyin (üst ve alt kollikulus) (Şekil 3) demarcates. Beyincik Ortabeyinde bitişiğinde bulunan ve koyu bir gölge belirir. Bir nokta ile beyincik belirtmek için kalıcı bir kalem kullanın. Önemli: Sabit pozisyonda yavru tutun! Not: Bu işlem sırasında anestezi kapalı giymeli, önce DNA enjekte izoflurana yavruyu maruz.
- İğneyi (Şekil 3) takın ve yavaş yavaş beyincik DNA'nın 3 ul enjekte.
- DNA solüsyonu, 30-60 saniye için yaygın olsun.
- Eksi kutup başının arkasına (serebella'sı ile temas yapar o kadar tweezertrodes arasında yavru başını yerleştirinr bölgesi) ve artı kutup temas kafanın karşı tarafına (Şekil 3) bu.
- 5 elektriksel darbeleri tabi yavru. Hayatta kalma (Tablo 1) ödün vermeden iyi bir verim sağlamak için elektroporasyon yavruların ağırlığına gerilimi ayarlar.
Tablo 1. P4 sıçan yavruların eîektroporasyonu.Ağırlık Gerilim Nabız Aralık 8-9 g 160 V 50 msn 950 ms 9-10 g 165 V 50 msn 950 ms > 10 g 170 V 50 msn 950 ms - Yavrular ısıtılmış pad üzerinde veya kızılötesi lamba altında kurtarmak edelim. Baraj yavrular dönün. Önemli: Isıtma kaynağı herhangi yanıklara vermek olmadığından emin olun.
- CO başı kesilerek 2 izledi onları yerleştirerek 5 gün elektroporasyon sonra yavrular kurban.
- Bir floresan mikroskop kullanılarak serebella'sı GFP pozitif olanlar için cerebella ve ekran izole.
- O cerebella lavabo kadar tüpün dibine 4 ° C'de% 30 sukroz içinde inkübe, 4 ° C 'de% 4 PFA O / N cerebella düzeltildi.
- OCT/30% sakaroz cerebella embed ve sirostat kullanılarak 40 mikron koronal bölümleri kesti. Not: Bir kör bir şekilde Bölüm her beyincik.
- Konu bölümleri GFP antikor kullanarak immünohistokimyaya. Nükleer boya (DAPI veya Hoechst 33258) Counterstain ve hayvan başına en az 200 transfekte nöronların lokalizasyonu belirler.
- Derinlemesine bir analizi için, ML ve beyaz madde bakan bir düşük değerli IGL bakan bir üst IGL sonuçlanan parçaya IGL bölmek ve her yarım ikamet GFP-pozitif nöronların sayısı. Not: Bir kör bir şekilde her bölümün GFP pozitif nöronlar Kont.
3. Dendrite Uzunluk Ölçme, bir konfokal mikroskop kullanılarak x, y, z Düzlem Bölüm görüntüleri Edinme
Not: örneğin, 1 um bir z-stwp ile 40 mikron bölüm için 40 görüntüleri kullanır.
- Dendritler bir 3D görüntü oluşturmak için yazılım, Imaris açık resim serisi.
- 3D nöron görüntülemek için 'aşmak' moduna tıklayın.
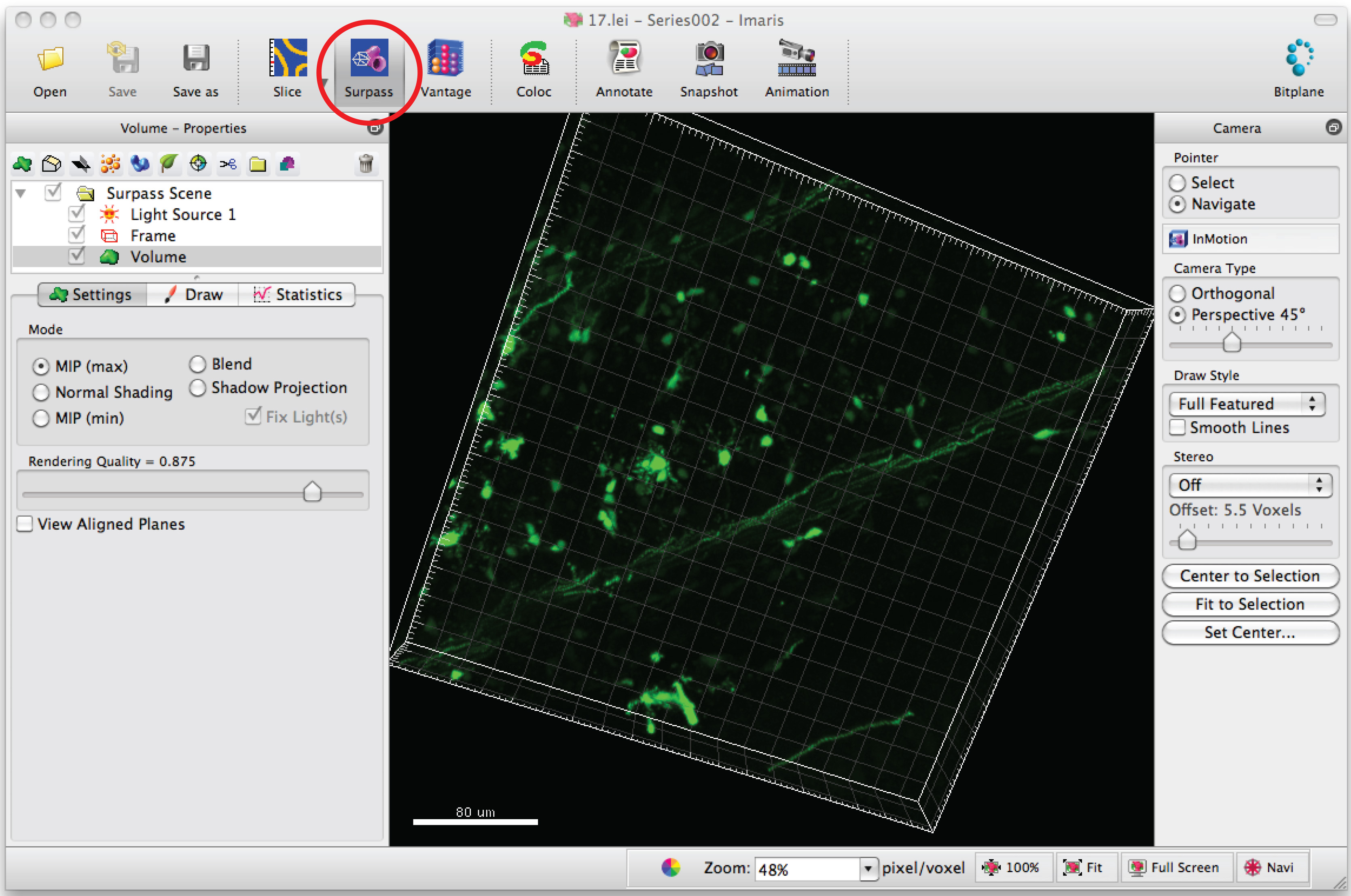
- 'Yeni filamanın Ekle' seçeneğini seçin ve yarı otomatik izlemeyi başlatmak için 'otomatik oluşturulmasını yap' ı tıklatın.

Not: Bir kör bir şekilde her 3D görüntü analiz - 'Beraberlik' sekmesini ve 'autopath' seçeneğini seçin.
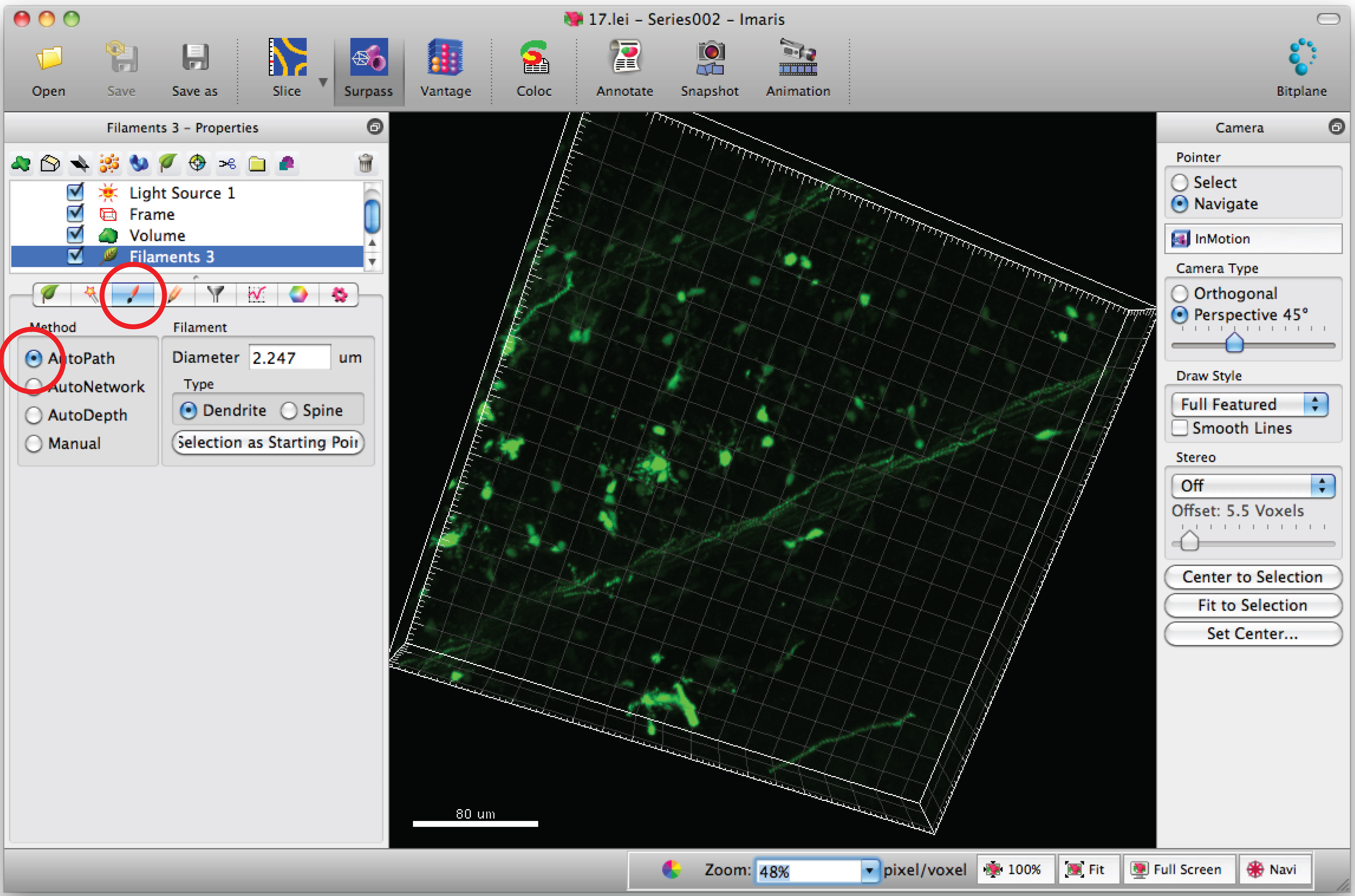
- C fare imleciell vücut ve Shift + fare sağ hücre gövdesini seçmek için tıklatın. Not: yazılım tarafından Autocalculation birkaç dakika gerekebilir.

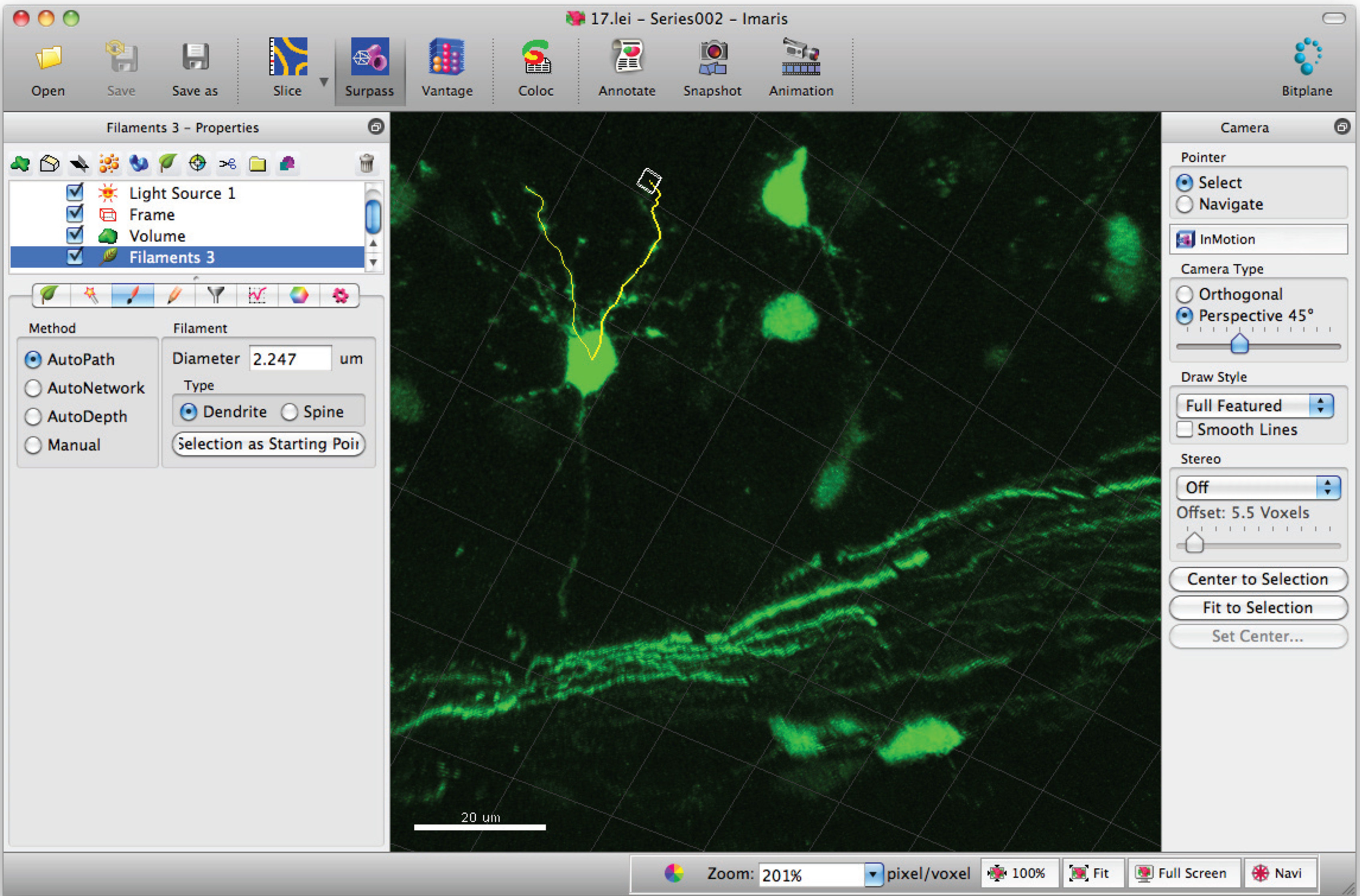
- Shift + fare sol tıklama kullanarak filamanın (dallantı) yol eklemek. Not: Yollar gerçek zamanlı olarak görülebilir.
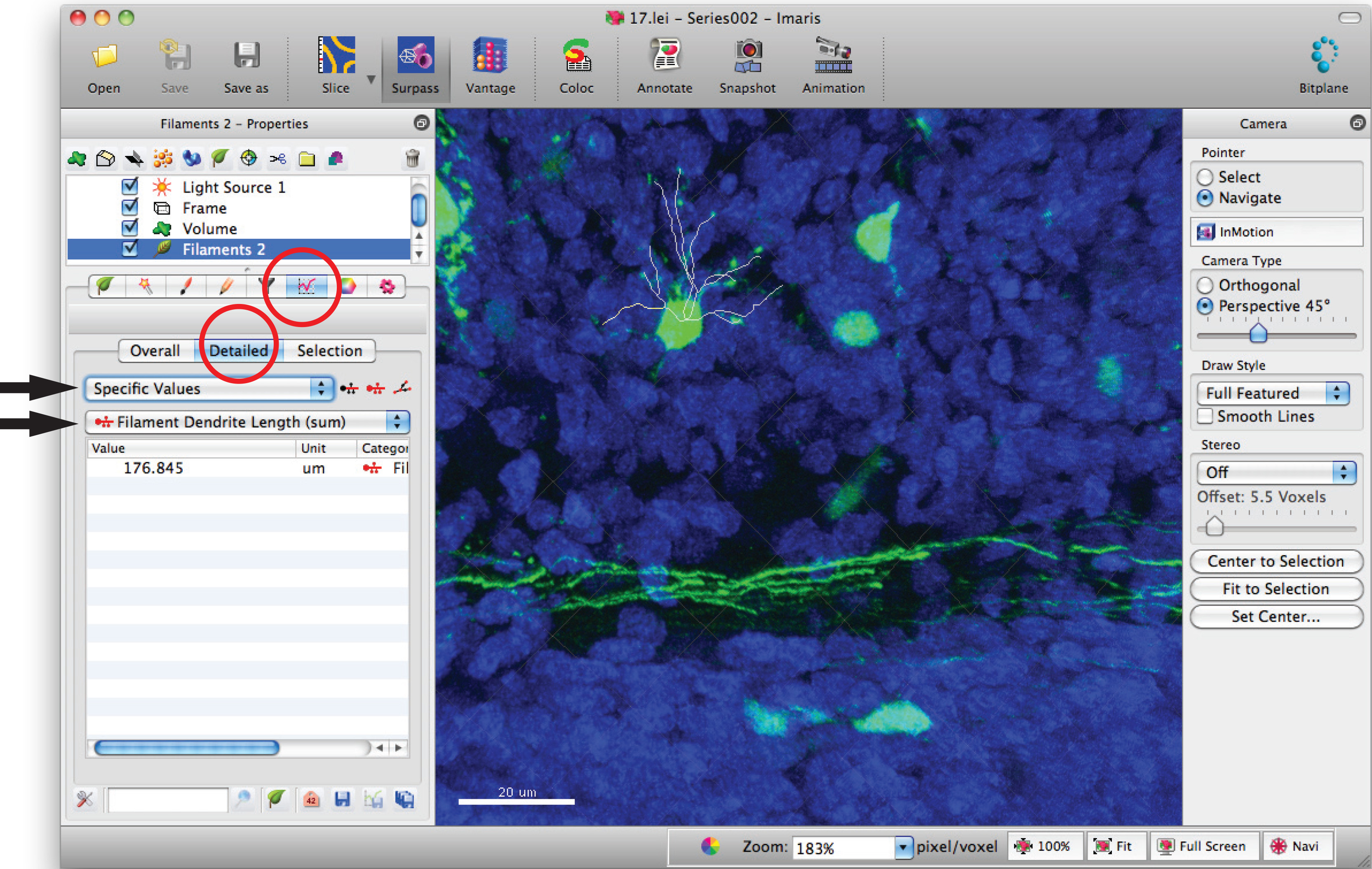
- Filament istatistik pencereye gidin ve 'Ayrıntılı', 'Belirli değerleri' ve toplam dendrit uzunluğu toplamı için 'Filament dendrit uzunluğu (toplamı)' üzerine tıklayın.
- Verileri analiz etmek için uygun istatistiksel testler kullanın.
Sonuçlar
Yukarıda tarif edildiği gibi, farklı kültür koşullarına göre CGNs morfolojisini analiz etmek için, DIV 0 üzerindeki nöronların transfekte edildi. Transfeksiyondan sonra, tam bir ortam (BME,% 10 dana serumu, 2 mM PSG, 25 mM KCl) ve minimum ortamı ihtiva eden, insülin başka bir grubu (BME, 25 mM glukoz, 2 mM PSG, 10 ug / içine nöronların bir takım yerleştirilmiştir ml insülin). Biz, Bölüm 1, 2 de GFP antikoru kullanılarak, bağışıklık kimyası için, nöronların tabi tutuldu ve 3, sadece bir ...
Tartışmalar
Avantajları ve in vitro ve in vivo metotları tarif sınırlamaları:
Fare ve sıçan Kültür CGNs eşit derecede iyi morfolojik analizler için uygundur. Bir sıçan beyincik büyük boyutu sayesinde, sıçan yavrularından CNGs verim fare yavrularının 3-4x o aşıyor. Kenara CGNs gelen, kortikal ve hipokampal nöronların yanı sıra kültür sistemi olarak kullanılabilir. Kalsiyum fosfat yöntemi bireysel nöronların morfolojisini analiz etmek için arzu edilen bir...
Açıklamalar
Yazarlar herhangi bir mali çıkarlarını beyan.
Teşekkürler
Biz istatistiksel analizler ile yardım için, mükemmel teknik yardım C. Hammer ve S. Papiol N. Schwedhelm-Domeyer teşekkür ederim. Çalışmalarımız Max Planck Derneği, Deutsche Forschungsgemeinschaft, Nanoseviye Mikroskopi Merkezi ve Beyin Moleküler Fizyoloji (CNMPB), Göttingen, Almanya ve Göttingen Üniversitesi GGNB Gençler Grubu Stipend tarafından finanse edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Referanslar
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır