Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Genetische Manipulation von Kleinhirnkörnerzellen
In diesem Artikel
Zusammenfassung
Neuronale Morphogenese und Migration sind entscheidende Ereignisse zugrunde liegenden richtige Entwicklung des Gehirns. Hier beschreiben wir Verfahren zur genetischen Manipulation kultivierten zerebellären Körnerzellen und die Entwicklung von Kleinhirn für die Beurteilung der Morphologie und der Migrationseigenschaften von Neuronen.
Zusammenfassung
Entwicklungs Ereignisse im Gehirn einschließlich der neuronalen Morphogenese und Migration sind hoch orchestriert Prozesse. In-vitro-und in vivo-Analysen erlauben eine detaillierte Charakterisierung von Wegen an diesen Veranstaltungen beteiligt sind. Kleinhirnkörnerzellen (CGN), die von sich entwickelnden Kleinhirn abgeleitet werden, sind ein ideales Modell-System, das für die morphologische Analysen ermöglicht. Hier beschreiben wir eine Methode, wie man genetisch zu manipulieren, CGN und wie axono-und dendritogenesis von einzelnen Nervenzellen zu studieren. Mit diesem Verfahren werden die Auswirkungen der RNA-Interferenz, Überexpression oder kleinen Molekülen verglichen werden, um Nervenzellen zu steuern. Darüber hinaus ist das Nagetier Kleinhirnrinde ein leicht in vivo-System zugänglich aufgrund ihrer vorherrschenden postnatale Entwicklung. Wir präsentieren auch eine in vivo Elektroporation Technik genetisch zu manipulieren und die Entwicklung von Kleinhirn Kleinhirn beschreiben nachfolgenden Analysen eine neuronale Morphologie beurteilennd Migration.
Einleitung
Das Kleinhirn ist ein ausgezeichnetes System, die Mechanismen der Axon Wachstum und Migration zu untersuchen. Das Kleinhirn hat sich seit den Anfängen der Neurowissenschaften ein Gegenstand von anatomischen Studien. Moderne Mikroskopie und immunhistochemischen Techniken erheblich erweitert und verfeinert die ersten Entdeckungen von Santiago, Ramon und Cajal 2-4. Maus-Genetik und molekulare Untersuchungen aufgedeckt wesentliche Wachstums-und Transkriptionsfaktoren bei der Kontrolle der Entwicklung des Kleinhirns, die zu einem besseren Verständnis der entscheidenden Ereignisse der richtigen Verkabelung von verschiedenen Arten von Neuronen, einschließlich Kleinhirnkörnerzellen (CGN) 7.5 erforderlich geführt.
Das Kleinhirn ist ein Derivat von Rhombomer 1 der Entwicklungs hindbrain 8. Die rhombische Lippe, die einen Teil des Daches des 4. Ventrikels, entsteht Kleinhirn-Körner Neuron Vorläufern, die die zahl neuronalen Population in der darstellen wirderwachsenen Kleinhirn 9. Nach rostral Migration, begnügen sie sich in der Kleinhirn-anlage. Hier Mitose Granulat Neuron Vorstufen führt zu der dramatischen Expansion der äußeren Körnerschicht (EGL), die postnatal Ort bei Nagetieren dauert. Von der EGL, starten Neuronen nach innen durch die Migration der Molekularschicht (ML), vorbei an der Purkinje-Zellschicht, um letztendlich ihren Wohnsitz in der internen Körnerschicht (IGL 2). Während dieser Migrationsprozess, eine bipolare Form erwerben sie mit zwei Axone in die ML erstreckt. Beim weiteren Migration der Zellkörper wandert von den Axonen und die beiden Prozesse zu verschmelzen, um eine gabelförmige, T-förmige Axon 10 zu bilden. Anschließend wird diese Axone fasciculate und werden als parallele Fasern bezeichnet. Nachdem in der IGL siedelt, CGN wachsen Dendriten, die dendritischen Klauen bilden Synapsen mit Moosfasern herzustellen. Um grundlegende Prozesse in der Entwicklung von Kleinhirn zu untersuchen, ein in vitro und in vivo approac kombinierth ermöglicht zuverlässige Ergebnisse und Schlussfolgerungen.
CGN sind nicht nur die zahlreichen Nervenzellen des Kleinhirns, sondern des gesamten Gehirns und kultiviert, um die hohe Reinheit von 11 bis 13 sein. In der Kultur, wird diese sehr homogene neuronalen Population schnell postmitotische und erwirbt eine polare Morphologie mit leicht identifizierbaren Axonen und Dendriten. Kultivierte, CGN haben sich als äußerst nützlich, um verschiedene Aspekte der neuronalen Entwicklung einschließlich Vorläufer Proliferation, Differenzierung und axonalen Dendriten Entwicklung, neuronale Migration, Apoptose und elektrophysiologischen Eigenschaften (14-19 und viele andere) zu studieren sein. Die Nutzung genetischer Manipulation hat die Vielseitigkeit des kultivierten, CGN erweitert und für weitere mechanistische Einblicke in die genannten Veranstaltungen erlaubt. Transfektion von kultivierten Neuronen mit niedrigem Wirkungsgrad Calciumphosphat oder lipophile Methoden gefolgt von Immunzytochemie mit Polaritätsmarkierungen oder softwaregestützte Analyse FaciliTAATEN die Beurteilung zB der Morphologie der einzelnen Neuronen in einem neuronalen dichten Kultur. Mit diesem Ansatz kann die Rolle der Proteine von Interesse in Axon oder Dendritenwachstum 20-25,26-28 sucht werden. Das Kultursystem ist jedoch weniger nützlich, um neuronale Migration zu analysieren, wie die Migration in sehr hoher Dichte Kulturen begrenzt und würden Cokulturen erfordern. Die in vitro-Analyse von Axons und Dendriten-Wachstum ermöglicht auch die Prüfung von miteinander verbundenen Proteine eines Signalweges unter Verwendung von Kombinationen der RNA-Interferenz (I), Überexpression oder kleine Moleküle.
Um die Bedeutung des Proteins von Interesse in Axon und Dendriten Wachstumsregulierung oder neuronale Migration zu schaffen, ermöglicht die Analyse der Entwicklung von Kleinhirnrinde der in-vivo-Elektroporation (IVE)-Technik. Aufgrund der Tatsache, dass Kleinhirnentwicklung bei Nagetieren verlängert Weg in den ersten zwei Lebenswochen, das Kleinhirn stellt eine accessible Hirnstruktur für genetische Manipulationen zu untersuchen, entwickeln Axone und Dendriten, neuronale Migration, Synaptogenese und Apoptose 20-24,29,30,26,27,31-34. Darüber hinaus ist auch in diesem Modellsystem auch für andere Aspekte der neuronalen Entwicklung, die die intakte Kleinhirnrinde wie Axon Pathfinding, Verkabelung und Vernetzung der Neuronen und Glia-Neuron-Interaktionen Zusammengenommen benötigen, bietet dieses Protokoll in vitro und in-vivo-Techniken zur Bewältigung ein komplementärer Ansatz für die neuronalen Morphogenese und Migration.
Protokoll
CGN kann entweder von postnatalen Tag (P) 5 Welpen Maus oder Ratte P6 Welpen vorbereitet werden. Wir folgen ein Protokoll, durch Bilimoria und Kollegen beschrieben, die eine Mitoseinhibitor nutzt, um für postmitotische, CGN 13 auswählen.
Ethik-Erklärung:
Alle Experimente mit lebenden Tieren wurden nach dem von der "Verbraucherschutz und Lebensmittelsicherheit" des Landes Niedersachsen, Deutschland zugelassenen Tier Protokoll durchgeführt.
In-vitro-Assay:
1. Herstellung von DNA Plasmid, Medien und Puffer für den Calciumphosphat-Transfektion Methode
- Lösen Plasmid-DNA in sterilem Endotoxin-freies Wasser; DMEM (high Glucose); machen 2,5 M CaCl 2; machen 2x HBSS (aufzulösen 4 g NaCl, 0,1775 g KCl, 0,095 g Na 2 HPO 4 • 7 H 2 O, 0,675 g Glucose und 2,5 g HEPES in 250 ml Reinstwasser und pH-Wert auf 7.05, 7.08 und 7.11). Hinweis: Bei der Vorbereitung2x die HBSS-Lösung, pH-Test, liefert die besten Ergebnisse in Bezug auf Effizienz der Transfektion bestimmten Kombination von Plasmiden.
2. Transfektion von kultivierten Neuronen
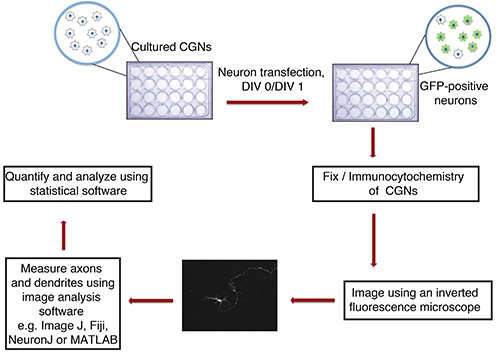
Fig. 1 ist. Flussdiagramm der in vitro-Axon und Dendriten Wachstumstest. Cultured CGN (24-Well-Platte mit Deckgläschen), isoliert von P6 Rattenjungen, werden bei DIV 0 oder 1 mit DNA-Niederschlag, der einen fluoreszierenden Marker Transfektion (zB GFP) transfiziert. Nach der Fixierung und Immunzytochemie, werden Nervenzellen in einer verblindeten Weise abgebildet. Bilder werden in ImageJ importiert und Prozesse gemessen werden. Die Messungen werden dann mit einem Statistikprogramm verarbeitet.
- Seed, CGN (20 x 10 6 pro 24-Well-Platte, BME, 10% Kälberserum, 2 mM Penicillin-Streptomycin-Glutamin (PSG), 25 mM KCl) auf Salpetersäure gewaschen, Polyornithin-beschichtete 12 mm Deckgläschen in einer 24-Well-Platte mit 500 ul Medium pro Vertiefung.
- Am Tag in vitro (DIV) 0 (mindestens 8 Stunden nach dem Ausstreichen) oder DIV 1, sammeln Wachstumsmedien und halten bei 37 ° C Zweimal waschen Neuronen mit 500 &mgr; l vorgewärmtem DMEM und füge 500 &mgr; l DMEM.
- Ort Neuronen im Inkubator (37 ° C, 5% CO 2) für 45 min.
- Bereiten Sie 40 ul DNA-Niederschlag für jeden gut durch Mischen: DNA (2-2,5 g / gut, 10% der Gesamt-DNA-Transfektion sollte ein Marker zB GFP transfizierten Neuronen sichtbar sein), Wasser (bis zu 18 ul), fügen Sie 2 ul 2,5 M CaCl 2, gut mischen und mit 20 ul 2x HBSS.
- Inkubieren DNA Niederschlag 5 min bei RT.
- In DNA-Niederschlag in jede Vertiefung und Inkubation für 18 min Neuronen im Inkubator.
- Entfernen DMEM / DNA-Mischung und waschen Neuronen zweimal mit 500 ul vorgewärmten DMEM.
- In gesammelten Medien von Schritt 2.2 zurück zu Neuronen. Wenn Nervenzellen in Kultur für mehr als 3 Tage, zu ergänzen, Medien mit 25 mM Glucose bei DIV 3 Kohlenstoffquelle aufzufüllen.
- Nach 1-5 Tagen, vorbehaltlich Neuronen Immunzytochemie mit GFP-Antikörpern.
- Bild mindestens 30 einzelnen Neuronen pro Bedingung in einer verblindeten Weise unter Verwendung eines Fluoreszenzmikroskops.
3. Messen Sie Axone und Dendriten mit NeuronJ, ein NIH ImageJ Plugin
Wichtig: Stellen Sie sicher, dass die Bilder werden correctluy durch geeignete Pixel skaliert: um Verhältnis je nach Vergrößerung und Auflösung des Bildes.
- Konvertieren von Bildern in 8-Bit mit ImageJ: Bild öffnen, wählen Sie 'Bild' -> 'Typ' -> '8-Bit '->' Bild speichern ".
- Führen NeuronJ Plugin und öffnen Sie die 8-Bit-Bild.
- Verwenden Sie die Option 'In Kurven ", um das Axon zu verfolgen: click die linke Maustaste einmal am Anfang des Axons und bewegen Sie die Maus auf den Prozess. Klicken Sie doppelt auf Spitze des Axons, wenn Spur axonalen Form entspricht.
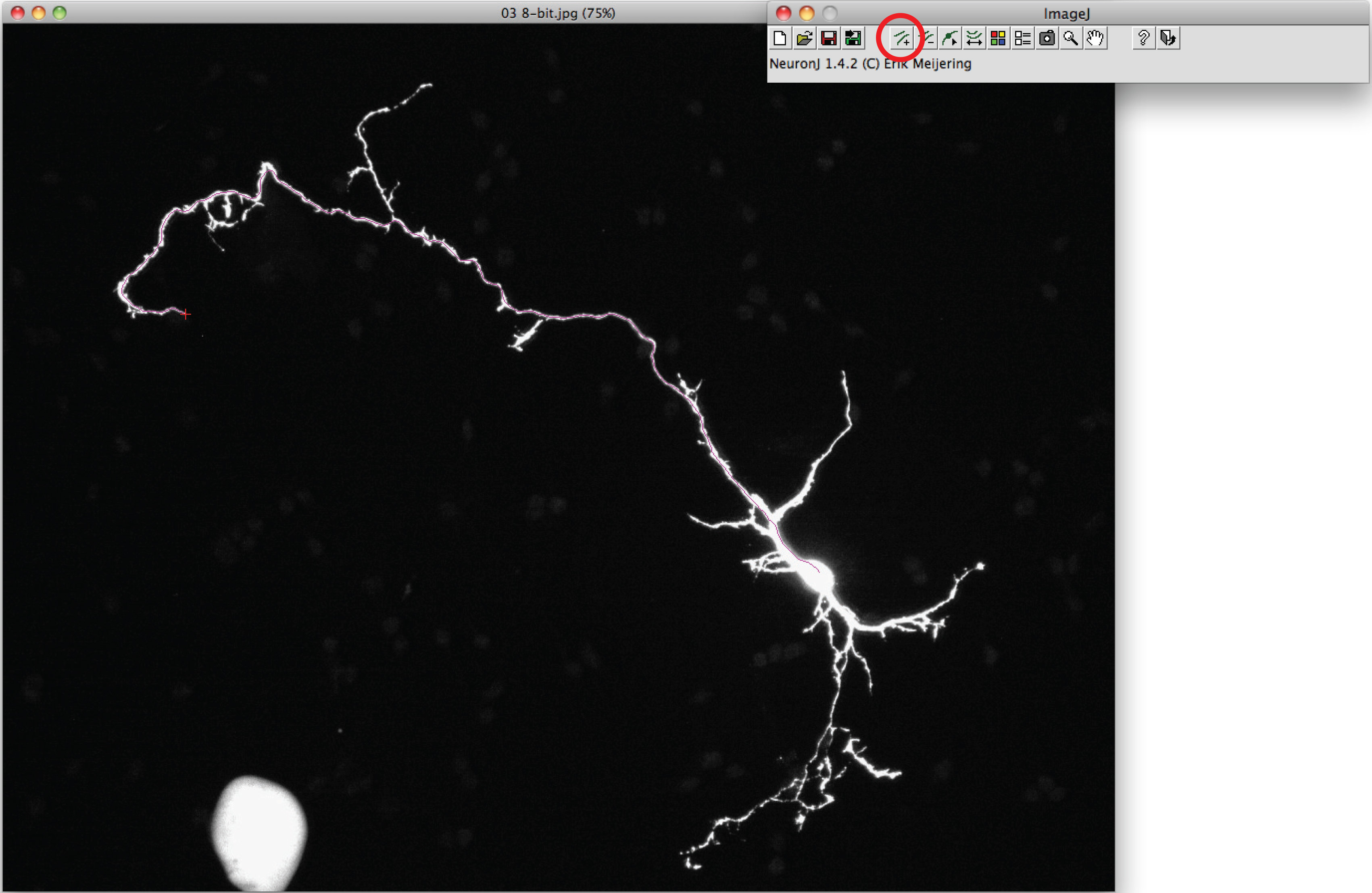
Hinweis: Sollte die vorgeschlagene Spur von axonalen Form unterscheiden, klicken Sie einmal auf der axonalen Prozess Spur zu verankern, dann klicken Sie doppelt auf Spitze des Axons. - Klicken Sie auf "Measure-Kurs", wählen Sie die 'Display-Messungen Tracing "-Option, und drücken Sie auf" Ausführen ". Axon Messungen sind alle in einem neuen Fenster angezeigt. Für Dendriten, wählen Sie die "Anzeigegruppen Messungen Option", und drücken Sie auf "Ausführen".
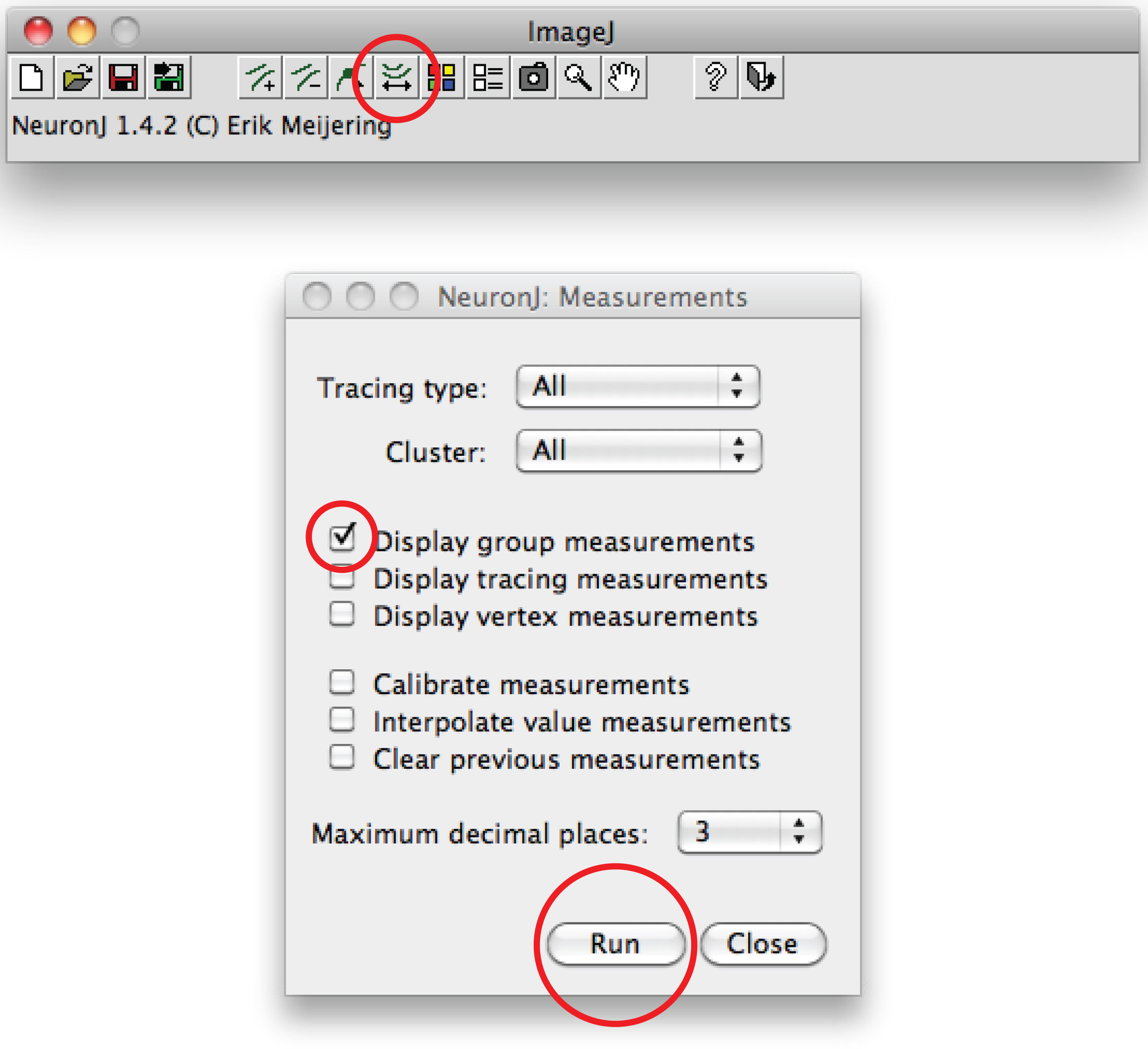
Insgesamt Dendriten Messungen sind alle in einem neuen Fenster angezeigt. Speichern Sie sie als separate Datei, die in jedem Tabellenkalkulationsprogramm geöffnet werden kann. - Alternativ zur manuellen Tracing, verwenden Fidschi-Software: Klicken Sie rechts auf the Option "Gerade", wählen Sie "Freehand-line ',
halten Sie die linke Maustaste gedrückt und den Prozess manuell verfolgen, drücken Sie "Strg + M" zu messen. - Berechnen Sie die durchschnittliche axonalen / dendritischen Länge pro Bedingung und geeignete statistische Tests.
In-vivo-Elektroporation:
1. Ausrüstung und Vorbereitung der Reagenzien
- Sie müssen 30 G Nadeln, Abstandhalter (1-2 mm), Spritze, Totvolumen Minderer (DVR), Elektroporator und tweezertrodes, Heizkissen oder Infrarot-Wärmelampe, Schwanenhals-Lampe und Isofluran.
- Setzen DVR in die Nadel, dann bringen Nadel der Spritze, und endlich Distanzstück auf Nadel (Abbildung 2).
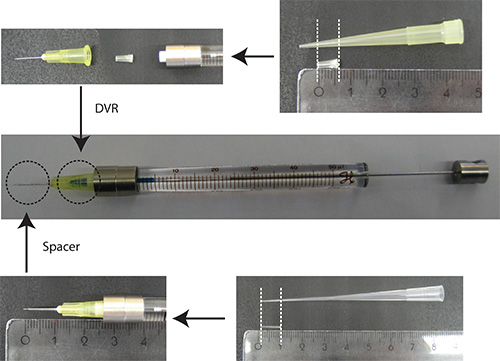
Abbildung2. Vorbereitung der Nadel. DVR wird von einer 200 ul Pipettenspitze abgeschnitten und in die Nadel, um das Totvolumen platziert. Abstandshalter aus einem 200 &mgr; l Ladespitze abgeleitet und auf das Ende der Nadel angeordnet, um die Eindringtiefe in das Kleinhirn zu etwa 2 mm zu regeln. Ruler Einheiten: cm - Lösen DNA in PBS/0.03% Fast Green. Anmerkung: In der Transfektion Marker ist es vorteilhaft, um ein fluoreszierendes Protein, das unter einem Neuron-spezifischen Promotors (zB Synapsin) ist, um nur Neuronen zu visualisieren. 25% der Gesamtmenge sollte das Plasmid das Plasmid Transfektion Marker kodiert.
- Machen Sie 70% Ethanol.
- Mix gleiche Mengen von Oktober und 30% Saccharose in PBS gelöst.
- Füllen Spritze mit 4 ul der DNA (4 ug / ul von Plasmid-DNA in PBS/0.03% Fast Green).
2. IVE von Rattenjungen
Flussdiagramm des IVE: siehe Abbildung 3
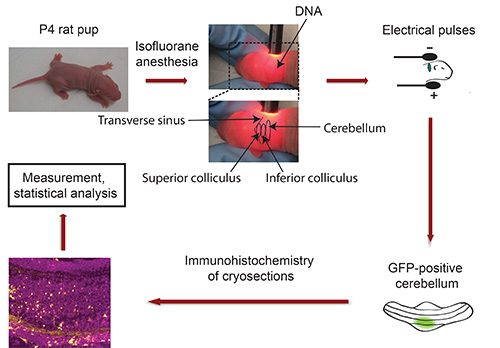
3. Flussdiagramm in vivo Elektroporation. P4 Rattenjungen mit Isofluran und Plasmid-DNA, die ein fluoreszierendes Transfektion Marker (zB GFP) codiert anästhesiert in Kleinhirn injiziert, gefolgt von Behandlung mit 5 elektrischen Impulsen. Fünf Tage später, isoliert GFP-positive Kleinhirne sind geschnitten und Immunhistochemie unterzogen. Bilder werden mit einem konfokalen Mikroskop aufgenommen und mit Imaris Software analysiert. Daten werden mit einem Statistikprogramm verarbeitet.
- Verwenden P4 Rattenjungen von Albino-Stamm (Wistar oder Long Evans).
- Anesthetize Welpen (eine nach der anderen) mit Isofluran in kleine Box (zB P1000 Pipettenspitze Box) mit 200 ul von Isofluran (im Gewebe eingeweicht) für 1-2 min bis Welpe ist nicht mehr bewegt. Achten Sie darauf, die Jungtiere nicht in Kontakt kommen with Flüssigkeit ein Isofluran. Überwachung der Zeit genau wie einzelne Welpen reagieren unterschiedlich auf die Anästhesie.
- Sterilisieren Hinterkopf Welpe mit 70% Ethanol.
- Fix Leiter der Welpe zwischen Daumen und Zeigefinger und Schwanenhalslampe Kleinhirn von Albino-Welpen zu finden. Die Quer Sinus scharf grenzt die Mittelhirn (Colliculus superior und inferior) aus den kortikalen Hemisphären (Abbildung 3). Das Kleinhirn ist neben Mittelhirn gelegen und erscheint in einem dunkleren Farbton. Verwenden Sie eine dauerhafte Markierung, um das Kleinhirn mit einem Punkt geben. Wichtig: Halten Sie Welpen in fester Position! Hinweis: Sollte Anästhesie tragen während dieser Prozedur aussetzen Welpen vor der Injektion der DNA Isofluran.
- Die Nadel (3) und langsam zu injizieren 3 ul DNA in das Kleinhirn.
- Lassen Sie die DNA-Lösung diffundieren für 30-60 sek.
- Zeigen Leiter der Welpe zwischen tweezertrodes, so dass der Minus-Pol in Kontakt mit dem Hinterkopf (KleinhirnR-Region) und der Pluspol an der gegenüberliegenden Seite des Kopfes (3).
- Betreff Welpen bis 5 elektrischen Impulsen. Stellen Spannung Gewicht der Jungtiere, gute Elektroporation Effizienz ohne ihr Überleben (Tabelle 1) Kompromisse zu gewährleisten.
Tabelle 1. Elektroporation von P4 Rattenjungen.Gewicht Spannung Puls Intervall 8-9 g 160 V 50 msec 950 ms 9-10 g 165 V 50 msec 950 ms > 10 g 170 V 50 msec 950 ms - Lassen Welpen wieder auf beheizten Unterlage oder unter einer Infrarotlampe. Zurück zu Welpen, min. Wichtig: Stellen Sie sicher, dass Wärmequelle keine Verbrennungen zuzufügen.
- Sacrifice Welpen 5 Tage nach der Elektroporation, indem sie in CO 2, gefolgt von der Enthauptung.
- Trennen Sie das Kleinhirn und Leinwand für GFP-positive Kleinhirne mit einem Fluoreszenzmikroskop.
- Fix Kleinhirne in 4% PFA O / N bei 4 ° C, dann in 30% Saccharose Inkubation bei 4 ° C bis cerebella Körper den Boden des Röhrchens.
- Embed cerebella in OCT/30% Saccharose und schneiden 40 um koronalen Abschnitte mit einem Kryostaten. Hinweis: Abschnitt jedes Kleinhirn in einer Weise geblendet.
- Betreff Abschnitte Immunhistochemie mit dem GFP-Antikörper. Gegenfärbung mit Kernfarbstoff (DAPI oder Hoechst 33258), und ermittelt die Lokalisierung von mindestens 200 transfizierten Neuronen pro Tier.
- Für eine eingehende Analyse, unterteilen die IGL in zwei Hälften, was zu einer oberen IGL mit Blick auf den ML und einen unteren IGL vor der weißen Substanz und zählen GFP-positive Neurone wohnhaft in jeder Hälfte. Hinweis: Graf GFP-positiven Neuronen jedes Abschnitts in verblindet.
3. Mess Dendrite Länge, Erwerben Sie die Bilder von der Sektion in x, y, z-Ebene mit einem konfokalen Mikroskop
Hinweis: Verwenden Sie beispielsweise 40 Bilder für eine 40 um Schnitt mit einem z-stwp von 1 um.
- Offene Bild-Serie in der Software, Imaris, um ein 3D-Bild der Dendriten zu generieren.
- Klicken Sie auf "Surpass"-Modus, um das Neuron in 3D-Ansicht.
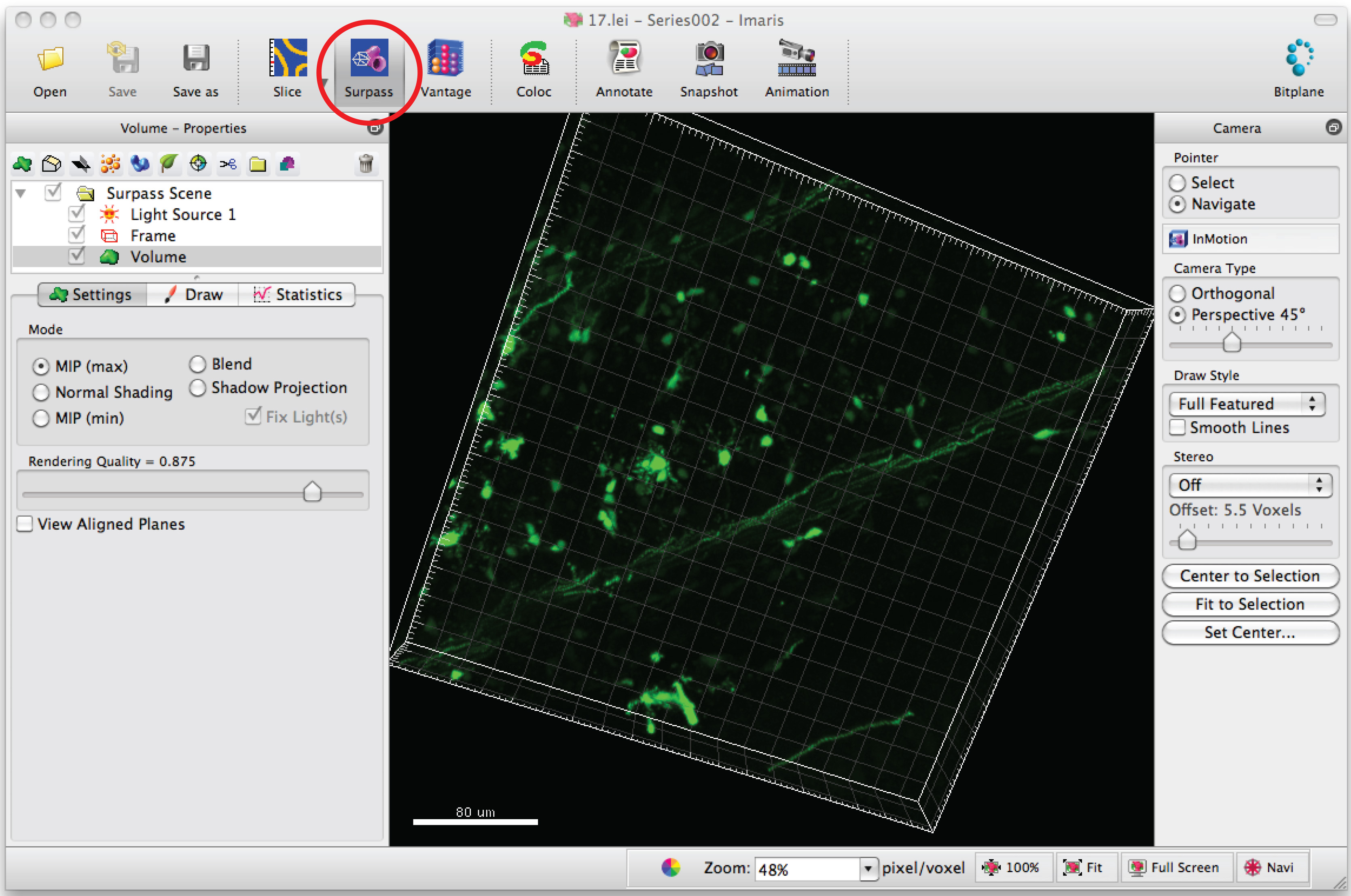
- Wählen Sie "Neuen Faden" und klicken Sie auf "Weiter automatische Erstellung", um halbautomatische Ablaufverfolgung starten.

Hinweis: Analysieren Sie jede 3D-Bild in einer Weise geblendet - Wählen Sie die Registerkarte "Zeichnen" und "AutoPath.
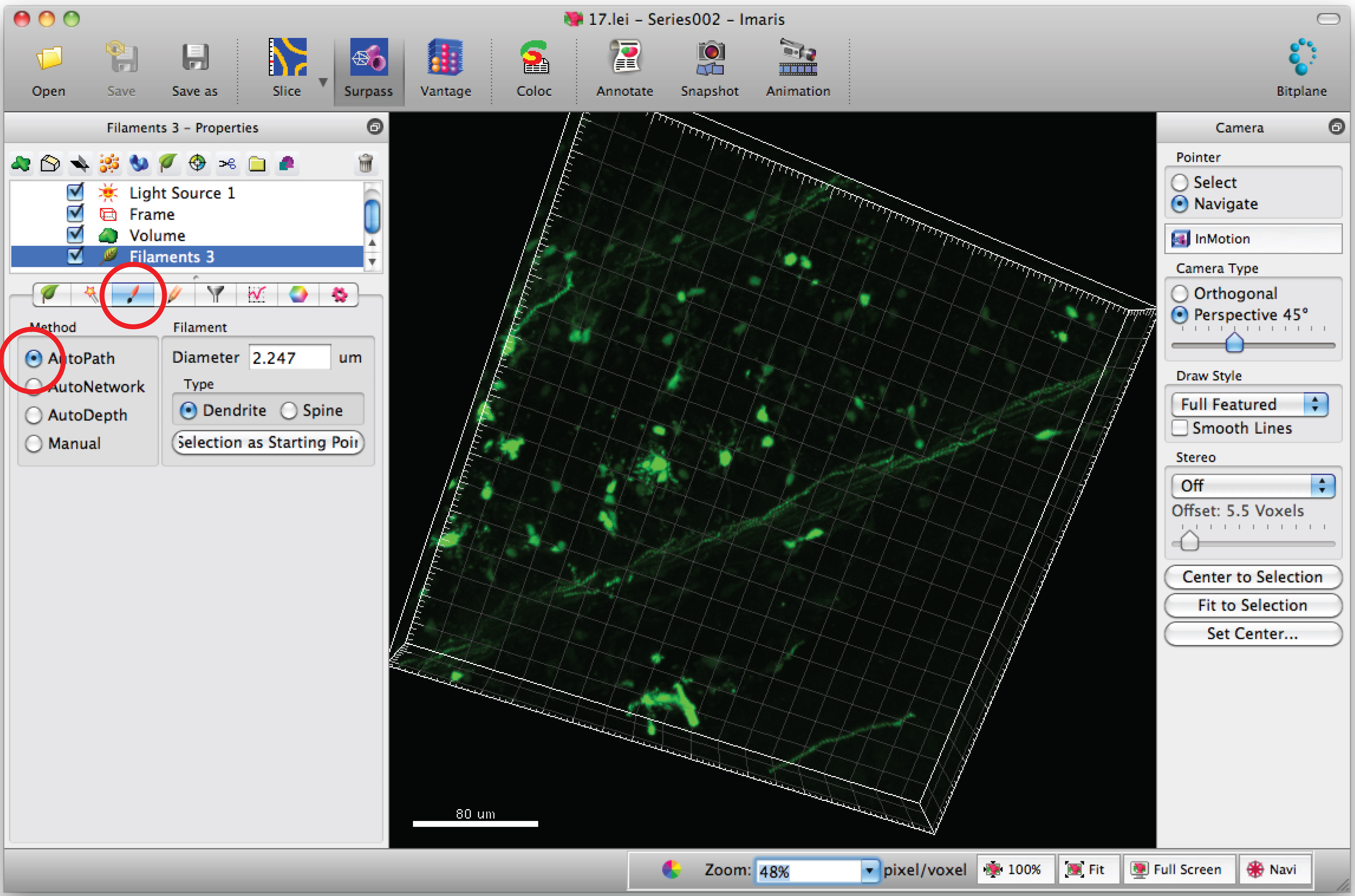
- Bewegen Sie den Mauszeiger auf der cell Körper und Shift + Maus rechts klicken, um den Zellkörper zu wählen. Hinweis: autocalculation durch Software kann einige Minuten dauern.

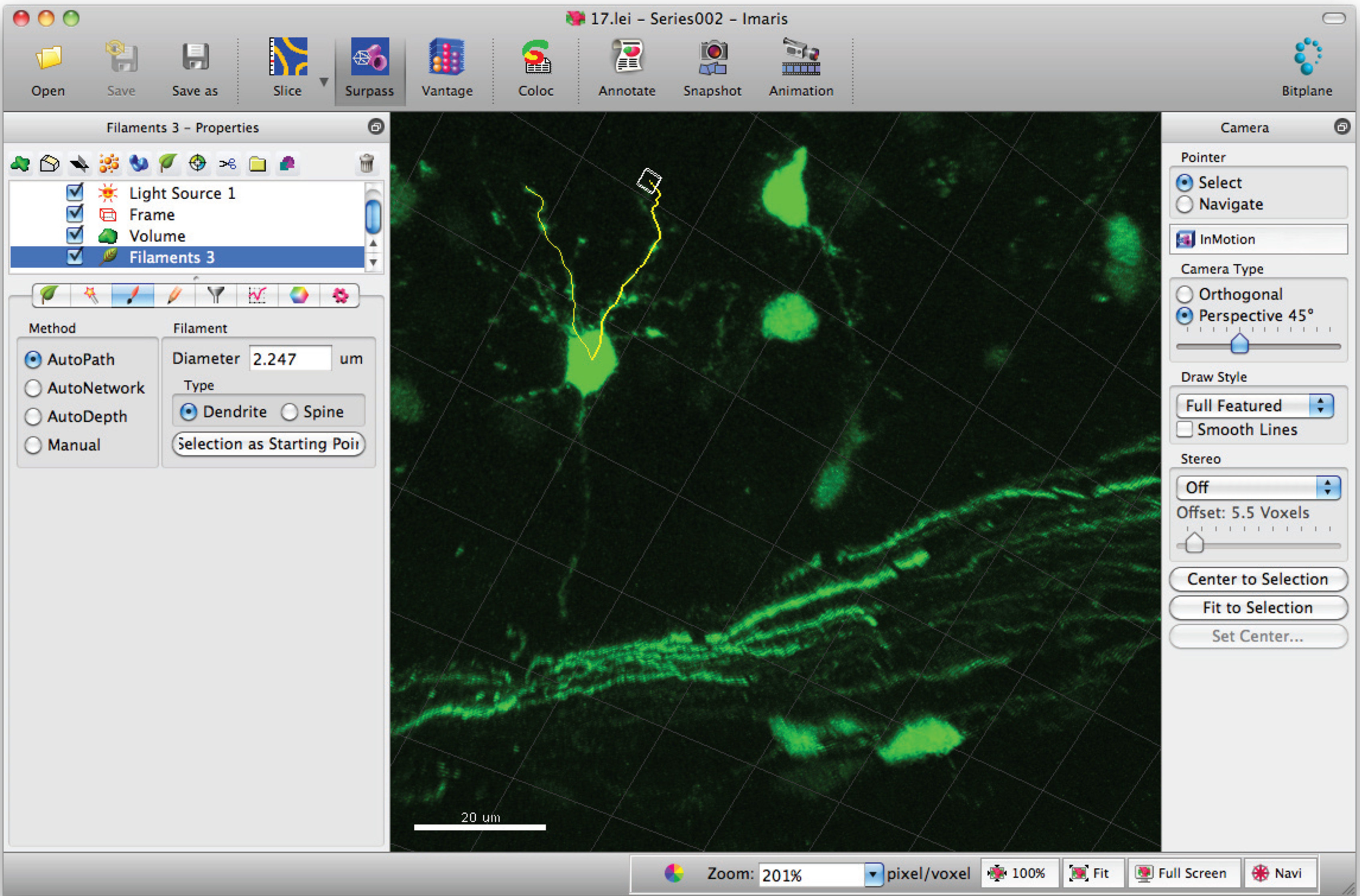
- In den Pfaden des Filaments (Dendriten) mit Shift + Maus links klicken. Hinweis: Pfade können in Echtzeit visualisiert werden.
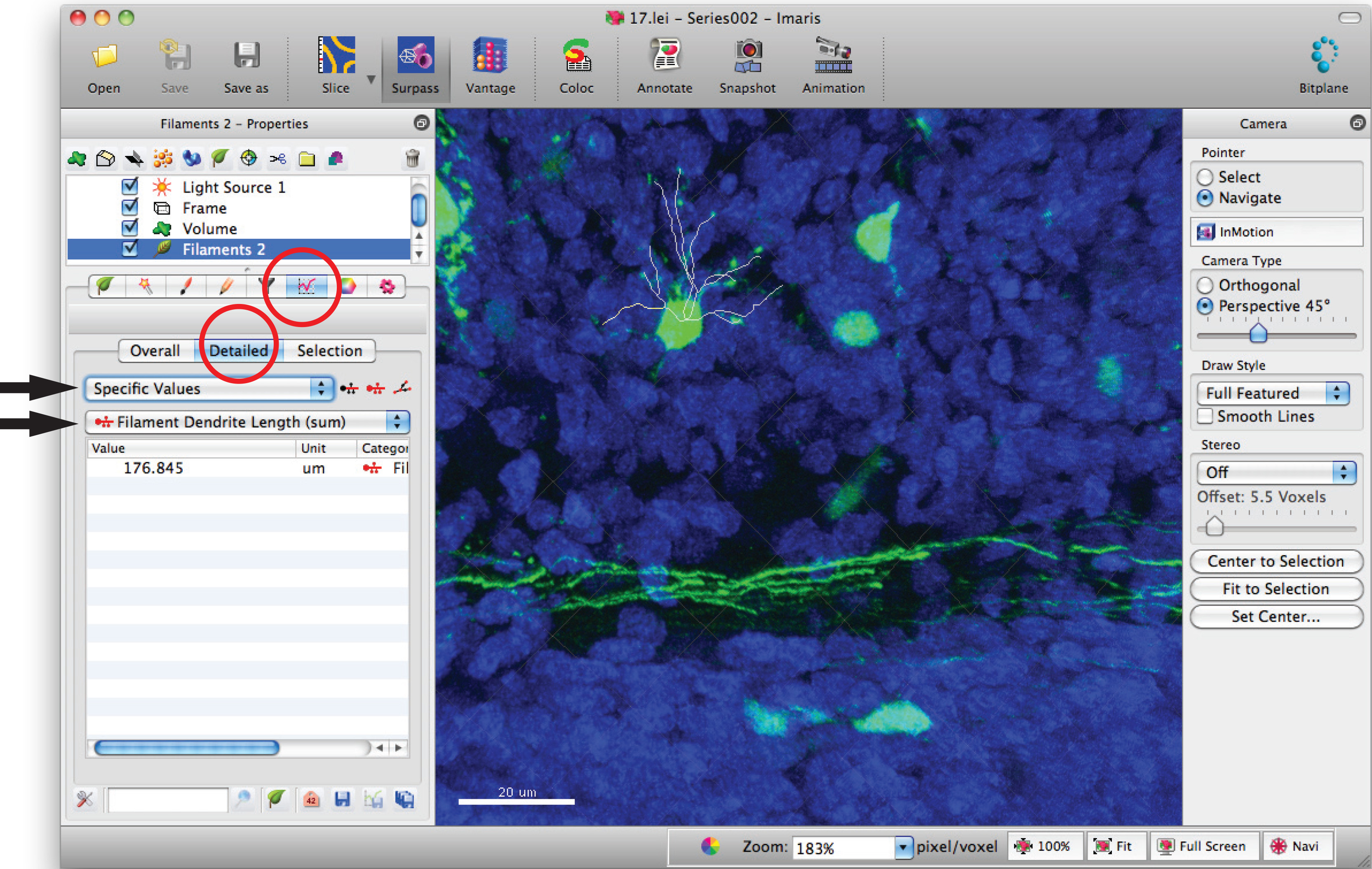
- Zum Filament Statistik-Fenster und klicken Sie auf "Detaillierte ',' Spezifische Werte" und "Filament Dendritenlänge (Summe) 'für Summe der Gesamt Dendritenlänge.
- Verwenden Sie geeignete statistische Tests, um Daten zu analysieren.
Ergebnisse
Um die Morphologie der CGN in Reaktion auf unterschiedliche Kultivierungsbedingungen zu analysieren, transfizierten wir die Neuronen auf DIV 0 wie oben beschrieben. Nach der Transfektion war, legten wir einen Satz von Neuronen in Vollmedium (BME, 10% Kälberserum, 2 mM PSG, 25 mM KCl) und ein anderer Satz in Minimalmedium mit Insulin (BME, 25 mM Glucose, 2 mM PSG, 10 ug / ml Insulin). Wir Immuncytochemie unter die Neuronen mit dem GFP-Antikörper bei DIV 1, 2 und 3, gefolgt von der Messung Axonen und Dendriten und Axone...
Diskussion
Vorteile und Grenzen der in vitro-und in vivo-Methoden beschrieben:
Kultivierte, CGN von Maus und Ratte sind gleich gut für die morphologische Analysen geeignet. Aufgrund der größeren Größe eines Rattenkleinhirn, die Ausbeute von CNG aus Rattenjungen übersteigt die Maus Welpen 3-4x. Abgesehen von CGN kann kortikalen und hippocampalen Neuronen als Kultursystem verwendet, sowie werden. Das Calciumphosphat-Verfahren führt zu einer niedrigen (0,01-5%) Transfektionseffizienz, die ...
Offenlegungen
Die Autoren erklären, keine finanziellen Interessen konkurrieren.
Danksagungen
Wir danken N. Schwedhelm-Domeyer für hervorragende technische Unterstützung, C. und S. Hammer Papiol für die Hilfe bei statistischen Analysen. Unsere Arbeit wird von der Max-Planck-Gesellschaft, der Deutschen Forschungsgemeinschaft, dem Center for Nanoscale Mikroskopie und Molekularphysiologie des Gehirns (CNMPB), Göttingen, Deutschland und der Junior-Gruppe GGNB Stipendium von der Universität Göttingen finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Referenzen
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten