A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מניפולציה גנטית של Cerebellar גרגיר נוירונים
In This Article
Summary
המורפוגנזה ונדידת נוירונים הן אירועים מכריעים שבבסיס התפתחות מוח תקין. כאן אנו מתארים שיטות לתמרן גנטי נוירונים בתרבית המוח הקטן גרגיר והמוח קטן מתפתח להערכה של מורפולוגיה ומאפייני נדידה של תאי עצב.
Abstract
אירועים התפתחותיים במוח כולל המורפוגנזה ונדידת נוירונים הם מתוזמרים מאוד תהליכים. במבחנה in vivo מנתחים לאפשר לאפיון מעמיק כדי לזהות מסלולים מעורבים באירועים אלו. נוירונים גרגיר cerebellar (CGNs) המופקים מהמוח הקטן מתפתח הם מערכת מודל אידיאלית המאפשרת לניתוחים מורפולוגיים. כאן אנו מתארים שיטה כיצד לתפעל גנטי CGNs ואיך ללמוד-axono וdendritogenesis של נוירונים בודדים. בשיטה זו ניתן להשוות את ההשפעות של התערבות RNA, ביטוי יתר או מולקולות קטנות כדי לשלוט בנוירונים. בנוסף, קליפת המוח הקטן המכרסם היא נגישה בקלות במערכת vivo בשל ההתפתחות לאחר הלידה הדומיננטית שלה. גם אנחנו מציגים את in vivo electroporation טכניקה כדי לתפעל גנטי cerebella לפתח ולתאר במוח קטן שלאחר מכן מנתח כדי להעריך מורפולוגיה עצביתnd הגירה.
Introduction
המוח הקטן הוא מערכת מצוינת ללמוד מנגנונים של צמיחת האקסון ונדידה. המוח הקטן כבר את הנושא של מחקרים אנטומיים משחר מדעי המוח 1. מיקרוסקופ מודרני וטכניקות immunohistochemical הרחיבו באופן משמעותי ומעודן תגליות הראשוניות על ידי סנטיאגו, רמון, וקחל 2-4. גנטיקה עכבר ומחקרים מולקולריים חשפו גורמי גדילה ושעתוק חיוניים בשליטה על התפתחות המוח הקטן, מה שהובילו להבנה טובה יותר של אירועים קריטיים דרושים לחיווט נכון סוגים שונים של תאי עצב, כולל נוירונים במוח קטנים גרגיר (CGNs) 5-7 של.
המוח הקטן הוא נגזר של rhombomere 1 של המוח האחורי פיתוח 8. השפתיים rhombic, שהוא חלק מהגג של חדר 4 ה, מולידה אבות נוירון גרגר המוח הקטן, אשר יהוו את האוכלוסייה עצבית הרבות ביותר בהמוח הקטן בוגר 9. בעקבות הגירה מקורי, הם להתיישב בanlage המוח הקטן. הנה, מיטוזה של מבשרי נוירון הגרגר מובילה להתרחבות הדרמטית של השכבה החיצונית הפרטנית (EGL), המתרחש לאחר לידה במכרסמים. מEGL, הנוירונים להתחיל נודדים פנימה דרך השכבה המולקולרית (מ"ל), בעבר בשכבת תא פורקינג' סופו של דבר לקחת את מגוריו בשכבת גרגרים הפנימיים (IGL 2). במהלך תהליך נדידה זו, הם רוכשים צורה דו קוטבית עם שני אקסונים הארכה לML. על הגירה נוספת, גוף התא נודד הרחק מאקסונים ושני תהליכי הפתיל כדי ליצור האקסון אחד מפוצל, בצורת אות T 10. בהמשך לכך, אקסונים אלה fasciculate ומכונים סיבים במקביל כ. לאחר שהתיישב בIGL, CGNs לגדול דנדריטים, המהווים טפרים הדנדריטים להקים סינפסות עם סיבי אזובי. כדי לבחון תהליכים בסיסיים במוח הקטן מתפתח, בשילוב במבחנה בapproac vivoשעות מאפשרת לתוצאות ומסקנות אמינות.
CGNs הם לא רק נוירונים הרבים ביותר של המוח הקטן, אלא של כל המוח ויכול להיות מתורבת לטוהר גבוה 11-13. בתרבות, אוכלוסייה עצבית הומוגנית מאוד זה הופך במהירות postmitotic ורוכשת מורפולוגיה קוטב עם אקסונים ודנדריטים לזיהוי בקלות. CGNs התרבית הוכיחו להיות מאוד שימושי כדי ללמוד היבטים שונים של התפתחות עצבית הכוללים ריבוי אב, בידול, אקסון ופיתוח דנדריט, נדידת נוירונים, אפופטוזיס ומאפייני אלקטרו (14-19 ועוד רבים אחרים). השימוש במניפולציה גנטית הרחיבה את הרבגוניות של CGNs התרבותי ואיפשר לתובנה מכניסטית נוסף לאירועים האמורים. Transfection של נוירונים בתרבית באמצעות סידן זרחה יעילות נמוכה או שיטות lipophilic אחרי immunocytochemistry עם סמני קוטביות או הוא מסייע ניתוח נתמך תוכנהtates ההערכה למשל המורפולוגיה של נוירונים בודדים בתרבות עצבית צפופה. עם גישה זו, תפקידם של חלבונים של עניין צמיחת האקסון או דנדריט ניתן ללמוד 20-25,26-28. מערכת תרבות אולם זה היא פחות שימושי לנתח נדידת נוירונים כהגירה היא מוגבלת מאוד בתרבויות בצפיפות גבוהה ותדרוש cocultures. הניתוח במבחנה של האקסון וצמיחת דנדריט גם מאפשר הבדיקה של חלבונים ביניהם של מסלול איתות באמצעות שילובים של התערבות RNA (i), על ביטוי או מולקולות קטנות.
כדי לבסס את הרלוונטיות של החלבון של העניין בהאקסון ורגולציה צמיחת דנדריט או נדידת נוירונים, electroporation in vivo הטכניקה (IVE) מאפשר הניתוח בפיתוח המוח הקטן קליפת המוח. בשל העובדה שפיתוח המוח הקטן במכרסמים משתרע דרך כלשבועות לאחר הלידה הראשון, המוח הקטן מייצג accessibמבנה המוח le למניפולציות גנטיות כדי לבחון פיתוח אקסונים ודנדריטים, נדידת נוירונים, synaptogenesis ואפופטוזיס 20-24,29,30,26,27,31-34. בנוסף, מערכת מודל זה שימושי גם להיבטים אחרים של התפתחות עצבית הדורשים את קליפת המוח הקטן בשלמותה כגון pathfinding האקסון, חיווט וקישוריות של תאי עצב ונוירון, גליה אינטראקציות יחדיו, פרוטוקול זה מספק במבחנה בטכניקות vivo כדי להתמודד עם גישה משלימה לגבי המורפוגנזה ונדידת נוירונים.
Protocol
ניתן להכין CGNs או מיום לידה (P) 5 גורי עכבר או גורי החולדה P6. אנחנו עוקבים אחרי פרוטוקול, שתואר על ידי Bilimoria ועמיתיו, אשר עושה שימוש במעכבי mitotic כדי לבחור עבור CGNs postmitotic 13.
שמירה על אתיקה:
כל הניסויים מעורבים בעלי חיים שנערכו על פי הפרוטוקול שאושר על ידי בעלי החיים את "Verbraucherschutz und Lebensmittelsicherheit 'של סקסוניה התחתונה שבגרמניה.
ב assay חוץ גופית:
1. הכנה של ה-DNA פלסמיד, מדיה, וחוצצים לסידן פוספט Transfection השיטה
- ממיסים פלסמיד דנ"א במים סטריליים, ללא רעלן פנימי; DMEM (גלוקוז גבוהה); להפוך 2.5 M CaCl 2; להפוך 2x HBSS (לפזר 4 גרם NaCl, 0.1775 גרם KCl, 0.095 גרם Na 2 • 7H 2 O, גלוקוז 0.675 גרם 4 HPO ו2.5 HEPES גרם ב250 מים ultrapure מ"ל וכדי להתאים את pH 7.05, 7.08, ו7.11). שים לב: בעת הכנהפתרון 2x HBSS, הבדיקה שpH נותן תוצאות הטובות ביותר לגבי יעילות transfection של שילוב נתון של פלסמידים.
2. Transfection של תרבית נוירונים
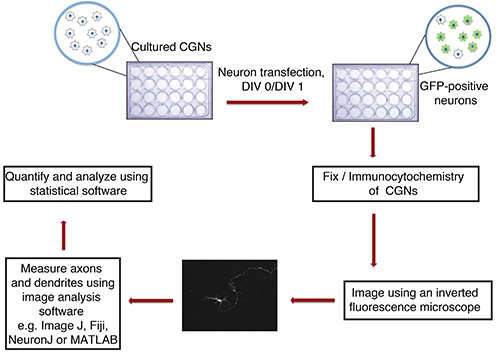
איור 1. תרשים זרימה של במבחנה האקסון וassay צמיחת דנדריט. התרבותי CGNs (24 גם צלחת עם coverslips זכוכית), מבודדת מגורי החולדה P6, הם transfected בDIV 0 או 1 עם משקע DNA המכיל סמן פלואורסצנטי transfection (למשל GFP). לאחר הקיבוע וimmunocytochemistry, הנוירונים הם צילמו באופן עיוור. תמונות מיובאות לImageJ ותהליכים נמדדים. לאחר מכן מדידות מעובדות באמצעות תכנית סטטיסטית.
- CGNs זרע (20 x 10 6 לכל צלחת 24 גם; BME, 10% נסיוב עגל, 2 מ"מ פניצילין-Streptomycin-גלוטמין (PSG), 25 מ"מ KCl) ב, coverslips חנקן שטף חומצה מצופה polyornithine 12 מ"מ הזכוכית בצלחת 24 גם עם 500 μl של תקשורת בכל טוב.
- ביום במבחנה (DIV) 0 (לפחות 8 שעות לאחר ציפוי) או DIV 1, לאסוף תקשורת צמיחה ולשמור על 37 ° C. שטוף פעמיים עם תאי עצב 500 μl של DMEM prewarmed ולהוסיף 500 μl של DMEM.
- נוירונים מקום חממה (37 ° C CO, 2 5%) ל45 דקות.
- הכן 40 משקע DNA μl לכל אחד גם על ידי ערבוב: ה-DNA (2-2.5 מיקרוגרם / טוב, 10% של ה-DNA בסך הכל צריך להיות למשל סמן transfection GFP לדמיין נוירונים transfected), מים (עד 18 μl), להוסיף 2 μl של 2.5 M CaCl 2, לערבב היטב ולהוסיף 20 μl של 2x HBSS.
- דגירה משקע DNA במשך 5 דקות ב RT.
- הוספת משקע ה-DNA לכל היטב דגירה נוירונים ל18 דקות בחממה.
- הסר תמהיל DMEM / DNA ולשטוף נוירונים פעמיים עם 500 μl של DM prewarmedEM.
- הוסף מדיה שנאספו מהשלב 2.2 בחזרה לתאי עצב. אם הנוירונים יהיו בתרבות במשך יותר מ 3 ימים, מדיה תוסף עם 25 גלוקוז מ"מ בDIV 3 כדי לחדש את מקור פחמן.
- אחרי 1-5 ימים, הנוירונים בכפוף לimmunocytochemistry באמצעות נוגדני ה-GFP.
- לפחות תמונה 30 נוירונים בודדים לכל מצב בצורה עיוורה באמצעות מיקרוסקופ פלואורסצנטי.
3. מדדו אקסונים ודנדריטים עם NeuronJ, NIH ImageJ תוסף
חשוב: ודא כי תמונות הם מדורגים correctluy באמצעות פיקסל מתאים: יחס מיקרומטר בהתאם להגדלה ורזולוציה של תמונה.
- המרת תמונות ל8-bit עם ImageJ: תמונה פתוחה, בחר 'תמונה' -> 'סוג' -> '8 סיביות' -> 'התמונה' השמורה '.
- הפעל תוסף NeuronJ ולפתוח את התמונה של 8 ביט.
- השתמש באפשרות 'ההעתקים הוסף' כדי לעקוב אחר האקסון: CLאיכס לחצן העכבר השמאלי פעם אחת בתחילתו של האקסון ולהזיז את העכבר לאורך התהליך. לחץ לחיצה כפולה על קצה האקסון אם עקבות תואמת לצורת עצב.
הערה: במידה והעקבות הציעו שונות מצורת אקסון, לחץ פעם אחת על תהליך אקסון לעגן עקבות, ולאחר מכן לחץ לחיצה כפולה על קצה האקסון. - לחץ על 'העתקי מדוד', בחר 'תצוגת התחקות מדידות "אפשרות ולחץ על' הפעל '. כל מדידות אקסון מוצגות בחלון חדש. לדנדריטים, לבחור את 'האופציה מדידות קבוצת המדיה' ולחץ על 'הפעל'.
כל מדידות דנדריט סך הכל מוצגות בחלון חדש. לשמור אותם כקובץ נפרד שניתן לפתוח בכל תוכנת גיליונות אלקטרוניים. - לחלופין לאיתור ידני, להשתמש בתוכנת פיג'י: לחץ לחיצה ימנית על הדואר אפשרות 'קו ישר', בחר 'קו פריהנד',
לשמור על לחצן העכבר השמאלי לחוץ ולעקוב אחר התהליך באופן ידני, לחץ על Ctrl + M 'למדוד. - חישוב אורך ממוצע אקסון / דנדריטים לכל מצב ולהשתמש במבחן סטטיסטי מתאים.
ב electroporation vivo:
1. ציוד והכנת ריאגנטים
- אתה צריך 30 מחטי G, spacer (1-2 מ"מ), מזרק, מפחית מת נפח (DVR), electroporator, וtweezertrodes, כרית חימום או מנורת חום אינפרא אדום, מנורת השולחן מתכווננת וisoflurane.
- לשים DVR למחט, לאחר מכן לצרף מחט מזרק, וסוף סוף לשים spacer אל מחט (איור 2).
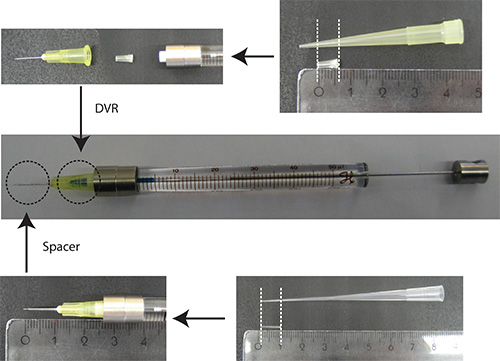
דמות 2. הכנה של המחט. DVR מנותק קצה פיפטה 200 μl והניחה לתוך המחט כדי להפחית את הנפח המת. Spacer נגזר מקצה 200 טעינת μl והוא ממוקם בקצה של המחט לווסת את עומק החדירה למוח הקטן לכ -2 מ"מ. יחידות שליט: סנטימטר - לפזר DNA בPBS/0.03% ירוקים מהיר. הערה: כסמן transfection, זה יתרון להשתמש בחלבון פלואורסצנטי כי הוא תחת אמרגן נוירון הספציפי (למשל synapsin) כדי להמחיש נוירונים בלבד. 25% מהסכום הכולל של פלסמיד צריכים להיות קידוד פלסמיד סמן transfection.
- הפוך 70% אתנול.
- לערבב כמויות שווה של אוקטובר וסוכרוז 30% מומסים ב-PBS.
- מלא מזרק עם 4 μl של ה-DNA (4 מיקרוגרם / μl של ה-DNA פלסמיד בPBS/0.03% גרין המהיר).
2. IVE של גורי חולדה
תרשים זרימה של IVE: ראה איור 3
עמודים = "כל זמן"> 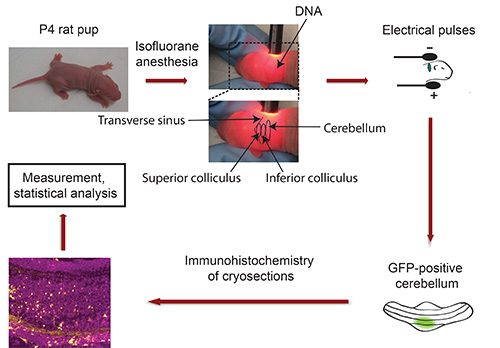
איור 3. תרשים זרימה של בvivo electroporation. גורי החולדה P4 הם מורדמים בIsoflurane ופלסמיד דנ"א קידוד סמן פלואורסצנטי transfection (למשל GFP) מוזרק לתוך המוח הקטן, ואחרי חשיפה ל -5 פולסים חשמליים. חמישה ימים לאחר מכן, cerebella GFP החיובי מבודד הם מחולק ונתון אימונוהיסטוכימיה. תמונות נלכדות באמצעות מיקרוסקופ confocal ונותחו באמצעות תוכנת Imaris. הנתונים מעובדים באמצעות תוכנה סטטיסטית.
- השתמש גורי חולדה P4 מזן לבקן (Wistar או הארוך אוונס).
- הרדימי גורים (אחד אחרי השני) עם isoflurane בתיבה קטנה (לדוגמא תיבת קצה פיפטה P1000) עם 200 μl של isoflurane (שהושר ברקמה) עבור 1-2 דקות עד שגור הוא כבר לא זז. תשמור על עצמך שגורים לא נכנסים לקשר wה-i Iiquid isoflurane. לפקח באופן הדוק זמן כגורי אדם מגיבים באופן שונה להרדמה.
- לעקרו אחורי של ראשו של הגור עם 70% אתנול.
- תקן את ראש הגור בין האגודל ואצבע ולהשתמש במנורת שולחן מתכווננת לאתר את המוח הקטן של גור לבקן. הסינוס הרוחבי חד תוחם את המוח התיכון (colliculus העליון והנחותים) מההמיספרות בקליפת המוח (איור 3). המוח הקטן ממוקם בצמוד למוח תיכון ומופיע בגוון כהה יותר. השתמש בטוש בלתי מחיק, כדי לציין את המוח הקטן עם נקודה. חשוב: שמור על גור בתנוחה קבועה! הערה: צריכה הרדמה להתפוגג במהלך הליך זה, לחשוף את הגור לIsoflurane לפני הזרקת ה-DNA.
- להכניס מחט (איור 3) ולאט להזריק 3 μl של ה-DNA לתוך המוח הקטן.
- תן פתרון ה-DNA מפוזר ל30-60 sec.
- הנח את ראשו של גור בין tweezertrodes כך שקוטב מינוס יוצר קשר עם החלק האחורי של הראש (cerebellaאזור r), וכי קשר המוט ועוד בצד השני של הראש (איור 3).
- גור בכפוף ל5 פולסים חשמליים. התאם מתח למשקל של גורים על מנת להבטיח יעילות electroporation טובה מבלי להתפשר על ההישרדות שלהם (טבלת 1).
טבלת 1. Electroporation של גורי חולדה P4.משקל מתח דופק הפסקה 8-9 גרם 160 V 50 msec 950 msec 9-10 גרם 165 V 50 msec 950 msec > 10 גרם 170 V 50 msec 950 msec - בואו גורים להתאושש על כרית מחוממת או מתחת מנורת אינפרא אדום. להחזיר גורים לסכר. חשוב: ודא שמקור חימום לא לגרום לכל כוויות.
- להקריב גורים 5 ימים לאחר electroporation ידי הצבת אותם בCO 2 ואחריו עריפת ראש.
- לבודד את cerebella ומסך לאלה GFP החיובי cerebella באמצעות מיקרוסקופ פלואורסצנטי.
- תקן את cerebella ב% PFA 4 O / N ב 4 ° C, ואז דגירה בסוכרוז 30% על 4 מעלות צלזיוס עד כיור cerebella לתחתית צינור.
- להטביע cerebella בסוכרוז OCT/30% ולקצץ 40 מיקרומטר סעיפי העטרה באמצעות cryostat. הערה: סעיף זה המוח הקטן באופן עיוור.
- סעיפים בכפוף לאימונוהיסטוכימיה באמצעות נוגדני ה-GFP. Counterstain עם צבע גרעיני (DAPI או Hoechst 33258) ולקבוע את הלוקליזציה של לפחות 200 נוירונים transfected לכל בעל חיים.
- לניתוח מעמיק, לחלק את IGL לחצאים, וכתוצאה מכך IGL העליון מול ML וIGL נמוך מול החומר הלבן ולספור נוירונים GFP חיובי המתגוררים בכל מחצית. הערה: ספירת תאי עצב GFP החיובי של כל סעיף באופן עיוור.
3. מדידת אורך דנדריט, רוכשת את תמונות של סעיף ב x, y, z מטוס באמצעות מיקרוסקופ confocal
הערה: לדוגמא, השתמש 40 תמונות לסעיף 40 מיקרומטר עם z-stwp של 1 מיקרומטר.
- סדרה פתוחה תמונה בתוכנה, Imaris, כדי ליצור תמונת 3D של דנדריטים.
- לחץ על מצב "לעלות" כדי להציג נוירון ב-3D.
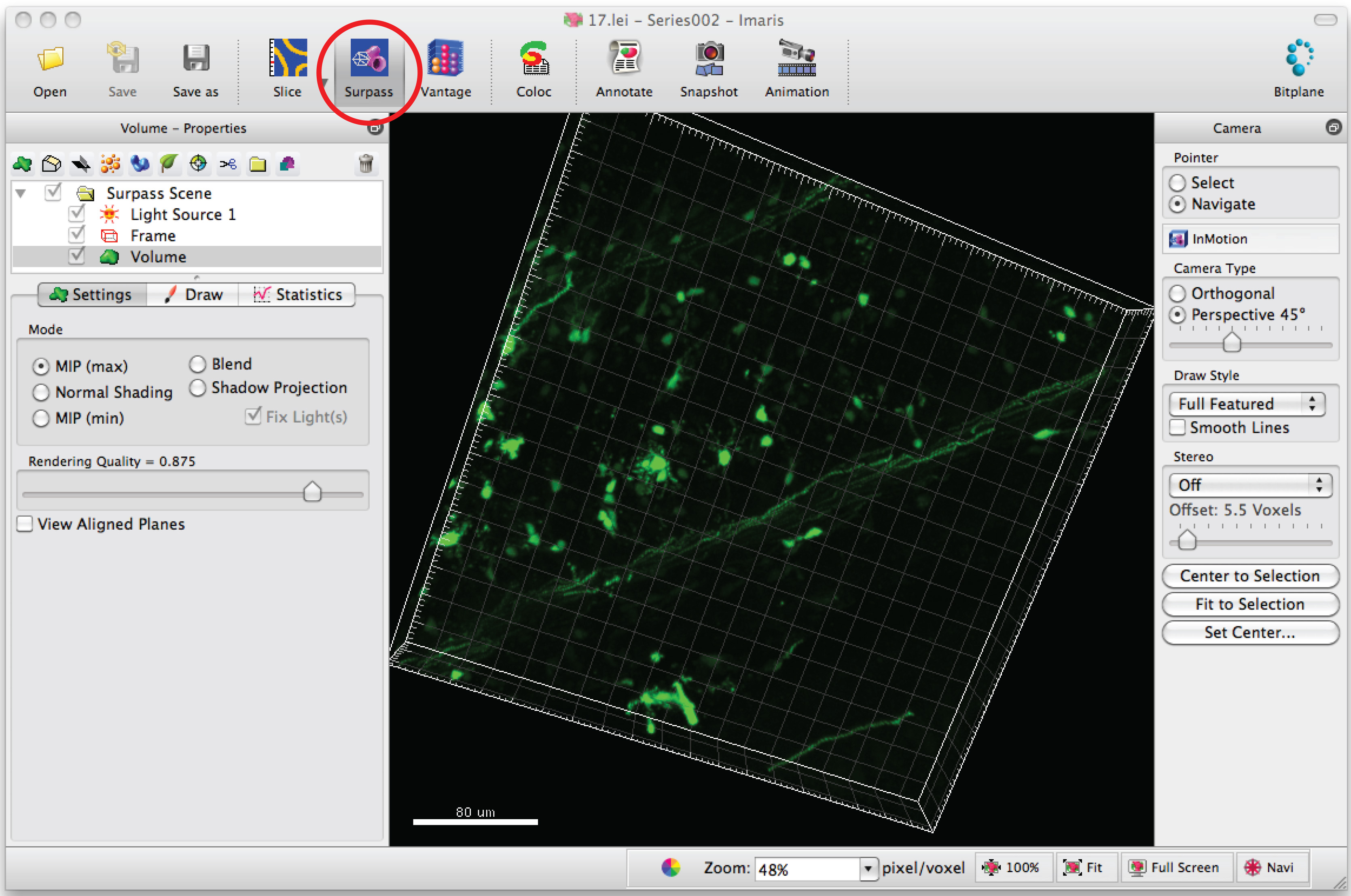
- בחר 'הוסף נימה חדשה' ולחץ על "דלג יצירה אוטומטית 'כדי להתחיל מעקב חצי אוטומטי.

הערה: לנתח כל תמונת 3D בצורה עיוורה - בחר בכרטיסייה 'צייר' ו 'AutoPath'.
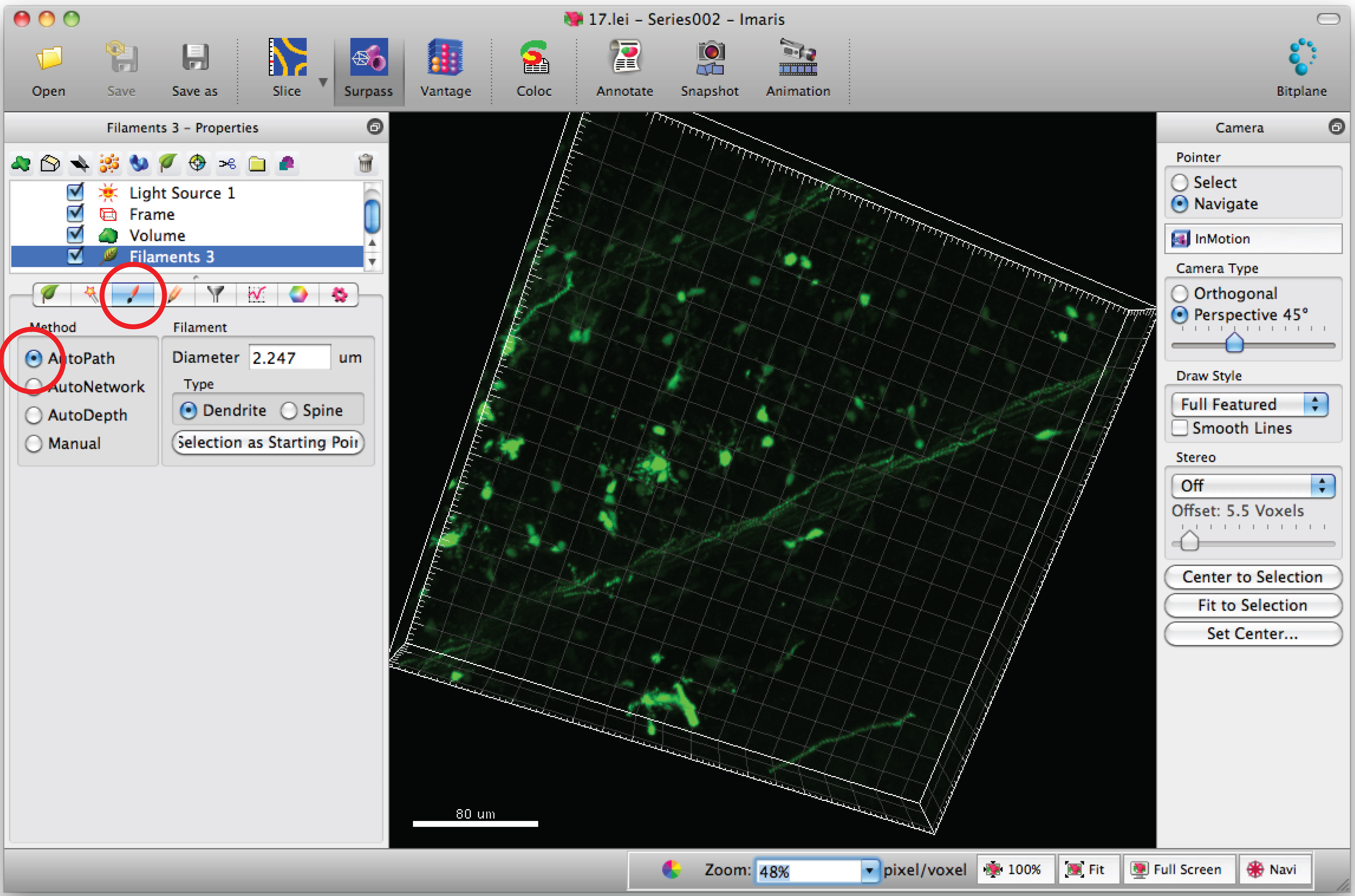
- הזז את סמן העכבר על גגוף ell וShift + עכבר ימני לחצו כדי לבחור את הגוף של התאים. הערה: Autocalculation ידי תוכנה עשויה לדרוש כמה דקות.

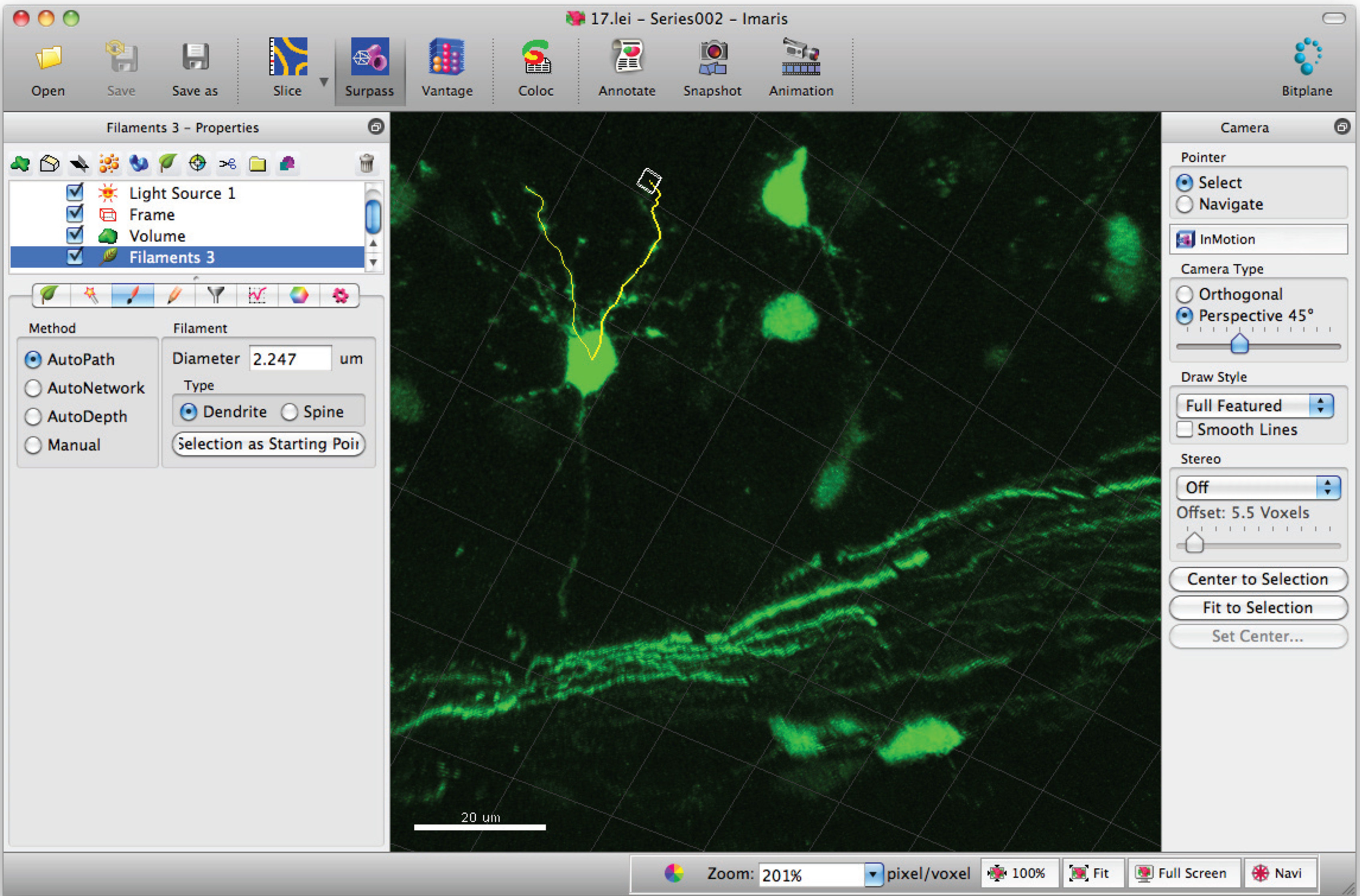
- להוסיף נתיבים לחוט הלהט (דנדריט) בעזרת Shift + לחיצת עכבר שמאלית. הערה: ניתן דמיינו נתיבים בזמן אמת.
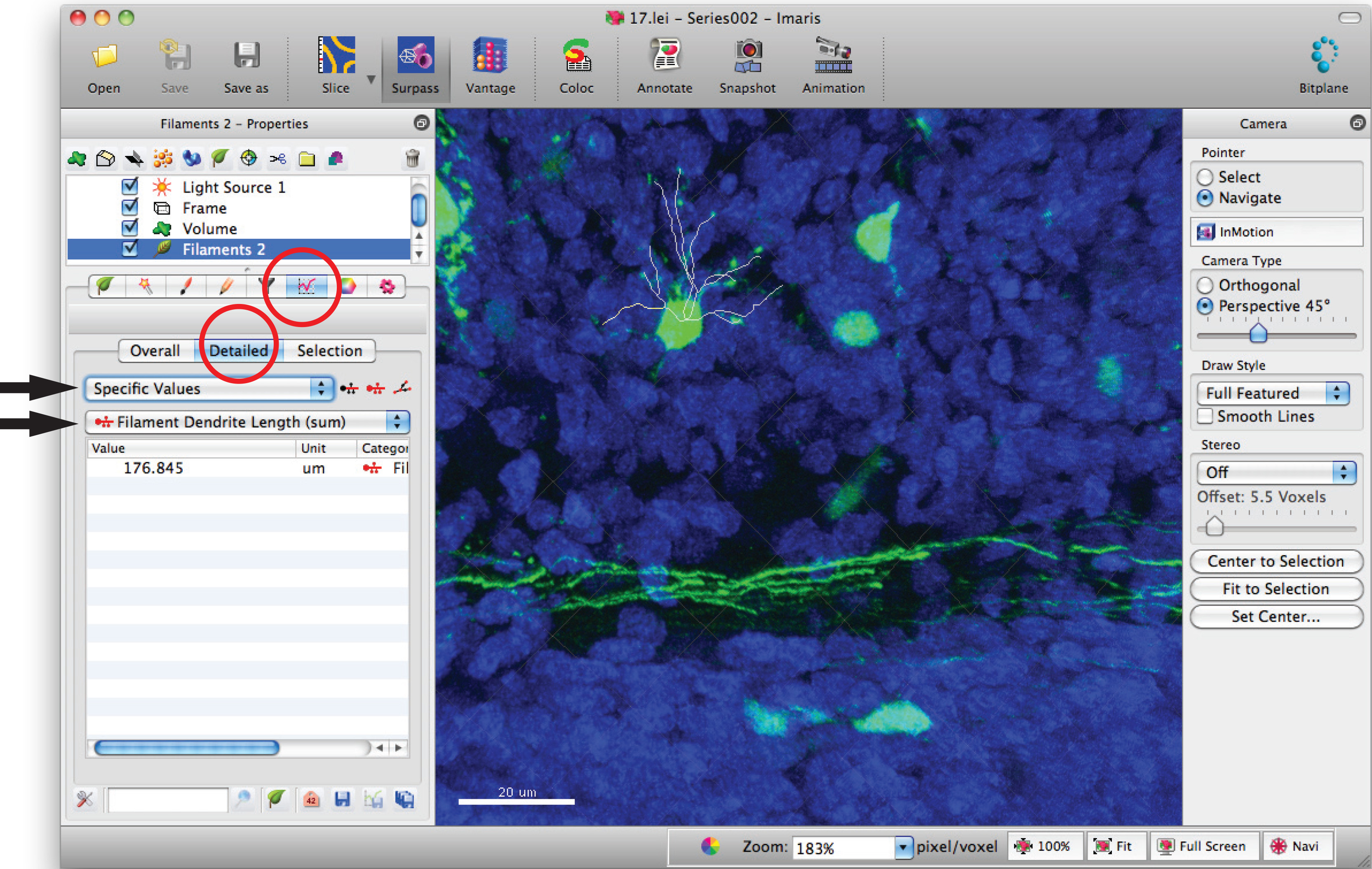
- עבור לחלון סטטיסטיקת נימה ולחץ על 'ערכים ספציפיים' מפורטים 'ו' אורך חוט להט דנדריט (סכום) 'לסכום בסך הכל אורך דנדריט.
- השתמש במבחנים סטטיסטיים מתאימים כדי לנתח את הנתונים.
תוצאות
כדי לנתח את המורפולוגיה של CGNs בתגובה לתנאי culturing שונים, אנו transfected תאי העצב בDIV 0 כפי שתואר לעיל. לאחר transfection, אנו ממוקמים קבוצה אחת של תאי עצב לתוך מדיום מלא (BME, 10% נסיוב עגל, 2 מ"מ PSG, 25 מ"מ KCl) וקבוצה נוספת לאינסולין בינוני מכיל מינימאלי (BME, 25 גלוקוז מ"מ, 2 מ"מ PSG,...
Discussion
יתרונות ומגבלות של תאר במבחנה בשיטות vivo:
CGNs תרבית מעכבר והחולדות מתאימים באותה מידה גם עבור ניתוחים מורפולוגיים. בשל הגודל גדול יותר של המוח הקטן עכברוש, התשואה של CNGs מגורי חולדה עולה על זו של גורי עכבר 3-4x. מלבד CGNs, ניתן להשתמ?...
Disclosures
המחברים מצהירים שום אינטרסים כלכליים מתחרים.
Acknowledgements
אנחנו מודים N. Schwedhelm-Domeyer לקבלת סיוע טכני מעולה, ג האמר וש 'פאפיול לעזרה בניתוחים סטטיסטיים. העבודה שלנו ממומנת על ידי אגודת מקס פלנק, Forschungsgemeinschaft דויטשה, מרכז ננו מיקרוסקופית, מולקולרי ופיזיולוגיה של המוח (CNMPB), גטינגן, גרמניה ועל ידי ג 'וניור קבוצת מלגת GGNB של אוניברסיטת גטינגן.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
References
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved