É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Manipulação genética de Cerebelar Granule Neurônios
Neste Artigo
Resumo
Morfogênese neuronal ea migração são eventos cruciais subjacentes ao desenvolvimento do cérebro. Aqui, descrevemos os métodos para manipular geneticamente cultivadas neurônios granulares do cerebelo e do cerebelo em desenvolvimento para a avaliação da morfologia e características migratórias dos neurônios.
Resumo
Eventos do desenvolvimento do cérebro, incluindo a morfogênese neuronal ea migração são altamente processos orquestrado. In vitro e in vivo analisa permitir uma caracterização aprofundada para identificar vias envolvidas nestes eventos. Neurónios de grânulos de cerebelo (CGNs) que são derivadas a partir do cerebelo em desenvolvimento, são um sistema modelo ideal, que permite visualizar as alterações morfológicas. Aqui, descrevemos um método de como manipular geneticamente CGNs e como estudar axono e dendritogenesis de neurônios individuais. Com este método, os efeitos de interferência de ARN, ou a sobre-expressão de moléculas pequenas podem ser comparadas para controlar neurónios. Além disso, o córtex cerebelar é um roedor facilmente acessíveis no sistema in vivo, devido ao seu desenvolvimento pós-natal predominante. Apresentamos também uma técnica de eletroporação in vivo para manipular geneticamente o cerebelo desenvolver e descrever cerebelar posterior análise para avaliar a morfologia neuronal umaª migração.
Introdução
O cerebelo é um sistema excelente para estudar mecanismos de crescimento do axônio e migração. O cerebelo tem sido objeto de estudos anatômicos desde o alvorecer da neurociência 1. Microscopia moderna e técnicas de imunohistoquímica têm significativamente ampliado e aperfeiçoado as descobertas iniciais de Santiago, Ramon e Cajal 2-4. Genética do rato e estudos moleculares descobriram fatores de crescimento e de transcrição essenciais no controle do desenvolvimento do cerebelo, o que levou a uma maior compreensão dos acontecimentos cruciais necessários para a ligação adequada dos diferentes tipos de neurônios, incluindo os neurônios granulares do cerebelo (CGNs) 5-7.
O cerebelo é um derivado de rhombomere 1 da parte posterior do cérebro em desenvolvimento 8. O lábio rômbico, que é parte do teto do 4 º ventrículo, dá origem a progenitores grânulo de neurônios do cerebelo, que constituem a população neuronal mais numerosos nocerebelo adulto 9. Após a migração rostral, eles se instalarem no anlage cerebelar. Aqui, a mitose dos precursores de grânulos de neurónios conduz à expansão dramática da camada granular externa (EGL), que tem lugar após o nascimento, em roedores. A partir da EGL, os neurônios começam a migrar para o interior através da camada molecular (ML), passando pela camada de células de Purkinje de tomar em última instância, a residir na camada granular interna (IGL 2). Durante esse processo migratório, eles adquirem uma forma bipolar com dois axônios que se estende para o ML. Após mais de migração, o corpo da célula migra longe dos axônios e os dois processos se fundem para formar um bifurcado, axônio em forma de T 10. Posteriormente, esses axônios fasciculada e são referidas como fibras paralelas. Tendo estabelecido no IGL, CGNs crescer dendritos, que formam garras dendríticas para estabelecer sinapses com fibras musgosas. Para examinar os processos fundamentais no cerebelo em desenvolvimento, um combinado in vitro e in vivo approach permite resultados confiáveis e conclusões.
CGNs não são apenas os mais numerosos neurônios do cerebelo, mas de todo o cérebro e pode ser cultivado ao elevado grau de pureza 11-13. Na cultura, essa população neuronal altamente homogêneo torna-se rapidamente pós-mitótico e adquire uma morfologia polar com axônios e dendritos facilmente identificáveis. CGNs cultivadas têm provado ser extremamente útil para estudar vários aspectos do desenvolvimento neuronal, incluindo a proliferação de células progenitoras, diferenciação, axonal e desenvolvimento dendrito, a migração neuronal, apoptose e propriedades eletrofisiológicas (14-19 e muitos outros). O uso da manipulação genética ampliou a versatilidade de CGNs cultivadas e permitiu uma visão mais mecanicista nos eventos acima mencionados. A transfecção de neurônios cultivados utilizando fosfato de cálcio de baixa eficiência ou métodos lipofílicos seguido por imunocitoquímica com marcadores de polaridade ou apoiados pelo software de análise de facilitarstados a avaliação de, por exemplo a morfologia de neurónios individuais na cultura neuronal densa. Com esta abordagem, o papel de proteínas de interesse em axónio ou dendrito crescimento pode ser estudada 20-25,26-28. Este sistema de cultivo, porém, é menos útil para analisar a migração neuronal como a migração é muito limitado em culturas de alta densidade e exigiria co-culturas. A análise in vitro de axônio e dendritos crescimento também permite a análise de proteínas interligados de uma via de sinalização que utilizam combinações de interferência de RNA (i), a sobre-expressão ou pequenas moléculas.
Para estabelecer a relevância da proteína de interesse em axônio e dendritos regulação do crescimento ou da migração neuronal, a eletroporação in vivo (IVE) técnica permite a análise no córtex cerebelar em desenvolvimento. Devido ao facto de o desenvolvimento do cerebelo em roedores estende caminho para as primeiras duas semanas após o nascimento, o cerebelo representa um accessibestrutura cerebral le para manipulações genéticas para examinar o desenvolvimento de axônios e dendritos, a migração neuronal, sinaptogênese e apoptose 20-24,29,30,26,27,31-34. Além disso, este modelo de sistema também é útil para outros aspectos do desenvolvimento neuronal que exigem o córtex cerebelar intacto como pathfinding axônio, cabeamento e conectividade dos neurônios e interações neurônio-glia em conjunto, este protocolo fornece in vitro e in vivo, para enfrentar uma abordagem complementar sobre morfogênese neuronal e migração.
Protocolo
CGNs pode ser preparado a partir dia pós-natal (P) 5 filhotes de rato ou P6 filhotes de ratos. Seguimos o protocolo descrito por Bilimoria e colegas, que utiliza um inibidor mitótico para seleccionar para CGNs postmitotic 13.
Declaração de Ética:
Todos os experimentos envolvendo animais vivos foram realizados de acordo com o protocolo de animais aprovado pela "Verbraucherschutz und Lebensmittelsicherheit" da Baixa Saxônia, Alemanha.
Ensaio in vitro:
1. Preparação de DNA plasmídeo, Mídia e amortecedores para o fosfato de cálcio método de transfecção
- Dissolver DNA plasmídeo em água livre de endotoxina estéril; DMEM (glicose alta); fazer 2,5 M CaCl 2; fazer 2x HBSS (dissolver 4 g de NaCl, 0,1775 g KCl, 0,095 g de Na 2 HPO 4 • 7H 2 O, 0,675 g de glicose e 2,5 g de HEPES em 250 ml de água ultrapura e ajustar o pH a 7,05, 7,08, e 7,11). Observação: Ao se preparara solução 2x HBSS, teste que pH dá melhores resultados em termos de eficiência de transfecção de determinada combinação de plasmídeos.
2. A transfecção de Cultivadas neurônios
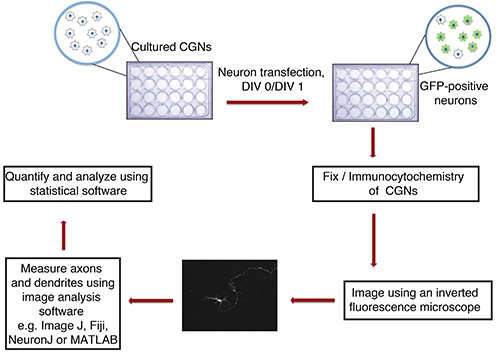
Figura 1. Fluxograma do axónio vitro e em ensaio de crescimento de dendrites. Cultivadas CGNs (placa de 24 cavidades com lamelas de vidro), isolado a partir de crias de ratos P6, são transfectadas pelo DIV 0 ou 1, com precipitado de ADN contendo um marcador fluorescente transfecção (por exemplo, GFP). Após a fixação e imunocitoquímica, os neurônios são gravadas de forma cega. As imagens são importadas para ImageJ e os processos são medidos. As medições são então processados usando um programa de estatística.
- CGNs sementes (20 x 10 6 por placa de 24 poços; BME, 10% de soro de vitelo, 2 mM de Penicilina-Streptomycin-Glutamina (PSG), KCl 25 mM) em lavou-ácido nítrico, 12 mm de lamelas de vidro revestidas de poliornitina em uma placa de 24 poços com 500 ul de meio por poço.
- No dia in vitro (DIV) 0 (pelo menos 8 horas após o plaqueamento) ou DIV 1, recolher meios de crescimento e manter a 37 ° C. Lavar neurónios duas vezes com 500 ul de DMEM pré-aquecido e adicionar 500 mL de meio DMEM.
- Colocar os neurónios em incubadora (37 ° C, 5% CO 2) durante 45 min.
- Preparar 40 ul precipitado de ADN para cada poço, misturando: ADN (2-2,5 ug / poço, 10% do DNA total deve ser um marcador de transfecção, por exemplo GFP para visualizar os neurónios transfectadas), água (até 18 mL), adicionar 2 mL de 2,5 M de CaCl2, misturar bem e adicionar 20 ul de HBSS 2X.
- Incubar ADN precipitado durante 5 minutos à temperatura ambiente.
- Adicionar precipitado de ADN a cada poço e incubar durante 18 min neurónios na incubadora.
- Retirar mistura de DMEM / ADN e lavar duas vezes com neurónios 500 ul de DM pré-aquecidoEM.
- Adicionar mídia coletadas a partir do passo 2.2 de volta para os neurônios. Se neurónios será em cultura durante mais do que 3 dias, meios com suplemento de 25 mM de glucose no DIV 3 para reabastecimento da fonte de carbono.
- Depois de 1-5 dias, os neurônios sujeitos a imunocitoquímica utilizando anticorpos GFP.
- Imagem de, pelo menos, 30 neurónios individuais por condição de uma maneira cega usando um microscópio de fluorescência.
3. Meça axônios e dendritos com NeuronJ, uma NIH ImageJ Plugin
Importante: Certifique-se de que as imagens são escaladas correctluy usando pixels apropriado: relação mM dependendo ampliação e resolução de imagem.
- Converter imagens de 8-bit com ImageJ: Abrir imagem, escolha a opção 'Imagem' -> 'Tipo' -> '8 bits "->" Salvar imagem.
- Execute NeuronJ plugin e abra a imagem de 8 bits.
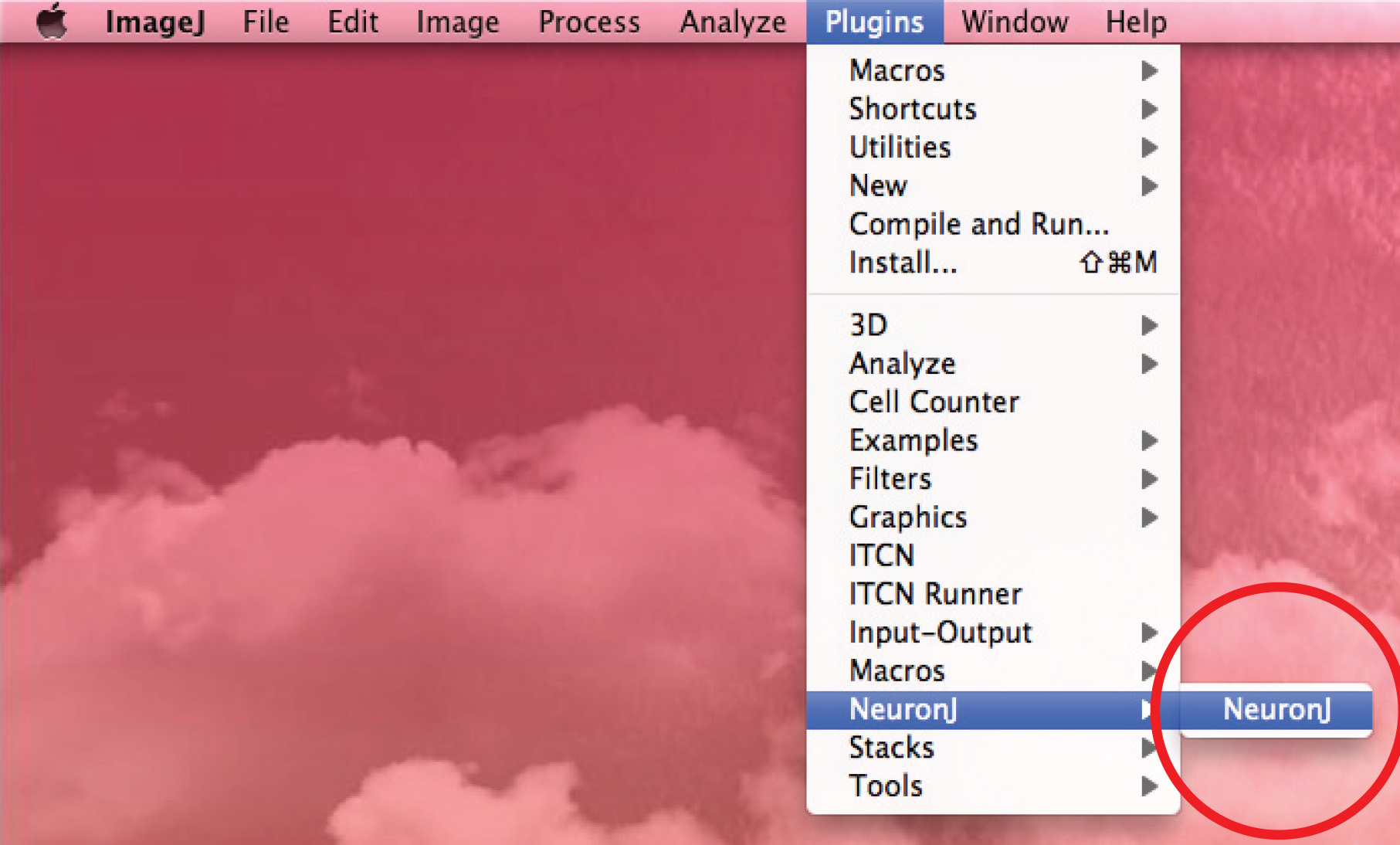
- Use a opção "Adicionar traçados 'para acompanhar o axônio: click o botão esquerdo do mouse uma vez no início do axônio e mova o mouse ao longo do processo. Dê um clique duplo na ponta da axônio se traço corresponde forma axonal.
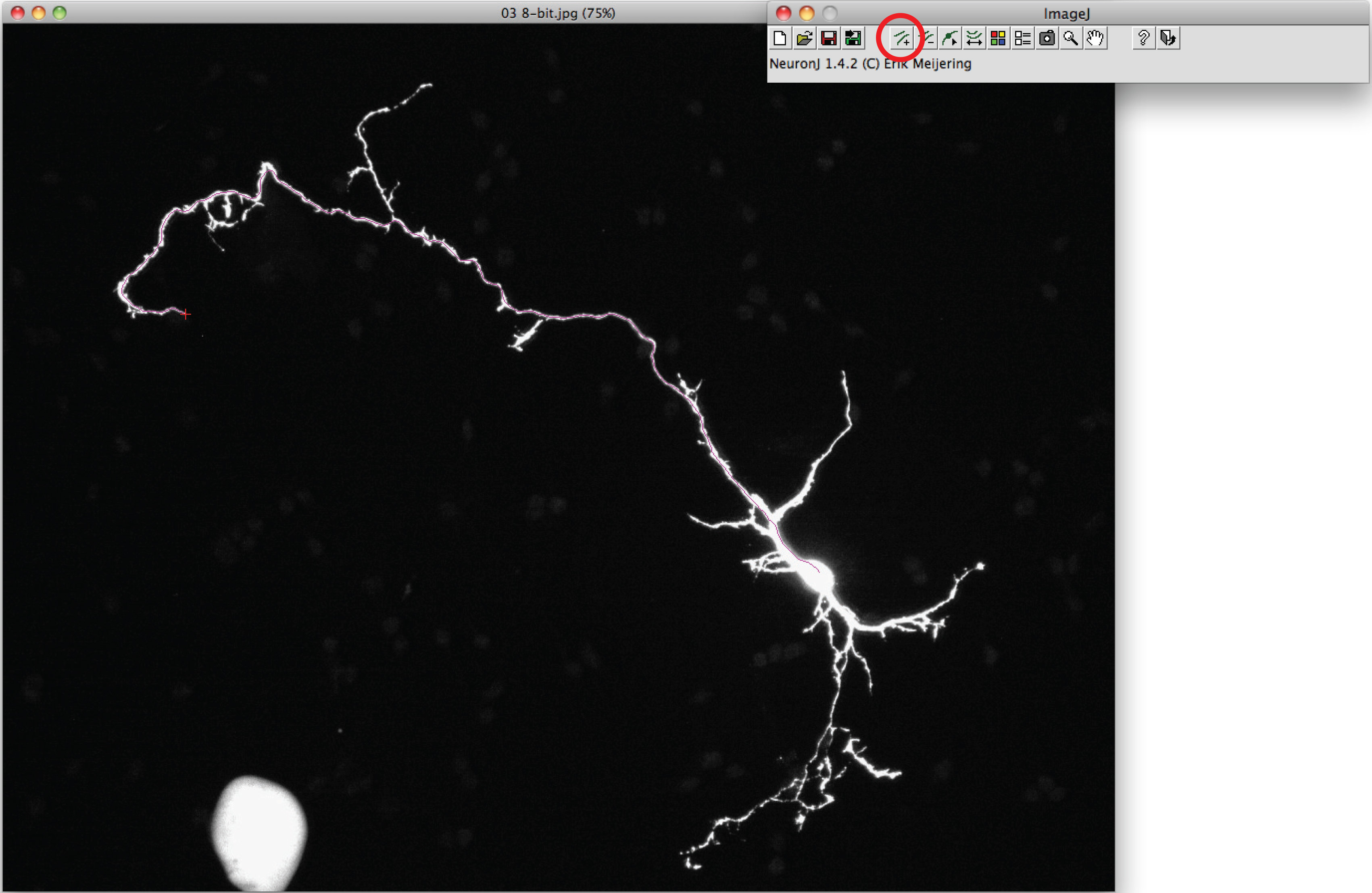
Nota: Se o traço sugerido diferem de forma axonal, clique uma vez sobre o processo axonal para ancorar traço, então dê um duplo clique na ponta da axônio. - Clique em 'traçados medida ", escolha a' Mostrar medições rastreamento 'opção e pressione' Run '. Medições Axon são todos exibidos em uma nova janela. Para dendrites, escolha a opção 'medições grupo de exibição' e pressione 'Run'.
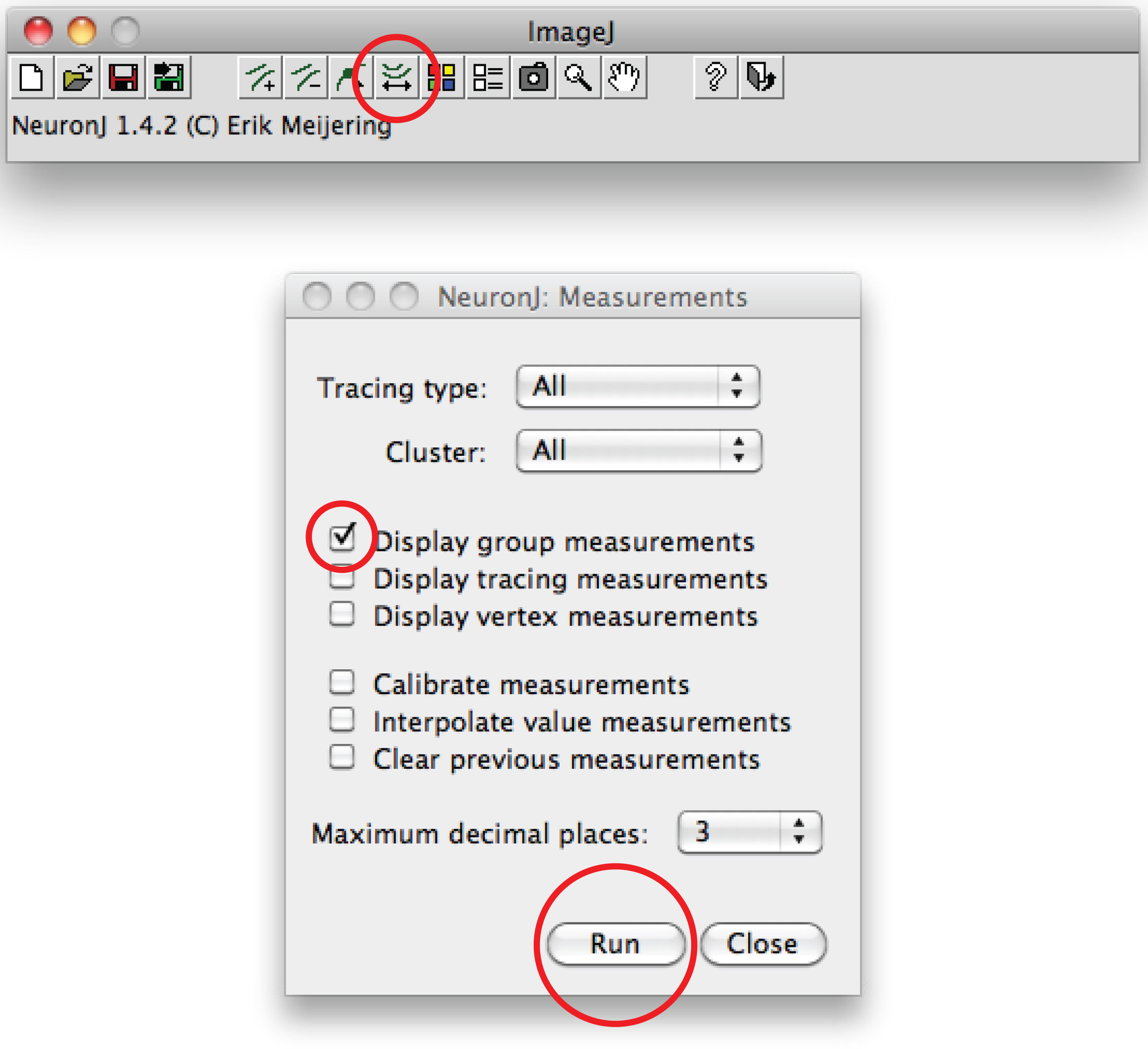
Total de medições dendríticas são todos exibidos em uma nova janela. Salvá-los como um arquivo separado que pode ser aberto em qualquer programa de planilha. - Como alternativa para o traçado manual, use software Fiji: clique com o botão direito no the opção "Reta", escolha "linha Freehand ',
mantenha o botão esquerdo do mouse pressionado e traçar manualmente o processo, pressione "Ctrl + M 'para medir. - Calcular comprimento / axonal média dendrítica por condição e usar o teste estatístico apropriado.
Na eletroporação vivo:
1. Equipamentos e Preparação de Reagentes
- Você precisa de 30 agulhas G, espaçador (1-2 mm), seringa, redutor de volume morto (DVR), electroporador e tweezertrodes, almofada de aquecimento ou lâmpada de calor infravermelho, luminária e isoflurano.
- Coloque DVR em agulha, em seguida, anexar a agulha na seringa e, finalmente, colocar espaçador na agulha (Figura 2).
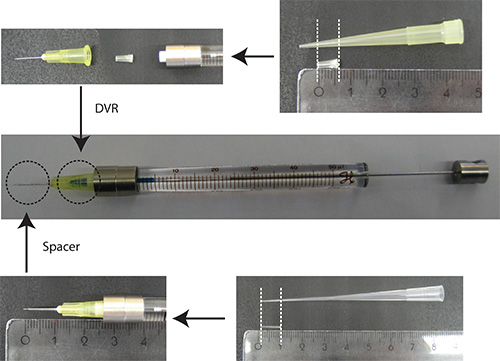
Figura2. Preparação de agulha. DVR é cortada de uma pipeta de ponta de 200 ul e colocados dentro da agulha, para reduzir o volume morto. Espaçador é derivada a partir de uma ponta de 200 ul de carga e está colocado na extremidade da agulha para regular a profundidade de penetração no cerebelo de aproximadamente 2 mm. Unidades da régua: cm - Dissolve-se o ADN em PBS/0.03% Fast Green. Observação: Como um marcador de transfecção, é vantajosa a utilização de uma proteína fluorescente que está sob um promotor específico de neurónios (por exemplo, sinapsina) para visualizar apenas neurónios. 25% da quantidade total de plasmídeo deve ser o plasmídeo que codifica para o marcador de transfeco.
- Faça etanol 70%.
- Mistura de volumes iguais de outubro e 30% de sacarose dissolvida em PBS.
- Encher a seringa com 4 ul de DNA (4 mg / mL de DNA de plasmídeo em PBS/0.03% Fast Green).
2. IVE de filhotes de rato
Fluxograma de IVE: veja a Figura 3
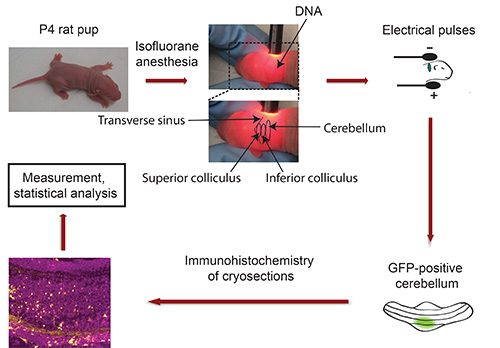
Figura 3. Fluxograma de electroporação in vivo. Filhotes de rato P4 são anestesiados com isoflurano e do plasmídeo de ADN que codifica um marcador de transfecção fluorescente (por exemplo, GFP) é injectado no cerebelo, seguido por exposição a cinco impulsos eléctricos. Cinco dias depois, isolado a GFP-positiva cerebelos são seccionadas e submetidas a imuno-histoquímica. As imagens foram capturadas usando um microscópio confocal e analisados usando o software Imaris. Os dados são processados com um programa de análise estatística.
- Use filhotes de ratos P4 do albino (Wistar ou Long Evans).
- Anestesiar filhotes (um após o outro) com isoflurano em pequena caixa (por exemplo, caixa de ponteira P1000) com 200 mL de isoflurano (embebido em tecido) para 1-2 min até cachorro não é mais comovente. Tome cuidado para que os filhotes não entrar em contato wom Iiquid isoflurano. Monitore o tempo de perto como filhotes individuais respondem diferentemente à anestesia.
- Esterilizar trás da cabeça de cachorro com etanol 70%.
- Fix cabeça de cachorro entre o polegar eo dedo indicador e usar luminária para localizar cerebelo de filhote albino. O seio transverso demarca nitidamente do mesencéfalo (colículo superior e inferior) dos hemisférios corticais (Figura 3). O cerebelo está localizado ao lado do mesencéfalo e aparece em um tom mais escuro. Use um marcador permanente para indicar o cerebelo com um ponto. Importante: Mantenha filhote em posição fixa! Nota: No caso de anestesia desgastar durante este procedimento, expor filhote ao isoflurano antes de injetar o DNA.
- Inserir a agulha (Figura 3) e, lentamente, injectar 3 ul de DNA para o cerebelo.
- Deixe a solução de DNA para difundir 30-60 seg.
- Coloque a cabeça do filhote entre tweezertrodes de modo que o pólo negativo entra em contato com a parte de trás da cabeça (cerebeloregião r) e que o pólo positivo em contacto com o lado oposto da cabeça (Figura 3).
- Assunto cachorro para 5 pulsos elétricos. Ajustar a tensão de peso das crias para garantir uma boa eficiência de electroporação, sem comprometer a sua sobrevivência (Tabela 1).
Tabela 1. Eletroporação de P4 filhotes de ratos.Peso Tensão Pulso Intervalo 8-9 g 160 V 50 mseg 950 ms 9-10 g 165 V 50 mseg 950 ms > 10 g 170 V 50 mseg 950 ms - Vamos recuperar os filhotes na almofada aquecida ou debaixo de uma lâmpada infravermelha. Retornar filhotes para barragem. Importante: Certifique-se de que a fonte de aquecimento não infligir qualquer queimaduras.
- Sacrifício filhotes de 5 dias após a electroporação, colocando-os em CO 2 seguido por decapitação.
- Isolar o cerebelo e a tela para as GFP positivas cerebelos utilizando um microscópio de fluorescência.
- Fix cerebelo em PFA a 4% O / N a 4 ° C, em seguida, incuba-se 30% de sacarose a 4 ° C até pia cerebelos de fundo do tubo.
- Incorporar no cerebelo OCT/30% de sacarose e 40 mM cortar secções coronais utilizando um criostato. Nota: A secção cada cerebelo de uma forma cega.
- Assunto seções à imuno-histoquímica utilizando o anticorpo GFP. Contrastante com corante nuclear (DAPI ou Hoechst 33258) e determinar a localização de pelo menos 200 neurônios transfectadas por animal.
- Para uma análise aprofundada, subdividir o IGL em metades, resultando em uma IGL superior de frente para o ML e um IGL menor de frente para a substância branca e contar neurônios GFP positivas que residem em cada semestre. Nota: Contagem neurônios GFP positivas de cada seção de forma cega.
3. Medindo Dendrite Comprimento, adquirir as imagens da Seção em x, y, z Plano Usando um microscópio confocal
Nota: por exemplo, usar 40 imagens para uma seção 40 mM com um z-stwp de 1 mícron.
- Abrir série de imagens no software, Imaris, para gerar uma imagem 3D dos dendritos.
- Clique no modo 'Superar' para ver o neurônio em 3D.
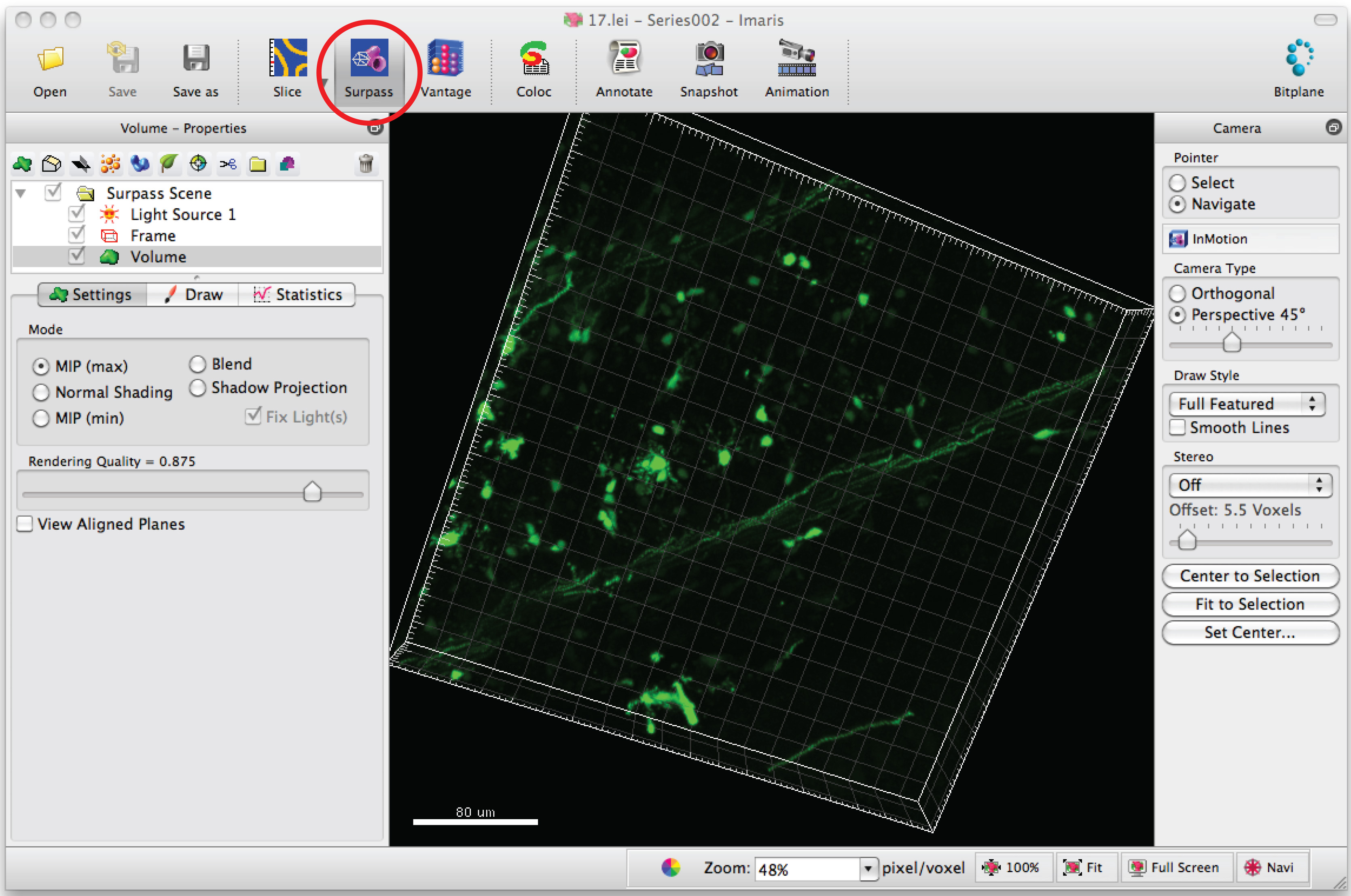
- Selecione "Adicionar novo filamento" e clique em "Ir criação automática 'para iniciar o rastreamento semi-automática.

Nota: Analise cada imagem 3D de uma forma cega - Selecione a guia 'Draw' e 'autopath'.
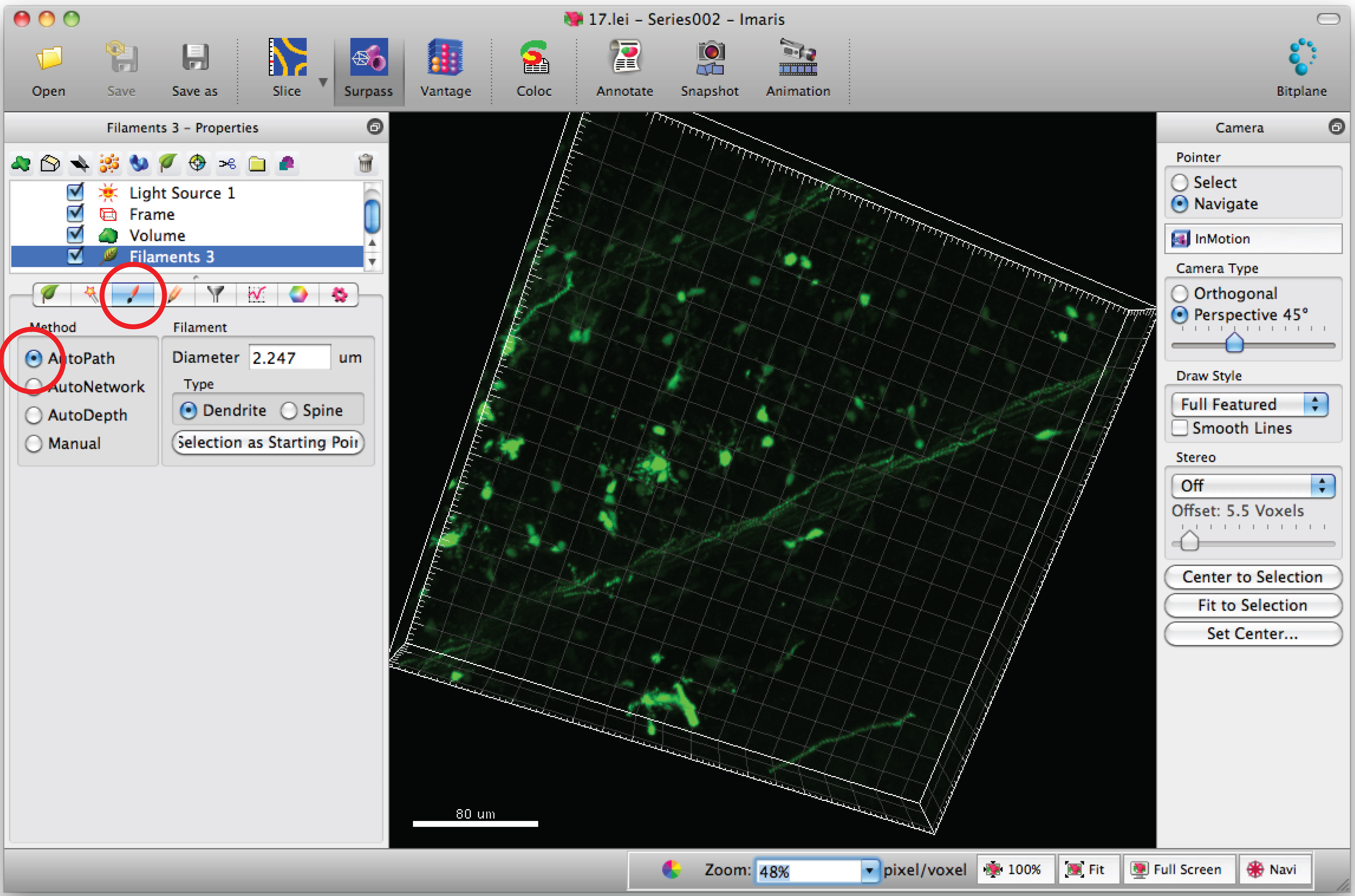
- Mova o cursor do mouse no cell corpo e Shift + clique do mouse para a direita para selecionar o corpo celular. Nota: autocalculation por software pode requerer alguns minutos.

- Adicionar caminhos para o filamento (dendritos), usando Shift + clique do mouse para a esquerda. Nota: Os caminhos podem ser visualizados em tempo real.
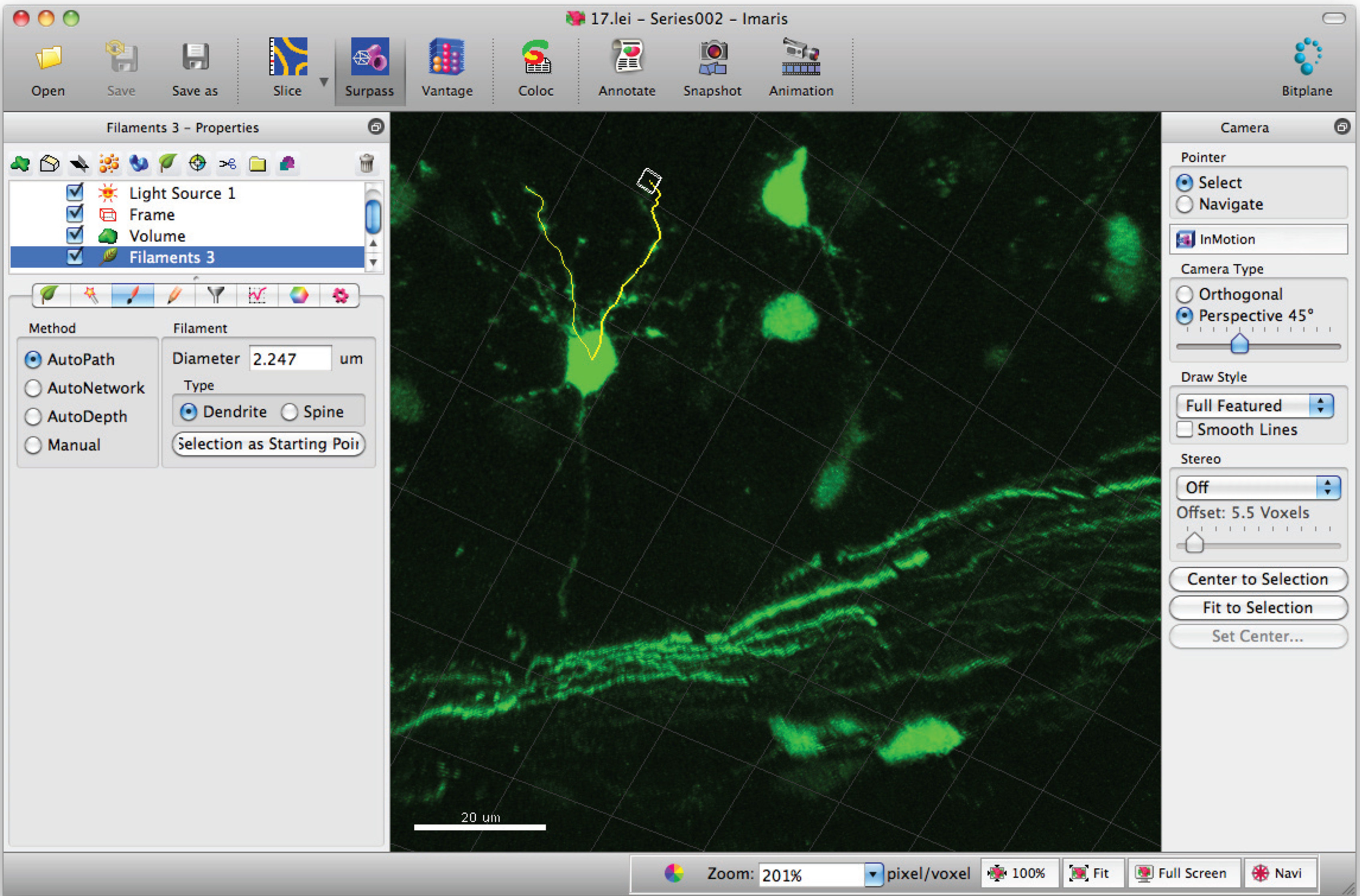
- Vá para a janela de estatísticas de filamento e clique em, "valores específicos» 'detalhadas' e 'comprimento Filament dendrito (soma) "para a soma do comprimento total dendrito.
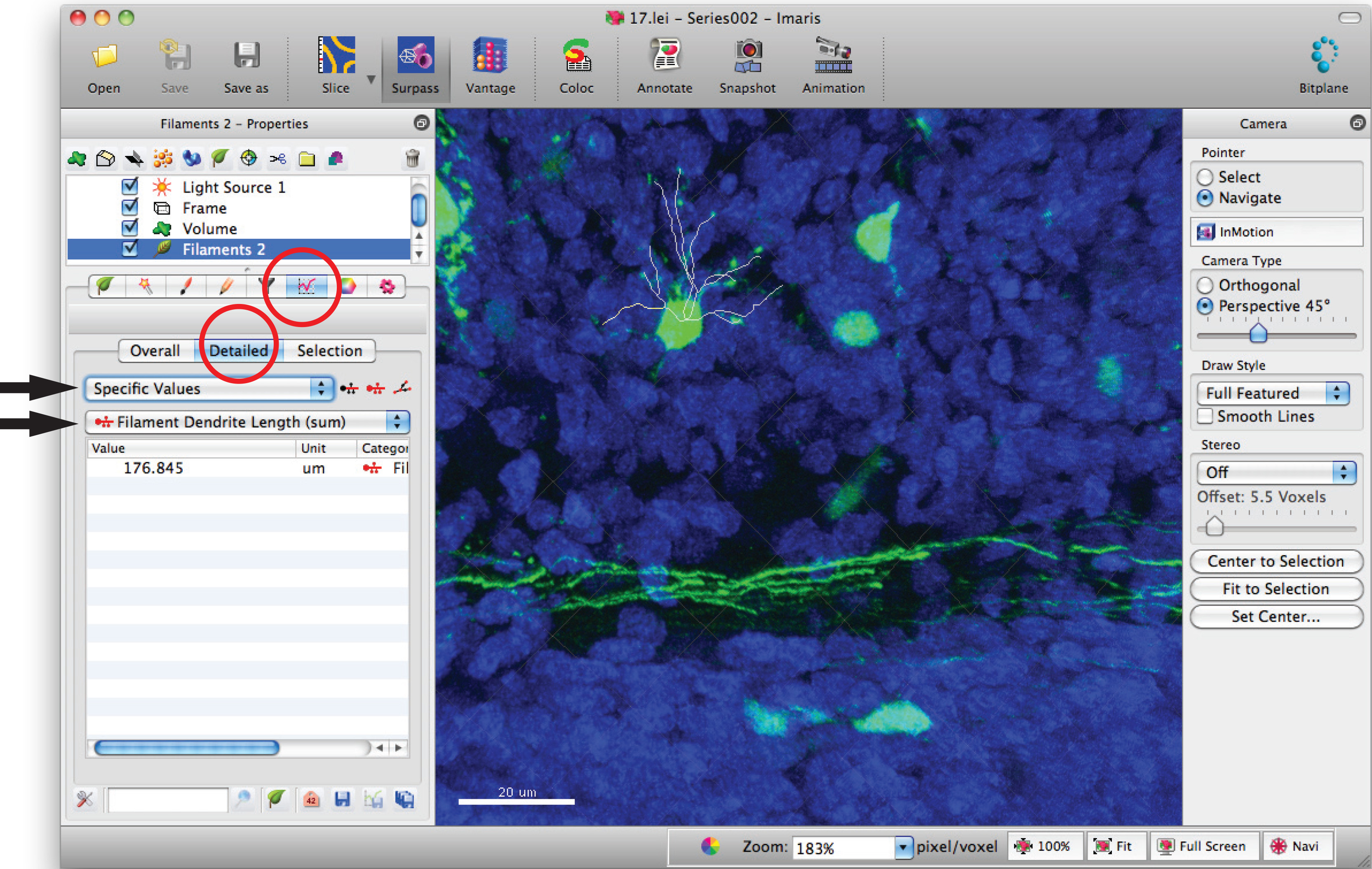
- Use testes estatísticos apropriados para analisar dados.
Resultados
Para analisar a morfologia de CGNs em resposta a diferentes condições de cultura, que transf os neurónios em DIV 0, como descrito acima. Após a transfecção, que colocado um conjunto de neurónios em meio completo (BME, 10% de soro de vitelo, PSG 2 mM, KCl 25 mM) e um outro conjunto em meio mínimo contendo insulina (BME, glicose 25 mM, PSG a 2 mM, 10 ug / ml de insulina). Nós submetidos os neurônios a imunocitoquímica, utilizando o anticorpo GFP em DIV 1, 2 e 3, seguido pela medição axônios e dendritos para ...
Discussão
Vantagens e limitações do descrito, in vitro e in vivo em métodos:
CGNs cultivadas de rato e ratos são igualmente adequado para análises morfológicas. Devido ao maior tamanho de cerebelo de rato, o rendimento de CNGs a partir de crias de ratos excede a de filhotes de rato de 3-4x. Além de CGNs, os neurónios corticais e do hipocampo pode ser usado como sistema de cultura, bem. O método de fosfato de cálcio resulta numa baixa (0,01-5%) eficiência de transfecção, ...
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Agradecemos N. Schwedhelm-Domeyer pela excelente assistência técnica, C. Martelo e S. Papiol ajuda com as análises estatísticas. Nosso trabalho é financiado pela Sociedade Max Planck, o Deutsche Forschungsgemeinschaft, o Centro de Microscopia nanoescala e Fisiologia Molecular do Cérebro (CNMPB), Göttingen, Alemanha e pelo GGNB Júnior Grupo Bolsa da Universidade de Göttingen.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Referências
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados