Method Article
تحسين ثقافة خلايا الورم الدبقي عالية الجودة من العينات الجراحية لاستخدامها في النماذج الحيوانية ذات الصلة سريريا والكيمياء المناعية ثلاثية الأبعاد
In This Article
Summary
بروتوكول لنشر العينات الجراحية الورم الدبقي عالية الدرجة المفككة في وسيطة الغلاف العصبي الخالية من المصل لتحديد الخلايا ذات النمط الظاهري للخلايا الجذعية السرطانية. بالنسبة للعينات التي تفشل في النمو كغلاف عصبي ، يقترح بروتوكول بديل. ويرد وصف تقنية تضمين البارافين للحفاظ على العمارة العصبية ثلاثية الأبعاد للكيمياء المناعية.
Abstract
الأورام الأرومية الدبقية، الشكل الأكثر شيوعا وعدوانية من astrocytoma، هي الانكسار للعلاج، وغير متجانسة جزيئيا. القدرة على إنشاء ثقافات الخلايا التي تحافظ على الملف الجينومي للأورام الأبوية ، لاستخدامها في المختبر المحدد للمريض وفي نماذج الجسم الحي ، لديها القدرة على إحداث ثورة في التطور قبل السريري للعلاجات الجديدة للورم الأرومي الدبقي المصممة وفقا للخصائص الجزيئية لكل ورم.
بدءا من أورام astrocytoma عالية الجودة الطازجة المشتتة إلى خلايا واحدة ، نستخدم المقايسة العصبية كطريقة إثراء للخلايا التي تقدم النمط الظاهري للخلايا الجذعية السرطانية ، بما في ذلك التعبير عن علامات الخلايا الجذعية العصبية ، والتجديد الذاتي على المدى الطويل في المختبر، والقدرة على تشكيل أورام xenograft orthotopic. وقد سبق اقتراح هذه الطريقة، ويستخدمها الآن العديد من المحققين. استنادا إلى تجربتنا في فصل وزراعة 125 عينة من الورم الأرومي الدبقي ، وصلنا إلى البروتوكول التفصيلي الذي نقدمه هنا ، ومناسب لزراعة الغلاف العصبي الروتيني للخلايا الفلكية عالية الجودة والتوسع على نطاق واسع في الخلايا السرطانية للدراسات ما قبل السريرية. نحن نقدم تقريرا عن كفاءة الثقافات الناجحة على المدى الطويل باستخدام هذا البروتوكول واقتراح بدائل بأسعار معقولة لزراعة خلايا الورم الأرومي الدبقي المفككة التي تفشل في النمو كغلاف عصبي. كما نقوم بوصف بروتوكول مفصل للحفاظ على العمارة ثلاثية الأبعاد للكيمياء المناعية. ثقافات الخلايا المخصبة في CSCs، قادرة على توليد نماذج xenograft تقويم العظام التي تحافظ على التوقيعات الجزيئية وعدم التجانس من GBMs، أصبحت شعبية متزايدة لدراسة بيولوجيا GBMs وتحسين تصميم الاختبار قبل السريرية من العلاجات المحتملة.
Introduction
الورم الأرومي الدبقي (GBM)، وهو ورم فلكي من الدرجة الرابعة من منظمة الصحة العالمية، هو الورم الدماغي الأولي الأكثر انتشارا وعدوانية. يتم اعتماد الأنماط الظاهرية التنموية المتنوعة من قبل الخلايا السرطانية GBM ، بما في ذلك الخلايا التي تظهر خصائص "الخلايا الجذعية السرطانية" (CSC) ، مثل التعبير عن علامات الخلايا الجذعية العصبية (NSC) ، والتجديد الذاتي على المدى الطويل ، وإمكانية إحداث خلايا أكثر تميزا تعبر عن علامات فلكية وتشكل الجزء الأكبر من الورم1-3. في حين لا تزال هناك حاجة إلى توضيح فيما يتعلق بالهوية الجزيئية CSC والآثار السريرية ، فإن تركيز العمل الحالي ينصب على التعريف التشغيلي ل CSC: التجديد الذاتي على المدى الطويل في المختبر والقدرة على تمييز وإعادة إنتاج الورم الأصلي عند زرع تقويم العظام في القوارض المنافرة المناعية.
وقد تم استزراع خلايا الورم الأرومي الدبقي لعقود في الوسط التقليدي الذي يحتوي على 10٪ من مصل الأبقار الجنيني (FBS) والعديد من الممرات العالية المتاحة تجاريا خطوط خلايا GBM المستزرعة في مصل الأورام هي tumorigenic في القوارض المنافرة المناعية ، ولكن هناك اختلاف كبير في الجينوم والجزيئية من الورم الأصلي4، مما يحد من استخدامها كنماذج ذات صلة سريريا. في الآونة الأخيرة، تم تحديد الخلايا ذات النمط الظاهري الجذعية / السلف استجابة لEGF وbFGF في GBMs2. في وقت لاحق، تم زرع عينات الورم GBM فصلها في المتوسط خالية من المصل3،وضعت أصلا لاختيار وتوسيع الخلايا الجذعية العصبية من الدماغ الثدييات الكبار5. هذه الظروف الثقافية تعوق نمو معظم مجموعات الخلايا السرطانية غير البلاستيكية والأكثر تميزا ، مع تفضيل نمو الخلايا الجذعية والذرية كرويدات عائمة متعددة الخلايا ، أو الخلايا العصبية3، تحاكي سلوك الخلايا الجذعية العصبية للثدييات البالغة5. مقارنة شاملة جنبا إلى جنب من الخلايا GBM الأولية المستزرعة في إما الوسط العصبي تكملها عوامل النمو (NMGF) أو في المتوسط النمو التقليدية تكملها مع 10٪ FBS، كشفت أن GBM العصبية كانت tumorigenic، قدمت إمكانات التمايز متعدد الخطوط، والحفاظ على النمط الجيني للورم الأصلي، على النقيض من الثقافات FBS 10٪ التي لم تكن tumorigenic في الممرات المنخفضة وتباينت إلى حد كبير من الأورام الأصلية في الممرات المتأخرة4.
عزل CSC من الأورام GBM فصلها عن طريق فرز الخلايا على أساس التعبير عن المفترض CSC علامة CD133 كما اقترح6,7, ولكن المزيد من العمل أشار إلى أن النمط الظاهري CSC لا يرتبط بشكل قاطع مع التعبير عن مثل هذه العلامات8-10, خفض الحماس الأولي لهذه الاستراتيجية, في حين لا تزال علامات جديدة يجري اختبار10. عدم توفر مجموعة من العلامات التي تم التحقق من صحتها لتحديد CSC حتى الآن ، إلى جانب هدف تضخيم هذه الخلايا على نطاق واسع للدراسات ما قبل السريرية ، يجعل استخدام فرز الخلايا غير عملي للثقافات الروتينية المخصبة ب CSC. خلايا GBM التي تختارها القدرة على النمو كما neurospheres في NMGF تعبر دائما علامات الخلايا الجذعية العصبية. لقد لاحظنا أن Sox2 و nestin يتم التعبير عنها في كل مكان في ثقافات الغلاف العصبي ، في حين أن بروتين CD133 موجود في مجموعة فرعية من الخلايا العصبية GBM (البيانات غير المنشورة والمرجع11).
العديد من المختبرات تسعى الثقافات العصبية من أورام الورم الأرومي الدبقي باستخدام نفس النهج العام للتفكك الأنزيمي وزراعة في المتوسط الخالي من المصل تكملها عوامل النمو3,4,11-14, في حين أبلغ زملاء آخرون محاولات لزراعة الثقافات العصبية على المدى الطويل من عينات GBM دون نجاح . الطريقة العامة للانزيمية الإنزيمية والثقافة العصبية من الأورام الدبقية عالية الجودة المعروضة هنا مماثلة لما تم توضيحه في المنشورات المذكورة أعلاه. لقد قمنا بتحسين البروتوكول بناء على خبرتنا في فصل وزراعة أكثر من 100 عينة GBM. كفاءة الحصول على ثقافات الأعصاب على المدى الطويل من عينات GBM الطازجة تطبيق البروتوكول المعروض هنا هو أكثر من 40٪، على غرار التقارير القليلة التي تظهر كفاءة البيانات3،15، مما يؤدي إلى استكشاف بروتوكولات بديلة مثل زراعة الخلايا باستمرار أو متقطعة في المتوسط خالية من المصل في وجود EGF وbFGF كما monolayers على الأسطح المغلفة بروتين ECM16،17. الثقافات العصبية لا تزال النهج الأكثر صحة وشعبية متزايدة للحفاظ على الخصائص الجزيئية لأورام GBM والإمكانات الورمية3،4،11-14، وبالتالي فإن نهجنا هو محاولة ثقافات الغلاف العصبي أولا ، في حين أن الاختبار المصاحب لطرق بديلة لزراعة خلايا GBM التي تفشل في تشكيل مجالات عصبية ذاتية التجديد على المدى الطويل ( الشكل1) ، لزيادة تمثيل أورام GBM التي يمكن استخدامها في النماذج الحيوانية. هنا نقدم بروتوكولا لزراعة الخلايا العصبية من GBMs. بالنسبة للخلايا التي تفشل في تشكيل الغلاف العصبي ، نظهر تعديلا بسيطا في متوسط النمو ، كأول محاولة زراعة الخلايا السرطانية من الغلاف غير المحيطي التي تشكل GBMs ، مع نتائج واعدة ولا تزال تخضع للتحقق من صحة واسعة النطاق.
Protocol
1. تعليق خلية واحدة من عينة الورم الأرومي الدبقي الجراحي الطازج لثقافة الغلاف العصبي
- مع موافقة خطية من المرضى ووفقا للمبادئ التوجيهية المؤسسية، وجمع عينات الورم لثقافة الخلية مباشرة بعد جراحة استئصال الورم الدبقي عالية الجودة.
- تأكيد تشخيص عينة الورم حسب علم الأنسجة. نقل العينة فورا من غرفة العمليات إلى غطاء زراعة الأنسجة تدفق صفح، لمعالجة في غضون 1 ساعة من الجراحة.
ملاحظة: بالنسبة للجراحات في موقع بعيد، اقطع عينة الورم إلى أجزاء أصغر ووضعها في أنبوب يحتوي على DMEM/F12 (حافظ على الثلج). يمكن معالجة الورم بعد عدة ساعات من الجراحة. - بدءا من 200-500 ملغ من الأنسجة (الأمثل)، فرم عينة الورم باستخدام شفرة مشرط، ونقل إلى أنبوب 15 مل تحتوي على 10 مل DMEM/F12 المتوسطة الخالية من المصل. مزيج عن طريق عكس عدة مرات، والسماح للورم قطع الرواسب عن طريق الجاذبية، وإزالة المتوسطة، وكرر حسب الضرورة.
- إعداد محلول انزيمي انسداد الأنسجة ووقف الحل الطازجة.
- محلول تفكك الأنسجة الأنزيمية: 5 مل 0.05٪ تريبسين-EDTA، 2.5 مل محلول الملح المتوازن من هانك (HBSS) الخالي من الكالسيوم والمغنيسيوم، 2.5 مل كولاجيناز IV محلول الأسهم (2000 U/ml في HBSS مع الكالسيوم والمغنيسيوم).
- وقف الحل: 5 مل حل مثبط تريبسين, 5 مل DMEM/F12, 2 ميكرولتر من 5,000 U/ml DNAse I (المحرز في HBSS الكالسيوم والمغنيسيوم خالية).
- إزالة المتوسطة وإضافة محلول تفكك الأنسجة الأنزيمية لعينة الورم المفروم، وذلك باستخدام 2 مل لكل 0.5 غرام من الأنسجة. مزيج بلطف عن طريق عكس.
- احتضان الأنسجة في المحلول عند 37 درجة مئوية في حاضنة زراعة الأنسجة تحت الدوران لمدة 30 دقيقة.
- Triturate مع ماصة 2 مل ووقف الهضم أو العودة إلى الحاضنة لاحتضان آخر 15-30 دقيقة اعتمادا على مستوى الهضم.
- وقف الهضم عن طريق إضافة 2 مجلدات من وقف الحل وتريتورات ميكانيكيا مع ماصة المصلية 5 مل.
- تصفية المواد غير المهضومة من خلال مصفاة الخلية 40 ميكرومتر. بيليه الخلايا في 800 × ز لمدة 5 دقائق في درجة حرارة الغرفة، تليها غسل 3x في 10 مل DMEM/F12.
- Resuspend بيليه الخلية النهائية في 5 مل DMEM/F12.
- طبقة ببطء تعليق الخلية أكثر من 5 مل من Lympholyte-M والكريهة في 1,300 x g لمدة 20 دقيقة في درجة حرارة الغرفة.
- نقل طبقة واجهة تحتوي على الخلايا النووية إلى أنبوب 15 مل تحتوي على 10 مل من DMEM/F12.
- بيليه الخلايا في 800 × ز لمدة 5 دقائق في درجة حرارة الغرفة. كرر الغسيل مع DMEM/F12 2x أكثر.
- Cryopreserve الخلايا الناتجة واحدة لمزيد من الاستخدام عن طريق إعادة تعليق بيليه في الانتعاش الخلية تجميد المتوسطة، aliquoting في cryovials، تجميد بطيء، وتخزينها في النيتروجين السائل.
- إلى الثقافة، وإعادة إنفاق الخلايا في Neurosphere المتوسطة تكملها عوامل النمو (NMGF)، ولوحة في كثافة منخفضة نسبيا (<1 × 105 خلايا / مل) في قارورة زراعة الأنسجة T25 العادية في ظل الظروف القياسية، 5٪ CO2،37 درجة مئوية، حاضنة زراعة الأنسجة الرطبة (الشكل 1A).
- إعداد NMGF باستخدام الوصفة التالية
ل500 مل من DMEM/F12 حل المخزون حجم التركيز النهائي N2 الملحق (10x) 5 مل 1x 250 ملغم/مل محلول مخزون BSA 1 مل 0.5 ملغم/مل 10 ملغم/مل كاشف جنتامايسين 1.25 مل 25 ميكروغرام/مل 100x مضاد حيوي / مضاد لليميكوتيك 2.5 مل 0.5x 100 ملغم/مل bFGF 0.1 مل 20 نانوغرام/مل 100 ملغم/مل من EGF 0.1 مل 20 نانوغرام/مل
- إعداد NMGF باستخدام الوصفة التالية
- نقل الخلايا العصبية التي تشكل أكثر من 1-3 أسابيع (الشكل 1B-E) إلى قوارير جديدة، لفصل من الخلايا المرفقة والحطام. إجراء تغييرات جزئية في الوسائط كل 3-4 أيام.
ملاحظة: إذا فصل الورم xenograft تقويم العظام باستخدام البروتوكول أعلاه، يمكن حذف الخطوات 1.11-1.13.
2. جليوبلاستوما Neurosphere الثقافة الصيانة وتطبيقات المصب
-
التفكك: مراقبة الثقافات العصبية وإجراء تغييرات متوسطة جزئية كل 3-4 أيام. عندما تصل معظم الخلايا العصبية المتعددة في القارورة إلى قطر 100 ميكرومتر ، ينقسم إلى تعليق خلية واحدة:
- نقل المتوسطة التي تحتوي على الأعصاب إلى أنبوب 15 مل، والجاذبية الرواسب neurospheres لحوالي 5 دقائق، وإزالة المتوسطة وإعادة إنفاق بيليه الخلية في 10 مل من الكالسيوم والمغنيسيوم خالية DPBS.
- مزيج واحتضان لمدة 10 دقيقة في درجة حرارة الغرفة، والخلايا الرواسب عن طريق الجاذبية.
- إزالة 7-8 مل من DPBS ثم ينفصم الأعصاب ميكانيكيا مع ماصة المصلية prewetted.
- بيليه الخلايا المفككة في 800 × ز لمدة 5 دقائق في 4 درجة مئوية.
- Passaging: Resuspend الخلايا المفككة (الخطوة 2.1.) في NMGF وتقسيمها إلى العدد اللازم من القوارير (1:3) ، واحتضان في ظل الظروف القياسية. سوف تتشكل الخلايا العصبية الثانوية، وينبغي فصلها في وقت لاحق لتشكيل المجالات الثالثية.
- تقييم التجديد الذاتي على المدى الطويل:كرر إجراء الانفصال حتى تحقق ثقافة الغلاف العصبي ما لا يقل عن 10 مقاطع ، أي ما يعادل شهرين على الأقل في الثقافة.
-
تجميد: للحفاظ على التبريد في neurospheres، فصل الأعصاب (الخطوة 2.1.) وإعادة إنفاق بيليه الخلية في الانتعاش الخلية تجميد المتوسطة، aliquot في cryovials، تجميد بطيء، وتخزينها في النيتروجين السائل.
- زراعة خلايا الغلاف العصبي من مخزون مجمد: إذابة الخلايا عند 37 درجة مئوية ونقلها على الفور إلى أنبوب 15 مل يحتوي على 10 مل DMEM/F12. خلط أنبوب بلطف ثم تدور الخلايا في 800 × ز لمدة 5 دقائق في 4 درجة مئوية. غسل بيليه الخلية مرة أخرى وإعادة إنفاق الخلايا في NMGF ونقلها إلى قارورة زراعة الأنسجة T25.
-
تعليق الخلية لزرع داخل الجمجمة في الماوس منقوص المناعة:
- فصل الخلايا العصبية (الخطوة 2.1.) وإعادة إنفاق بيليه الخلية في DPBS خالية من الكالسيوم والمغنيسيوم. عد الخلايا القابلة للحياة باستخدام مقياس الدم والاستبعاد الأزرق تريبان.
- حساب عدد الخلايا اللازمة لزرع، وعادة 3 × 105 خلايا / الماوس، ونقل العدد المطلوب من الخلايا في قارورة، والكريه الخلايا في 1000 × ز.
- إعادة تشغيل بيليه الخلية في حجم مناسب لزرع (5 ميكرولتر / الماوس) عن طريق التنصت بلطف على أنبوب الطرد الدقيق. وضع تعليق الخلية على الجليد واستخدامها في غضون 2 ساعة.
3. البروتوكول البديل لزراعة الأورام الخلايا الأرومية (للحالات التي تفشل فيها ثقافة الغلاف العصبي)
- تكملة المتوسط NMGF مع مصل البقر الجنين إلى تركيز النهائي من 2٪ FBS / NMGF.
- بدءا من الخلايا في الثقافة NMGF: حصاد خلايا قابلة للحياة من قارورة NMGF (الشكل 1F)، resuspend في 2٪ FBS / NMGF ولوحة في كثافة منخفضة نسبيا (<1 × 105 خلايا / مل) في قارورة زراعة الأنسجة T25 العادية، والثقافة في ظل الظروف القياسية، 5٪ CO2، 37 درجة مئوية، حاضنة ثقافة الأنسجة الرطبة (الشكل 1G).
- بدءا من الخلايا المجمدة أبدا المستزرعة (الخطوة 1.14.): إذابة الخلايا، وغسل في المتوسط الخالي من المصل ولوحة في 2٪ FBS / NMGF والثقافة كما هو موضح في الخطوة 3.2. زراعة في NMGF لمدة 3 أيام قبل نقل خلايا قابلة للحياة إلى 2٪ FBS / NMGF هو بديل للاختيار المسبق بعيدا الخلايا المتمايزة.
4. التحليل المورفولوجي والجزيئي للغلاف العصبي بواسطة الكيمياء المناعية
- ثقافة الأعصاب حتى معظم كرويدات متعددة الخلايا العائمة تصل إلى قطر 100 ميكرومتر.
- إزالة قوارير الثقافة من الحاضنة وعلى الفور بيليه neurospheres، وإزالة المتوسطة وإضافة 10 مل من DPBS دون إزعاج بيليه. إزالة DPBS، resuspend في 10٪ محايدة العازلة الفورماتين واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
- بيليه كرويدات، ريسوسبند في الإيثانول 30٪ واحتضان لمدة 30-45 دقيقة.
- استبدال الإيثانول 30٪ مع الإيثانول 50٪، واحتضان لمدة 15 دقيقة واستبدالها بالإيثانول الطازجة 50٪، واحتضان 30 دقيقة أخرى.
- كرر (الخطوة 4.4.) مع الإيثانول 70٪.
- استبدال مع 95٪ الإيثانول تغييرين 10-20 دقيقة لكل منهما، وكرر مع الإيثانول المطلق حتى كرويدات بيضاء زاهية ومكثفة.
- جعل مخروط ورقة تصفية صغيرة من ورق العدسة ووضعه في قمع صغير في كوب. الرطب ورقة العدسة مع الكحول المطلق.
- تخفيف بيليه قليلا مع الإيثانول الطازجة 100٪، صب قبالة الإيثانول الزائد وصب كرويدات من خلال مخروط ورقة العدسة، والتأكد من أنها تذهب إلى غيض من المخروط. شطف أنبوب مع الإيثانول المطلق إضافية وصب أي كرويدات المتبقية من خلال مخروط ورقة العدسة.
- إزالة مخروط الورق من القمع وتحريك بعناية كرويدات في الجزء السفلي من المخروط. أضعاف ورقة في مربع وتأكد من أن تكون مغلقة بشكل آمن كما كرويدات ممكن.
- نقل الخلايا العصبية المعبأة إلى كاسيت ونقلها إلى معالج الأنسجة التلقائي.
- برمجة معالج الأنسجة التلقائي على النحو التالي: الإيثانول المطلق، 10 دقيقة، الزيلين، 15 دقيقة (2x)، البارافين، 10 دقيقة (4x).
- إزالة كاسيت من المعالج ووضعه على الجزء ساخنة من نظام تضمين البارافين . تأكد من أن السطح بأكمله خال من الشظايا أو الغبار أو الحطام الآخر وشفط جميع البارافين من الآبار الدافئة. دافئة نظيفة البارافين ملقط الحرة وإضافة كمية صغيرة من البارافين إلى قالب قاعدة ساخنة.
- افتح الكاسيت وأزل الحزمة وضعه على الجزء المسخن من نظام التضمين. افتح مخروط الورق بعناية حتى تظهر الكرويات. جمع أكبر قدر ممكن من المواد مع ملقط prewarmed ونقلها إلى البارافين السائل في العفن قاعدة.
- كرر كما هو مطلوب لاسترداد أكبر عدد ممكن من كرويدات. كشط بلطف ورقة الأنسجة مع شفرة حلاقة نظيفة prewarmed التي تم مسحها مع الإيثانول لجمع أي كرويات المتبقية دون الحصول على أي ورقة في الكتلة.
- تفريق بعناية أي كتل كروية مع ملقط دافئ. نقل كرويدات بعيدا عن زوايا في طبقة مركزية موحدة. نقل العفن قاعدة إلى منطقة التبريد لتأمين كرويدات في مكان، إضافة كاسيت، وملء ببطء مع البارافين، والبرد جيدا.
- يمكن استخدام كتلة البارافين العصبي للقسم العادي والكيمياء المناعية.
النتائج
لقد طبقنا البروتوكول المذكور أعلاه على فصام والثقافة 125 عينات الورم الأرومي الدبقي الجراحية الطازجة (الشكل 1)، 88 تشخيص حديثا، و 37 الأورام المتكررة (الجدول 2)، بموافقة المريض المعتمدة وبموجب المبادئ التوجيهية المؤسسية. وكانت كفاءة البروتوكول لإنشاء ثقافات الأعصاب على المدى الطويل 41.6٪، وما شابه ذلك للأورام التي تم تشخيصها حديثا والأورام المتكررة (الجدول 2). بالنسبة لبعض عينات GBM ، تتشكل الخلايا العصبية في الأيام القليلة الأولى(الشكلان 1B و 1C)، بينما بالنسبة للآخرين يلزم وقت زراعة أطول(الشكلان 1D و 1E).
لم تكن كفاءة تكوين الغلاف العصبي تعتمد بشكل حصري على مستوى النخر في الأنسجة ، كما يتضح من نتائج الورم الذي تم تشخيصه حديثا مع كثافة الخلايا العالية (GBM1) والورم المتكرر والنخري (GBM2) المعالج وفقا للبروتوكولين 1 و 2 ، وكلاهما ينتج ثقافات الغلاف العصبي(الشكل 2).
اختبار الإمكانات الورمية لكل ثقافة الغلاف العصبي في الفئران منقوصة المناعة هو التحقق الحاسم من هذا النهج لإثراء CSCs. باستخدام بروتوكول مماثلل18وصفها سابقا ، تم زرع GBM1 و GBM2 neurospheres في أدمغة الفئران منقوصة المناعة ، بموجب المبادئ التوجيهية المؤسسية وIACUC لرعاية الحيوانات. أورام xenograft تقديم الخصائص المورفولوجية من GBMs، مثل غزو في الدماغ parenchyma ونخر (الشكل 2).
تم فصل GBM3(الشكل 1A)ومثقف في الوسط العصبي(الشكلان 1D و 1E)،وفي 2٪ FBS/NMGF (الأرقام 1D، 1G، و 1H). تم فصل خلايا أحادية الطبقة المستزرعة في 2٪ FBS /NMGF وخلايا الغلاف العصبي المستزرعة في NMGF وزرع نفس العدد من الخلايا في الماوس العاري ، وذلك باستخدام نفس الإجراء كما هو الحال في الشكل 2. لم تلاحظ أي اختلافات في البقاء على قيد الحياة، وديناميات نمو الورم، أو مورفولوجيا بين طريقتي الثقافة قبل الزرع(الشكل 3A-C). خصائص نمو الورم لا تتغير حتى آخر مرور اختبارها، P20 للأعصاب، وP10 ل2٪ FBS / NMGF. في حين أن علامات الخلايا الجذعية العصبية، بما في ذلك Sox2، يتم downregulated في معظم خلايا GBM الأولية المستزرعة في 10٪ FBS 3،4،11، NMGF تكملها مع 2٪ FBS يسمح للاحتفاظ التعبير Sox2 (الشكل 3D).
تمت معالجة الخلايا العصبية وفقا للبروتوكول 4، ووصفت مع H &؛ E (الشكل 4A)، المضادة لSox2 الأجسام المضادة، والتي تبين توطين النووية (الشكل 4B)،والأجسام المضادة EGFR، خلية غشاء توطين (الشكل 4C). وقد تم تطبيق هذا البروتوكول للوصول إلى التعديلات التي تعتمد على المحفزات في التعبير عن نيستين، GFAP، وعلامة الانتشار Ki6711.
الجدول 2 - الأرباح كفاءة اشتقاق ثقافات الأعصاب ذاتية التجديد على المدى الطويل من GBMs.
| علم الأمراض | ن | النسبة المئوية للعينات التي تنتج عن الخلايا العصبية ذاتية التجديد على المدى الطويل (n) |
| الورم الأرومي الدبقي - غير معالج، الجراحة الأولى | 88 | 42.0% (37) |
| الورم الأرومي الدبقي - متكرر | 37 | 40.5% (15) |
| مجموع | 125 | 41.6% (52) |
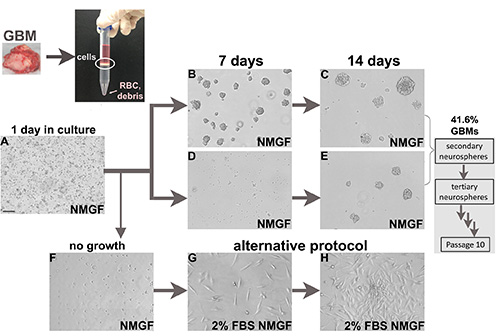
الشكل 1 - الأرقام 1- الأرقام 1 زراعة الخلايا من عينات جراحية جليوبلاستوما الطازجة. تنقسم الأورام الطازجة بشكل أنزيمي إلى خلايا واحدة. ثم يتم طلاء واجهة الخلية النواة من متوسط فصل الكثافة في NMGF. مطلية neurospheres فصل في NMGF، وعادة 1 بعد يوم من الطلاء هناك خلايا ميتة، والحطام، والخلايا المفردة المرفقة، وأحيانا تقسيم الخلايا في تعليق (أ). تكوين العصبية أسرع لبعض الحالات (B, C), وأبطأ بالنسبة للآخرين (D, E). يتم فصل جميع الخلايا العصبية وإعادة طلاءها لمدة 10 مقاطع على الأقل ، وينتج 41.6٪ GBMs عن مجالات عصبية ذاتية التجديد على المدى الطويل. يمكن نقل الخلايا القابلة للحياة التي تفكك GBM التي تفشل في النمو كغلاف عصبي(F)إلى ظروف ثقافية بديلة ، على سبيل المثال 2٪ FBS / NMGF (G ، H). شريط (A), 100 ميكرومتر, ينطبق على جميع الصور. انقر هنا لعرض صورة أكبر.
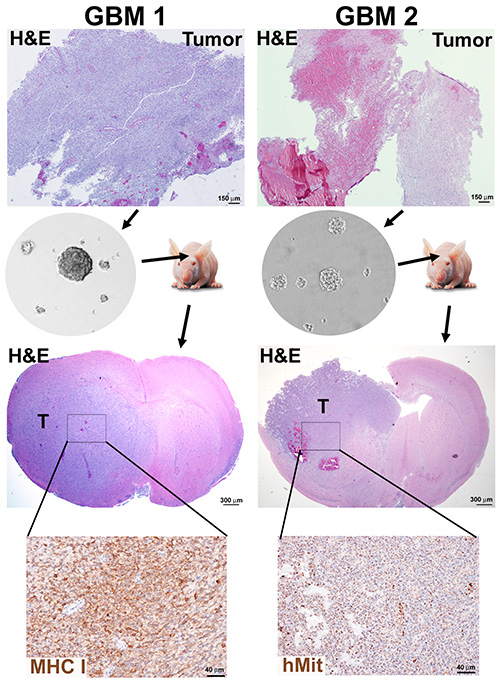
الشكل 2 - الأرقام 2- الأرقام التي تم الجيل العصبي والفأر التقويمي xenografts من أورام GBM. تم فصل عينة ورم تمثل كثافة الخلايا العالية (GBM1) وورم يحتوي على محتوى عالي (GBM2) وتم استزراع الغلاف العصبي لمدة 10 مقاطع وفقا للبروتوكولين 1 و 2. تم زرع الفئران المناعة مع 3 × 105 خلايا الغلاف العصبي المفككة والتضحية بها عند احتضارها. وكانت أدمغة الفئران الفورمالين ثابتة والبارافين جزءا لا يتجزأ من تلطيخ H &؛ E والكشف عن الكيمياء المناعية من علامات الإنسان، الميتوكوندريا البشرية (hMit) أو فئة التوافق الهستوني الرئيسي I subunit HLA-A (MHC-I). انقر هنا لعرض صورة أكبر.
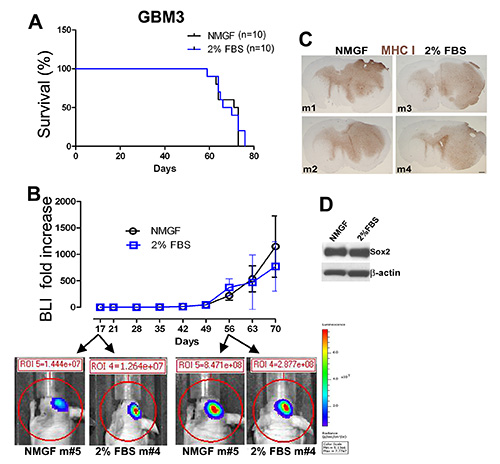
الشكل 3 - الأرقام 3- الأرقام التي يمكن أن نمو الورم مماثلة في الفئران المزروعة داخل الجمجمة مع خلايا GBM3 المستزرعة كما neurospheres في NMGF أو أحادية الطبقات في 2٪ FBS / NMGF. (أ)منحنيات كابلان ماير البقاء على قيد الحياة لGBM3 مثقف إما العصبية في NMGF أو monolayers في 2٪ FBS / NMGF (كلا مرور <10) تظهر أي فرق في البقاء على قيد الحياة (ن = 10، ف = 0.7174، اختبار سجل رتبة). (ب)نمو الورم الذي رصده التصوير الحيوي الحي (BLI) لا يظهر فرقا كبيرا في ديناميكيات نمو الورم بين المجموعتين. (ج)مورفولوجيا الورم لا يمكن تمييزها عن 4 GBM3 xenografts، 2 مثقف في NMGF و 2 مثقف في 2٪ FBS / NMGF. MHC-I وصمة عار كما هو موضح للشخصية 2. مقياس، 600 ميكرومتر. (D) لطخة الغربية تظهر الخلايا الجذعية صانع Sox2 التعبير الاحتفاظ بها في 2٪ FBS / NMGF الثقافات المستخدمة لبدء الأورام xenograft (A-C). انقر هنا لعرض صورة أكبر.
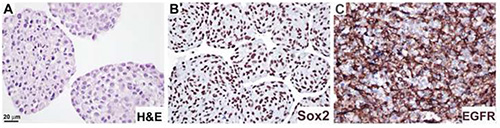
الشكل 4 - الأرقام 4- الأرقام التي تم ال تحليل التعبير البروتيني في أقسام الغلاف العصبي عن طريق الكيمياء المناعية. كانت الثقافات العصبية الفورمالين الثابتة والبارافين جزءا لا يتجزأ كما هو موضح في الإجراء 4، وملطخة H &؛ E (A)، المضادة لSox2 الأجسام المضادة(B)،والأجسام المضادة للEGFR(C). تم استخدام ركيزة DAB لتصور (B, C). بار، 20 ميكرومتر. انقر هنا لعرض صورة أكبر.
Discussion
إن فصام الخلايا السرطانية الأنزيمية السليم هو خطوة حاسمة في هذا البروتوكول. يجب أن يتم فرم الأنسجة قبل فترة وجيزة من الحضانة في محلول فصيل الخلية عند 37 درجة مئوية تحت الدوران ، لمدة لا تقل عن 30 دقيقة ، عندما يجب أن يكون النسيج متهاتة ميكانيكيا ويتم التحقق من تمديد التفكك. اعتمادا على درجة تماسك الأنسجة، يمكن تمديد الحضانة لمدة إضافية 15-30 دقيقة، حسب الحاجة لإكمال الانفصال إلى خلايا واحدة. لا ينصح باحتضان محلول الانفصال لأكثر من ساعة واحدة بسبب انخفاض صلاحية الخلية. على الرغم من أن الكمية المثلى من الأنسجة البداية هي 200-500 ملغ، وقد أدى هذا البروتوكول إلى الثقافات العصبية الناجحة من أقل من 50 ملغ من أنسجة الورم.
NMGF الخالية من المصل هي وسيلة انتقائية ، ونسبة مئوية من الخلايا البلاستيكية الجديدة التي تضم الجزء الأكبر من الورم ، وكذلك الخلايا المضيفة ، لن تبقى على قيد الحياة ، في حين أن البعض الآخر سيلتصق بقارورة الأنسجة المعالجة بعد الطلاء. ومن الأهمية بمكان أن يتم نقل الخلايا العصبية التي ستشكل أكثر من 1-3 أسابيع(الشكل 1B-E)إلى قوارير جديدة، لفصلها عن الخلايا السرطانية والحطام المتمايز.
يمكن أن تكون خلايا GBM منسدة بشكل أنزيمي ومثقفة أبدا (الخطوة 1.10) كمصدر احتياطي للخلايا للثقافة في وسائل الإعلام البديلة ، في حالة فشل ثقافة الغلاف العصبي. لقد نجحنا في الحصول على ثقافات الغلاف العصبي من هذه المخزونات المجمدة ، وكذلك الخلايا أحادية الطبقة التي تنمو في 2٪ FBS / NMGF.
من الناحية المفاهيمية ، "الخلايا الجذعية السرطانية" هو عمل جار وهذا المجال الناشئ سيستفيد من توضيح إضافي ، لأن الآثار السريرية كبيرة ، خاصة في توليد عدم تجانس الورم ، اللدونة ، ومقاومة العلاج1 9،20. بالإضافة إلى كونها حيوية لتوليد نماذج حيوانية GBM خاصة بالمرضى ، فإن ثقافات الغلاف العصبي ذات قيمة أيضا للدراسات المختبرية مثل التغيير في إشارات الخلايا والتعبير الجيني استجابة لعوامل النمو ونقص الأكسيد والعوامل الدوائية11و21. لقد اخترنا استخدام المقاطع العرضية من الجيوسفيرات العصبية الثابتة والبارافين المضمنة ، والحفاظ على العمارة ثلاثية الأبعاد ، لدراسة التعبير البروتيني والتعديلات اللاحقة للترجمة عن طريق الكيمياء المناعية11، بسبب التعريب شبه الخلوي المتفوق فيما يتعلق بطريقة أكثر شيوعا لوضع العلامات وتصوير الكرة بأكملها.
وقد ثبت أن ليس كل الخلايا داخل neurospheres المستمدة من دماغ الثدييات الكبار هي الخلايا الجذعية22. وبالمثل ، فإن الخلايا العصبية المستزرعة من أورام GBM من المرجح ألا تكون كلونية ، بسبب وجود خلايا سلف سرطان أكثر تمايزا وتجميع ذاتي ، معروف بأنه يحدث في كثافات الخلايا العالية23، وهو ما يعتبر قيدا على هذه الطريقة من قبل البعض. لصالح الإثراء للخلايا الجذعية ذاتية التجديد على المدى الطويل ، بدلا من السلف فقط التي يمكن أن تنمو بشكل عابر كغلاف عصبي22، يتم فصل الغلاف العصبي الأساسي لتكوين الغلاف العصبي الثانوي ، ويتم تمريره لمدة لا تقل عن 10 مقاطع ، أي ما يعادل شهرين تقريبا في الثقافة المستمرة ، وهو مؤشر على إثراء السكان في الخلايا الجذعية22. من خلال تجربتنا ، يمكن أن تستمر ثقافات الغلاف العصبي GBM التي تحقق هذه العلامة في التوسع كغلاف عصبي إلى أجل غير مسمى. درجة الورم مهمة، لأننا حصلنا على ثقافات ناجحة من GBMs وastrocytomas اللاتنسجي، منظمة الصحة العالمية الصف الرابع والثالث، على التوالي، ولكن ليس من الأورام الدبقية من الدرجة الدنيا.
الطريقة الأكثر انتشارا لزراعة خلايا الورم الأرومي الدبقي، في المتوسط النمو التقليدي تكملها 10٪ FBS، يؤدي إلى اختلاف كبير الجينوم و phenotypic من الأورام الأصلية 4. من ناحية أخرى، الثقافات العصبية هي مصدر مستقر وطويل الأجل للخلايا التي تقدم النمط الظاهري للخلايا الجذعية السرطانية4. أصبحت طريقة الغلاف العصبي شعبية متزايدة لإثراء CSC في الثقافات على المدى الطويل لنماذج xenograft الماوس orthotopic، على الرغم من عدم نجاحها لجميع عينات astrocytoma عالية الجودة، والذي يمثل الضعف الرئيسي لهذه الطريقة. تجري دراسات لفهم كيف يمكن للخصائص الجزيئية للأورام الأبوية أن تؤثر على تكوين الغلاف العصبي. يتم منح استكشاف طرق بديلة عملية لثقافة الأورام الدبقية عالية الجودة ، تليها التحقق من صحة واسعة النطاق ، نظرا للمزايا الهامة لوجود نماذج GBM محددة للمريض ، ونحن نتقدم إلى عصر الطب الشخصي ، تغذيه إمكانية الوصول إلى معلومات "omics" وزيادة أعداد العلاجات المستهدفة المحتملة.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
وقد تم تمويل هذا العمل من قبل مركز أورام الدماغ هيرميلين، مستشفى هنري فورد.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11330-032 | |
| Trypsin - EDTA 0.05% | Life Technologies | 25300-054 | |
| Hank’s Balanced Salt Solution, calcium- and magnesium-free | Life Technologies | 14170-120 | |
| Hank’s Balanced Salt Solution, with calcium and magnesium | Life Technologies | 24020-117 | |
| Collagenase Type 4 | Worthington | 5004188 | |
| Trypsin Inhibitor | Sigma | T7659 | |
| DNase I | Sigma | D4527 | |
| N2 Supplement (100x) | Life Technologies | 17502-048 | |
| Albumin from Bovine Serum, cell culture grade | Sigma | A4919 | |
| Gentamicin Reagent Solution | Life Technologies | 15710-064 | |
| Antibiotic/Antimycotic | Life Technologies | 15240-062 | |
| Recombinant Human FGF-basic | PeproTech | 100-18B | |
| Recombinant Human EGF | PeproTech | AF-100-15 | |
| Lympholyte-Mouse | Cedarlane Laboratories Ltd. | CL5031 | |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Sterile Cell Strainer, 40 μm | Fisher | 22363547 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS), no calcium and no magnesium | Life Technologies | 14190-144 | |
| Fetal bovine serum | Life Technologies | 26140-079 | |
| Trypan Blue Stain, 0.4% | Life Technologies | 15250-061 | |
| Neutral Buffered Formalin | Protocol | 245-684 | |
| Histoplex Tissue Cassettes | Thermo Scientific | 22-146-426 | |
| Rotator | Miltenyi BioTec | 130-090-753 | |
| GlutaMAX Supplement | Life Technologies | 35050-061 | |
| KnockOut D-MEM/F12 | Life Technologies | 12660-012 | |
| Stem Pro Neural Supplement | Life Technologies | A1058-01 |
References
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821-5828 (2003).
- Ignatova, T. N., et al. Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro. Glia. 39, 193-206 (2002).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756-760 (2006).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Beier, D., et al. CD133(+) and CD133(-) glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles. Cancer Res. 67, 4010-4015 (2007).
- Joo, K. M., et al. Clinical and biological implications of CD133-positive and CD133-negative cells in glioblastomas. Lab. Invest. 88, 808-815 (2008).
- Son, M. J., Woolard, K., Nam, D. H., Lee, J., Fine, H. A. SSEA-1 is an enrichment marker for tumor-initiating cells in human glioblastoma. Cell Stem cell. 4, 440-452 (2009).
- deCarvalho, A. C., et al. Gliosarcoma stem cells undergo glial and mesenchymal differentiation in vivo. Stem Cells. 28, 181-190 (2010).
- Azari, H., et al. Isolation and expansion of human glioblastoma multiforme tumor cells using the neurosphere assay. J. Vis. Exp. , (2011).
- Laks, D. R., et al. Neurosphere Formation Is an Independent Predictor of Clinical Outcome in Malignant Glioma. Stem Cells. 27, 980-987 (2009).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nat. Rev. Cancer. 6, 425-436 (2006).
- Gunther, H. S., et al. Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27 (20), 2897-2909 (2007).
- Fael Al-Mayhani, T. M., et al. An efficient method for derivation and propagation of glioblastoma cell lines that conserves the molecular profile of their original tumours. J. Neurosci. Methods. 176, 192-199 (2009).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem cell. 4, 568-580 (2009).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), (2010).
- Leder, K., Holland, E. C., Michor, F. The therapeutic implications of plasticity of the cancer stem cell phenotype. PLoS One. 5, (2010).
- Pietras, A. Cancer stem cells in tumor heterogeneity. Adv. Cancer Res. 112, 255-281 (2011).
- Lomonaco, S. L., et al. The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells. Int. J. Cancer. 125, 717-722 (2009).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres--re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved