Method Article
臨床関連動物モデルおよび3D免疫化学における使用のための外科検体からのハイグレード神経膠腫細胞培養の最適化
要約
無血清神経球培地における解離された高等度神経膠腫外科標本の伝播のためのプロトコルは、癌幹細胞表現型を有する細胞に対して選択する。神経球として成長できない標本については、代替プロトコルが提案される。免疫細胞化学のための3D神経球アーキテクチャを維持するためのパラフィン埋め込み技術について説明する。
要約
神経膠芽腫は、最も一般的で攻撃的な形態の星細胞腫であり、治療に難治性であり、分子的に不均一である。患者固有の in vitro および in vivo モデルで使用するために、親の腫瘍のゲノムプロファイルを維持する細胞培養を確立する能力は、各腫瘍の分子特性に合わせた神経膠芽腫の新しい治療法の前臨床開発に革命をもたらす可能性を有する。
単一細胞に解き明かされた新鮮な高等位の星細胞腫腫瘍から始まり、神経幹細胞マーカーの発現、 インビトロでの長期自己再生、異形移植腫瘍の形成能など、がん幹細胞表現型を呈する細胞の濃縮方法として神経球アッセイを用いる。この方法は以前に提案されており、現在は複数の調査員によって使用されています。125個の神経膠芽腫標本の解離と培養の経験に基づいて、我々は高グレードの星状細胞腫の日常的な神経球培養および前臨床試験のための腫瘍形成細胞の大規模な拡張に適した詳細なプロトコルに到着しました。我々は、このプロトコルを用いて成功した長期培養の効率を報告し、神経球として成長できない解解化神経膠芽腫細胞を培養するための手頃な価格の選択肢を提案する。また、免疫体系化学のためのニューロスフィア3Dアーキテクチャを保存するためのプロトコルについても詳細に説明する。CSCsに富んだ細胞培養は、GBMの分子シグネチャと不均一性を維持する同位体異種移植モデルを生成することができ、GBMの生物学の研究や潜在的な治療法の前臨床試験の改善された設計のためにますます人気が高まっています。
概要
神経膠芽腫(GBM)は、WHOグレードIVアストロサイトマであり、最も一般的で積極的な原発性脳腫瘍である。GBM腫瘍細胞では、神経幹細胞(NSC)マーカーの発現などの「がん幹細胞」(CSC)特性を示す細胞を含む多様な発生表現型が採用されており、長期自己再生、および天体マーカーを発現し、腫瘍の大部分を形成してより分化した細胞を生み出す可能性がある。CSC分子同一性と臨床的影響に関しては依然として明確化が必要であるが、本研究の焦点は、CSCの運用定義である、 インビトロでの長期的な自己再生と、免疫不全げ歯ぎぎげの中の異形移植時に元の腫瘍を分化し、再生する能力である。
神経膠芽腫細胞は、10%のウシ胎児血清(FBS)を含む伝統的な培地で何十年も培養されており、市販のいくつかの高い通路の血清培養GBM細胞株は免疫不全げ歯類において腫瘍性であるが、元の腫瘍4からかなりのゲノムおよび分子乖離があり、臨床的に関連するモデルとしての使用を制限している。最近では、EGFおよびbFGFに応答する幹細胞/前駆体表現型を有する細胞がGBM2で同定された。続いて、脱離したGBM腫瘍試料を無血清培地3で培養し、もともと成人哺乳動物脳5から神経幹細胞の選択及び拡張のために処方した。これらの培養条件は、ほとんどの非新生物およびより分化された腫瘍細胞集団の増殖を妨げる一方で、多細胞スフェロイド、または神経球3の浮遊として幹細胞および前駆細胞の増殖を支持する一方で、成人哺乳類神経幹細胞5の挙動を模倣する。成長因子(NMGF)を添加した神経球培地(NMGF)または10%FBSを添加した伝統的な成長培地のいずれかで培養された一次GBM細胞の包括的な並び GBM神経球は腫瘍性であり、多系統分化の可能性を提示し、元の腫瘍の遺伝子型を保存し、低い通路で腫瘍化せず、後期節で元の腫瘍からかなり発散した10%のFBS培養物とは対照的に4。
CSCマーカーCD133の発現に基づく細胞選別による解離されたGBM腫瘍からのCSCの分離も6,7で提案されているが、さらなる研究により、CSC表現型がそのようなマーカー8-10の発現と決定的に関連していないことを示したが、新しいマーカーは依然として10の新しいマーカーの初期の熱意を低下させる。CSCを定義する検証されたマーカーのセットの現在までに利用できない、前臨床試験のためにこれらの細胞の大規模な増幅の目標と共に、細胞の並べ替えの使用は日常的なCSC濃縮培養には実用的ではありません。NMGFにおいて神経球として増殖する能力によって選択されるGBM細胞は、神経幹細胞マーカーを必ず発現する。我々は、Sox2およびnestinが神経球培養において遍在的に発現し、CD133タンパク質はGBM神経球のサブセットに存在することを観察した(未発表データおよび参照11)。
いくつかの研究室では、成長因子3、4、11-14を補った無血清培地における酵素解離と培養の同じ一般的アプローチを用いて神経膠芽腫腫瘍から神経球培養を進めているが、他の同僚はGBMサンプルから長期的な神経球培養を成功させずに成長させようとする試みを報告している。ここで提示される高品位神経膠腫の酵素解離および神経圏培養の一般的な方法は、上記の出版物で概説されているものと類似している。100 GBM以上のサンプルの解離と培養の経験に基づいてプロトコルを最適化しました。ここで提示されるプロトコルを適用する新鮮なGBMサンプルから長期神経球培養物を得る効率は40%を超え、効率データ3、15を示すいくつかの報告と同様に、EGFおよびbFGFの存在下で細胞を血清フリー培地中で継続的または断続的に培養する代替プロトコルの探索につながる。神経球培養は、GBM腫瘍の分子特性と腫瘍発生の可能性を維持するための最も検証され、ますます普及しているアプローチである3、4、11-14であり、したがって、我々のアプローチは、長期的に自己更新神経球を形成しないGBM細胞を培養するための代替方法を一度にテストしながら、最初に神経圏培養を試みるものであり、動物モデルで使用できるGBM腫瘍の表現を高めることである。ここでは、GBMから神経球を培養するためのプロトコルを提示します。神経球を形成できない細胞については、GBMを形成する非神経球から腫瘍性細胞を培養する最初の試みとして、成長培地の単純な改変を示し、有望な結果を得て、依然として広範な検証を受けている。
プロトコル
神経球培養のための新鮮な外科的神経膠芽腫標本からの単一細胞懸濁液
- 患者からの書面による同意を得て、制度的ガイドラインに従って、高品位神経膠腫の切除手術直後に細胞培養のための腫瘍サンプルを採取する。
- 組織病理学による腫瘍試料の診断を確認する。手術室からラミナル流組織培養フードに直ちに検体を輸送し、手術から1時間以内に処理する。
注:遠隔地での手術の場合は、腫瘍サンプルを小さな断片に切り、DMEM/F12(氷の上に保管)を含むチューブに入れます。腫瘍は手術後数時間で処理することができる。 - 200〜500mgの組織(最適)から、メスのブレードを使用して腫瘍サンプルをミンチし、10ml DMEM/F12血清フリー培地を含む15mlチューブに移します。数回反転して混ぜ、腫瘍片を重力で沈め、培地を取り除き、必要に応じて繰り返します。
- 酵素組織解離液を調製し、溶液を新鮮に停止します。
- 酵素組織解離液:5ml 0.05%トリプシン-EDTA、2.5mlハンクのバランス塩溶液(HBSS)カルシウムおよびマグネシウムフリー、2.5 mlコラゲナーゼIVストック溶液(カルシウムおよびマグネシウムを含むHBSSで2,000 U/ml)。
- 停止溶液:5 mlトリプシン阻害剤溶液、5 ml DMEM/F12、5,000 U/ml DNAse Iの2 μl(HBSSカルシウムおよびマグネシウムフリー製)。
- 培地を取り除き、各0.5gの組織に2mlを使用して、ひき肉サンプルに酵素組織解離液を加える。反転してやさしく混ぜます。
- 30分間回転下の組織培養インキュベーターで37°Cの溶液中の組織をインキュベートする。
- 2 ml ピペットでトリチュレートし、消化を停止するか、消化のレベルに応じて、さらに 15-30 分間のインキュベーターに戻ります。
- 停止溶液の2つのボリュームを追加することによって消化を停止し、5 ml血清ピペットで機械的にトリチュレートします。
- 40 μmの細胞ストレーナーを通して未消化材料を除外します。800 x g のセルを室温で 5 分間ペレットし、続いて 10 ml DMEM/F12 で 3 倍洗浄します。
- 5 ml DMEM/F12 で最終細胞ペレットを再懸濁します。
- リンプホリュート-Mの5ml以上の細胞懸濁液をゆっくりと重ね、ペレットを室温で20分間1,300 x gにします。
- 有核細胞を含む界面層を、10mlのDMEM/F12を含む15mlチューブに移します。
- セルを室温で5分間800×gでペレット化する。DMEM/F12 2倍以上で洗浄を繰り返します。
- 得られた単一細胞を、回収細胞凍結培地中で再懸濁し、凍結、凍結の遅れ、液体窒素に貯蔵することによって、さらなる使用のために作られた単一細胞を維持する。
- 培養するには、成長因子(NMGF)を添加した神経球培地中の細胞を再懸濁し、標準条件下で通常のT25組織培養フラスコで比較的低密度(<1 x 105細胞/ml)のプレート、5%CO2、37°C、加湿組織培養インキュベーター(図1A)。
- 次のレシピを使用して NMGF を準備します。
DMEM/F12の500 mlの場合 ストックソリューション 容積 最終濃度 N2 サプリメント (10x) 5ml 1x 250 mg/ml BSA ストック溶液 1ml 0.5 mg/ml 10 mg/ml ゲンタマイシン試薬 1.25 ml 25 μg/ml 100x抗生物質/抗粘液 2.5 ml 0.5x 100 mg/ml bFGF 0.1 ml 20 ng/ml 100 mg/ml EGF 0.1 ml 20 ng/ml
- 次のレシピを使用して NMGF を準備します。
- 1~3週間にわたって形成される神経球(図1B-E)を新鮮なフラスコに移し、付着した細胞や破片から分離する。3~4日ごとに部分的なメディア変更を行います。
注:上記のプロトコルを使用して異交異片移植腫瘍を解離する場合、ステップ1.11-1.13は省略することができます。
2. 神経球培養の維持と下流の応用
-
解離: 神経圏培養をモニターし、3~4日ごとに部分的な培地変化を行う。フラスコのほとんどの多細胞神経球が直径100μmに達したら、単一細胞懸濁液に解約する:
- 神経球を含む培地を15mlチューブに移し、神経球を約5分間重力沈下し、培地を取り除き、カルシウム及びマグネシウムフリーDPBSで細胞ペレットを再懸濁する。
- 細胞が重力によって沈み込むので、室温で10分間混合してインキュベートします。
- 7-8 mlのDPBSを取り除き、予水した血清ピペットで神経球を機械的に解約します。
- 4°Cで5分間800xgで解約細胞をペレット化する。
- パッケージ:NMGFで解教細胞(ステップ2.1)を再中断し、必要なフラスコ数(1:3)に分け、標準的な条件下でインキュベートします。二次神経球が形成され、その後、第三球の形成のために解き明かされるべきである。
- 長期自己再生の評価: 神経圏培養が少なくとも10の通過を達成するまで解離手順を繰り返し、培養において最低2ヶ月に相当する。
-
凍結: 神経球を凍結保存し、神経球を解体し(ステップ2.1.)、回復細胞凍結培地中の細胞ペレットを再中断し、凍結、凍結の遅さ、液体窒素に貯蔵する。
- 凍結ストックから神経球細胞を培養するには:37°Cで細胞を解凍し、10mlDMEM/F12を含む15mlチューブに直ちに移す。チューブを軽く混ぜ、800 x gで細胞を回転させ、4°Cで5分間回転させます。 細胞ペレットをもう一度洗浄し、NMGF中の細胞を再懸濁し、T25組織培養フラスコに移します。
-
免疫不全マウスにおける頭蓋内インプラントの細胞懸濁液:
- 神経球を解離し(ステップ2.1)、カルシウムおよびマグネシウムフリーDPBS中の細胞ペレットを再懸濁する。ヘモサイトメーターとトリパンブルー排除を使用して生存細胞を数えます。
- インプラントに必要な細胞の数を計算し、通常3 x 105 細胞/マウス、所望の数の細胞をバイアルに移し、細胞を1,000 x gでペレットします。
- マイクロ遠心チューブを軽くタップして、インプラント(5 μl/マウス)に適した容積で細胞ペレットを再懸濁します。細胞懸濁液を氷の上に置き、2時間以内に使用してください。
3. 腫瘍性神経膠芽腫細胞の培養のための代替プロトコル(神経球培養が失敗した場合)
- 2%FBS/NMGFの最終濃度に牛の血清を胎児のNMGF培地を補う。
- NMGF培養の細胞から始まる:NMGFフラスコ(図1F)から生き生き細胞を収穫し、通常のT25組織培養フラスコで比較的低密度(<1 x 105細胞/ml)で2%FBS/NMGFおよびプレートに再懸濁し、標準条件下で培養し、5%CO2、37°C、加湿組織培養インキュベーター(図1G)
- 凍結しない培養細胞から始まる (ステップ1.14):細胞を解凍し、ステップ3.2に記載されているように2%FBS/NMGFおよび培養中の無血清培地およびプレートで洗浄する。2%FBS/NMGFに生存細胞を移す前に3日間NMGFで培養することは、分化した細胞を事前選択する代替手段である。
4. 免疫組織化学による神経球の形態学的・分子的解析
- ほとんどの浮遊多細胞スフェロイドが直径100μmに達するまで神経球を培養する。
- 培養フラスコをインキュベーターから除去し、すぐに神経球をペレットし、培地を除去し、ペレットを乱すことなく10mlのDPBSを加える。DPBSを取り除き、10%中性緩衝ホルマリンで再懸濁し、室温で20分間インキュベートする。
- ペレットは、スフェロイドを、30%エタノールで再懸濁し、30〜45分間インキュベートする。
- 30%エタノールを50%エタノールに置き換え、15分間インキュベートし、新鮮な50%エタノールに置き換え、さらに30分間インキュベートします。
- 70%エタノールを繰り返します(ステップ4.4)。
- 95%エタノールに置き換え、それぞれ10〜20分で2回変更し、スフェロイドが明るい白色になるまで絶対エタノールで繰り返し、凝縮します。
- レンズ紙から小さなフィルターペーパーコーンを作り、ビーカーの小さな漏斗に入れ.絶対アルコールでレンズ紙を濡らします。
- 新鮮な100%エタノールでペレットを少し緩め、余分なエタノールを注ぎ、レンズペーパーコーンを通してスフェロイドを注ぎ、コーンの先端に行くようにします。追加の絶対エタノールでチューブをリンスし、レンズペーパーコーンを通して残りのスフェロイドを注ぎます。
- 漏斗から紙コーンを取り出し、円錐の底に慎重に回転楕円体を移動します。紙を正方形に折り、回転楕円体ができるだけしっかりと囲まれていることを確認します。
- パッケージ化された神経球をカセットに移し、自動ティッシュプロセッサに移します。
- 次のように自動組織処理装置をプログラム:絶対エタノール、10分、キシレン、15分(2x)、パラフィン、10分(4x)
- カセットをプロセッサから取り出し、パラフィン埋め込みシステムの加熱された部分に置きます。表面全体に破片、ほこり、その他の破片がなく、鉗子の温暖化井戸からすべてのパラフィンを吸い出してください。温かいきれいなパラフィンフリー鉗子を加え、少量のパラフィンを加えて、温めたベースモールドを作ります。
- カセットを開き、パケットを取り外し、埋め込みシステムの加熱された部分に置きます。回転楕円体が見えるまで慎重に紙の円錐を開きます。温め込んだ鉗子でできるだけ多くの材料を集め、ベースモールドの流動パラフィンに移します。
- 必要に応じて繰り返して、できるだけ多くの回転楕円体を取得します。エタノールで拭いた温めのきれいなカミソリの刃でティッシュペーパーをそっと削り取り、紙をブロックに入れずに残りのスフェロイドを収集します。
- 慎重に暖かい鉗子で任意のスフェロイド塊を分割します。回転楕円体をコーナーから離して均一な中央レイヤーに移動します。ベースモールドを冷却領域に移動して、スプヘロイドを所定の位置に固定し、カセットを追加し、パラフィンでゆっくりと充填し、十分に冷やします。
- 神経圏パラフィンブロックは、正常な切除および免疫体染色に使用することができる。
結果
我々は、上記のプロトコルを解約及び培養125新鮮な外科的神経膠芽腫標本(図1)、88新たに診断された88個、および37の再発性腫瘍(表2)に適用し、承認された患者の同意を得て、制度的ガイドラインに基づく。長期神経球培養を確立するためのプロトコルの効率は41.6%であり、新たに診断された腫瘍および再発性腫瘍に対して類似した(表2)。一部の GBM サンプルでは、最初の数日間に神経球が形成されます (図 1B と 1C) が、他の場合はより長い培養時間が必要です (図 1D および 1E)。
神経球形成の効率は、組織における壊死のレベルだけに依存せず、高細胞密度(GBM1)および再発性および壊死性腫瘍(GBM2)をプロトコル1および2に従って処理した新たに診断された腫瘍の結果によって例示されるように、両方の神経球培養を生じさせる(図2)。
免疫不全マウスにおける各神経球培養の腫瘍形成可能性をテストすることは、CSCsの濃縮に対するこのアプローチの重要な検証である。異種移植片腫瘍は、脳のパレンキマや壊死への侵入などのGBMの形態学的特徴を提示する(図2)。
GBM3は解約(図1A)を、神経圏培地(図1Dおよび1E)および2%FBS/NMGF(図1D、1G、および1H)で培養した。NMGFで培養した2%FBS/NMGFおよび神経球細胞で培養した単層細胞を解離し、同数の細胞をヌードマウスに移植し、図2と同様の手順を用いた。2つの移植前培養方法の間に生存、腫瘍増殖ダイナミクス、または形態に違いは認められなかった(図3A-C)。腫瘍の成長特性は、最新の通過試験、神経球のP20、2%FBS/NMGFのP10まで変化しない。Sox2を含む神経幹細胞マーカーは、10%FBS 3,4,11で培養されたほとんどの一次GBM細胞でダウンレギュレートされているが、NMGFは2%FBSを補ってSox2発現の保持を可能にする(図3D)。
ニューロ球をプロトコル4に従って処理し、H&E(図4A)、抗Sox2抗体で標識し、核局在(図4B)およびEGFR抗体、細胞膜局在を示す(図4C)。このプロトコルは、ネスチン、GFAP、および増殖マーカーKi6711の発現における刺激依存的変化にアクセスするために適用されている。
表 2.GBMから長期的な自己更新神経球培養を導き出す効率。
| 病理学 | n | 長期自己更新神経球を生み出すサンプルの割合 (n) |
| 神経膠芽腫 - 未治療、最初の手術 | 88 | 42.0% (37) |
| 神経膠芽腫 - 再発 | 37 | 40.5% (15) |
| トータル | 125 | 41.6% (52) |
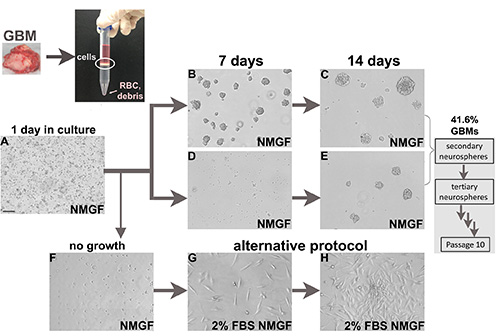
図 1.新鮮な神経膠芽腫の外科標本からの細胞培養.新鮮な腫瘍は、単一細胞に酵素的に解き分ける。密度分離媒体からの有核細胞界面は、NMGFでメッキされた後に行う。解剖された神経球はNMGFでメッキされ、典型的にはめっきの1日後に、死んだ細胞、破片、単一細胞が付着し、時折分裂細胞が懸濁液中にある(A)。神経球形成は、いくつかのケース(B,C)では速く、他の場合は遅い(D,E)。すべての神経球は解約され、少なくとも10の通路のために再入れ替えされ、41.6%GBMは長期的な自己更新神経球をもたらす。神経球として増殖に失敗した生き生きとしたGBM解約細胞(F)は、例えば2%FBS/NMGF(G,H)などの代替培養条件に移すことができる。バー(A)、100 μm、すべての画像に適用されます。ここをクリックすると、より大きな画像が表示されます。
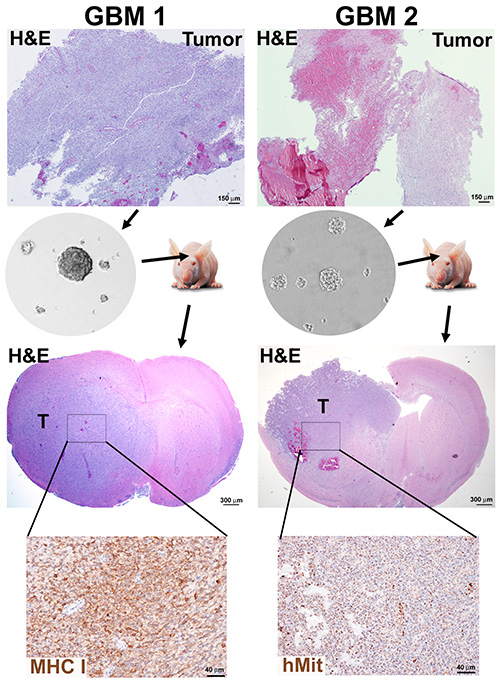
図 2.GBM腫瘍からの神経球発生および異形マウス異種移植片。 高い細胞密度(GBM1)を呈する腫瘍試料と高い壊死含量(GBM2)を有する腫瘍を解約し、プロトコル1および2に従って10の通過に対して培養した神経球を採取した。免疫不全マウスを3 x105 の解約神経球細胞で移植し、モリバンド時に屠殺した。マウス脳は、ヒトマーカー、ヒトミトコンドリア(hMit)または主要組織適合性クラスIサブユニットHLA-A(MHC-I)のH&E染色および免疫組織化学検出のために組み込まれたホルマリンおよびパラフィンであった。 ここをクリックすると、より大きな画像が表示されます。
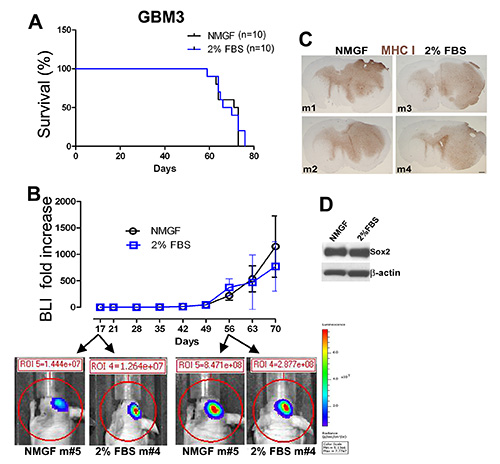
図 3.同様の腫瘍増殖は、NMGFで神経球として培養されたGBM3細胞を用いて、あるいは2%FBS/NMGFにおいて単層として培養したGBM3細胞を有する恒発的に移植されたマウスにおける腫瘍の増殖である。(A)2%FBS/NMGF(両方の通路<10)で、NMGFまたは単層の神経球として培養されたGBM3のカプランマイヤー生存曲線は生存期間に差を示さない(n=10、p=0.7174、ログランク検定)。(B)生生物発光イメージング(BLI)によってモニタリングされた腫瘍増殖は、2つの群間の腫瘍成長ダイナミクスに有意な差を示さない。(C)腫瘍形態は、4GBM3異種移植片について区別がつかないが、2つはNMGFで培養され、2は2%FBS/NMGFで培養される。図2に記載されているMHC-I染色スケール、600 μm。(D) 異種移植腫を開始するために使用される2%FBS/NMGF培養物に保持された幹細胞メーカーSox2発現を示すウェスタンブロット(A-C).ここをクリックすると、より大きな画像が表示されます。
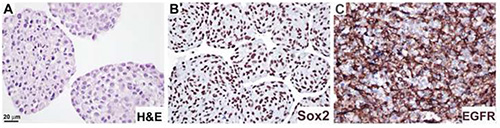
図 4.免疫体化学による神経圏切片におけるタンパク質発現の解析ニューロスフェア培養物は、手順4に記載されているようにホルマリン固定およびパラフィン埋め込み、H&E(A)、抗Sox2抗体(B)および抗EGFR抗体(C)で染色した。DAB基板を使用して可視化した(B,C)。バー、20 μm。ここをクリックすると、より大きな画像が表示されます。
ディスカッション
適切な酵素腫瘍細胞解離は、このプロトコルの重要なステップです。組織は、37°Cの回転下で細胞解離液中でインキュベーションする前に、組織を機械的に三分引きし、解離の延長を確認する必要がある場合、最低30分間ミンチする必要があります。組織凝集の程度に応じて、インキュベーションは、単一細胞への解離を完了するために必要に応じて、さらに15〜30分間延長することができる。細胞の生存率の低下により、解離液中の1時間以上のインキュベーションは推奨されません。開始組織の最適な量は200〜500mgであるが、このプロトコルは、腫瘍組織のわずか50mgから成功した神経球培養につながっている。
無血清NMGFは選択的培地であり、腫瘍の大部分、ならびに宿主細胞を含む腫瘍の腫瘍細胞の割合は生き残らず、他のものはめっき後にフラスコ処理した組織培養に付着する。1~3週間にわたって形成される神経球(図1B-E)は、分化した腫瘍細胞および破片から分離するために、新鮮なフラスコに移されることが重要である。
GBM細胞は、神経圏培養が失敗した場合に、細胞を代替培地で培養するバックアップ源として、酵素的に解約し、培養しない(ステップ1.10)培養することができる。このような冷凍株から神経圏培養物を得るとともに、FBS/NMGFの2%で増殖する単層細胞も得ています。
概念的には、「癌幹細胞」は進行中の作業であり、この新たな分野は、臨床的な意味合いがかなり、特に腫瘍不均一性、可塑性、および治療19、20に対する耐性の生成においてかなりのものであるため、さらなる解明の恩恵を受けるだろう。神経圏培養は、患者固有のGBM動物モデルの生成に不可欠であることに加えて、成長因子、低酸素、および薬理学的薬剤11,21に応答して細胞シグナル伝達および遺伝子発現の変化などのインビトロ研究にも有用である。我々は、ホルマリン固定及びパラフィン組み込み神経球の断面を使用して、3Dアーキテクチャを維持し、免疫体化学11によるタンパク質発現および翻訳後修飾を研究することを選択した。
成人哺乳類の脳由来の神経球内の細胞のすべてが幹細胞であるわけではないことが示されている。同様に、GBM腫瘍から培養された神経球はクローン性ではない可能性が高く、より分化された癌前駆細胞および自己凝集の存在に起因して、高細胞密度23で生じることが知られており、これはこの方法の制限と考えられている。長期自己再生幹細胞の濃縮を支持するために、神経球22として一過性に成長できる前駆物質とは対照的に、一次神経球は二次神経球形成のために解離され、さらに10の通路をさらに10個の通路に分けて、幹細胞に富んだ集団の指標である。私たちの経験では、そのマークを達成するGBM神経球文化は、神経球として無期限に拡大し続けることができます。腫瘍グレードは、GBMおよび再生不良星細胞腫、WHOグレードIVおよびIIIからそれぞれ成功した培養を得ているが、低グレードの神経膠腫からは得られていないので、問題である。
神経膠芽腫細胞を培養する最も一般的な方法は、10%FBSを添加した伝統的な成長培地において、元の腫瘍4からかなりのゲノムおよび形質転換をもたらす。一方、神経球培養は、癌幹細胞表現型4を提示する細胞の安定かつ長期的な供給源である。神経球法は、この方法の主な弱点を表すすべての高等級アストロサイトーマサンプルに対して成功していないにもかかわらず、直交性マウス異種移植片モデルの長期培養におけるCSCの濃縮にますます人気が高まっている。親腫瘍の分子特性が神経球形成に及ぼす影響を理解するための研究が進められている。「オミックス」情報のアクセシビリティと潜在的な標的療法の数の増加に伴い、パーソナライズされた医療の時代に進むにつれて、患者固有のGBMモデルを持つことの重大な利点を考えると、培養高等度の神経膠腫に対する実用的な代替方法の探求、続いて広範な検証が認められる。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
この研究は、ハーメリン脳腫瘍センター、ヘンリーフォード病院によって資金提供されています。
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11330-032 | |
| Trypsin - EDTA 0.05% | Life Technologies | 25300-054 | |
| Hank’s Balanced Salt Solution, calcium- and magnesium-free | Life Technologies | 14170-120 | |
| Hank’s Balanced Salt Solution, with calcium and magnesium | Life Technologies | 24020-117 | |
| Collagenase Type 4 | Worthington | 5004188 | |
| Trypsin Inhibitor | Sigma | T7659 | |
| DNase I | Sigma | D4527 | |
| N2 Supplement (100x) | Life Technologies | 17502-048 | |
| Albumin from Bovine Serum, cell culture grade | Sigma | A4919 | |
| Gentamicin Reagent Solution | Life Technologies | 15710-064 | |
| Antibiotic/Antimycotic | Life Technologies | 15240-062 | |
| Recombinant Human FGF-basic | PeproTech | 100-18B | |
| Recombinant Human EGF | PeproTech | AF-100-15 | |
| Lympholyte-Mouse | Cedarlane Laboratories Ltd. | CL5031 | |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Sterile Cell Strainer, 40 μm | Fisher | 22363547 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS), no calcium and no magnesium | Life Technologies | 14190-144 | |
| Fetal bovine serum | Life Technologies | 26140-079 | |
| Trypan Blue Stain, 0.4% | Life Technologies | 15250-061 | |
| Neutral Buffered Formalin | Protocol | 245-684 | |
| Histoplex Tissue Cassettes | Thermo Scientific | 22-146-426 | |
| Rotator | Miltenyi BioTec | 130-090-753 | |
| GlutaMAX Supplement | Life Technologies | 35050-061 | |
| KnockOut D-MEM/F12 | Life Technologies | 12660-012 | |
| Stem Pro Neural Supplement | Life Technologies | A1058-01 |
参考文献
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821-5828 (2003).
- Ignatova, T. N., et al. Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro. Glia. 39, 193-206 (2002).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756-760 (2006).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Beier, D., et al. CD133(+) and CD133(-) glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles. Cancer Res. 67, 4010-4015 (2007).
- Joo, K. M., et al. Clinical and biological implications of CD133-positive and CD133-negative cells in glioblastomas. Lab. Invest. 88, 808-815 (2008).
- Son, M. J., Woolard, K., Nam, D. H., Lee, J., Fine, H. A. SSEA-1 is an enrichment marker for tumor-initiating cells in human glioblastoma. Cell Stem cell. 4, 440-452 (2009).
- deCarvalho, A. C., et al. Gliosarcoma stem cells undergo glial and mesenchymal differentiation in vivo. Stem Cells. 28, 181-190 (2010).
- Azari, H., et al. Isolation and expansion of human glioblastoma multiforme tumor cells using the neurosphere assay. J. Vis. Exp. , (2011).
- Laks, D. R., et al. Neurosphere Formation Is an Independent Predictor of Clinical Outcome in Malignant Glioma. Stem Cells. 27, 980-987 (2009).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nat. Rev. Cancer. 6, 425-436 (2006).
- Gunther, H. S., et al. Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27 (20), 2897-2909 (2007).
- Fael Al-Mayhani, T. M., et al. An efficient method for derivation and propagation of glioblastoma cell lines that conserves the molecular profile of their original tumours. J. Neurosci. Methods. 176, 192-199 (2009).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem cell. 4, 568-580 (2009).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), (2010).
- Leder, K., Holland, E. C., Michor, F. The therapeutic implications of plasticity of the cancer stem cell phenotype. PLoS One. 5, (2010).
- Pietras, A. Cancer stem cells in tumor heterogeneity. Adv. Cancer Res. 112, 255-281 (2011).
- Lomonaco, S. L., et al. The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells. Int. J. Cancer. 125, 717-722 (2009).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres--re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved