Method Article
优化高等级胶质瘤细胞培养从外科标本用于临床相关的动物模型和3D免疫化学
摘要
在无血清神经球介质中分离出的高档胶质瘤手术标本的传播协议,为具有癌症干细胞表型的细胞进行选择。对于不能作为神经圈生长的标本,建议采取替代方案。描述了一种石蜡嵌入技术,用于维持免疫细胞化学的3D神经球结构。
摘要
胶质母细胞瘤是天体细胞瘤最常见和最具有攻击性的形式,对治疗有难治性,在分子上是异质的。建立细胞培养,保持父母肿瘤的基因组特征,用于患者特定 的体外 和 体内 模型的能力,有可能彻底改变针对每个肿瘤的分子特性的胶质母细胞瘤新疗法的药物前开发。
从新的高等级天体细胞瘤肿瘤分离成单细胞开始,我们使用神经球检测作为呈现癌干细胞表型的细胞的丰富方法,包括神经干细胞标记的表达、 体外的长期自我更新以及形成矫形异种移植肿瘤的能力。这种方法以前曾提出过,现在由几位调查人员使用。根据我们分离和培养125个胶质母细胞瘤样本的经验,我们得出了详细的协议,我们在这里提出,适合常规神经圈培养高等级天体细胞和大规模扩张肿瘤细胞的预科研究。我们报告使用此协议的成功长期培养的效率,并建议负担得起的替代培育分离的胶质母细胞,不能成长为神经圈。我们还详细描述了一个保护免疫造血的神经圈3D结构的协议。在CSC中丰富的细胞培养,能够产生能够保存GBM分子特征和异质性的正交异种模型,对于GBM生物学的研究和改进潜在疗法的细胞前测试设计,正变得越来越受欢迎。
引言
胶质母细胞瘤(GBM)是世卫组织IV级天体细胞瘤,是最普遍和最具攻击性的原发性脑肿瘤。GBM肿瘤细胞采用多种发育表型,包括具有"癌症干细胞"(CSC)特征的细胞,如神经干细胞(NSC)标记的表达、长期自我更新,以及产生更多表达星体细胞标记的分化细胞并形成肿瘤1-3的潜力。虽然仍需要澄清CSC分子特性和临床影响,但当前工作的重点是CSC的操作定义: 体外长期自我更新,以及在免疫功能不全啮齿动物的正交植入后分化和复制原肿瘤的能力。
胶质母细胞在传统介质中培养了几十年,含有10%的胎儿牛血清(FBS),几个高通量商业可用的血清培养GBM细胞系在免疫功能低下的啮齿动物中具有肿瘤原发性,但与原始肿瘤4有相当大的基因组和分子差异,限制了它们作为临床相关模型的使用。最近,在GBM2中发现了对EGF和bFGF有反应的干细胞/祖细胞表型。随后,分离的GBM肿瘤样本在无血清介质3中培养,最初用于从成年哺乳动物大脑5中选择和扩展神经干细胞。这些培养条件阻碍了大多数非肿瘤细胞群的生长,同时有利于干细胞和祖细胞的生长,如浮动多细胞球体,或神经球体3,模仿成年哺乳动物神经干细胞的行为5。在神经球介质中培养的原发性GBM细胞的全面并排比较,辅以生长因子(NMGF),或在补充10%FBS的传统生长介质中, 揭示出GBM神经圈具有肿瘤原性,具有多线分化潜力,并保留了原肿瘤的基因型,与10%的FBS培养物形成鲜明对比,后者在低通道时不致肿瘤,在后通道4中与原始肿瘤有较大差异。
CSC与分离的GBM肿瘤通过细胞排序基于假定CSC标记CD133的表达也提出了6,7,但进一步的工作表明,CSC表型没有明确与这种标记的表达8-10,降低最初的热情,这一策略,而新的标记仍在测试10。迄今无法使用一组经验证的标记来定义 CSC,以及大规模放大这些细胞用于细胞前研究的目标,使得对常规 CSC 丰富培养物使用细胞分类不切实际。在NMGF中作为神经球生长的能力选择的GBM细胞总是表达神经干细胞标记。我们观察到,Sox2和巢蛋白在神经圈培养中随处可见,而CD133蛋白存在于GBM神经圈的子集(未公开的数据和参考文献11)中。
一些实验室正在利用同样的酶分离和培养方法,在无血清介质中,辅以生长因子3、4、11-14,从胶质母细胞瘤肿瘤中追求神经球培养,而其他同事则报告说,他们试图从GBM样本中培养长期神经球培养物,但没有成功。这里介绍的高档胶质瘤酶分离和神经球培养的一般方法与上述出版物所概述的方法相似。我们根据分离和培养 100 多个 GBM 样本的经验优化了协议。从应用此处所展示的协议的新鲜GBM样本获得长期神经球培养物的效率超过40%,与显示效率数据3、15的少数报告相似,导致在EGF和bFGF作为单层涂层的表面上涂有ECM蛋白16、17的情况下,不断或间歇性地在无血清介质中培养细胞等替代方案的探索。神经圈培养仍然是保存GBM肿瘤分子特征和肿瘤遗传潜力的最验证和越来越流行的方法3,4,11-14,因此我们的方法是首先尝试神经球培养,同时测试替代方法培育GBM细胞,未能形成长期自我更新的神经圈(图1),以增加GBM肿瘤的代表性,可用于动物模型。在这里,我们提出一个协议,从GBM培养神经球。对于未能形成神经圈的细胞,我们在生长介质上进行了简单的修饰,这是首次尝试从非神经球形成GBM培养肿瘤细胞,结果很有希望,并且仍在进行广泛的验证。
研究方案
1. 神经圈培养的新鲜外科胶质母细胞瘤标本的单细胞悬架
- 经患者书面同意,按照机构指引,在高等级胶质瘤切除手术后立即采集肿瘤样本进行细胞培养。
- 通过组织病理学确认肿瘤样本的诊断。立即将标本从手术室运送到层流组织培养罩,在手术后1小时内处理。
注意:对于远程部位的手术,将肿瘤样本切成较小的片段,放入含有DMEM/F12的管子中(保持冰上)。肿瘤可以在手术后几个小时处理。 - 从 200-500 毫克组织(最佳)开始,使用手术刀刀片切碎肿瘤样本,并转移到包含 10 毫升 DMEM/F12 无血清介质的 15 毫升管中。通过倒置几次混合,让肿瘤碎片沉积物的重力,去除介质,并在必要时重复。
- 准备酶组织分离溶液并新鲜停止溶液。
- 酶组织分离溶液:5 毫升 0.05% Trypsin-EDTA,2.5 毫升汉克平衡盐溶液 (HBSS) 无钙和镁,2.5 毫升拼贴酶 IV 库存溶液(2,000 U/ml HBSS 含钙和镁)。
- 停止解决方案:5毫升特普辛抑制剂溶液,5毫升DMEM/F12,2微升5,000U/毫升DNAse I(HBSS钙和镁制)。
- 去除介质,并在切碎的肿瘤样本中加入酶组织分离溶液,每 0.5 克组织使用 2 毫升。通过倒置轻轻混合。
- 在旋转下在组织培养孵化器中以 37 °C 将组织在溶液中孵化 30 分钟。
- 用2毫升的移液器进行三次,停止消化或返回孵化器,根据消化水平再进行15-30分钟的孵化。
- 通过添加 2 卷停止溶液并用 5 毫升血清移液器机械地三次处理来停止消化。
- 通过 40μm 细胞过滤器过滤掉未消化的材料。在室温下以 800 x g 的速度将细胞颗粒 5 分钟,然后在 10 毫升 DMEM/F12 中清洗 3 次。
- 将最终细胞颗粒重新喷入 5 毫升 DMEM/F12 中。
- 在室温下,将细胞悬浮物缓慢地分层至 5 毫升淋巴解体-M 和颗粒,以 1,300 x g 的速度分层 20 分钟。
- 将包含核细胞的接口层转移到包含 10 毫升 DMEM/F12 的 15 毫升管中。
- 在室温下以800 x g的温度将细胞颗粒化5分钟。重复使用DMEM/F12洗涤2倍以上。
- 冷冻保存由此产生的单个细胞,通过在恢复细胞冻结介质中重新悬念颗粒、引用到低温细胞、缓慢冻结和储存液氮中进一步使用。
- 为了培养,在标准条件下,在常规T25组织培养瓶中,在生长因子(NMGF)和密度相对较低(<1 x10 5细胞/毫升)的板中补充神经圈中细胞,5%的二氧化碳2,37°C,加湿组织培养孵化器(图1A)。
- 使用以下配方准备 NMGF
对于 500 毫升的 DMEM/F12 库存解决方案 卷 最终浓度 N2 补充剂 (10x) 5 毫升 1x 250毫克/毫升BSA库存解决方案 1 毫升 0.5毫克/毫升 10毫克/毫升根塔米辛试剂 1.25 毫升 25微克/毫升 100x 抗生素/抗菌剂 2.5 毫升 0.5倍 100毫克/毫升 bFGF 0.1 毫升 20 ng/毫升 100毫克/毫升EGF 0.1 毫升 20 ng/毫升
- 使用以下配方准备 NMGF
- 将形成超过1-3周的神经球(图1B-E)转移到新鲜的烧瓶中,从附着的细胞和碎片中分离出来。每 3-4 天执行部分媒体更改。
注意:如果使用上述协议分离正交异种肿瘤,则可以省略步骤 1.11-1.13。
2. 胶质母细胞瘤神经球培养维护与下游应用
-
分离:监测神经圈培养物,每3-4天进行部分中等变化。当烧瓶中的大多数多细胞神经球直径达到 100μm 时,分离成单个细胞悬架:
- 将含有神经球的介质转移到15毫升的管子上,重力沉积神经圈约5分钟,取出介质,将细胞颗粒重新用10毫升无钙和无镁的DPBS。
- 在室温下混合孵育10分钟,因为细胞被重力沉积。
- 取出 7-8 毫升 DPBS,然后用预先准备的血清移液器机械地分离神经球。
- 在 800 x g 下将分离的细胞颗粒化 5 分钟,在 4 °C 下。
- 通过:在NMGF中重新插入分离细胞(步骤2.1.),并分成必要的烧瓶数量(1:3),并在标准条件下孵化。二级神经球将形成,随后应分离为形成第三个球体。
- 评估长期自我更新:重复分离过程,直到神经圈培养达到至少10段,相当于至少2个月的文化。
-
冷冻: 低温保存神经球,分离神经球(步骤2.1.),并恢复细胞冻结中等的细胞颗粒,在低温中引用,缓慢冻结,并储存在液氮中。
- 从冷冻库存培养神经球细胞:在37°C解冻细胞,并立即转移到含有10毫升DMEM/F12的15毫升管。轻轻混合管子,然后在 800 x g 下旋转细胞,在 4 °C 下旋转 5 分钟。 再清洗一次细胞颗粒,并重新消耗 NMGF 中的细胞,并转移到 T25 组织培养瓶中。
-
免疫功能低下小鼠颅内植入物的细胞悬浮:
- 分离神经球(第2.1步),在无钙和无镁的DPBS中补充细胞颗粒。使用血细胞仪和尝试盘蓝色排除来计数可行的细胞。
- 计算植入所需的细胞数量,通常为 3 x 105 个细胞/鼠标,将所需的细胞数量转移到小瓶中,并将细胞颗粒为 1,000 x g。
- 通过轻轻敲击微中枢管,将细胞颗粒以适合植入物(5μl/mouse)的体积中恢复。将细胞悬浮在冰上,并在2小时内使用。
3. 培养肿瘤胶质母细胞的替代议定书(用于神经球培养失败的情况)
- 用胎儿牛血清补充NMGF介质,最终浓度为2%FBS/NMGF。
- 从 NMGF 培养中的细胞开始:从 NMGF 烧瓶 (图 1F)中收获可行的细胞,在普通 T25 组织培养瓶中以相对较低密度 (<1 x 105细胞/毫升) 在 2000 年 FBS/NMGF 和板中补充活性细胞,并在标准条件下培养 5% CO2、37 °C,加湿组织培养器 (图 1G)。
- 从冷冻从未培养的细胞开始 (步骤1.14):解冻细胞,用无血清介质和板洗2%FBS/NMGF和培养,如步骤3.2所述。在将可行细胞转移到 2% FBS/NMGF 之前,在 NMGF 中培养 3 天是预选去分化细胞的替代方案。
4. 免疫化学对神经球的形态学和分子分析
- 培养神经圈,直到大多数漂浮的多细胞球体达到100μm直径。
- 从孵化器中取出培养烧瓶,立即颗粒神经球,去除介质,加入10毫升DPBS,而不会干扰颗粒。取出 DPBS,在 10% 中性缓冲形式素中重新喷出,并在室温下孵育 20 分钟。
- 颗粒球体,在30%乙醇中再喷,孵育30-45分钟。
- 用50%乙醇代替30%乙醇,孵育15分钟,再换成新鲜的50%乙醇,再孵化30分钟。
- 重复(步骤4.4.)与70%乙醇。
- 替换为 95% 乙醇两个变化 10-20 分钟每个,并重复与绝对乙醇,直到球体是明亮的白色和浓缩。
- 用透镜纸制作一个小滤纸锥,放入烧嘴中的小漏斗中。用绝对酒精润湿透镜纸。
- 用新鲜的100%乙醇稍微松开颗粒,倒掉多余的乙醇,通过透镜纸锥体倒入球形,确保它们进入圆锥体的顶端。用额外的绝对乙醇冲洗管子,并通过透镜纸锥倒入剩余的球体。
- 从漏斗中取出纸锥体,小心地将球形体移入圆锥体底部。将纸张折叠成正方形,确保球体尽可能安全地封闭。
- 将包装的神经球转移到盒式磁带中,并转移到自动组织处理器。
- 自动组织处理器的编程如下:绝对乙醇,10分钟,二甲苯,15分钟(2倍),石蜡,10分钟(4倍)。
- 从处理器中取出盒式磁带,并将其放置在石蜡嵌入系统的加热部分。确保整个表面没有碎片、灰尘或其他碎片,并从变暖井中吸走所有石蜡。温暖干净的石蜡自由钳,并添加少量石蜡到加热的基础模具。
- 打开盒式磁带,取出数据包并将其放置在嵌入系统的加热部分。小心地打开纸锥,直到球体可见。用预热钳收集尽可能多的材料,并转移到基模中的液体石蜡中。
- 根据需要重复检索尽可能多的球体。用预先预热的清洁剃须刀轻轻刮刮纸巾,用乙醇擦拭,以收集任何残留的球体,而不会将任何纸张放入方块中。
- 小心地用温暖的钳子分解任何球形团块。将球体从角落移到统一的中央层中。将基模移到冷却区域,固定球体到位,添加盒式磁带,慢慢填充石蜡,彻底冷却。
- 神经圈石蜡块可用于正常分割和免疫化学。
结果
我们已应用上述协议分离和培养125个新的手术胶质母细胞瘤标本(图1),88个新诊断,和37个复发性肿瘤(表2),经患者同意,并在机构指南下。建立长期神经球培养的议定书效率为41.6%,新诊断的肿瘤和复发性肿瘤的效率相似(表2)。对于一些GBM样本,神经球在头几天形成(图1B和1C),而对于其他需要更长的培养时间(图1D和1E)。
神经圈形成的效率并不完全取决于组织中的坏死水平,新诊断出的高细胞密度肿瘤(GBM1)和根据协议1和2处理的复发性坏死因子肿瘤(GBM2)的结果就是例证,这两种肿瘤都产生神经球培养(图2)。
根据机构和ICUC动物护理指南,使用类似先前描述的18、GBM1和GBM2神经球被植入免疫功能低下小鼠大脑的协议,测试免疫功能低下小鼠中每个神经圈培养的肿瘤潜力,是验证这种方法对CSC富集的关键验证。异种移植肿瘤具有GBM的形态特征,如侵入脑帕奇马和坏死(图2)。
GBM3分离(图1A),在神经球介质(图1D和1E)和2%FBS/NMGF(图1D,1G和1H)培养。在2%的FBS/NMGF培养的单层细胞和NMGF培养的神经球细胞分离,并采用与图2相同的程序,将相同数量的细胞植入裸鼠体内。两种植物培养方法(图3A-C)在存活率、肿瘤生长动力学或形态学方面没有发现差异。肿瘤生长特征不改变,最新通过测试,P20神经球,和P10为2%FBS/NMGF。虽然神经干细胞标记,包括Six2,在大多数原发性GBM细胞培养在10%FBS 3,4,11,NMGF补充2%FBS允许保留Sex2表达(图3D)。
神经球按照协议4处理,并标有H&E(图4A)、抗Sex2抗体,显示核定位(图4B)和EGFR抗体,细胞膜定位(图4C)。该协议已应用于获取刺激依赖的改变,在内斯汀,GFAP,和增殖标记Ki6711的表达。
表2。从 GBM 中获得长期自我更新神经球培养的效率。
| 病理学 | n | 产生长期自我更新神经圈的样本百分比 (n) |
| 胶质母细胞瘤 - 未经治疗,第一次手术 | 88 | 42.0% (37) |
| 胶质母细胞瘤 - 复发性 | 37 | 40.5% (15) |
| 总 | 125 | 41.6% (52) |
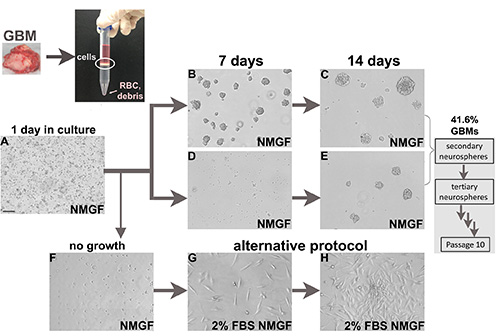
图1。细胞培养从新鲜的胶质母细胞瘤手术标本。新鲜肿瘤酶分离成单细胞。然后在 NMGF 中镀上密度分离介质的核细胞接口。分离的神经球在NMGF中镀层,通常电镀后1天有死细胞、碎片、附着的单个细胞和偶尔分离的细胞在悬浮(A)中。神经球的形成对于某些情况(B,C)更快,而对于其他情况(D,E)则更慢。所有神经球被分离并重新镀出至少10个通道,41.6%的GBM产生长期自我更新的神经圈。可行的GBM分离细胞不能作为神经圈(F)生长,可以转移到替代培养条件,例如2%的FBS/NMGF(G,H)。条(A), 100μm, 适用于所有图像。单击此处查看更大的图像。
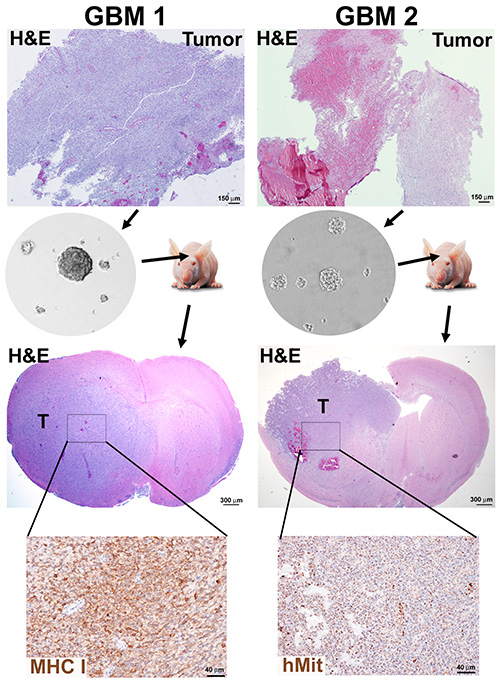
图2。来自GBM肿瘤的神经圈生成和矫形小鼠异种移植。 根据协议1和2,对具有高细胞密度(GBM1)和坏死含量(GBM2)的肿瘤样本进行分离,神经球培养为10个通道。免疫功能低下的小鼠被植入3×105 分离的神经球细胞,并在死亡时牺牲。小鼠大脑是形式固定和石蜡嵌入用于人类标记的H&E染色和免疫化学检测,人类线粒体(hMit)或主要组织相容性类I亚单位HLA-A(MHC-I)。 单击此处查看更大的图像。
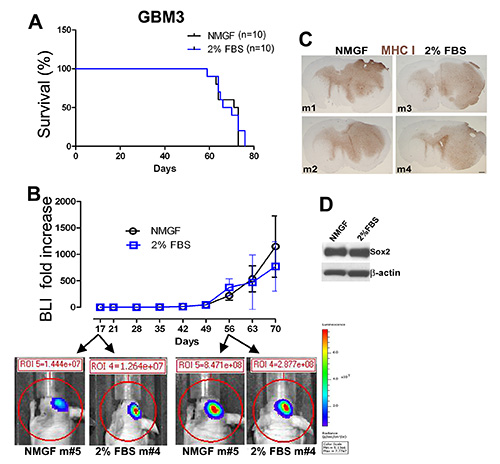
图3。在小鼠体内植入的类似肿瘤生长与GBM3细胞培养为神经球在NMGF或作为单层在2%FBS/NMGF。(A) GBM3 的卡普兰-迈尔生存曲线在 NMGF 中培养为神经球,或在 2%FBS/NMGF 中培养为单层(两段<10)均显示生存率没有差异(n=10,p=0.7174,日志级测试)。(B) 活生物发光成像 (BLI) 监测的肿瘤生长显示两组肿瘤生长动力学没有显著差异。(C) 肿瘤形态对于 4 个 GBM3 异种格拉夫特、2 个在 NMGF 培养和 2 个在 2% FBS/NMGF 中培养是无法区分的。MHC-I 污渍如 图 2所描述的那样。缩放,600 μm。(D) 显示干细胞制造商 Sox2 表达保留在 2% FBS/NMGF 培养用于启动异种移植肿瘤(A-C) 的西方污点。 单击此处查看更大的图像。
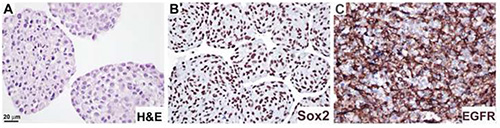
图4。免疫造血术对神经圈部分蛋白质表达的分析。神经球培养物是形式固定和石蜡嵌入程序4中描述的,并染色H&E(A),抗 Sox2 抗体(B)和抗 EGFR 抗体(C).民建联基板用于可视化(B,C)。酒吧,20微米。单击此处查看更大的图像。
讨论
适当的酶肿瘤细胞分离是本协议的关键步骤。在细胞分离溶液在旋转下 37 °C 的孵化之前,组织必须经过切碎,最少 30 分钟,此时组织必须进行机械三次三次修剪,并验证分离的扩展。根据组织凝聚程度,孵化可以延长15-30分钟,以完成分离成单细胞。由于细胞存活率降低,不建议在分离溶液中孵育超过 1 小时。虽然启动组织的最佳量是200-500毫克,但该协议已经导致成功的神经圈培养从只有50毫克的肿瘤组织。
无血清NMGF是一种选择性介质,由肿瘤大部分构成的肿瘤细胞以及宿主细胞的百分比将无法存活,而其他细胞在电镀后将附着在经过处理的烧瓶组织培养物上。至关重要的是,将形成超过1-3周的神经球(图1B-E)转移到新的烧瓶,从分化的肿瘤细胞和碎片分离。
GBM细胞酶分离,从未培养(步骤1.10)可以低温保存作为细胞的备用来源培养在替代媒体,以防神经圈培养失败。我们已经成功地从这些冷冻种群中获得了神经球培养物,以及生长在2%FBS/NMGF中的单层细胞。
从概念上讲,"癌症干细胞"是一项正在进行中的工作,这一新兴领域将受益于额外的澄清,因为临床意义是相当大的,特别是在肿瘤异质性,可塑性和抗治疗19,20的产生。神经圈培养除了对生成特定于患者的GBM动物模型至关重要外,还对体外研究(如细胞信号和基因表达的改变,以应对生长因子、缺氧和药理制剂11、21)等具有价值。由于与更常见的球体标记和成像方法相比,免疫造血术11采用的形式素固定和石蜡嵌入式神经球的横截面,保留了3D结构,研究蛋白质表达和免疫化学11的转化后修饰。
研究表明,并非所有来自成年哺乳动物大脑的神经圈内的细胞都是干细胞。同样,从GBM肿瘤培养的神经球可能不是克隆体,因为存在更分化的癌症祖细胞和自我聚集,已知发生在高细胞密度23,这被认为是这种方法的限制,有些人认为。为了有利于长期自我更新干细胞的富集,而不是仅仅作为神经圈22的祖先,原发性神经球被分离为继发神经球的形成,并进一步通过至少10个通道,大致相当于连续培养2个月,这表明在干细胞22中丰富了人口。根据我们的经验,达到这一标记的GBM神经圈培养可以继续作为神经圈无限期地扩展。肿瘤等级很重要,因为我们分别从GBM和肿瘤性天体、世卫组织四级和三级获得成功的培养,但并非来自低级胶质瘤。
在传统的生长介质中,以10%FBS补充的胶质母细胞培养最普遍的方法,导致与原始肿瘤4的基因组和表型差异相当大。另一方面,神经圈培养是一个稳定和长期的细胞来源,呈现癌症干细胞表型4。神经球方法在正位小鼠异种移植模型的长期培养中,CSC的丰富越来越受欢迎,尽管所有高档天体细胞瘤样本都未成功,但代表了该方法的主要弱点。目前正在进行研究,以了解父母肿瘤的分子特征如何影响神经球的形成。探索培养高等级胶质瘤的实用替代方法,然后进行广泛的验证,因为我们进入一个个性化医学时代,由"omics"信息的可及性和潜在靶向疗法数量增加所推动,具有患者特定的GBM模型的重要优势。
披露声明
作者宣称他们没有相互竞争的经济利益。
致谢
这项工作由亨利福特医院赫梅林脑肿瘤中心资助。
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11330-032 | |
| Trypsin - EDTA 0.05% | Life Technologies | 25300-054 | |
| Hank’s Balanced Salt Solution, calcium- and magnesium-free | Life Technologies | 14170-120 | |
| Hank’s Balanced Salt Solution, with calcium and magnesium | Life Technologies | 24020-117 | |
| Collagenase Type 4 | Worthington | 5004188 | |
| Trypsin Inhibitor | Sigma | T7659 | |
| DNase I | Sigma | D4527 | |
| N2 Supplement (100x) | Life Technologies | 17502-048 | |
| Albumin from Bovine Serum, cell culture grade | Sigma | A4919 | |
| Gentamicin Reagent Solution | Life Technologies | 15710-064 | |
| Antibiotic/Antimycotic | Life Technologies | 15240-062 | |
| Recombinant Human FGF-basic | PeproTech | 100-18B | |
| Recombinant Human EGF | PeproTech | AF-100-15 | |
| Lympholyte-Mouse | Cedarlane Laboratories Ltd. | CL5031 | |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Sterile Cell Strainer, 40 μm | Fisher | 22363547 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS), no calcium and no magnesium | Life Technologies | 14190-144 | |
| Fetal bovine serum | Life Technologies | 26140-079 | |
| Trypan Blue Stain, 0.4% | Life Technologies | 15250-061 | |
| Neutral Buffered Formalin | Protocol | 245-684 | |
| Histoplex Tissue Cassettes | Thermo Scientific | 22-146-426 | |
| Rotator | Miltenyi BioTec | 130-090-753 | |
| GlutaMAX Supplement | Life Technologies | 35050-061 | |
| KnockOut D-MEM/F12 | Life Technologies | 12660-012 | |
| Stem Pro Neural Supplement | Life Technologies | A1058-01 |
参考文献
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821-5828 (2003).
- Ignatova, T. N., et al. Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro. Glia. 39, 193-206 (2002).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756-760 (2006).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Beier, D., et al. CD133(+) and CD133(-) glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles. Cancer Res. 67, 4010-4015 (2007).
- Joo, K. M., et al. Clinical and biological implications of CD133-positive and CD133-negative cells in glioblastomas. Lab. Invest. 88, 808-815 (2008).
- Son, M. J., Woolard, K., Nam, D. H., Lee, J., Fine, H. A. SSEA-1 is an enrichment marker for tumor-initiating cells in human glioblastoma. Cell Stem cell. 4, 440-452 (2009).
- deCarvalho, A. C., et al. Gliosarcoma stem cells undergo glial and mesenchymal differentiation in vivo. Stem Cells. 28, 181-190 (2010).
- Azari, H., et al. Isolation and expansion of human glioblastoma multiforme tumor cells using the neurosphere assay. J. Vis. Exp. , (2011).
- Laks, D. R., et al. Neurosphere Formation Is an Independent Predictor of Clinical Outcome in Malignant Glioma. Stem Cells. 27, 980-987 (2009).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nat. Rev. Cancer. 6, 425-436 (2006).
- Gunther, H. S., et al. Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27 (20), 2897-2909 (2007).
- Fael Al-Mayhani, T. M., et al. An efficient method for derivation and propagation of glioblastoma cell lines that conserves the molecular profile of their original tumours. J. Neurosci. Methods. 176, 192-199 (2009).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem cell. 4, 568-580 (2009).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), (2010).
- Leder, K., Holland, E. C., Michor, F. The therapeutic implications of plasticity of the cancer stem cell phenotype. PLoS One. 5, (2010).
- Pietras, A. Cancer stem cells in tumor heterogeneity. Adv. Cancer Res. 112, 255-281 (2011).
- Lomonaco, S. L., et al. The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells. Int. J. Cancer. 125, 717-722 (2009).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres--re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。