Method Article
Optimierung der hochwertigen Gliom-Zellkultur von chirurgischen Proben für den Einsatz in klinisch relevanten Tiermodellen und 3D-Immunchemie
In diesem Artikel
Zusammenfassung
Protokoll zur Verbreitung von dissoziierten hochgradigen chirurgischen Gliomproben im serumfreien Neurosphärenmedium zur Auswahl für Zellen mit Krebsstammzellphänotyp. Für Proben, die nicht als Neurosphären wachsen, wird ein alternatives Protokoll vorgeschlagen. Eine Paraffin-Einbettungstechnik zur Aufrechterhaltung der 3D-Neurosphärenarchitektur für die Immunzytochemie wird beschrieben.
Zusammenfassung
Glioblastome, die häufigste und aggressivste Form des Astrozytom, sind feuerfest bis zur Therapie und molekular heterogen. Die Fähigkeit, Zellkulturen zu etablieren, die das genomische Profil der elterlichen Tumoren erhalten, für den Einsatz in patientenspezifischen In-vitro- und In-vivo-Modellen, hat das Potenzial, die präklinische Entwicklung neuer Behandlungen für Glioblastom zu revolutionieren, die auf die molekularen Eigenschaften jedes Tumors zugeschnitten sind.
Beginnend mit frischen hochgradigen Astrozytom-Tumoren, die in Einzelzellen dissoziiert sind, verwenden wir den Neurosphären-Assay als Anreicherungsmethode für Zellen, die Krebsstammzell-Phänotyp darstellen, einschließlich der Expression von neuronalen Stammzellmarkern, der langfristigen Selbsterneuerung in vitround der Fähigkeit, orthotopische Xenograft-Tumoren zu bilden. Diese Methode wurde bereits vorgeschlagen und wird nun von mehreren Ermittlern angewandt. Basierend auf unserer Erfahrung der Dissoziierung und Kultivierung von 125 Glioblastom-Proben gelangten wir zu dem detaillierten Protokoll, das wir hier vorstellen, geeignet für die routinemäßige Neurosphärenkultivierung von hochgradigen Astrozymen und eine großflächige Expansion tumorigener Zellen für präklinische Studien. Wir berichten über die Effizienz erfolgreicher Langzeitkulturen mit diesem Protokoll und schlagen erschwingliche Alternativen für die Kultivierung dissoziierter Glioblastomzellen vor, die nicht als Neurosphären wachsen. Wir beschreiben auch im Detail ein Protokoll zur Erhaltung der Neurosphären 3D-Architektur für die Immunhistochemie. Zellkulturen, die in CSCs angereichert sind und in der Lage sind, orthotopische Xenograft-Modelle zu erzeugen, die die molekularen Signaturen und die Heterogenität von GBMs bewahren, werden immer beliebter für das Studium der Biologie von GBMs und für die verbesserte Gestaltung präklinischer Tests potenzieller Therapien.
Einleitung
Glioblastom (GBM), ein Astrozytom des WHO-Grades IV, ist der am weitesten verbreitete und aggressivste primäre Hirntumor. Verschiedene Entwicklungsphänotypen werden von GBM-Tumorzellen übernommen, einschließlich Zellen, die "Krebsstammzell"-Eigenschaften (CSC) aufweisen, wie die Expression von neuronalen Stammzellmarkern (NSC), langfristige Selbsterneuerung und das Potenzial, differenziertere Zellen hervorrufen zu können, die astrozytische Marker exzieren und den Großteil des Tumors1-3bilden. Während noch Klärungsbedarf in Bezug auf die molekulare Identität von CSC und die klinischen Implikationen besteht, liegt der Schwerpunkt der vorliegenden Arbeit auf der operativen Definition von CSC: langfristige Selbsterneuerung in vitro und die Fähigkeit, den ursprünglichen Tumor bei orthotopischer Implantation bei immungeschwächten Nagetieren zu differenzieren und zu reproduzieren.
Glioblastom-Zellen werden seit Jahrzehnten in traditionellen Medien kultiviert, die 10% fetales Rinderserum (FBS) und mehrere hochdurchlässige kommerziell erhältliche serumkultivierte GBM-Zelllinien bei immungeschwächten Nagetieren tumorigene, aber es gibt eine erhebliche genomische und molekulare Divergenz vom ursprünglichen Tumor4, die ihre Verwendung als klinisch relevante Modelle einschränken. In jüngerer Zeit wurden In GBMs2Zellen mit Stamm-/Vorläufer-Phänotyp identifiziert, die auf EGF und bFGF reagieren. Anschließend wurden dissoziierte GBM-Tumorproben in einem serumfreien Medium3kultiviert, ursprünglich für die Auswahl und Erweiterung neuronaler Stammzellen aus dem erwachsenen Säugetierhirnformuliert 5. Diese Kulturbedingungen behindern das Wachstum der meisten nichtneoplastischen und differenzierteren Tumorzellpopulationen, während sie das Wachstum von Stamm- und Vorläuferzellen als schwimmende mehrzellige Sphäroide oder Neurosphären3bevorzugen, die das Verhalten von adulten neuronalen Stammzellen imitieren5. Umfassender Vergleich der primären GBM-Zellen, die entweder in Neurosphärenmedium kultiviert werden, ergänzt durch Wachstumsfaktoren (NMGF) oder im traditionellen Wachstumsmedium, ergänzt durch 10% FBS, zeigte, dass die GBM-Neurosphären tumoriogen waren, ein Multilineage-Differenzierungspotenzial darstellten und den Genotyp des ursprünglichen Tumors bewahrten, im Gegensatz zu den 10% FBS-Kulturen, die bei niedrigen Passagen nicht tumoriogen waren und in den späten Passagen erheblich von den ursprünglichen Tumoren abwichen4.
Die Isolierung von CSC von dissoziierten GBM-Tumoren durch Zellsortierung auf der Grundlage der Expression des vermeintlichen CSC-Markers CD133 wurde ebenfalls vorgeschlagen6,7, aber weitere Arbeiten deuteten darauf hin, dass der CSC-Phänotyp nicht definitiv mit der Expression solcher Marker8-10in Verbindung gebracht wird, was die anfängliche Begeisterung für diese Strategie verringert, während neue Marker noch getestet werden10. Die bisher nicht verfügbare eines validierten Satzes von Markern, die CSC definieren, zusammen mit dem Ziel einer großflächigen Verstärkung dieser Zellen für präklinische Studien macht die Verwendung von Zellsortierung für routinemäßige CSC-angereicherte Kulturen unpraktisch. GBM-Zellen, die durch die Fähigkeit ausgewählt wurden, als Neurosphären in NMGF zu wachsen, drücken ausnahmslos neuronale Stammzellmarker aus. Wir haben beobachtet, dass Sox2 und Nestin allgegenwärtig in Neurosphärenkulturen exprimiert werden, während CD133-Protein in einer Teilmenge der GBM-Neurosphären vorhanden ist (unveröffentlichte Daten und Referenz11).
Mehrere Laboratorien verfolgen Neurosphärenkulturen aus Glioblastom-Tumoren mit dem gleichen allgemeinen Ansatz der enzymatischen Dissoziation und Kultivierung in serumfreien Medium mit Wachstumsfaktoren3,4,11-14, während andere Kollegen haben Versuche berichtet, langfristige Neurosphärenkulturen aus GBM-Proben ohne Erfolg wachsen . Die allgemeine Methode für enzymatische Dissoziation und Neurosphärenkultur von hochgradigen Gliomen, die hier vorgestellt wird, ähnelt dem, was in den obigen Veröffentlichungen beschrieben wurde. Wir haben das Protokoll auf der Grundlage unserer Erfahrungen mit der Trennung und Kultivierung von über 100 GBM-Samples optimiert. Die Effizienz der Gewinnung langfristiger Neurosphärenkulturen aus frischen GBM-Proben unter Anwendung des hier vorgestellten Protokolls beträgt über 40 %, ähnlich wie bei den wenigen Berichten, die Effizienzdaten3,15zeigen, was zur Erforschung alternativer Protokolle wie der kontinuierlichen oder zeitweise kultivierenden Zellkultivierung in serumfreiem Medium in Gegenwart von EGF und bFGF als Monolayer n. B. auf Oberflächen führt, die mit ECM-Protein16,17beschichtet sind. Neurosphärenkulturen sind immer noch der am meisten validierte und immer beliebter werdende Ansatz, um GBM-Tumoren molekulare Eigenschaften und tumorigenes Potenzialzuerhalten 3,4,11-14, daher ist unser Ansatz, Neurosphärenkulturen zuerst zu versuchen, während gleichzeitig alternative Methoden zur Kultivierung von GBM-Zellen getestet werden, die keine langfristigen selbsterneuernden Neurosphären bilden ( Abbildung1), um die Darstellung von GBM-Tumoren zu erhöhen, die in Tiermodellen verwendet werden können. Hier stellen wir ein Protokoll zur Kultivierung von Neurosphären aus GBMs vor. Für Zellen, die keine Neurosphären bilden, zeigen wir eine einfache Modifikation im Wachstumsmedium, als erster Versuch, tumorigene Zellen aus nichtneurosphärenden GBMs zu kultivieren, mit vielversprechenden Ergebnissen und noch immer einer umfassenden Validierung.
Protokoll
1. Einzelzellsuspension von frischem chirurgischen Glioblastom-Exemplar für Neurosphärenkultur
- Mit schriftlicher Zustimmung der Patienten und in Übereinstimmung mit institutionellen Richtlinien, sammeln Tumorproben für die Zellkultur unmittelbar nach Resektionsoperation von hochgradigem Gliom.
- Bestätigen Sie die Diagnose der Tumorprobe durch Histopathologie. Transportieren Sie die Probe sofort aus dem Operationssaal zur laminaren Strömungsgewebekulturhaube, um sie innerhalb von 1 Stunde von der Operation zu verarbeiten.
HINWEIS: Bei Operationen an einem abgelegenen Ort die Tumorprobe in kleinere Fragmente schneiden und in ein Rohr mit DMEM/F12 legen (auf Eis bleiben). Der Tumor kann mehrere Stunden nach der Operation verarbeitet werden. - Beginnend mit 200-500 mg Gewebe (optimal), Hacken sie die Tumorprobe mit einer Skalpellklinge und übertragen sie in ein 15 ml-Rohr mit 10 ml DMEM/F12-Serum-freien Medium. Mischen Sie durch Mehrmalsinvertieren, lassen Sie die Tumorstücke Sediment durch Schwerkraft, entfernen Medium, und wiederholen Sie bei Bedarf.
- Bereiten Sie die Enzymatische Gewebedissoziationslösung und die Stop-Lösung frisch vor.
- Enzymatische Gewebedissoziationslösung: 5 ml 0,05% Trypsin-EDTA, 2,5 ml Hank es Balanced Salt Solution (HBSS) calcium- und magnesiumfrei, 2,5 ml Collagenase IV-Stammlösung (2.000 U/ml in HBSS mit Calcium und Magnesium).
- Stop-Lösung: 5 ml Trypsin-Hemmer-Lösung, 5 ml DMEM/F12, 2 l 5.000 U/ml DNAse I (hergestellt in HBSS calcium- und magnesiumfrei).
- Entfernen Sie das Medium und fügen Sie der gehackten Tumorprobe eine Lösung für die Enzymatische Gewebedissoziation hinzu, wobei 2 ml für jedes 0,5 g Gewebe verwendet werden. Sanft durch Invertieren mischen.
- Inkubieren Sie das Gewebe in Lösung bei 37 °C in einem Gewebekultur-Inkubator unter Rotation für 30 min.
- Trituieren Sie mit einer 2 ml Pipette und stoppen Sie die Verdauung oder kehren Sie in den Inkubator für eine weitere 15-30 min Inkubation in Abhängigkeit vom Grad der Verdauung.
- Beenden Sie die Verdauung, indem Sie 2 Bände Stop Solution hinzufügen und mechanisch mit einer 5 ml serologischen Pipette trituieren.
- Filtern Sie das unverdaute Material durch ein 40-m-Zellsieb heraus. Pellet die Zellen bei 800 x g für 5 min bei Raumtemperatur, gefolgt von waschen 3x in 10 ml DMEM/F12.
- Das letzte Zellpellet in 5 ml DMEM/F12 wieder aufhängen.
- Die Zellsuspension über 5 ml Lympholyt-M und Pellet bei 1.300 x g für 20 min bei Raumtemperatur langsam schichten.
- Übertragen Sie die Schnittstellenschicht, die die nukleierten Zellen enthält, in eine 15 ml Tube mit 10 ml DMEM/F12.
- Pellet die Zellen bei 800 x g für 5 min bei Raumtemperatur. Wiederholen Sie die Wäsche mit DMEM/F12 2x mehr.
- Cryopreserve die resultierenden Einzelzellen für die weitere Verwendung durch Wiederaussetzung des Pellets in Recovery Cell Freezing Medium, Aliquoting in Kryovials, langsames Einfrieren, und Lagerung in flüssigem Stickstoff.
- Um Kultur zu sein, setzen Sie die Zellen in Neurosphere Medium, ergänzt mit Growth Factors (NMGF), und Platte mit relativ geringer Dichte (<1 x 105 Zellen/ml) in einem regelmäßigen T25 Gewebekulturkolben unter Standardbedingungen, 5%CO2, 37 °C, befeuchtete Gewebekultur Inkubator (Abbildung 1A).
- Bereiten Sie NMGF mit dem folgenden Rezept vor
Für 500 ml DMEM/F12 Lagerlösung Volumen Endkonzentration N2-Ergänzung (10x) 5 ml 1x 250 mg/ml BSA Stofflösung 1 ml 0,5 mg/ml 10 mg/ml Gentamicin-Reagenz 1,25 ml 25 g/ml 100x Antimykotik 2,5 ml 0,5x 100 mg/ml bFGF 0,1 ml 20 ng/ml 100 mg/ml EGF 0,1 ml 20 ng/ml
- Bereiten Sie NMGF mit dem folgenden Rezept vor
- Übertragen Sie Neurosphären, die sich über 1-3 Wochen bilden (Abbildungen 1B-E) auf frische Kolben, um sich von angeschlossenen Zellen und Ablagerungen zu trennen. Führen Sie alle 3-4 Tage teilweise Medienänderungen durch.
HINWEIS: Wenn orthotopische Xenograft-Tumormitn mit dem obigen Protokoll getrennt werden, können die Schritte 1.11-1.13 weggelassen werden.
2. Glioblastom Neurosphäre Kultur Pflege und Downstream Anwendungen
-
Dissoziation: Überwachen Sie die Neurosphärenkulturen und führen Sie alle 3-4 Tage partielle mittlere Veränderungen durch. Wenn die meisten mehrzelligen Neurosphären im Kolben einen Durchmesser von 100 m erreichen, lösen Sie sich in eine einzellige Suspension auf:
- Übertragen Sie das Medium, das die Neurosphären enthält, auf eine 15 ml-Röhre, Gravitationssediment der Neurosphären für ca. 5 min, entfernen Sie das Medium und setzen Sie das Zellpellet in 10 ml Calcium- und Magnesium-freien DPBS wieder auf.
- Mischen und inkubieren für 10 min bei Raumtemperatur, wie die Zellen Sediment durch Schwerkraft.
- Entfernen Sie 7-8 ml DPBS und dissoziieren Sie die Neurosphären mechanisch mit einer vorgewetteten serologischen Pipette.
- Pellet die dissoziierten Zellen bei 800 x g für 5 min bei 4 °C.
- Passaging: Setzen Sie die dissoziierten Zellen (Schritt 2.1.) in NMGF wieder aus und teilen Sie sie in die erforderliche Anzahl von Kolben (1:3) auf und inkubieren Sie sie unter Standardbedingungen. Sekundäre Neurosphären bilden sich und sollten anschließend für die Bildung tertiärer Sphären dissoziiert werden.
- Beurteilung der langfristigen Selbsterneuerung:Wiederholen Sie das Dissoziationsverfahren, bis die Neurosphärenkultur mindestens 10 Passagen erreicht, was einem Minimum von 2 Monaten in der Kultur entspricht.
-
Einfrieren: Um die Neurosphären kryokonservieren, die Neurosphären (Schritt 2.1.) zu dissoziieren und das Zellpellet in Recovery Cell Freezing Medium wieder auszusetzen, aliquot in Kryovials, langsames Einfrieren und in flüssigem Stickstoff lagern.
- Um Neurosphärenzellen aus einem gefrorenen Bestand zu kultitopfen: die Zellen bei 37 °C auftauen und sofort in eine 15 ml Tube mit 10 ml DMEM/F12 übertragen. Mischen Sie das Rohr sanft und drehen Sie die Zellen dann bei 800 x g für 5 min bei 4 °C. Waschen Sie das Zellpellet noch einmal und suspendieren Sie die Zellen in NMGF und übertragen Sie es in einen T25-Gewebekulturkolben.
-
Zellsuspension für intrakranielles Implantat in immungeschwächter Maus:
- Dissoziieren Sie die Neurosphären (Schritt 2.1.) und setzen Sie das Zellpellet in kalzium- und magnesiumfreien DPBS wieder auf. Zählen Sie lebensfähige Zellen mit einem Hämozytometer und Trypanblau-Ausschluss.
- Berechnen Sie die Anzahl der Zellen, die für das Implantat benötigt werden, in der Regel 3 x 105 Zellen/Maus, übertragen Sie die gewünschte Anzahl von Zellen in eine Durchstechflasche, und pellet die Zellen bei 1.000 x g.
- Setzen Sie das Zellpellet in einem für das Implantat geeigneten Volumen (5 l/Maus) wieder auf, indem Sie vorsichtig auf das Mikrozentrifugenrohr tippen. Legen Sie die Zellsuspension auf Eis und verwenden Sie sie innerhalb von 2 Stunden.
3. Alternatives Protokoll zur Kultivierung tumorigener Glioblastomzellen (für die Fälle, in denen die Neurosphärenkultur versagt)
- Ergänzen Sie das NMGF-Medium mit fetalem Rinderserum auf eine Endkonzentration von 2% FBS/NMGF.
- Beginnend mit Zellen in der NMGF-Kultur: Ernte lebensfähige Zellen aus dem NMGF-Kolben (Abbildung 1F), Resuspend in 2% FBS/NMGF und Platte mit relativ geringer Dichte (<1 x 105 Zellen/ml) in einem normalen T25-Gewebekulturkolben und Kultur unter Standardbedingungen, 5%CO2,37 °C, befeuchteter Gewebekultur-Inkubator (Abbildung 1G).
- Beginnend mit gefrorenen nie kultivierten Zellen (Schritt 1.14.): Die Zellen auftauen, in serumfreiem Medium waschen und in 2% FBS/NMGF und Kultur, wie in Schritt 3.2 beschrieben, waschen. Culturing in NMGF für 3 Tage vor der Übertragung lebensfähiger Zellen auf 2% FBS/NMGF ist eine Alternative zur Vorauswahl differenzierter Zellen.
4. Morphologische und molekulare Analyse von Neurosphären durch Immunhistochemie
- Kultur die Neurosphären, bis die meisten schwimmenden mehrzelligen Sphäroide erreichen 100 m Durchmesser.
- Entfernen Sie Kulturkolben aus dem Inkubator und pellet sofort die Neurosphären, entfernen Sie Medium und fügen Sie 10 ml DPBS, ohne das Pellet zu stören. DPBS entfernen, in 10% neutral gepuffertem Formalin wieder aufsetzen und 20 min bei Raumtemperatur brüten.
- Pellet die Sphäroide, resuspendieren in 30% Ethanol und inkubieren für 30-45 min.
- 30% Ethanol durch 50% Ethanol ersetzen, 15 min brüten und durch frisches 50% Ethanol ersetzen, weitere 30 min inkubieren.
- Wiederholen Sie (Schritt 4.4.) mit 70% Ethanol.
- Ersetzen Sie mit 95% Ethanol zwei Änderungen 10-20 min jeder, und wiederholen Sie mit absolutem Ethanol, bis Sphäroide hellweiß und kondensiert sind.
- Machen Sie einen kleinen Filterpapierkegel aus Linsenpapier und legen Sie ihn in einen kleinen Trichter in einem Becher. Befeuchten Sie das Linsenpapier mit absolutem Alkohol.
- Lösen Sie das Pellet leicht mit frischem 100% Ethanol, gießen Sie überschüssiges Ethanol ab und gießen Sie die Sphäroide durch den Linsenpapierkegel, um sicherzustellen, dass sie an die Spitze des Kegels gehen. Spülen Sie das Rohr mit zusätzlichem absolutem Ethanol und gießen Sie alle verbleibenden Sphäroide durch den Linsenpapierkegel.
- Entfernen Sie den Papierkegel aus dem Trichter und bewegen Sie die Sphäroide vorsichtig in den Boden des Kegels. Falten Sie das Papier in ein Quadrat und stellen Sie sicher, dass die Sphäroide so sicher wie möglich eingeschlossen sind.
- Übertragen Sie die verpackten Neurosphären auf eine Kassette und übertragen Sie sie auf einen automatischen Gewebeprozessor.
- Programmieren Sie den automatischen Gewebeprozessor wie folgt: absolutes Ethanol, 10 min, Xylol, 15 min (2x), Paraffin, 10 min (4x).
- Entfernen Sie die Kassette aus dem Prozessor und legen Sie sie auf den beheizten Teil eines Paraffin-Einbettsystems . Stellen Sie sicher, dass die gesamte Oberfläche frei von Fragmenten, Staub oder anderen Ablagerungen ist und saugen Sie alle Paraffin aus den Zangen wärmenden Brunnen. Reinigen Sie saubere Paraffinfreie Zangen und fügen Sie eine kleine Menge Paraffin zu einer erwärmten Basisform hinzu.
- Öffnen Sie die Kassette, entfernen Sie das Paket und legen Sie es auf den beheizten Teil des Einbettsystems. Öffnen Sie den Papierkegel vorsichtig, bis die Sphäroide sichtbar sind. So viel Material wie möglich mit vorgewärmten Zangen sammeln und in die flüssige Paraffin in der Grundform übertragen.
- Wiederholen Sie dies bei Bedarf, um so viele Sphäroide wie möglich abzurufen. Kratzen Sie das Tissuepapier vorsichtig mit einer vorgewärmten sauberen Rasierklinge, die mit Ethanol abgewischt wurde, um Restsphäride zu sammeln, ohne Papier in den Block zu bekommen.
- Brechen Sie vorsichtig alle Sphäroidklumpen mit warmen Zangen auf. Verschieben Sie die Sphäroide von den Ecken weg in eine gleichmäßige zentrale Schicht. Bewegen Sie die Basisform in den Kühlbereich, um die Sphäroide an Ort und Stelle zu sichern, fügen Sie die Kassette hinzu, füllen Sie sie langsam mit Paraffin und kühlen Sie gründlich ab.
- Der Neurosphären-Paraffinblock kann für normale Schnitte und Immunhistochemie verwendet werden.
Ergebnisse
Wir haben das oben beschriebene Protokoll auf die Trennung und Kultur 125 frische chirurgische Glioblastom-Proben (Abbildung 1), 88 neu diagnostizierte und 37 wiederkehrende Tumoren (Tabelle 2), mit genehmigter Patientenzustimmung und unter institutionellen Richtlinien angewendet. Die Effizienz des Protokolls zur Etablierung langfristiger Neurosphärenkulturen betrug 41,6 % und ähnlich bei neu diagnostizierten Tumoren und wiederkehrenden Tumoren (Tabelle 2). Für einige GBM-Proben bilden sich in den ersten Tagen Neurosphären (Abbildungen 1B und 1C), während für andere längere Kultivierungszeit erforderlich ist (Abbildungen 1D und 1E).
Die Effizienz der Neurosphärenbildung war nicht ausschließlich vom Grad der Nekrose im Gewebe abhängig, wie die Ergebnisse eines neu diagnostizierten Tumors mit hoher Zelldichte (GBM1) und einem rezidivierenden und nekrotischen Tumor (GBM2) zeigten, der nach den Protokollen 1 und 2 verarbeitet wurde und beide Neurosphärenkulturen nachlieferten (Abbildung 2).
Die Erprobung des tumorigen Potentials jeder Neurosphärenkultur bei immungeschwächten Mäusen ist die entscheidende Validierung dieses Ansatzes zur Anreicherung von CSCs. Unter Verwendung eines Protokolls ähnlich den zuvor beschriebenen18, GBM1und GBM2 Neurosphären wurden in das Gehirn von immungeschwächten Mäusen implantiert, unter institutionellen und IACUC Tierpflegerichtlinien. Die Xenograft-Tumoren zeigen morphologische Eigenschaften von GBMs, wie invasion in das Gehirn Parenchym und Nekrose (Abbildung 2).
GBM3 wurde dissoziiert (Abbildung 1A) und kultiviert in Neurosphärenmedium (Abbildungen 1D und 1E), und in 2% FBS/NMGF (Abbildungen 1D, 1G und 1H). Monolayer-Zellen, die in 2% FBS/NMGF und Neurosphärenzellen kultiviert wurden, wurden in NMGF gekultiviert und die gleiche Anzahl von Zellen wurden in die Nackte Maus implantiert, mit dem gleichen Verfahren wie in Abbildung 2. Zwischen den beiden Präimplantationskulturmethoden wurden keine Unterschiede in Überleben, Tumorwachstumsdynamik oder Morphologie beobachtet (Abbildungen 3A-C). Die Tumorwachstumseigenschaften ändern sich nicht bis zur letzten getesteten Passage, P20 für Neurosphären und P10 für 2% FBS/NMGF. Während neuronale Stammzellmarker, einschließlich Sox2, in den meisten primären GBM-Zellen, die in 10% FBS 3,4,11kultiviert sind, nach unten reguliert werden, ermöglicht NMGF, ergänzt durch 2% FBS, die Beibehaltung der Sox2-Expression (Abbildung 3D).
Neurosphären wurden gemäß Protokoll 4 verarbeitet und mit H&E (Abbildung 4A), Anti-Sox2-Antikörper, gekennzeichnet, die die Kernlokalisierung zeigen (Abbildung 4B), und EGFR-Antikörper, Zellmembranlokalisierung (Abbildung 4C). Dieses Protokoll wurde angewendet, um auf Reize abhängige Änderungen in der Expression von Nestin, GFAP und dem Proliferationsmarker Ki6711zuzugreifen.
Tabelle 2. Effizienz der Ableitung langfristiger selbsterneuernder Neurosphärenkulturen aus GBMs.
| Pathologie | N | Prozentsatz der Proben, die langfristige selbsterneuernde Neurosphären ergeben (n) |
| Glioblastom - unbehandelt, erste Operation | 88 | 42.0% (37) |
| Glioblastom - rezidivierend | 37 | 40.5% (15) |
| gesamt | 125 | 41.6% (52) |
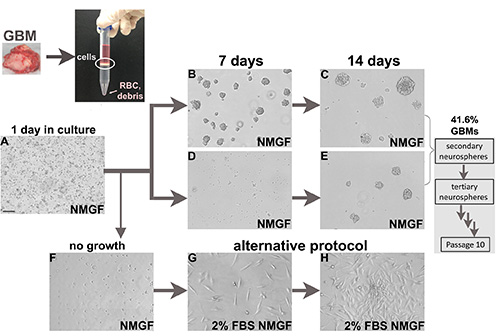
Abbildung 1. Zellkultur aus frischen Glioblastom chirurgischen Proben. Frische Tumoren werden enzymatisch in einzelne Zellen zerlegt. Die Nukleat-Zellschnittstelle aus dem Dichtetrennmedium wird dann in NMGF plattiert. Dissoziierte Neurosphären sind in NMGF plattiert, und in der Regel 1 Tag nach der Beschichtung gibt es tote Zellen, Trümmer, angehängte Einzelzellen und gelegentliche Teilen von Zellen in Suspension (A). Neurosphärenbildung ist in einigen Fällen schneller (B,C), und langsamer für andere (D,E). Alle Neurosphären sind dissoziiert und für mindestens 10 Passagen neu plattiert, 41,6% GBMs ergeben langfristige selbsterneuernde Neurosphären. Lebensfähige GBM-dissoziierte Zellen, die nicht wachsen, da Neurosphären (F) auf alternative Kulturbedingungen übertragen werden können, z. B. 2% FBS/NMGF (G,H). Bar (A), 100 m, gilt für alle Bilder. Klicken Sie hier, um ein größeres Bild anzuzeigen.
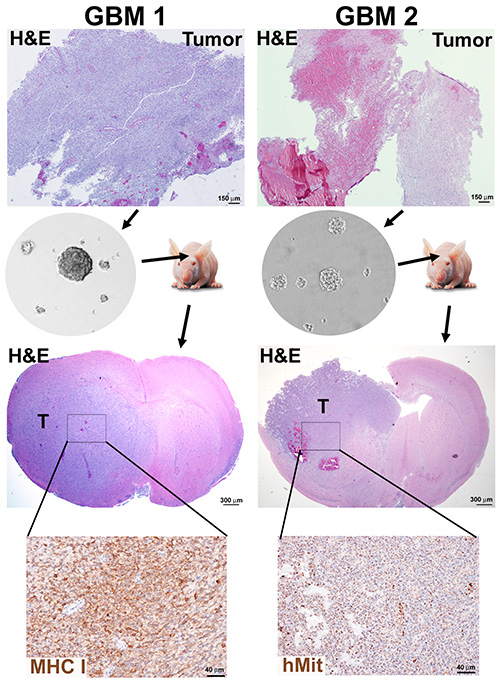
Abbildung 2. Neurosphären-Generierung und orthotopische Maus-Xenografts aus GBM-Tumoren. Eine Tumorprobe mit hoher Zelldichte (GBM1) und ein Tumor mit hohem nekrotischen Gehalt (GBM2) wurden dissoziiert und Neurosphären für 10 Passagen gemäß den Protokollen 1 und 2 kultiviert. Immungeschwächte Mäuse wurden mit 3 x 105 dissoziierten Neurosphärenzellen implantiert und bei Moribund geopfert. Mausgehirne wurden formalin fixiert und Paraffin für H&E-Färbung und Immunhistochemie-Detektion von menschlichen Markern, menschlichen Mitochondrien (hMit) oder der großen Histokompatibilitätsklasse I Untereinheit HLA-A (MHC-I) eingebettet. Klicken Sie hier, um ein größeres Bild anzuzeigen.
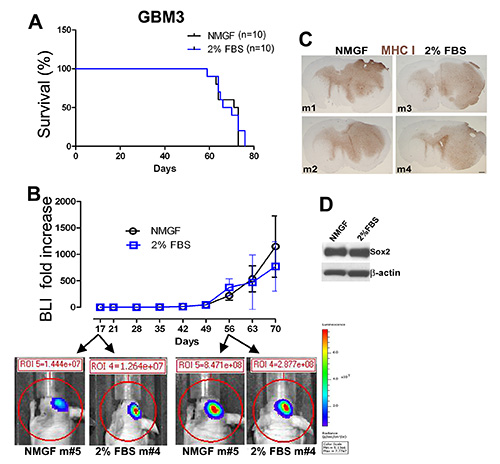
Abbildung 3. Ähnliches Tumorwachstum bei Mäusen, die intrakraniell mit GBM3-Zellen implantiert wurden, die als Neurosphären in NMGF oder als Monolayer in 2% FBS/NMGF kultiviertwurden. (A) Kaplan-Meier-Überlebenskurven für GBM3, die entweder als Neurosphären in NMGF oder monolayer in 2%FBS/NMGF (beide Passage <10) kultiviert werden, zeigen keinen Überlebensunterschied (n=10, p=0,7174, Log-Rank-Test). (B) Das durch live beobachtete Biolumineszenz-Bildgebung (BLI) zeigt keinen signifikanten Unterschied in der Tumorwachstumsdynamik zwischen den beiden Gruppen. (C) Tumormorphologie ist nicht zu unterscheiden für 4 GBM3 Xenografts, 2 kultiviert in NMGF und 2 kultiviert in 2% FBS/NMGF. MHC-I-Färbung wie in Abbildung 2beschrieben . Skala, 600 m. (D) Western Blot zeigt den Stammzellhersteller Sox2-Expression, die in 2% FBS/NMGF-Kulturen beibehalten wird, die zur Initiierung der Xenograft-Tumoren verwendet werden (A-C). Klicken Sie hier, um ein größeres Bild anzuzeigen.
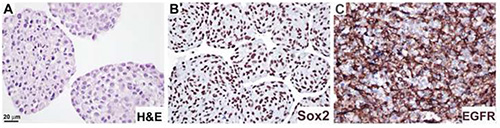
Abbildung 4. Analyse der Proteinexpression in Neurosphärenabschnitten durch Immunhistochemie. Neurosphärenkulturen wurden formalfixiert und Paraffin, wie in Verfahren 4 beschrieben, eingebettet und mit H&E (A), Anti-Sox2-Antikörper (B) und Anti-EGFR-Antikörper (C) gefärbt. DAB Substrat wurde verwendet, um zu visualisieren (B,C). Bar, 20 m. Klicken Sie hier, um ein größeres Bild anzuzeigen.
Diskussion
Die richtige enzymatische Tumorzelldissoziation ist ein kritischer Schritt in diesem Protokoll. Das Gewebe muss vor der Inkubation in der Zelldissoziationslösung bei 37 °C unter Rotation für mindestens 30 min gehackt werden, wenn das Gewebe mechanisch trituiert und die Verlängerung der Dissoziation überprüft werden muss. Je nach Grad des Gewebezusammenhalts kann die Inkubation um weitere 15-30 min verlängert werden, je nach Bedarf, um die Dissoziation in einzelne Zellen zu vervollständigen. Inkubation in Dissoziationslösung länger als 1 Stunde wird aufgrund der verminderten Zelllebensfähigkeit nicht empfohlen. Obwohl die optimale Menge an Startgewebe 200-500 mg beträgt, hat dieses Protokoll zu erfolgreichen Neurosphärenkulturen von nur 50 mg Tumorgewebe geführt.
Serumfreies NMGF ist ein selektives Medium, und ein Prozentsatz der neoplastischen Zellen, die den Großteil des Tumors sowie Wirtszellen umfassen, wird nicht überleben, während andere nach der Beschichtung an den mit der Gewebekultur behandelten Kolben anhaften. Es ist entscheidend, dass die Neurosphären, die sich über 1-3 Wochen bilden (Abbildungen 1B-E) auf frische Kolben übertragen werden, um sich von differenzierten Tumorzellen und Ablagerungen zu trennen.
GBM-Zellen enzymatisch dissoziiert und nie kultiviert (Schritt 1.10) können als Backup-Quelle von Zellen zur Kultur in alternativen Medien kryokonserviert werden, falls die Neurosphärenkultur versagt. Wir haben erfolgreich Neurosphärenkulturen aus solchen gefrorenen Beständen gewonnen, sowie Monolayer-Zellen, die in 2% FBS/NMGF wachsen.
Konzeptionell ist "Krebsstammzelle" eine Arbeit in Arbeit und dieses aufstrebende Feld wird von zusätzlichen Klärung profitieren, da die klinischen Implikationen erheblich sind, insbesondere bei der Erzeugung von Tumorheterogenität, Plastizität, und Resistenz gegen Therapie19,20. Die Neurosphärenkulturen sind nicht nur für die Erzeugung patientenspezifischer GBM-Tiermodelle von entscheidender Bedeutung, sondern auch für In-vitro-Studien wie die Veränderung der Zellsignalisierung und der Genexpression als Reaktion auf Wachstumsfaktoren, Hypoxie und pharmakologische Wirkstoffe11,21. Wir haben uns für die Verwendung von Querschnitten von formalin fixierten und paraffinintegrierten Neurosphären entschieden, um die 3D-Architektur zu erhalten, um die Proteinexpression und posttranslationale Modifikationen durch Immunhistochemie11zu untersuchen, aufgrund der überlegenen subzellulären Lokalisation in Bezug auf die häufigere Methode der Kennzeichnung und Abbildung der gesamten Sphäre.
Es hat sich gezeigt, dass nicht alle Zellen innerhalb von Neurosphären aus adulten Säugetiergehirn abgeleitet sind Stammzellen22. In ähnlicher Weise sind die Neurosphären, die von GBM-Tumoren kultiviert werden, wahrscheinlich nicht klonal, aufgrund der Anwesenheit von differenzierteren Krebsvorläuferzellen und Selbstaggregation, bekannt, bei hohen Zelldichten auftreten23, die eine Einschränkung dieser Methode von einigen betrachtet wird. Um die Anreicherung für langfristige, sich selbst erneuernde Stammzellen zu begünstigen, im Gegensatz zu nur Vorläufern, die vorübergehend als Neurosphären wachsen können22, werden die primären Neurosphären für die sekundäre Neurosphärenbildung dissoziiert und für mindestens 10 Passagen weitergeführt, was in etwa 2 Monaten in der kontinuierlichen Kultur entspricht, was ein Hinweis auf eine in Stammzellen angereicherte Populationist 22. Unserer Erfahrung nach können GBM-Neurosphärenkulturen, die diese Marke erreichen, auf unbestimmte Zeit als Neurosphären erweitert werden. Tumor-Grade ist wichtig, da wir erfolgreiche Kulturen von GBMs und anaplastischen Astrozytomen, WHO-Grad IV bzw. III, aber nicht von niedrigeren Gliomen erhalten haben.
Die am weitesten verbreitete Methode zur Kultivierung von Glioblastomzellen, in traditionellen Wachstumsmedium mit 10% FBS ergänzt, führt zu erheblichen genomischen und phänotypischen Divergenz von den ursprünglichen Tumoren 4. Auf der anderen Seite sind Neurosphärenkulturen eine stabile und langfristige Quelle von Zellen, die Krebsstammzellphänotyp4präsentieren. Die Neurosphärenmethode ist für die Anreicherung von CSC in Langzeitkulturen für orthotopische Maus-Xenograft-Modelle immer beliebter geworden, obwohl sie nicht für alle hochwertigen Astrozytomproben erfolgreich ist, was die Hauptschwäche dieser Methode darstellt. Studien, um zu verstehen, wie molekulare Eigenschaften der elterlichen Tumoren die Bildung der Neurosphäre beeinflussen können, sind im Gange. Die Erforschung praktischer alternativer Methoden zu kulturhochwertigen Gliomen, gefolgt von einer umfassenden Validierung, wird angesichts der bedeutsamen Vorteile patientenspezifischer GBM-Modelle gewährt, während wir in eine Ära der personalisierten Medizin vordringen, die durch die Zugänglichkeit von "omics"-Informationen und eine erhöhte Anzahl potenzieller gezielter Therapien angetrieben wird.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde vom Hermelin Brain Tumor Center, Henry Ford Hospital, finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11330-032 | |
| Trypsin - EDTA 0.05% | Life Technologies | 25300-054 | |
| Hank’s Balanced Salt Solution, calcium- and magnesium-free | Life Technologies | 14170-120 | |
| Hank’s Balanced Salt Solution, with calcium and magnesium | Life Technologies | 24020-117 | |
| Collagenase Type 4 | Worthington | 5004188 | |
| Trypsin Inhibitor | Sigma | T7659 | |
| DNase I | Sigma | D4527 | |
| N2 Supplement (100x) | Life Technologies | 17502-048 | |
| Albumin from Bovine Serum, cell culture grade | Sigma | A4919 | |
| Gentamicin Reagent Solution | Life Technologies | 15710-064 | |
| Antibiotic/Antimycotic | Life Technologies | 15240-062 | |
| Recombinant Human FGF-basic | PeproTech | 100-18B | |
| Recombinant Human EGF | PeproTech | AF-100-15 | |
| Lympholyte-Mouse | Cedarlane Laboratories Ltd. | CL5031 | |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Sterile Cell Strainer, 40 μm | Fisher | 22363547 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS), no calcium and no magnesium | Life Technologies | 14190-144 | |
| Fetal bovine serum | Life Technologies | 26140-079 | |
| Trypan Blue Stain, 0.4% | Life Technologies | 15250-061 | |
| Neutral Buffered Formalin | Protocol | 245-684 | |
| Histoplex Tissue Cassettes | Thermo Scientific | 22-146-426 | |
| Rotator | Miltenyi BioTec | 130-090-753 | |
| GlutaMAX Supplement | Life Technologies | 35050-061 | |
| KnockOut D-MEM/F12 | Life Technologies | 12660-012 | |
| Stem Pro Neural Supplement | Life Technologies | A1058-01 |
Referenzen
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821-5828 (2003).
- Ignatova, T. N., et al. Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro. Glia. 39, 193-206 (2002).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756-760 (2006).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Beier, D., et al. CD133(+) and CD133(-) glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles. Cancer Res. 67, 4010-4015 (2007).
- Joo, K. M., et al. Clinical and biological implications of CD133-positive and CD133-negative cells in glioblastomas. Lab. Invest. 88, 808-815 (2008).
- Son, M. J., Woolard, K., Nam, D. H., Lee, J., Fine, H. A. SSEA-1 is an enrichment marker for tumor-initiating cells in human glioblastoma. Cell Stem cell. 4, 440-452 (2009).
- deCarvalho, A. C., et al. Gliosarcoma stem cells undergo glial and mesenchymal differentiation in vivo. Stem Cells. 28, 181-190 (2010).
- Azari, H., et al. Isolation and expansion of human glioblastoma multiforme tumor cells using the neurosphere assay. J. Vis. Exp. , (2011).
- Laks, D. R., et al. Neurosphere Formation Is an Independent Predictor of Clinical Outcome in Malignant Glioma. Stem Cells. 27, 980-987 (2009).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nat. Rev. Cancer. 6, 425-436 (2006).
- Gunther, H. S., et al. Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27 (20), 2897-2909 (2007).
- Fael Al-Mayhani, T. M., et al. An efficient method for derivation and propagation of glioblastoma cell lines that conserves the molecular profile of their original tumours. J. Neurosci. Methods. 176, 192-199 (2009).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem cell. 4, 568-580 (2009).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), (2010).
- Leder, K., Holland, E. C., Michor, F. The therapeutic implications of plasticity of the cancer stem cell phenotype. PLoS One. 5, (2010).
- Pietras, A. Cancer stem cells in tumor heterogeneity. Adv. Cancer Res. 112, 255-281 (2011).
- Lomonaco, S. L., et al. The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells. Int. J. Cancer. 125, 717-722 (2009).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres--re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten