Method Article
Optimisation de la culture cellulaire de gliome de haut grade à partir d’échantillons chirurgicaux pour une utilisation dans des modèles animaux cliniquement pertinents et l’immunochimie 3D
Dans cet article
Résumé
Protocole pour la propagation des spécimens chirurgicaux à haute teneur dissociés de gliome dans le milieu sans sérum de neurosphère pour sélectionner pour des cellules avec le phénotype de cellules souches cancéreuses. Pour les spécimens qui ne se développent pas en tant que neurosphères, un protocole alternatif est suggéré. Une technique de incorporation de paraffine pour maintenir l’architecture 3D de neurosphère pour immunocytochemistry est décrite.
Résumé
Les glioblastomes, la forme la plus commune et la plus agressive d’astrocytoma, sont réfractaires à la thérapie, et moléculairement hétérogènes. La capacité d’établir des cultures cellulaires qui préservent le profil génomique des tumeurs parentales, pour une utilisation dans des modèles in vitro et in vivo spécifiques aux patients, a le potentiel de révolutionner le développement préclinique de nouveaux traitements pour le glioblastome adaptés aux caractéristiques moléculaires de chaque tumeur.
En commençant par des tumeurs fraîches d’astrocytome de haut grade dissociées en cellules simples, nous utilisons l’analyse de neurosphère comme méthode d’enrichissement pour les cellules présentant le phénotype de cellule souche cancéreuse, y compris l’expression des marqueurs neuronaux de cellules souches, l’auto-renouvellement à long terme in vitro,et la capacité de former des tumeurs orthotopiques de xénogreffe. Cette méthode a déjà été proposée et est maintenant utilisée par plusieurs chercheurs. Basé sur notre expérience de dissocier et de cultiver 125 spécimens de glioblastoma, nous sommes arrivés au protocole détaillé que nous présentons ici, approprié pour la culture courante de neurosphère des astrocytomas à haute teneur et l’expansion à grande échelle des cellules tumorigènes pour des études précliniques. Nous rendons compte de l’efficacité des cultures à long terme réussies utilisant ce protocole et proposons des alternatives abordables pour la culture des cellules dissociées de glioblastoma qui ne se développent pas comme neurosphères. Nous décrivons également en détail un protocole pour préserver l’architecture 3D des neurosphères pour immunohistochemistry. Les cultures cellulaires enrichies en CSC, capables de générer des modèles de xénogreffe orthotopique qui préservent les signatures moléculaires et l’hétérogénéité des GBM, deviennent de plus en plus populaires pour l’étude de la biologie des GBM et pour l’amélioration de la conception des tests précliniques des thérapies potentielles.
Introduction
Le glioblastome (GBM), un astrocytome de grade IV de l’OMS, est la tumeur cérébrale primaire la plus répandue et la plus agressive. Divers phénotypes développementaux sont adoptés par les cellules tumorales GBM, y compris les cellules présentant des caractéristiques de « cellules souches cancéreuses » (CSC), telles que l’expression des marqueurs de cellules souches neurales (NSC), l’auto-renouvellement à long terme et le potentiel de donner naissance à des cellules plus différenciées exprimant des marqueurs astrocytaires et formant la majeure partie de la tumeur1-3. Bien que des éclaircissements soient encore nécessaires concernant l’identité moléculaire et les implications cliniques du CSC, le présent travail est axé sur la définition opérationnelle du CSC : l’auto-renouvellement à long terme in vitro et la capacité de différencier et de reproduire la tumeur originale lors de l’implantation orthotopique chez les rongeurs immunodéprimés.
Les cellules de glioblastome ont été cultivées pendant des décennies dans un milieu traditionnel contenant 10% de sérum fœtal bovin (FBS) et plusieurs lignées cellulaires gbm cultivées en sérum à passage élevé disponibles dans le commerce sont tumorigènes chez les rongeurs immunodéprimés, mais il existe une divergence génomique et moléculaire considérable par rapport à la tumeur originale4,limitant leur utilisation en tant que modèles cliniquement pertinents. Plus récemment, des cellules dont le phénotype souche/progéniteur répondait à l’EGF et au bFGF ont été identifiées dans des GBM2. Par la suite, des échantillons dissociés de tumeur GBM ont été cultivés dans un milieu sans sérum3,formulé à l’origine pour la sélection et l’expansion des cellules souches neurales du cerveau des mammifères adultes5. Ces conditions de culture entravent la croissance de la plupart des populations de cellules tumorales non néoplasiques et plus différenciées, tout en favorisant la croissance des cellules souches et progénitrices sous forme de sphéroïdes multicellulaires flottants, ou neurosphères3,imitant le comportement des cellules souches neurales de mammifères adultes5. La comparaison côte à côte complète des cellules primaires de GBM cultivées dans le milieu de neurosphère complété avec des facteurs de croissance (NMGF) ou dans le milieu de croissance traditionnel complété avec 10% FBS, a indiqué que les neurosphères de GBM étaient tumorigènes, a présenté le potentiel de différenciation de multilineage, et a préservé le génotype de la tumeur originale, contrairement aux cultures de 10% de FBS qui n’étaient pas tumorigènes aux bas passages et considérablement divergé des tumeurs originales aux passages tardifs4.
L’isolement du CSC des tumeurs dissociées de GBM par tri cellulaire basé sur l’expression du marqueur csc putatif CD133 a également été proposé6,7,mais d’autres travaux ont indiqué que le phénotype csc n’est pas définitivement associé à l’expression de tels marqueurs8-10,diminuant l’enthousiasme initial pour cette stratégie, tandis que de nouveaux marqueurs sont encore en cours de test10. L’indisponibilité à ce jour d’un ensemble validé de marqueurs définissant le CSC, ainsi que l’objectif d’amplification à grande échelle de ces cellules pour les études précliniques, rend l’utilisation du tri cellulaire peu pratique pour les cultures de routine enrichies de CSC. Les cellules GBM sélectionnées par la capacité de se développer sous forme de neurosphères dans NMGF expriment invariablement des marqueurs de cellules souches neurales. Nous avons observé que Sox2 et la nestine sont omniprésentes dans les cultures de la neurosphère, tandis que la protéine CD133 est présente dans un sous-ensemble des neurosphères GBM (données inédites et référence11).
Plusieurs laboratoires poursuivent des cultures de neurosphère à partir de tumeurs de glioblastome en utilisant la même approche générale de dissociation enzymatique et de culture dans un milieu sans sérum complété par des facteurs de croissance3,4,11-14,tandis que d’autres collègues ont signalé des tentatives de culture de neurosphère à long terme à partir d’échantillons de GBM sans succès. La méthode générale pour la dissociation enzymatique et la culture de neurosphère des gliomes de haut grade présentée ici est semblable à ce qui a été décrit dans les publications ci-dessus. Nous avons optimisé le protocole en fonction de notre expérience de dissociation et de culture de plus de 100 échantillons GBM. L’efficacité de l’obtention de cultures neurosphères à long terme à partir d’échantillons frais de GBM appliquant le protocole présenté ici est supérieure à 40%, similaire aux quelques rapports montrant des données d’efficacité3,15,conduisant à l’exploration de protocoles alternatifs tels que la culture de cellules continuellement ou par intermittence en milieu sans sérum en présence d’EGF et de bFGF en tant que monocouches sur des surfaces recouvertes de protéine ECM16,17. Les cultures de neurosphère sont toujours l’approche la plus validée et de plus en plus populaire pour préserver les caractéristiques moléculaires des tumeurs GBM et le potentiel tumorigène3,4,11-14,donc notre approche est de tenter d’abord des cultures de neurosphères, tout en testant simultanément des méthodes alternatives pour la culture des cellules GBM qui ne parviennent pas à former des neurosphères autorenouvatrices à long terme ( Figure1), pour augmenter la représentation des tumeurs GBM qui peuvent être utilisées dans des modèles animaux. Nous présentons ici un protocole pour la culture des neurosphères des GBM. Pour les cellules qui ne parviennent pas à former des neurosphères, nous montrons une modification simple dans le milieu de croissance, comme la première tentative de culture de cellules tumorigènes à partir de SGB nonneurosphere formant, avec des résultats prometteurs et subissant encore une validation approfondie.
Protocole
1. Suspension unicellulaire d’un échantillon de glioblastome chirurgical frais pour la culture de la neurosphère
- Avec le consentement écrit des patients et conformément aux directives de l’établissement, prélever des échantillons de tumeurs pour la culture cellulaire immédiatement après la chirurgie de résection du gliome de haut grade.
- Confirmer le diagnostic de l’échantillon de tumeur par l’histopathologie. Transporter immédiatement l’échantillon de la salle d’opération à la hotte de culture de tissu à flux laminaire, pour le traitement dans les 1 heure suivant la chirurgie.
REMARQUE: Pour les chirurgies sur un site éloigné, couper l’échantillon de tumeur en fragments plus petits et placer dans un tube contenant du DMEM / F12 (garder sur la glace). La tumeur peut être traitée plusieurs heures après la chirurgie. - En commençant par 200-500 mg de tissu (optimal), hachez l’échantillon de tumeur à l’aide d’une lame de scalpel et transférez-le dans un tube de 15 ml contenant 10 ml de milieu sans sérum DMEM / F12. Mélanger en inversant plusieurs fois, laisser les morceaux tumoraux sédimenter par gravité, enlever le milieu et répéter si nécessaire.
- Préparez la solution de dissociation tissulaire enzymatique et arrêtez la solution fraîche.
- Solution de dissociation tissulaire enzymatique : 5 ml 0,05 % de trypsine-EDTA, 2,5 ml de solution saline équilibrée de Hank (HBSS) sans calcium et sans magnésium, 2,5 ml de solution mère de collagénase IV (2 000 U/ml dans du HBSS avec du calcium et du magnésium).
- Solution d’arrêt : 5 ml de solution d’inhibiteur de trypsine, 5 ml de DMEM/F12, 2 μl de 5 000 U/ml de DNAse I (fabriquée dans hbss sans calcium et sans magnésium).
- Retirer le milieu et ajouter la solution de dissociation tissulaire enzymatique à l’échantillon de tumeur haché, en utilisant 2 ml pour chaque tissu de 0,5 g. Mélanger doucement en inversant.
- Incuber le tissu en solution à 37 °C dans un incubateur de culture tissulaire en rotation pendant 30 min.
- Triturer avec une pipette de 2 ml et arrêter la digestion ou retourner à l’incubateur pour une autre incubation de 15 à 30 minutes en fonction du niveau de digestion.
- Arrêtez la digestion en ajoutant 2 volumes de Stop Solution et triturez mécaniquement avec une pipette sérologique de 5 ml.
- Filtrer le matériau non digéré à travers une passoire cellulaire de 40 μm. Granulé les cellules à 800 x g pendant 5 min à température ambiante, suivi d’un lavage 3x dans 10 ml de DMEM/F12.
- Ressusciter le culot cellulaire final dans 5 ml de DMEM/F12.
- Couchez lentement la suspension cellulaire sur 5 ml de Lympholyte-M et de granulés à 1 300 x g pendant 20 min à température ambiante.
- Transférer la couche d’interface contenant les cellules nucléées dans un tube de 15 ml contenant 10 ml de DMEM/F12.
- Granuler les cellules à 800 x g pendant 5 min à température ambiante. Répétez le lavage avec DMEM / F12 2x plus.
- Cryoconserver les cellules individuelles résultantes pour une utilisation ultérieure en remettant la pastille dans le milieu de congélation des cellules de récupération, en aliquote dans les cryovials, en lente et en stockant dans de l’azote liquide.
- Pour la culture, ressusciter les cellules dans le milieu neurosphère complété par des facteurs de croissance (NMGF), et plaque à densité relativement faible (<1 x 105 cellules/ml) dans une fiole de culture tissulaire T25 régulière dans des conditions standard, 5%co2,37 °C, incubateur de culture tissulaire humidifié(Figure 1A).
- Préparez NMGF en utilisant la recette suivante
Pour 500 ml de DMEM/F12 Solution mère volume concentration finale Supplément de N2 (10x) 5 ml 1x 250 mg/ml de solution mère de BSA 1 ml 0,5 mg/ml 10 mg/ml de réactif de gentamicine 1,25 ml 25 μg/ml 100x antibiotique/antimycotique 2,5 ml 0,5 x 100 mg/ml de bFGF 0,1 ml 20 ng/ml 100 mg/ml d’EGF 0,1 ml 20 ng/ml
- Préparez NMGF en utilisant la recette suivante
- Transférer les neurosphères qui se forment sur une 1 à 3 semaines (figures 1B-E) dans des flacons frais, afin de les séparer des cellules et des débris attachés. Effectuez des modifications partielles du média tous les 3-4 jours.
REMARQUE: Si dissociant la tumeur orthotopic de xénogreffe utilisant le protocole ci-dessus, les étapes 1.11-1.13 peuvent être omises.
2. Maintien de la culture neurosphère du glioblastome et applications en aval
-
Dissociation: Surveiller les cultures de la neurosphère et effectuer des changements partiels du milieu tous les 3-4 jours. Lorsque la plupart des neurosphères multicellulaires dans le ballon atteignent 100 μm de diamètre, dissociez-les en une seule suspension cellulaire:
- Transférer le milieu contenant les neurosphères dans un tube de 15 ml, sédimenter par gravité les neurosphères pendant environ 5 min, retirer le milieu et ressusciter le culot cellulaire dans 10 ml de DPBS sans calcium et magnésium.
- Mélanger et incuber pendant 10 min à température ambiante, car les cellules sédimentent par gravité.
- Retirer 7-8 ml de DPBS puis dissocier mécaniquement les neurosphères avec une pipette sérologique préwetted.
- Granuler les cellules dissociées à 800 x g pendant 5 min à 4 °C.
- Passaging: Remettre en suspension les cellules dissociées (étape 2.1.) dans le NMGF et les diviser en nombre nécessaire de fioles (1:3), et incuber dans des conditions standard. Des neurosphères secondaires se formeront et devraient ensuite être dissociées pour la formation de sphères tertiaires.
- Évaluation de l’auto-renouvellement à long terme: Répétez la procédure de dissociation jusqu’à ce que la culture neurosphère atteigne au moins 10 passages, soit l’équivalent d’un minimum de 2 mois en culture.
-
Congélation: Pour cryoconserver les neurosphères, dissocier les neurosphères (étape 2.1.) et remettre en suspension le culot cellulaire dans le milieu de congélation des cellules de récupération, aliquote dans les cryovials, gel lent et stockage dans de l’azote liquide.
- Pour faire la culture de cellules neurosphères à partir d’un stock congelé : décongeler les cellules à 37 °C et les transférer immédiatement dans un tube de 15 ml contenant 10 ml de DMEM/F12. Mélanger doucement le tube, puis faire tourner les cellules à 800 x g pendant 5 min à 4 °C. Laver le culot cellulaire une fois de plus et ressusciter les cellules dans NMGF et les transférer dans une fiole de culture tissulaire T25.
-
Suspension cellulaire pour implant intracrânien chez une souris immunodéprimée:
- Dissociez les neurosphères (étape 2.1.) et ressuscitez la pastille cellulaire dans le DPBS sans calcium et sans magnésium. Comptez les cellules viables à l’aide d’un hémocytomètre et d’une exclusion bleue trypan.
- Calculer le nombre de cellules nécessaires pour l’implant, généralement 3 x 105 cellules/souris, transférer le nombre souhaité de cellules dans un flacon et granuler les cellules à 1 000 x g.
- Remettez en suspension la pastille cellulaire dans un volume approprié pour l’implant (5 μl/souris) en tapotant doucement le tube de microcentrifugation. Placez la suspension cellulaire sur de la glace et utilisez-la dans les 2 heures.
3. Protocole alternatif pour la culture de cellules de glioblastome tumorigène (pour les cas où la culture de la neurosphère échoue)
- Compléter le milieu NMGF avec du sérum bovin fœtal à une concentration finale de 2% FBS/NMGF.
- En commençant par les cellules en culture NMGF: Récolter des cellules viables dans la fiole NMGF(figure 1F),les ressusciter dans 2% FBS/NMGF et la plaque à une densité relativement faible (<1 x 105 cellules/ml) dans une fiole de culture tissulaire T25 régulière, et la culture dans des conditions standard, 5%CO2,37 °C, incubateur de culture tissulaire humidifié(figure 1G).
- En commençant par des cellules congelées jamais cultivées (étape 1.14.) : Décongeler les cellules, laver en milieu sans sérum et en plaque à 2 % fbs/nmgf et culture comme décrit à l’étape 3.2. La culture dans NMGF pendant 3 jours avant de transférer des cellules viables à 2% FBS / NMGF est une alternative pour présélectionner les cellules différenciées.
4. Analyse morphologique et moléculaire des neurosphères par immunohistochimie
- Culturez les neurosphères jusqu’à ce que la plupart des sphéroïdes multicellulaires flottants atteignent 100 μm de diamètre.
- Retirer les fioles de culture de l’incubateur et granuler immédiatement les neurosphères, enlever le milieu et ajouter 10 ml de DPBS sans perturber le culot. Retirer le DPBS, ressusciter dans 10% de forcine tamponnée neutre et incuber pendant 20 min à température ambiante.
- Granuler les sphéroïdes, ressusciter dans de l’éthanol à 30% et incuber pendant 30-45 min.
- Remplacer l’éthanol à 30 % par de l’éthanol à 50 %, incuber pendant 15 min et remplacer par de l’éthanol frais à 50 %, incuber 30 min supplémentaires.
- Répéter (étape 4.4.) avec de l’éthanol à 70 %.
- Remplacer par de l’éthanol à 95% deux changements de 10 à 20 minutes chacun, et répéter avec de l’éthanol absolu jusqu’à ce que les sphéroïdes soient blanc vif et condensés.
- Faites un petit cône de papier filtre en papier de lentille et placez-le dans un petit entonnoir dans un bécher. Mouiller le papier de lentille avec de l’alcool absolu.
- Desserrez légèrement le culot avec de l’éthanol frais à 100%, versez l’excès d’éthanol et versez les sphéroïdes à travers le cône de papier de la lentille, en vous assurant qu’ils vont à l’extrémité du cône. Rincez le tube avec de l’éthanol absolu supplémentaire et versez tous les sphéroïdes restants à travers le cône de papier de la lentille.
- Retirez le cône de papier de l’entonnoir et déplacez soigneusement les sphéroïdes dans le fond du cône. Pliez le papier dans un carré et assurez-vous que les sphéroïdes sont aussi bien fermés que possible.
- Transférer les neurosphères emballées sur une cassette et transférer vers un processeur de tissus automatique.
- Programmez le processeur automatique de tissu comme suit: éthanol absolu, 10 min, xylène, 15 min (2x), paraffine, 10 min (4x).
- Retirez la cassette du processeur et placez-la sur la partie chauffée d’un système d’encastrement de paraffine. Assurez-vous que toute la surface est exempte de fragments, de poussière ou d’autres débris et siphonnez toute la paraffine des puits de réchauffement des pinces. Réchauffez les pinces sans paraffine et ajoutez une petite quantité de paraffine à un moule de base chauffé.
- Ouvrez la cassette, retirez-la et placez-la sur la partie chauffée du système d’intégration. Ouvrez soigneusement le cône de papier jusqu’à ce que les sphéroïdes soient visibles. Rassemblez autant de matériau que possible avec des pinces pré-indemnes et transférez-la dans la paraffine liquide dans le moule de base.
- Répétez l’opération si nécessaire pour récupérer autant d’asphéroïdes que possible. Grattez doucement le papier de soie avec une lame de rasoir propre et pré-nauséagée qui a été essuyée avec de l’éthanol pour recueillir les sphéroïdes résiduels sans entrer de papier dans le bloc.
- Brisez soigneusement les touffes sphéroïdes avec des pinces chaudes. Éloignez les sphéroïdes des coins dans un calque central uniforme. Déplacez le moule de base vers la zone de refroidissement pour fixer les sphéroïdes en place, ajoutez la cassette, remplissez lentement avec de la paraffine et refroidissez bien.
- Le bloc de paraffine de neurosphère peut être employé pour la section normale et immunohistochemistry.
Résultats
Nous avons appliqué le protocole décrit ci-dessus pour dissocier et faire la culture de 125 échantillons frais de glioblastome chirurgical(figure 1),de 88 tumeurs nouvellement diagnostiquées et de 37 tumeurs récurrentes(tableau 2),avec le consentement approuvé du patient et selon les lignes directrices de l’établissement. L’efficacité du protocole pour établir des cultures de neurosphère à long terme était de 41,6%, et similaire pour les tumeurs nouvellement diagnostiquées et les tumeurs récurrentes(tableau 2). Pour certains échantillons de GBM, des neurosphères se forment dans les premiers jours(figures 1B et 1C),tandis que pour d’autres, un temps de culture plus long est nécessaire(figures 1D et 1E).
L’efficacité de la formation de la neurosphère ne dépendait pas exclusivement du niveau de nécrose dans le tissu, comme en témoignent les résultats d’une tumeur nouvellement diagnostiquée à haute densité cellulaire (GBM1) et d’une tumeur récurrente et nécrotique (GBM2) traitée selon les protocoles 1 et 2, les deux produisant des cultures de neurosphère(figure 2).
Tester le potentiel tumorigène de chaque culture neurosphère chez des souris immunodéprimées est la validation cruciale de cette approche pour l’enrichissement des CSC. En utilisant un protocole similaire à celui décrit précédemment18,les neurosphères GBM1 et GBM2 ont été implantées dans le cerveau de souris immunodéprimées, conformément aux lignes directrices en matière de soins aux animaux de l’IACUC et de l’IACUC. Les tumeurs de xénogreffe présentent des caractéristiques morphologiques des GBM, telles que l’invasion dans le parenchyme cérébral et la nécrose (Figure 2).
Gbm3 a été dissocié(Figure 1A)et cultivé dans un milieu neurosphère(figures 1D et 1E),et dans 2% FBS/NMGF(Figures 1D, 1G et 1H). Les cellules monocouches cultivées dans 2% fbs/nmgf et les cellules neurosphère cultivées dans NMGF ont été dissociées et le même nombre de cellules ont été implantées chez la souris nue, en utilisant la même procédure que sur la figure 2. Aucune différence dans la survie, la dynamique de croissance tumorale ou la morphologie n’a été observée entre les deux méthodes de culture préimplantes(figures 3A-C). Les caractéristiques de croissance de tumeur ne changent pas jusqu’au dernier passage examiné, P20 pour des neurosphères, et P10 pour 2% FBS/NMGF. Alors que les marqueurs de cellules souches neurales, y compris Sox2, sont régulés à la baisse dans la plupart des cellules GBM primaires cultivées dans 10% FBS 3,4,11,NMGF complété par 2% FBS permet la rétention de l’expression Sox2 (Figure 3D).
Les neurosphères ont été traitées conformément au Protocole 4, et étiquetées avec H&E(figure 4A),anticorps anti-Sox2, montrant la localisation nucléaire(figure 4B),et anticorps EGFR, localisation de la membrane cellulaire(figure 4C). Ce protocole a été appliqué pour accéder aux altérations stimuli-dépendantes de l’expression du nestin, du GFAP, et du marqueur de prolifération Ki6711.
Tableau 2. Efficacité de la dérivation de cultures neurosphères auto-renouvelées à long terme à partir de GBM.
| Pathologie | N | Pourcentage d’échantillons produisant des neurosphères auto-renouvelées à long terme (n) |
| Glioblastome - non traité, première chirurgie | 88 | 42.0% (37) |
| Glioblastome - récidive | 37 | 40.5% (15) |
| total | 125 | 41.6% (52) |
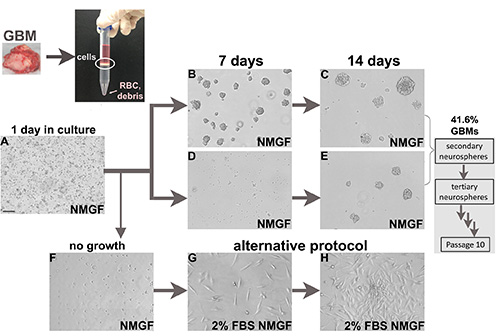
Figure 1. Culture cellulaire à partir d’échantillons chirurgicaux de glioblastome frais. Les tumeurs fraîches sont enzymatiquement dissociées en cellules simples. L’interface cellulaire nucléée à partir du milieu de séparation de densité est ensuite plaquée en NMGF. Les neurosphères dissociées sont plaquées en NMGF, et généralement 1 jour après le placage, il y a des cellules mortes, des débris, des cellules individuelles attachées et des cellules de division occasionnelles en suspension(A). La formation de la neurosphère est plus rapide dans certains cas(B,C),et plus lente pour d’autres(D,E). Toutes les neurosphères sont dissociées et replaquées pendant au moins 10 passages, 41,6% des GBM produisent des neurosphères auto-renouvelées à long terme. Les cellules dissociées de GBM viables qui ne parviennent pas à se développer sous forme de neurosphères(F)peuvent être transférées vers des conditions de culture alternatives, par exemple 2% FBS / NMGF (G, H). Bar(A),100 μm, s’applique à toutes les images. Cliquez ici pour agrandir l’image.
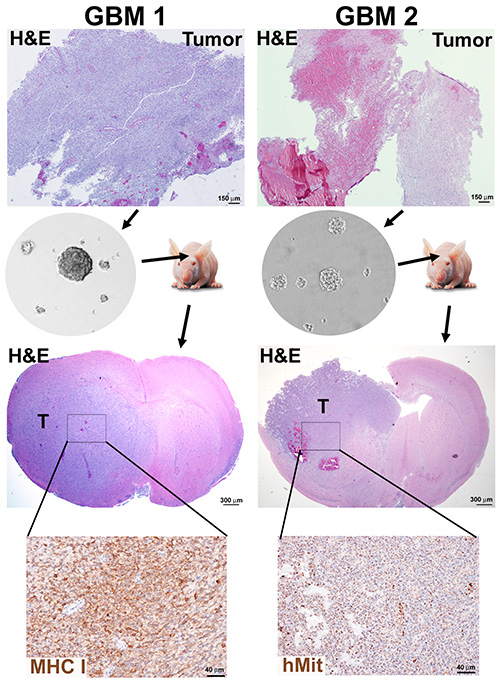
Figure 2. Génération de Neurosphere et xénogreffes orthotopic de souris des tumeurs de GBM. Un échantillon de tumeur présentant la densité élevée de cellules (GBM1) et une tumeur avec le contenu nécrotique élevé (GBM2) ont été dissociés et neurospheres cultivés pour 10 passages selon les protocoles 1 et 2. Des souris immunodéprimées ont été implantées avec 3 x 105 cellules de neurosphère dissociées et sacrifiées lorsqu’elles étaient moribondes. Des cerveaux de souris ont été forcéine fixes et paraffine incorporés pour la souillure de H&E et la détection immunohistochemistry des marqueurs humains, des mitochondries humaines (hMit) ou de la sous-unité principale HLA-A de la classe I d’histocompatibilité (MHC-I). Cliquez ici pour agrandir l’image.
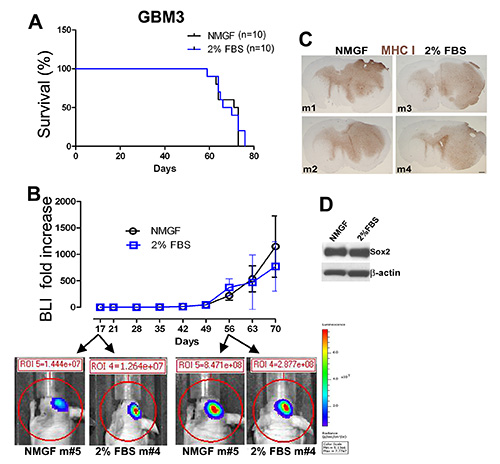
Figure 3. Croissance tumorale similaire chez les souris implantées intracrâniennement avec des cellules GBM3 cultivées sous forme de neurosphères dans NMGF ou sous forme de monocouches dans 2% FBS / NMGF. (A) Les courbes de survie de Kaplan-Meier pour GBM3 cultivé sous forme de neurosphères dans NMGF ou de monocouches dans 2% FBS/NMGF (passage <10) ne montrent aucune différence de survie (n= 10, p = 0,7174, test log-rank). (B) La croissance tumorale surveillée par imagerie par bioluminescence vivante (BLI) ne montre aucune différence significative dans la dynamique de croissance tumorale entre les deux groupes. (C) La morphologie tumorale est indiscernable pour 4 xénogreffes GBM3, 2 cultivées en NMGF et 2 cultivées dans 2% FBS/NMGF. Coloration du CMH-I décrite sur la figure 2. Écaille, 600 μm. (D) Western blot montrant l’expression Sox2 du fabricant de cellules souches conservée dans les cultures FBS/NMGF à 2% utilisées pour initier les tumeurs de xénogreffe(A-C). Cliquez ici pour agrandir l’image.
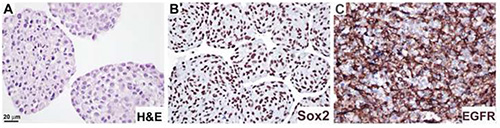
Figure 4. Analyse de l’expression des protéines dans les sections de la neurosphère par immunohistochimie. Des cultures de neurosphère ont été formaline-fixes et paraffine incorporées comme décrit dans la procédure 4, et souillées avec H&E(A),anticorps anti-Sox2(B),et anticorps anti-EGFR(C). Le substrat DAB a été utilisé pour visualiser(B,C). Bar, 20 μm. Cliquez ici pour agrandir l’image.
Discussion
La dissociation enzymatique appropriée de cellules de tumeur est une étape critique dans ce protocole. Le tissu doit être haché bien avant l’incubation dans une solution de dissociation cellulaire à 37 °C en rotation, pendant au moins 30 min, lorsque le tissu doit être trituré mécaniquement et que l’extension de la dissociation doit être vérifiée. Selon le degré de cohésion tissulaire, l’incubation peut être prolongée de 15 à 30 minutes supplémentaires, au besoin, pour compléter la dissociation en cellules individuelles. L’incubation dans une solution de dissociation pendant plus de 1 heure n’est pas recommandée en raison d’une diminution de la viabilité cellulaire. Bien que la quantité optimale de tissu de départ soit mg 200-500, ce protocole a mené aux cultures réussies de neurosphère d’aussi peu que mg 50 de tissu de tumeur.
Nmgf sans sérum est un milieu sélectif, et un pourcentage de cellules néo-plastiques comprenant la majeure partie de la tumeur, aussi bien que les cellules de centre serveur, ne survivra pas, tandis que d’autres se fixeront à la fiole traitée de culture de tissu après placage. Il est essentiel que les neurosphères qui se formeront sur 1 à 3 semaines(figures 1B-E)soient transférées dans des flacons frais, afin de les séparer des cellules tumorales et des débris différenciés.
Les cellules GBM enzymatiquement dissociées et jamais cultivées (étape 1.10) peuvent être cryoconservées comme source de sauvegarde des cellules à la culture dans des milieux alternatifs, au cas où la culture de la neurosphère échouerait. Nous avons obtenu avec succès des cultures de neurosphère à partir de ces stocks congelés, ainsi que des cellules monocouches poussant dans 2% FBS / NMGF.
Conceptuellement, la « cellule souche cancéreuse » est un travail en cours et ce domaine émergent bénéficiera d’une clarification supplémentaire, car les implications cliniques sont considérables, en particulier dans la génération d’hétérogénéité tumorale, de plasticité et de résistance à la thérapie19,20. En plus d’être vitales pour générer des modèles animaux GBM spécifiques au patient, les cultures neurosphères sont également précieuses pour des études in vitro telles que l’altération de la signalisation cellulaire et de l’expression des gènes en réponse aux facteurs de croissance, à l’hypoxie et aux agents pharmacologiques11,21. Nous avons opté pour l’utilisation de coupes transversales de neurosphères fixes au for forine et de paraffine incorporées, en préservant l’architecture 3D, pour étudier l’expression des protéines et les modifications post-traductionnelles par immunohistochimie11, en raison de la localisation subcellulaire supérieure par rapport à la méthode plus courante de étiquetage et d’imagerie de la sphère entière.
Il a été démontré que toutes les cellules des neurosphères dérivées du cerveau de mammifères adultes ne sont pas des cellules souches22. De même, les neurosphères cultivées à partir de tumeurs GBM ne sont probablement pas clonales, en raison de la présence de cellules progénitrices cancéreuses plus différenciées et de l’auto-agrégation, connue pour se produire à des densités cellulaires élevées23, ce qui est considéré comme une limitation de cette méthode par certains. Pour favoriser l’enrichissement pour les cellules souches autorenouvatrices à long terme, par opposition aux progéniteurs qui peuvent se développer transitoirement sous forme de neurosphères22,les neurosphères primaires sont dissociées pour la formation de neurosphères secondaires, et ensuite croisées pendant un minimum de 10 passages, soit à peu près l’équivalent de 2 mois en culture continue, ce qui est une indication d’une population enrichie en cellules souches22. D’après notre expérience, les cultures de neurosphère GBM qui atteignent cette marque peuvent continuer à être étendues en tant que neurosphères indéfiniment. L’importance de catégorie de tumeur, puisque nous avons obtenu les cultures réussies des GBMs et des astrocytomas anaplastiques, la catégorie IV et III d’OMS, respectivement, mais pas des gliomas de qualité inférieure.
La méthode la plus répandue de culture de cellules de glioblastome, dans le milieu de croissance traditionnel complété par 10% FBS, conduit à une divergence génomique et phénotypique considérable par rapport aux tumeurs originales 4. D’autre part, les cultures de neurosphère sont une source stable et à long terme de cellules présentant le phénotype de cellules souchescancéreuses 4. La méthode de neurosphère est devenue de plus en plus populaire pour l’enrichissement du CSC dans les cultures à long terme pour les modèles orthotopiques de xénogreffe de souris, en dépit de ne pas être réussie pour tous les échantillons de haut grade d’astrocytoma, qui représente la faiblesse principale de cette méthode. Des études visant à comprendre comment les caractéristiques moléculaires des tumeurs parentales peuvent affecter la formation de la neurosphère sont en cours. L’exploration de méthodes alternatives pratiques à la culture de gliomes de haut grade, suivie d’une validation approfondie, est accordée, étant donné les avantages considérables d’avoir des modèles gbm spécifiques au patient, alors que nous avançons dans une ère de médecine personnalisée, alimentée par l’accessibilité de l’information « omique » et le nombre accru de thérapies ciblées potentielles.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Ce travail a été financé par le Hermelin Brain Tumor Center de l’hôpital Henry Ford.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Life Technologies | 11330-032 | |
| Trypsin - EDTA 0.05% | Life Technologies | 25300-054 | |
| Hank’s Balanced Salt Solution, calcium- and magnesium-free | Life Technologies | 14170-120 | |
| Hank’s Balanced Salt Solution, with calcium and magnesium | Life Technologies | 24020-117 | |
| Collagenase Type 4 | Worthington | 5004188 | |
| Trypsin Inhibitor | Sigma | T7659 | |
| DNase I | Sigma | D4527 | |
| N2 Supplement (100x) | Life Technologies | 17502-048 | |
| Albumin from Bovine Serum, cell culture grade | Sigma | A4919 | |
| Gentamicin Reagent Solution | Life Technologies | 15710-064 | |
| Antibiotic/Antimycotic | Life Technologies | 15240-062 | |
| Recombinant Human FGF-basic | PeproTech | 100-18B | |
| Recombinant Human EGF | PeproTech | AF-100-15 | |
| Lympholyte-Mouse | Cedarlane Laboratories Ltd. | CL5031 | |
| Recovery Cell Culture Freezing Medium | Life Technologies | 12648-010 | |
| Sterile Cell Strainer, 40 μm | Fisher | 22363547 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS), no calcium and no magnesium | Life Technologies | 14190-144 | |
| Fetal bovine serum | Life Technologies | 26140-079 | |
| Trypan Blue Stain, 0.4% | Life Technologies | 15250-061 | |
| Neutral Buffered Formalin | Protocol | 245-684 | |
| Histoplex Tissue Cassettes | Thermo Scientific | 22-146-426 | |
| Rotator | Miltenyi BioTec | 130-090-753 | |
| GlutaMAX Supplement | Life Technologies | 35050-061 | |
| KnockOut D-MEM/F12 | Life Technologies | 12660-012 | |
| Stem Pro Neural Supplement | Life Technologies | A1058-01 |
Références
- Singh, S. K., et al. Identification of a cancer stem cell in human brain tumors. Cancer Res. 63, 5821-5828 (2003).
- Ignatova, T. N., et al. Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro. Glia. 39, 193-206 (2002).
- Galli, R., et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma. Cancer Res. 64, 7011-7021 (2004).
- Lee, J., et al. Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines. Cancer Cell. 9, 391-403 (2006).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Bao, S., et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature. 444, 756-760 (2006).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Beier, D., et al. CD133(+) and CD133(-) glioblastoma-derived cancer stem cells show differential growth characteristics and molecular profiles. Cancer Res. 67, 4010-4015 (2007).
- Joo, K. M., et al. Clinical and biological implications of CD133-positive and CD133-negative cells in glioblastomas. Lab. Invest. 88, 808-815 (2008).
- Son, M. J., Woolard, K., Nam, D. H., Lee, J., Fine, H. A. SSEA-1 is an enrichment marker for tumor-initiating cells in human glioblastoma. Cell Stem cell. 4, 440-452 (2009).
- deCarvalho, A. C., et al. Gliosarcoma stem cells undergo glial and mesenchymal differentiation in vivo. Stem Cells. 28, 181-190 (2010).
- Azari, H., et al. Isolation and expansion of human glioblastoma multiforme tumor cells using the neurosphere assay. J. Vis. Exp. , (2011).
- Laks, D. R., et al. Neurosphere Formation Is an Independent Predictor of Clinical Outcome in Malignant Glioma. Stem Cells. 27, 980-987 (2009).
- Vescovi, A. L., Galli, R., Reynolds, B. A. Brain tumour stem cells. Nat. Rev. Cancer. 6, 425-436 (2006).
- Gunther, H. S., et al. Glioblastoma-derived stem cell-enriched cultures form distinct subgroups according to molecular and phenotypic criteria. Oncogene. 27 (20), 2897-2909 (2007).
- Fael Al-Mayhani, T. M., et al. An efficient method for derivation and propagation of glioblastoma cell lines that conserves the molecular profile of their original tumours. J. Neurosci. Methods. 176, 192-199 (2009).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem cell. 4, 568-580 (2009).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), (2010).
- Leder, K., Holland, E. C., Michor, F. The therapeutic implications of plasticity of the cancer stem cell phenotype. PLoS One. 5, (2010).
- Pietras, A. Cancer stem cells in tumor heterogeneity. Adv. Cancer Res. 112, 255-281 (2011).
- Lomonaco, S. L., et al. The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells. Int. J. Cancer. 125, 717-722 (2009).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres--re-evaluating the relationship. Nat. Methods. 2, 333-336 (2005).
- Singec, I., et al. Defining the actual sensitivity and specificity of the neurosphere assay in stem cell biology. Nat. Methods. 3, 801-806 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon