A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
وهناك طريقة توسيع المركب-ينطبق على مجاميع من العصبية الجذعية البشرية والخلايا المشتقة من الخلايا السلف الجذعية المحفزة أو الجنين أنسجة المخ
In This Article
Erratum Notice
Summary
يصف هذا البروتوكول طريقة تقطيع الميكانيكية الرواية التي تسمح للتوسع كروية العصبية الجذعية والخلية السلف المجاميع دون التفكك إلى تعليق خلية واحدة. الحفاظ على الاتصال خلية / خلية يسمح النمو السريع والمستقر لأكثر من 40 المقاطع.
Abstract
ومن شأن التوسع تقنية خلية لجمع أعداد كبيرة من الخلايا من عينة واحدة لتجارب البحوث والتجارب السريرية تستفيد كثيرا المجتمع الخلايا الجذعية. العديد من وسائل التوسع الحالية هي شاقة ومكلفة، وتلك التي تنطوي على التفكك الكامل قد يسبب العديد من أنواع الخلايا الجذعية والسلف للخضوع لتمايز أو الشيخوخة المبكرة. للتغلب على هذه المشاكل، وقد وضعنا طريقة الركض الميكانيكية الآلية المشار إليها باسم "تقطيع" التي هي بسيطة وغير مكلفة. هذا الأسلوب يتجنب التفكك الكيميائية أو الإنزيمية في الخلايا واحد ويسمح لتوسيع نطاق واسع من علق، كروي الثقافات التي تحافظ على اتصال مستمر خلية / خلية بدلا من ذلك. وقد استخدمت في المقام الأول طريقة تقطيع للخلايا الجنينية المستمدة من الدماغ العصبية السلف أو neurospheres، ومؤخرا تم نشرها للاستخدام مع الخلايا الجذعية العصبية المشتقة من الخلايا الجذعية المحفزة الجنينية والتي يسببها. ويضم هذا الإجراءوفاق بذر neurospheres على طبق بتري زراعة الأنسجة ويمر بعد ذلك حاد، شفرة معقمة من خلال أتمتة الخلايا بشكل فعال في عملية شاقة من الانفصال يدويا ميكانيكيا كل مجال. تعليق الخلايا في الثقافة يوفر سطح نسبة مواتية المنطقة إلى حجم؛ كما أكثر من 500،000 الخلايا يمكن زراعتها داخل neurosphere واحد من أقل من 0.5 ملم في القطر. في واحدة قارورة T175، يمكن أن أكثر من 50 مليون تنمو الخلايا في الثقافات تعليق مقارنة ب 15 مليون فقط في الثقافات ملتصقة. الأهم من ذلك، وقد استخدم هذا الإجراء في إطار تقطيع الممارسات التصنيعية الجيدة الحالية (المركب)، والسماح إنتاج كمية الشامل من المنتجات الخلية السريرية الصف.
Introduction
هناك تاريخ طويل من توسيع الخلايا الجذعية العصبية في الثقافة القوارض إما أحادي الطبقة 1-3 أو 4-7 neurospheres الكلي. بالإضافة إلى ذلك، تم توسيع الخلايا الاصلية العصبية البشرية (hNPCs) المعزولة من مناطق مختلفة من الجهاز العصبي المركزي النامية في المختبر 8-17. هذه الخلايا هي ثنائية قوية، وقادرة على التفريق في كل من الخلايا النجمية والخلايا العصبية، وكانت أداة مفيدة جدا في دراسة التنمية العصبية وأمراض 18،19 20،21 آلية. كما تم زرع hNPCs في العديد من نماذج حيوانية مختلفة من أمراض الجهاز العصبي المركزي مع مستويات متفاوتة من التكامل والبقاء والآثار الفنية 22-24.
تقليديا، يتعرض الجنين القوارض أو الشخصيات المستمدة من الإنسان إلى عوامل النمو - عامل نمو البشرة في كثير من الأحيان (صندوق تعديل العولمة الأوروبي) و / أو عامل نمو الخلايا الليفية-2 (FGF-2) 25-28 - وكلاهما تمسكا 29 وثلاثةعادة و passaged أنظمة كروي الأبعاد باستخدام تفارق الأنزيمية في تعليق خلية واحدة 30-34. الطريقة القياسية لتوسيع الخلايا لأغراض البحث أو استخدام السريري هو بمثابة أحادي الطبقة ملتصقة بسبب التلاعب سهلة. ومع ذلك، ونحن قد أظهرت أن أحادي الطبقة الركض وneurosphere hNPCs مع الأنزيمية أو المحاليل الكيميائية أدى إلى الشيخوخة المبكرة 35. بالإضافة إلى ذلك، قد يؤدي تفارق الأنزيمية في زيادة مستويات التمايز والنمط النووي شذوذ استنادا إلى بيانات أظهرت مع الخلايا الجذعية الجنينية 36-38. على الرغم من أن أسلوب قياسي للhNPCs الركض وقد أنتجت ممارسة التصنيع الجيدة الحالية (المركب) منتجات الصف التي مرت في مرحلة التجارب السريرية 1 (الخلايا الجذعية شركة، Neuralstem شركة)، سمحت الطريقة فقط بضع جولات من التضخيم الخلية، مما يحد من المصرفية المحتملة.
بشكل واضح، يمكن أن التجارب البحثية الكبيرة والتجارب السريرية في المستقبل الاستفادة من القدرة علىنشر الخلايا بكميات كبيرة ومع تأخر الشيخوخة للسماح نمو واسع النطاق والمصرفية الخلية. لتلبية هذه الحاجة، قمنا بتطوير الرواية وسيلة مؤتمتة من neurospheres سليمة الركض ميكانيكيا بواسطة "تقطيع" لهم في مجموعات صغيرة للحفاظ على اتصال الخلية الى خلية. هذه الطريقة زيادة كبيرة تسمح عمر 39 وتعليق ثقافتهم استخدام أكثر فعالية من مساحة الحاضنة مقارنة الثقافات أحادي الطبقة، كما رأينا مع بديل 3D طريقة الثقافة مفاعل حيوي 40. بروتوكول تقطيع قدمت يسمح لإنتاج البنوك على نطاق واسع من عينة واحدة الجنين أكبر من مرور 10، إنجازا غير المرجح باستخدام أساليب الركض القياسية. في حين أن هذا الأسلوب لhNPCs الركض هو غير تقليدية، هو في تزايد شعبية وتم مؤخرا، نشرت مع أنواع الخلايا الأخرى مثل الخلايا الجذعية العصبية المشتقة من الأجنة البشرية والخلايا الجذعية المحفزة، مما يتيح توسيع نطاق واسع لمختلف التطبيقات بما في ذلك في الخامسitro النمذجة المرض 41-46. الأهم من ذلك، وقد تم بالفعل إنتاج المركب الصف hNPC بنك الخلايا مع أسلوب التقطيع، مما يدل على أن هذه التقنية يمكن تطبيقها تجاه التطبيقات السريرية في المستقبل.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. بيان الأخلاقية والسلامة
- ينطوي هذا الإجراء على استخدام منتجات خلية ثقافة المستمدة من البشر أو الحيوانات. يجب الموافقة على جميع الأنسجة المشتقة قبل استخدامها من قبل المجلس المختص المراجعة المؤسساتي (ق) و / أو لجنة رعاية الحيوان واستخدام المؤسسية (ق).
- يجب التخلص من جميع النفايات الحيوية الخطرة وفقا للوائح السلامة التي قررها المؤسسة المعنية. معرفة ومتابعة كل إرشادات السلامة والتخلص منها في محله في جميع أنحاء هذا الإجراء.
2. إعداد معدات ولوازم، الكواشف، وملاحظات
- إعداد
- الحصول على طبق بتري الزجاج، 8.5 سم مرشح الدوائر ورقة مزدوجة حافة ريش الإعدادية.
- وضع قطعة من ورق الترشيح في طبق بتري ونقل العديد من شفرات مستل على ورقة الترشيح في طبق بتري.
- مرارا وتكرارا طبقة ورق الترشيح وشفرات حتى طبق بتري هو ما يقرب من 75٪ كاملة، وغطاء الطرافةح بيتري غطاء الطبق والأوتوكلاف. تخزين في بيئة معقمة أو المغلقة للحفاظ على العقم.
- الأوتوكلاف 18 سم ملقط وautoclavable الجوز السائق في الحقيبة التعقيم. لإنتاج المركب، الأوتوكلاف عدة أقراص الرقاقة الفولاذ المقاوم للصدأ في الحقائب التعقيم. لمزيد من المعلومات حول القرص الرقاقة، راجع الخطوة 3.5.
- تطهير مجلس الوزراء السلامة البيولوجية (BSC) مع 70٪ ايزوبروبيل (IPA).
- يجب أن يتم تنفيذ جميع الإجراءات في BSC للحفاظ على العقم. نقل جو معقم و مطهر ما يلي في BSC:
- McIlwain الأنسجة المروحية (مروحية). مسح أسفل جميع الأسطح مع 70٪ IPA، وخصوصا الذراع المروحية (الشكل 1B). يمكن تطهير المروحية بأكملها باستخدام أكسيد الإثيلين إذا لزم الأمر.
- واحد تعقيمها الجوز سائق أو الجوز وجع (المضمنة مع المروحية، الشكل 1I)، واحدة 18 سم ملقط، مجموعة واحدة من micropipettors الحجم القياسي (20 ميكرولتر-1، 000 ميكرولتر)، pipetaid واحد ورفوف أنبوب.
- ماصات معقمة المتاح المصلية، نصائح حاجز الماصة، أنابيب مخروطية 15 مل، 60 مم أطباق بتري، انقر نقرا مزدوجا حافة ريش الإعدادية وقوارير T بحجم مناسب. تنبيه: فقط التعامل مع شفرات حادة مع ملقط.
- الكواشف
- توسيع hNPCs في صيانة وسائل الإعلام (MM)، ويتألف من العصبية الجذعية التوسع خلية متوسطة، EGF في 100 نانوغرام / مل واللوكيميا المثبطة عامل (LIF) في 10 نانوغرام / مل. نقل الكواشف وجهاز الترشيح (ق) اللازمة لإعداد وسائل الإعلام في BSC.
- إعادة تعليق EGF مجفف بالتجميد باستخدام الجذعية العصبية خلية متوسطة التوسع وإعداد aliquots في 100 ميكروغرام / مل لتخزين في -80 درجة مئوية لمدة تصل إلى 1 سنة. يتم تخزين LIF كما تم شراؤها في 4 درجات مئوية لمدة تصل إلى 6 أشهر أو تاريخ انتهاء الصلاحية تعطى من قبل الشركة المصنعة.
- نقل الكواشف MM في BSC. الجمع بين جميع الكواشف في جهاز الترشيح بحجم مناسب وتصفية باستخدام جهاز فراغ. تخزين عند 4 درجة مئوية لمدة تصل إلى 3 أسابيع.
- ملاحظات hNPC
- وهما أهم العوامل لمعالجة قبل تقطيع هو قطرها المجال وتكييف وسائل الإعلام أو اللون. يتم تعريف وسائل الإعلام مكيفة (CM) كوسط التي تم استقلابه من قبل hNPCs في الثقافة في ظل ظروف الحاضنة (37 درجة مئوية، 5٪ CO 2، 95٪ الرطوبة). كما استقلاب الخلايا وسائل الإعلام المكون أحمر الفينول سيتحول من اللون الوردي الى اللون الأصفر يدل على بيئة أكثر حامضية (الشكل 5D).
- عقد قارورة (ق) من hNPCs إلى الضوء لمعالجة اللون وسائل الإعلام (انظر المناقشة للحصول على التفاصيل).
- مسح من خلال القارورة مع المجهر لمراقبة الخلايا. استخدام شبيكة لدراسة حجم المجال. إذا العديد من المجالات ويبلغ قطرها 300 ميكرون أو أكبر، والمضي قدما في عملية التقطيع. ختم الخلايا كل 7-10 أيام.
- إن لم يكن هناك ما يبرر ختم، وتبادل 25-75٪ من CM مع وسائل الاعلام جديدة كل 3-4 أيام اعتمادا على مدى سرعة خلايا يتم تأييض وسائل الإعلام. يخدعلالستمرار في تبادل وسائل الإعلام حتى المجالات هي كبيرة بما يكفي لمرور.
- وعادة ما تكون المفروم hNPCs بنسبة 1:2، من قوارير قوارير أصغر لأكبر. استخدام الجدول 1 كدليل مرجعي لحجم القارورة وحجم التوصيات.
قارورة حجم مجموع وسائل الإعلام قبل فرم → بعد فرم 1 T12.5 5 مل 1 T12.5 → 1 T25 1 T25 10 مل 1 T25 → 1 T75 1 T75 20 مل 1 T75 → 1 T175 1 T175 40 مل 1 T175 → 2 T175s 2 T175s 80 مل 2 T175s * → 4 T175s * 2 T175s هو الحد الأقصى لعدد القوارير التي يمكن المفروم في وقت واحد. ختم في مجموعات من 2 T175s والرجوع إلى الخطوة 7. الجدول 1. توسيع نموذج hNPC. وصف خطة التوسع نموذجية لhNPCs. ذلك هو المعيار لتوسيع شقين volumetrically كل 7-10 أيام.
3. إعداد المروحية
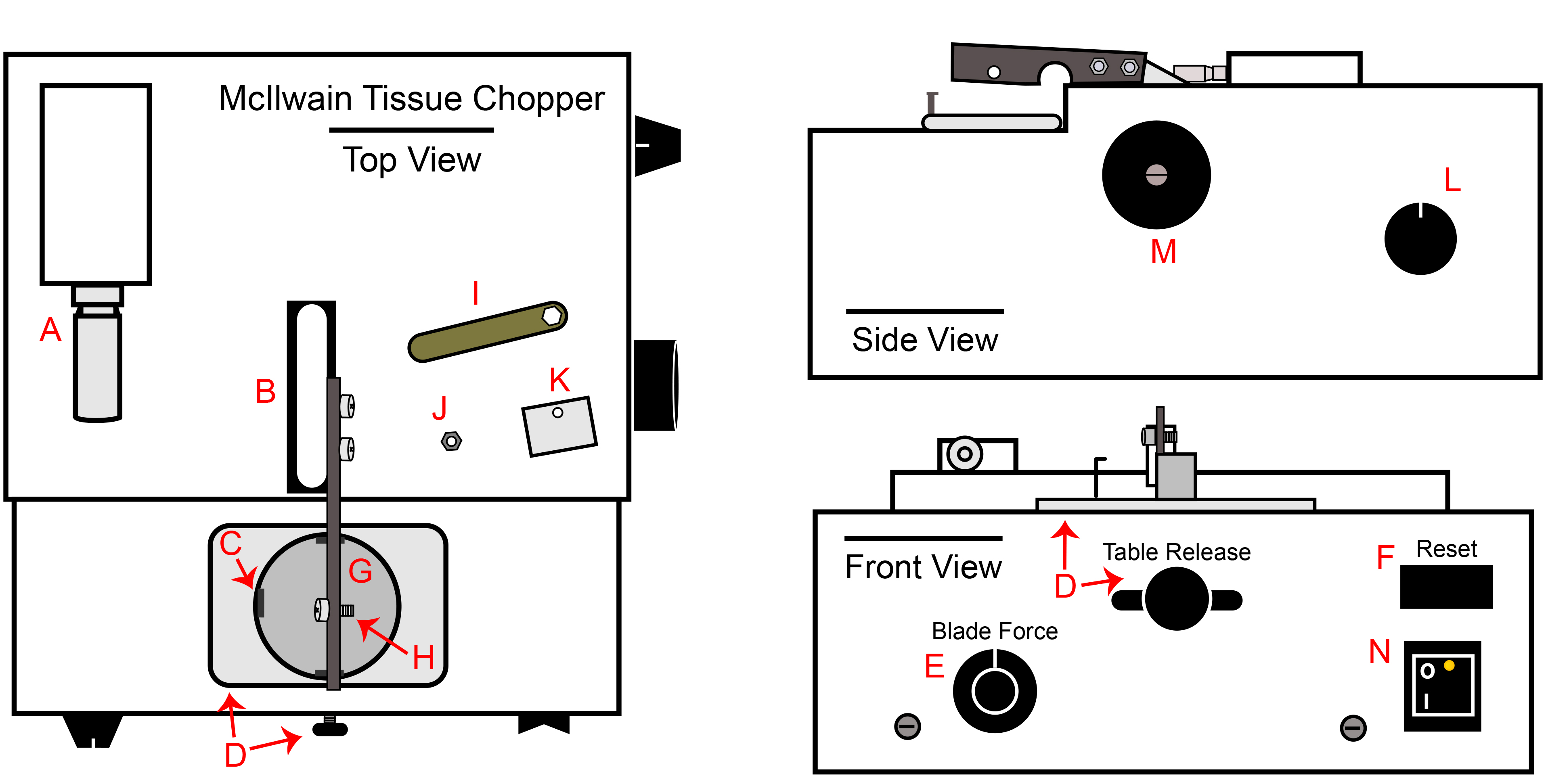
الشكل 1. McIlwain الأنسجة المروحية. A) ميكرومتر ختم تعديل سماكة، B) المروحية قاعدة ذراع وذراع المرفقة، C) هوك على حامل لوحة لطبق بيتري، D) الافراج عن الجدول مقبض الباب وصينية، E) مفتاح التحكم القوة بليد، F) إعادة تعيين التبديل، G) حامل لوحة، H) بولت المرفقات للشفرة، وقفل والجوز، I) البندق وجع المضمنة مع المروحية، J) شفرة / قفل الجوز، وقفل K) بليد، L ) مفتاح التحكم الآلي سرعة التقطيع، M) دليل الذراع تقطيع مقبض التشغيل، N) مفتاح الطاقة.- سد المروحية بمأخذ في BSC وتشغيل مفتاح الطاقة (الشكل 1N). تعيين مسافة التقطيع إلى 200 ميكرومتر (الشكل 1A). تعيين القوة نصل إلى 270 درجة أو 9:00 لو كان مقبض الباب على مدار الساعة (الشكل 1E). تأكد من أن سرعة مقبض التلقائي استدارة بقدر عكس ممكن. (الشكل 1L).
- نقل الجدول الإفراج عن جميع من وسيلة لتأكيد حق حامل لوحة غير مستقرة (1D الشكل).
- تدوير مانوآل الذراع مناور اتجاه عقارب الساعة لرفع الذراع إلى أقصى مستوى لها (الشكل 1M). يجب أن يكون دليل الذراع مناور فقط عقارب الساعة استدارة.
- جو معقم و مطهر نقل معقمة، ذو حدين شفرة تقطيع على المروحية ذراع الترباس باستخدام زوج من ملقط (الشكل 1H).
- إكمال هذه الخطوة فقط للالمركب الركض، كما طبق بيتري وحدها كافية لتجهيز البحوث الصف. كما لوحظ في الخطوة 2.1.4، يطلب من أقراص الرقائق وضعت داخل قاعدة طبق بيتري للالمركب. القرص الرقاقة يمنع شظايا البلاستيك من دمج في المجالات أثناء إجراء التقطيع. لكل ختم المخطط، نقل واحد القرص الرقاقة في قاعدة كل طبق بتري والغطاء.
- وضع جو معقم و مطهر المشبك (الشكل 1K) على شفرة باستخدام ملقط. يجب أن يكون الجزء المنحني من قفل على الحافة العلوية من الذراع. سوف قفل لن يبقى على الذراع حتى يتم الطراز الجوز بشكل آمن. استخدام ملقط لعقد كلاسع على الذراع وتأمين الجوز (الشكل 1J) على الترباس مع الجوز العقيمة سائق. يترك الجوز و¼ بدوره فضفاضة.
4. الإجراءات التمهيدية فرم
- نقل حجم اقترح من MM في قارورة جديدة (ق) كما في الجدول 2، العمود C.
- جو معقم و مطهر نقل الخلايا من الحاضنة في BSC. العجاف القارورة (ق) على رف أنبوب (الشكل 2A) والسماح المجالات ليستقر في القارورة (ق).
- مرة واحدة استقرت، ونضح ما يصل الى 12 مل من طاف مع 5 مل أو 10 مل ماصة المصلية وشطف جميع مجالات ملتصقة فضفاضة من سطح القارورة (ق). كرر حسب الضرورة وتسوية المجالات بين يشطف.
- نقل حجم اقترح من CM إلى القارورة جديد (ق) وفقا للجدول 2، العمود D. إذا الركض اثنين أو أكثر من قوارير T175، راجع الخطوة 7.1.
- نقل جميع ما تبقى من سم والمجالات في أنبوب 15 مل المخروطية جديدة. تسمح المجالات لذاتهttle وتجاهل قارورة المستعملة (ق).
- الخطوة الحاسمة: نقل ببطء المجالات من أنبوب 15 مل المخروطية على طبق بتري 60 ملم أو قرص الرقاقة في أدنى حجم ممكنا؛ ينصح 0.1-0.5 مل (الشكل 2B). الحفاظ على حجم ما تبقى من CM كما سيتم استخدامه لشطف الخلايا من طبق آخر ختم. محاولة لتقليل مساحة السطح من قبل وسائل الإعلام والمجالات على طبق (الشكل 2C) مغطاة.

الشكل 2. إعداد المجال لتقطيع ألف) العجاف القارورة (ق) ضد رف أنبوب أو ما يماثلها لتسوية المجالات في الزاوية من القارورة. ب) نقل المجالات بوصفها مكتظة ممكن من الأنبوب المخروطية إلى بيتري الطبق. C) بركة المجالات من الأنبوب المخروطية في رانه منتصف طبق بيتري. D) إزالة أكبر قدر ممكن من طاف الجزء العلوي من المجالات المجمعة. E) انتشار المجالات خارج باستخدام جانب من micropipettor غيض من البلاستيك. F) بلطف تحريك المجالات إلى جانب واحد من تجمع تنتشر المجالات. G) مثال من المجالات التي تم نقلها إلى جانب واحد من تجمع لتسهيل إزالة وسائل الاعلام. H) مكثف خارجا على طبق بيتري، وعلى استعداد لتقطيع. اضغط هنا لمشاهدة صورة أكبر.- المقبل، تحتاج المجالات لتكون موجزة عن طريق إزالة طاف نقلها عبر في الخطوة 4.6. نقل طاف مرة أخرى إلى 15 مل أنبوب مخروطي مع الهباء الجوي ذات الرؤوس حاجز micropipettor (الشكل 2D)، وتجنب إزالة المجالات. تبدأ عن طريق إزالة وسائل الإعلام قدر الإمكان من أعلى تجمع وسائط / خلية. عندما لا يكون ممكنالإزالة وسائل الاعلام من دون المجالات، انتقل إلى الخطوة التالية.
<الدفتيريا> 0 ملالعمود A العمود B العمود C العمود D العمود E العمود F قبل فرم قارورة الحجم → بعد فرم قارورة (ق) الحجم حجم اقترح من MM نقلها إلى قارورة جديد (ق) قبل ختم حجم اقترح من CM لنقلها إلى قارورة جديد (ق) قبل ختم حجم اقترح من المجالات / وسائل الإعلام لنقل في قارورة جديد (ق) آخر فرم- الحجم النهائي المصنف / قارورة T12.5 → T25 5 مل 0 مل 5 مل 10 مل T25 → T75 10 مل 10 مل 20 مل T75 → T175 20 مل 10 مل 10 مل 40 مل 1 T175 → 2 T175s 20 مل لكل قارورة 15 مل لكل قارورة 5 مل لكل قارورة 40 مل 2 T75s → 4 T175s 20 مل لكل قارورة 17.5 مل لكل قارورة 2.5 مل لكل قارورة 40 مل الجدول 2. دليل نقل وسائل الإعلام قبل / بعد ختم. أحجام اقترح لاستخدامها أثناء عملية التقطيع.
- تنتشر تجمع خارج باستخدام الجانب من طرف الماصة لزيادة مساحة السطح (الشكل 2E).
- الخطوة الحاسمة: تلميح طبق بيتري قليلا نحو لكم واستخدام الجانب من طرف الماصة لSL بلطفبيئة تطوير متكاملة كافة المجالات إلى جانب واحد من تجمع (الشكل 2F، G).
- الخطوة الحاسمة: عندما تم نقل جميع الخلايا، إبعاد ببطء طبق بيتري الاتجاه المعاكس. أثناء هذه العملية، فإن وسائل الإعلام وحدها تتدفق بعيدا عن المجالات. نقل وسائل الإعلام مرة أخرى إلى أنبوب مخروطي 15 مل. إزالة المجال الحد الأدنى المقبول.
- استخدام الجانب من طرف الماصة إلى الشريحة بلطف كافة المجالات إلى وسط طبق بتري حتى تجمع لديه قطره 0،5-2،4 سم (الشكل 2H). فمن المهم للحفاظ على عمق ضحل تجمع المجال. إذا تجمع عميقة جدا، وسوف يكون ببساطة دفعت المجالات جانبا أثناء تقطيع. ملاحظة: قطر تجمع المجال لا يمكن أن تكون أكبر من 2.5 سم أو سوف شفرة الاتصال حواف طبق بيتري، في عداد المفقودين الخلايا.
5. إجراء فرم
- نقل طبق بيتري على حامل لوحة (الشكل 1G) وضمان الطبقيتم تأمين تحت السنانير لوحة حامل (الشكل 1C).
- مقبض الإفراج الجدول يحتوي الشقوق حيث أنه سيكون من المناسب في حالة تأهب. استخدام مقبض الإفراج الجدول إلى الشريحة حامل لوحة إلى اليسار حتى النصل هو واضح من المجالات وحبيس العتاد (1D الشكل).
- الخطوة الحاسمة: اخفض الذراع المروحية عن طريق تدوير مقبض تتلاعب اليدوية (الشكل 1M) في اتجاه عقارب الساعة حتى يستقر أسفل النصل المسطح على طبق بيتري. استخدام يد واحدة في الضغط على الذراع جبل (الشكل 1B) مع تشديد الجوز مع nutdriver.
- تضغط على الزر إعادة تعيين مرة واحدة (الشكل 1F). ثابت طبق بيتري مع يد واحدة في حين تحول التلقائي الذراع مناور مقبض الباب (الشكل 1L) في اتجاه عقارب الساعة إلى 90 ° موقف أو 0:00 لو كان مقبض الباب على مدار الساعة. تنبيه: حافظ على الأصابع بعيدا عن شفرة تتحرك في جميع الأوقات.
- تمرير شفرة بالكامل من خلال مجموعة من المجالات. تدوير حامل لوحة90 °.
- تخفيف الترباس وكرر الخطوة 5،3-5،5.
- جو معقم و مطهر نقل طبق بيتري من صاحب لوحة على مساحة عمل في BSC.
6. الإجراءات بعد فرم
- رئيس و10 مل ماصة المصلية مع CM في أنبوب مخروطي من الخطوة 4.6 ثم نقل 1 مل على المجالات المفروم. بلطف اعادة تعليق ونقل في أنبوب 15 مل المخروطية جديدة. تجنب فقاعات وكرر عدة مرات كما اللازمة لجمع المجالات المفروم.
TIP: تصغير تجريف الطبق كأجزاء من البلاستيك قد يقلع. هذا ليس مصدر قلق إذا باستخدام أقراص الرقاقة الفولاذ المقاوم للصدأ. حذار من الخلايا المترتبة على الداخل من ماصة المصلية البلاستيك. إذا حدث هذا، فقاعات نضح بشكل متقطع من خلال وسائل الإعلام في ماصة لفصل الخلايا. - قياس حجم CM والمجالات المفروم. إضافة حجم مناسب من MM لتحقيق حجم المدرجة في الجدول 2، العمود E.
- يسحن ومجالات 2-3X لتفريق أي المجالات تنصهر فضفاضة.
- الخطوة الحاسمة: قسامة تعليق المجال في كل قارورة جديدة. نقل فقط تعليق المجال في قارورة واحدة في وقت واحد، وإعادة تعليق المجالات بين التحويلات. Aliquoting قوارير متعددة في وقت والنتائج في عدد غير متناسب من المجالات في كل قارورة. الحجم النهائي في كل قارورة يجب أن يساوي وحدات التخزين في الجدول 2، العمود F. انظر الخطوة 7.2 عند البذر أكبر من اثنين قوارير T175.
- إزالة الجوز مع الجوز سائق ثم قفل مع ملقط معقم. تطهير مناسب مع 70٪ IPA أو ما يعادلها. تنبيه: إزالة شفرة تقطيع تستخدم فقط مع ملقط وتجاهل في حاوية الأدوات الحادة للأخطار البيولوجية.
- تطهير جميع الأسطح من المروحية مع 70٪ IPA.
7 الاختلافات العملية - قوارير متعددة
هناك العديد من الاختلافات عند الركض أكثر من عقدين من T175s. الخطوةو فيما يلي التعديلات من الخطوة المشار إليه.
- إشارات إلى الخطوة 4.4:
- عند الركض اثنين T175s، والجمع بين جميع وسائل الإعلام والمجالات في واحدة قوارير T175. تسمح المجالات لتسوية ثم قسامة حجم المناسبة من سم في كل من قوارير جديدة كما جاء في الجدول 2، العمود D. انتقل إلى الخطوة 4.5.
- عند الركض أكبر من اثنين T175s، الحصول على قارورة T175 جديدة والتسمية باسم قارورة سم. خطوة كاملة 7.1.1 ولكن نقل سم في قارورة سم. تخزين القارورة على جانب BSC لاستخدامها لجمع سم من جميع القوارير حتى تم المفروم جميع القوارير. وبعد ذلك سيتم aliquoted وCM بالتساوي في كل من قوارير جديدة.
- المرجعية خطوة 6.4 - عندما تقطيع خط الخلية نفسها عدة مرات، ونقل تعليق المجال المفروم إلى T75 قارورة جديدة المجالات وصفت آخر ختم وتسجيل حجم نقل. مواصلة الجمع بين الخلايا في هذه بعد كل قارورة فرم وتخزين القارورة في الحاضنة عند 37 درجة مئوية، 5٪ CO 2، 95٪ الرطوبة. بعد أن تم الانتهاء من جميع القطع، قسامة تعليق المجال في الحجم في كل قارورة جديدة. انتقل إلى الخطوة 6.5.
8. الحفظ بالتبريد
بروتوكول التالية هي للحفاظ على جثمان hNPCs.
- ذوبان الجليد تجميد الخلايا المتوسطة في حمام الماء النظيف عند 37 درجة مئوية ومن ثم تخزينها على الجليد. خلية تجميد المتوسطة يمكن aliquoted وتخزينها في -80 ˚ مئوية لمدة تصل إلى 6 أشهر.
- اطلاق النار الزجاج البولندية pipets باستور عن طريق تناوب افتتاح الماصة في اللهب. إعداد ما لا يقل عن اثنين واثنين كبيرة تتحمل صغيرة pipets مصقول النار (الشكل 3). سيتم فصلها المجالات وذلك بالانتقال من كبيرة إلى صغيرة تحمل pipets.
- اختر مكان TrypLE في حمام الماء عند 37 درجة مئوية لمدة 5 دقائق. إزالة والحفاظ على درجة حرارة الغرفة حتى جاهزة للاستخدام.
her.within صفحة = "دائما">

الرقم 3. الزجاج النار تلميع pipets باستور. A) امسك الماصة في الجزء العلوي من اللهب وتدور من أجل بالتساوي الجولة حواف الزجاج الماصة. B) مثال كبير الجوف إطلاق النار مصقول الزجاج الماصة. C) مثال على العيار الصغير المصقول والزجاج النار الماصة.- جو معقم و مطهر نقل neurospheres في BSC. تسمح المجالات لتسوية بالانحناء القارورة (ق) ضد رف أنبوب وشطف أسفل القارورة لإزالة أي المجالات ملتصقة فضفاضة. تسمح المجالات لإعادة تسوية.
- نقل جميع ولكن مل من 5-10 سم في زجاجة معقمة وقياس حجم التداول الكلي. وضع المجالات المتبقية وسائل الإعلام في أنبوب مخروطي.
- بعد أن استقر كل الخلايا، ونقل جميع ولكن الغضروف المفصلي صغيرة من سم في زجاجة وsummate في المجلدأوميا.
- نقل جو معقم و مطهر 5-10 مل من درجة حرارة TrypLE الاختيار في أنبوب مخروطي الشكل وإعادة تعليق بيليه الخلية. نقل أنبوب مخروطي في 37 ° C حمام الماء لمدة 15-20 دقيقة. بعد 7.5-10 دقيقة، هز بلطف أنبوب مخروطي لخلط.
- استخدام حجم CM قياس من الخطوة 8.5 و إعداد حجم مساو من MM. الجمع بين وتحديد CM 50٪ و 50٪ MM الحل (حل CM / MM).
- جو معقم و مطهر نقل مصفاة 40 ميكرومتر إلى 50 مل أنبوب مخروطي.
- عند اكتمال الحضانة، وتدور في أنابيب 15 مل المخروطية لمدة 15 ثانية في 100 × ز.
- نضح بعناية وتجاهل TrypLE اختر أي والركيزة مفتول العضلات. ترك الغضروف المفصلي الصغيرة. إضافة بلطف 2-4 مل من CM / MM لتمييع ما تبقى من TrypLE اختر بينما لا إزعاج بيليه. تدع أي خلايا فكها إعادة توطين قبل رميه غسل.
- إضافة 2-5 مل CM / MM حل للأنبوب المجالات. فصل المجالات مع ماصة 5 مل من قبل الطحن 10X كحد أقصى. السماح للامم المتحدةمجالات فصلها تسوية لمدة 1-2 دقيقة. نقل تعليق الخلية فصلها على مصفاة 40 ميكرون لإزالة كتل undissociated بالكامل.
- كرر الخطوة 8.12 مع كوب كبير الجوف الماصة النار مصقول ثم صغيرة الجوف الزجاج الماصة.
- شطف مع مصفاة 2-5 مل من محلول سم / MM.
- مزيج تعليق خلية وإزالة عينات للتحليل جدوى.
- تمييع العينات مع الأزرق التريبان في عامل التخفيف المناسبة والاعتماد. استخدام المعادلة القياسية أدناه لحساب متوسط تركيز خلية قابلة للحياة وحساب مجموع خلايا قابلة للحياة.

- حساب الحجم الكلي للخلية تجميد وسائل الإعلام المطلوبة لاعادة تعليق الخلايا في 5.0 × 10 6 خلية / مل. سيتم المصنفة 1 مل من الخلايا في كل cryovial. نقل cryovials في BSC.
- الطرد المركزي تعليق خلية في 200 x ج لمدة 5 دقائق في 4 درجات مئوية في 15 مأنابيب ل المخروطية للحصول على أفضل عائد. إذا تم استخدام أنابيب مخروطية 50 مل لتجميد على نطاق واسع إلى أسفل، وزيادة معدل الوقت ل400 x ج لمدة 10 دقيقة.
- إعادة تعليق بيليه الخلية باستخدام الخلية تجميد المتوسطة في 5.0 × 10 6 خلية / مل. قسامة 1 مل من تعليق خلية في كل cryovial. ليتساوى التوزيع، نضح 6 مل من التعليق وقسامة 5 × 1 مل cryovials. نقل مل 1 المتبقية من التعليق مرة أخرى إلى مجموعة من الخلايا. كرر حتى يتم شغل كل قارورة.
- جو معقم و مطهر ختم جميع cryovials المصنف ونقلها على الجليد لمدة 5-10 دقيقة.
- استخدام أحد الخيارات التالية لاستراتيجيات الحفظ بالتبريد للحفاظ على hNPCs: الآيزوبروبيل غرفة الكحول
- ملء العدد المطلوب من الغرفة (s) مع 100٪ IPA في درجة حرارة الغرفة.
- نقل المصنف cryovials من الجليد في غرفة (ق) ونقل غرفة (ق) في الفريزر -80 درجة مئوية خلال الليل. الخلايا هي مستقرة لمدة تصل إلى أسبوع واحد على -80 درجة مئوية، ومع ذلكيقترح نقل قوارير لتخزين طويل الأجل النيتروجين السائل في اليوم التالي.
تسيطر قيم برادات
- تحميل برنامج تجميد المناسبة لبرامج الفريزر معدل التحكم في. تم سرد البرنامج المثال في الجدول 3. يوضح الشكل 4 منحنى تجميد نموذجية لhNPCs. ومع ذلك، فإن البرنامج الدقيق تختلف عن كل نموذج الفريزر. يجب أن يكون معدل العينة القياسية الشاملة على مقربة من -1 ° C / دقيقة حتى وصلت -40 درجة مئوية، حيث تصل نسبة التجميد يمكن أن يكون زيادة كبيرة على الأقل -80 درجة مئوية.
خطوة معدل (° C) نهاية درجة الحرارة (° C) عقد (دقيقة ثانية) الزناد 1 - - 5 دقيقة 0 ثانية غرفة 2 - 1.3 - 5 - عينة 3 - - 1 دقيقة 0 ثانية غرفة 4 - 45 - 58 - غرفة 5 + 10 - 26 - غرفة 6 + 3 - 23 - غرفة 7 - 0.8 - 40 - عينة 8 - 10 - 100 - غرفة 9 - 35 - 160 - غرفة الجدول 3. خطوات لتجميد hNPCs في ص رقابةأكلت الفريزر. برنامج مقترح لhNPC الحفظ بالتبريد على الفريزر معدل رقابة.

الشكل 4. منحنى تجميد عينة. منحنى تجميد نموذجية لhNPCs على الفريزر معدل رقابة.- نقل cryovials من الجليد في سلال المرتبطة الفريزر معدل السيطرة. تأكد من تحميل cryovial واحد مع الخلية فقط تجميد وسائل الإعلام لاستخدامه في التحقيق في درجة الحرارة العينة. نقل السلال في غرفة تجميد ووضع مسبار العينة إلى القارورة التحقيق. بدء تشغيل البرنامج.
- عند اكتمال البروتوكول، ونقل إلى قارورة على المدى الطويل تخزين النيتروجين السائل.
9. إجراء ذوبان
بروتوكول التالية هي للذوبان بالتبريد عhNPCs محفوظة.
- نقل cryovials من تخزين النيتروجين السائل على الفور على الثلج الجاف. تنبيه: يمكن أن يكون قوارير الشقوق أو الأغطية فضفاض يسمح النيتروجين السائل لدخول القارورة. عند إزالتها من ظروف التجميد العميق، ويمكن غلي السائل، لتنفجر على الفور القارورة. استخدام معدات الوقاية الشخصية المناسبة عند إزالة قارورة.
- إعداد كل من الكواشف واللوازم أدناه في وقت مبكر. مرة واحدة وقد بدأت عملية الذوبان، فمن الأهمية بمكان أن تتبع من خلال كفاءة.
- نقل الخلايا الجذعية العصبية التوسع متوسطة، MM، 15 مل أنبوب مخروطي الشكل، واحدة 2 مل و 10 مل واحد ماصة المصلية لكل cryovial في BSC.
- ما لا يقل عن 9 مل من العصبية الجذعية التوسع خلية متوسطة و 5 مل من MM مطلوب لكل قنينة. إعداد أكثر من كل وسائل الإعلام إذا لزم الأمر.
- ذوبان الجليد فقط قارورة واحدة من hNPCs في وقت واحد. نقل الخلايا المجمدة من الثلج الجاف في تنظيف 37 ° C حمام الماء ويحرك القارورة في حمام مائي مستمر. رصد حجمالجليد الذي ذاب. عندما يكون هناك قطعة من الجليد حوالي 0.5 سم اليسار في القارورة، ورذاذ ويمسح مع 70٪ ايزوبروبيل ونقل إلى BSC.
- نقل محتويات cryovial إلى أنبوب مخروطي 15 مل مع 2 مل ماصة المصلية. إضافة 1 مل من العصبية الجذعية التوسع خلية متوسطة إلى إفراغ cryovial ثم نقل 8 مل من العصبية الجذعية التوسع خلية متوسطة على إذابة الخلايا في بطء، وانخفاض بطريقة حكيمة حين يهز بلطف الأنبوب. يتم ذلك للتقليل من خطر التعرض لصدمة التناضحي.
- نقل شطف من cryovial إلى 9 مل من التعليق الخلية. نقل أنبوب مخروطي على الجليد وكرر الخطوات من 9،4-9،5 لجميع قارورة المتبقية.
- أجهزة الطرد المركزي في أنابيب مخروطية في 200 x ج لمدة 5 دقائق في 4 درجات مئوية. أثناء الطرد المركزي، وإعداد العدد المناسب من قوارير للبذار على أساس الجدول 4.
# من قارورة اجمالى حجم التداول البذر (مل) قارورة 1 5 T12.5 2 10 T25 3 15 T75 4 20 T75 5 25 T75 6 30 T175 7 35 T175 8 40 T175 8 + - مزيج من قوارير الجدول 4. أحجام قارورة استنادا إلى عدد من cryovials إذابة. حجم المقترحة وحجم القارورة إلى البذور hNPCs آخر ذوبان الجليد.
- اعادة تعليق والجمع بين جميع الأنابيب في حجم مناسب من MM على أساس الجدول 4. تخلط جيدا وإعادةنقل العينة للبقاء العد. نرى الخطوات 8،15-8،16 لحساب التفاصيل. مجموعة البذر هو معيار بين 160،000-320،000 خلية / سم 2.
- مزيج من الخلايا بشكل جيد وقسامة الخلايا في قوارير. نقل القوارير إلى 5٪ CO 2/37 ° C/95٪ الرطوبة الحاضنة. مزيج القارورة التي تهز بلطف ذهابا وإيابا لتوزيع بالتساوي الخلايا.
- فإن الخلايا تشكل المجالات ضمن 24-48 ساعة. أحيانا الخلايا ستلتزم إلى السطح البلاستيك وتشكيل مستعمرة توزيع مثل العسل. إذا حدث هذا، وترك الخلايا لمدة 3 أيام قبل الشطف الخلايا فضفاضة، والمساعدة في تشكيل المجال. شطف كل 1-3 أيام حتى لا توجد الخلايا الملتصقة. إذا لزم الأمر نقل الخلايا إلى قارورة جديدة.
- صرف 25-75٪ من وسائل الإعلام مع MM كل 3-4 أيام حتى الخلايا على استعداد لختم، وعادة 7-14 أيام آخر ذوبان الجليد.
Access restricted. Please log in or start a trial to view this content.
النتائج
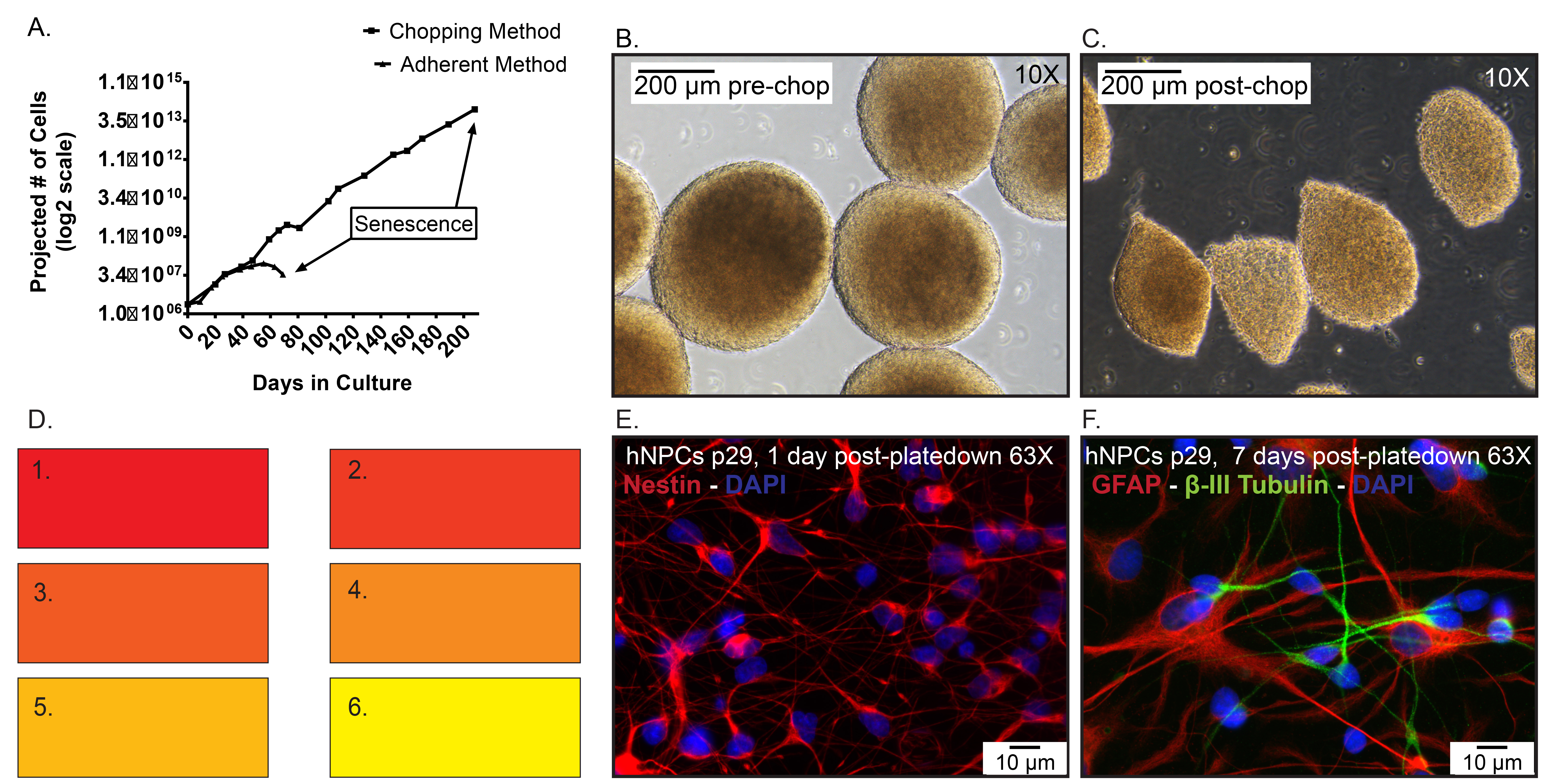
أرقام الخلية رقم 5. البيانات الممثل ألف) المتوقعة من hNPCs المجمدة في P19، ثم إذابة وتوسعت باعتبارها أحادي الطبقة ملتصقة باستخدام تفارق الأنزيمية مقارنة neurospheres passaged عبر أسلوب ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
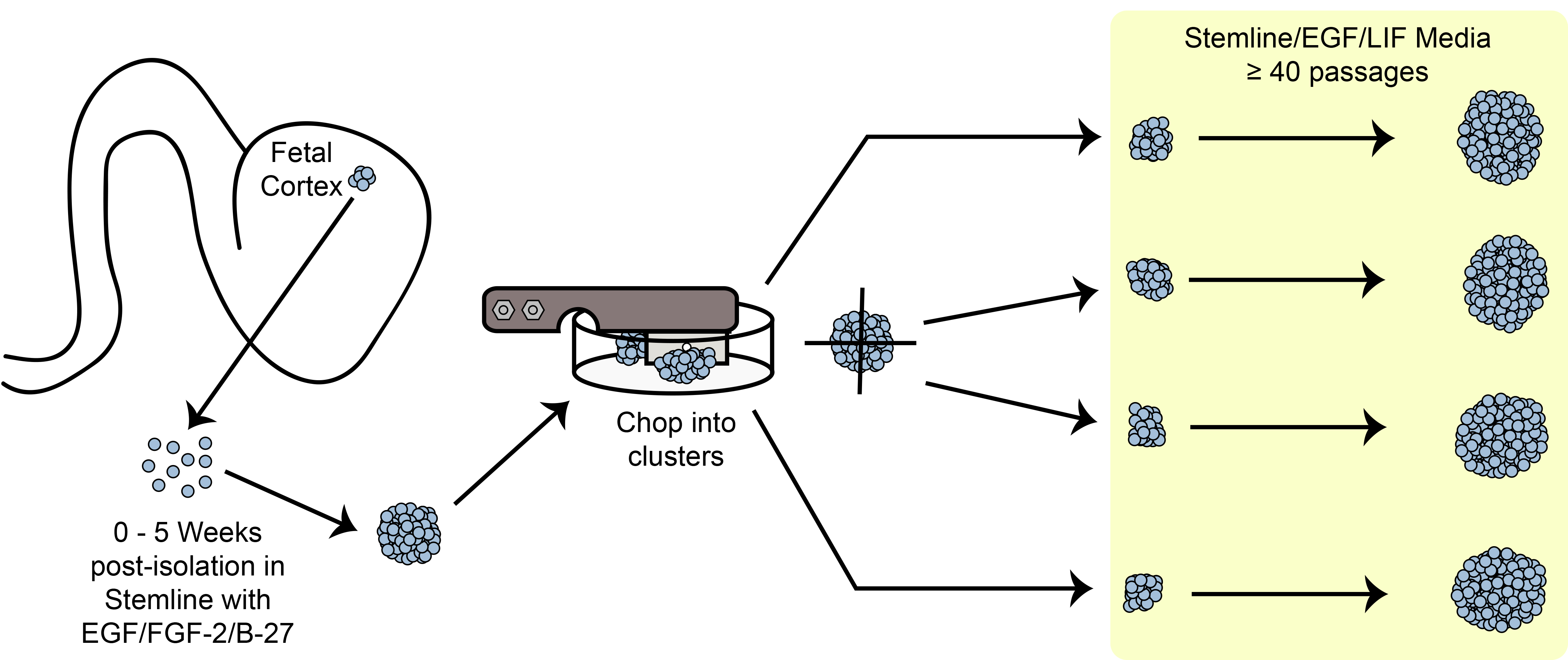
الرقم 6. تقطيع تخطيطي. توسيع الخلايا الجذعية كروي / السلف في الثقافة باستخدام طريقة تقطيع الميكانيكية.
خطوات حاسمة
Access restricted. Please log in or start a trial to view this content.
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر الدكتور Soshana سفندسن لمراجعة نقدية وتحرير هذا التقرير. وقد ساهم هذا العمل من قبل المعاهد الوطنية للصحة / NINDS 1U24NS078370-01 وCIRM DR2A-05320.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Beaker, 50 ml | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 ml inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 ml | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 ml | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 ml | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 ml | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 ml | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 ml | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern - Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37 °C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1-10 μl | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100-1,000 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2-20 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20-200 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μl | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1,000 μl | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μl | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μl | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 ml | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 ml | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 ml | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 ml | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1x) | Life Technologies | 12563-011 |
References
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. - IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 Forthcoming.
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. iP. S. C. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue. The corresponding author was changed from:
Brandon C. Shelley
to:
Clive Svendsen
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved