É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Método de Expansão cGMP-aplicável para Agregados de Neural Humano-tronco e células progenitoras derivadas de células-tronco pluripotentes ou tecido cerebral do feto
Neste Artigo
Erratum Notice
Resumo
Este protocolo descreve um método de desbastamento mecânico novela que permite a expansão de células progenitoras e estaminais neurais agregados esféricos sem dissociação de uma única suspensão de células. Manter contato célula / célula permite um crescimento rápido e estável por mais de 40 passagens.
Resumo
A técnica de expansão de células de acumular um grande número de células a partir de uma única amostra para experimentos de pesquisa e ensaios clínicos beneficiariam muito a comunidade de células-tronco. Muitos métodos de expansão atuais são trabalhoso e caro, e os que envolvem a dissociação completa pode causar vários tipos de tronco e células progenitoras se submeter a diferenciação ou senescência precoce. Para superar estes problemas, foi desenvolvido um método de passagens em mecânico automatizado designado por "picar" que é simples e barato. Esta técnica evita a dissociação química ou enzimática em células individuais e em vez permite a expansão em grande escala de culturas em suspensão, esferóides que mantêm contacto célula / célula constante. O método de cortar tem sido principalmente utilizado para células progenitoras fetais derivadas do cérebro neurais ou neuroesferas, e, recentemente, tem sido publicado para utilização com as células estaminais neurais derivadas de células estaminais embrionárias pluripotentes e induzidos. O processo envolvendoes semeando neurospheres em uma cultura de tecidos de Petri e, posteriormente, de passagem, uma lâmina afiada estéril através das células efetivamente automatizando o processo tedioso de manualmente dissociar mecanicamente cada esfera. Suspender as células em cultura proporciona uma relação de superfície favorável área para volume; como mais de 500.000 células podem ser cultivadas num único neuroesfera de menos de 0,5 mm de diâmetro. Em um balão T175, mais de 50 milhões de células podem crescer em culturas de suspensão em comparação com apenas 15 milhões em culturas aderentes. É importante ressaltar que o processo de corte tem sido utilizado com uma corrente de boas práticas de fabricação (cGMP), permitindo a produção em quantidade em massa de produtos celulares clínica grau.
Introdução
Há uma longa história de expansão de células-tronco neurais de roedores na cultura tanto como uma monocamada 1-3 ou 4-7 neurospheres agregados. Além disso, as células progenitoras neurais humanas (hNPCs) isolados a partir de várias regiões do sistema nervoso central em desenvolvimento 8-17 foram expandidas in vitro. Estas células são bi-potente, capaz de se diferenciar em ambos os astrócitos e neurônios e tem sido uma ferramenta muito útil no estudo do desenvolvimento neural 18,19 e doença mecanismo 20,21. hNPCs também têm sido transplantados em diversos modelos animais diferentes de doenças do sistema nervoso central, com diferentes níveis de integração, de sobrevivência e de efeitos funcionais 22-24.
Tradicionalmente, o roedor ou NPCs fetais derivadas de humanos são expostas a factores de crescimento - factor de crescimento epidérmico, muitas vezes (EGF) e / ou fator de crescimento de fibroblastos-2 (FGF-2) 25-28 - e ambos aderente 29 e trêsSistemas de esferóides-dimensionais são tipicamente repicadas utilizando dissociação enzimática numa suspensão de células individuais 30-34. O método padrão para expandir as células para a pesquisa ou uso clínico é como uma monocamada aderente devido à manipulação fácil. No entanto, temos mostrado que monocamada passaging e neuroesferas hNPCs com enzimática ou soluções químicas resultou em senescência precoce 35. Além disso, a dissociação enzimática pode resultar em níveis aumentados de diferenciação e alterações cariotípicas com base em dados demonstrados com células estaminais embrionárias 36-38. Embora o método padrão de hNPCs Passaging produziu atual boas práticas de fabrico (GMP) produtos de qualidade que passaram para a fase 1 de ensaios clínicos (Stem Cells Inc., Neuralstem Inc.), o método permitiu apenas algumas rodadas de amplificação celular, limitando a potencial bancário.
Claramente, as grandes experiências de pesquisa e ensaios clínicos futuros poderiam se beneficiar da capacidade depropagar células a granel e com a senescência tardia para permitir o crescimento em grande escala e bancos de células. Para atender a essa necessidade, desenvolvemos uma maneira nova e automatizada de neurospheres intactas Passaging mecanicamente por "cortar" os em pequenos grupos para manter contato célula-célula. Este método aumentou grandemente o seu tempo de vida e 39 de suspensão de cultura permite uma utilização mais eficiente do espaço da incubadora em comparação com as culturas de monocamada, como pode ser visto com um método de cultura de biorreactor 3D alternativa 40. O protocolo de desbastamento fornecida permite a produção de grandes bancos de uma amostra fetal maior do que a passagem 10, uma tarefa pouco provável usando métodos Passaging padrão. Enquanto este método para hNPCs Passaging é pouco convencional, que está crescendo em popularidade e foi recentemente publicado com outros tipos de células, como as células-tronco neurais derivadas de embriões humanos e células-tronco pluripotentes induzidas, permitindo a expansão em grande escala para várias aplicações, incluindo em vmodelagem de doenças ITRO 41-46. Importante, uma cGMP-grau hNPC banco de células já foi produzida com o método de corte, o que demonstra que a técnica pode ser aplicada para aplicações clínicas futuras.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Declaração de Segurança e Ética
- Este procedimento envolve a utilização de produtos de cultura de células derivadas a partir de seres humanos ou animais. Todos os tecidos derivados devem ser aprovados antes do uso pelo Conselho de Revisão Institucional apropriado (s) e / ou Animal Care e Use Comitê Institucional (s).
- Todos os resíduos bio-perigosos devem ser eliminados de acordo com as normas de segurança decididas pela respectiva instituição. Conhecer e seguir todas as orientações de segurança e eliminação pertinente ao longo deste processo.
2. Preparação de equipamentos, suprimentos, reagentes e Observações
- Preparação
- Obter uma placa de Petri de vidro, filtro círculos de papel 8,5 centímetros e lâminas de preparação de ponta dupla.
- Coloque um pedaço de papel de filtro numa placa de Petri e transferir várias lâminas desnudadas para o papel de filtro na caixa de Petri.
- Repetidamente papel de filtro de camada e lâminas até a placa de Petri é de aproximadamente 75% de sua capacidade, sagacidade coverh Petri tampa prato e autoclave. Armazene em um ambiente estéril ou fechado para preservar a esterilidade.
- Autoclave 18 centímetros fórceps e uma porca-motorista autoclave em uma bolsa de esterilização. Para a produção de cGMP, autoclave vários discos de calços de aço inoxidável em bolsas de esterilização. Para mais informações sobre o disco de calço, veja o passo 3.5.
- Higienizar o gabinete bio-segurança (BSC), com 70% de álcool isopropílico (IPA).
- Todos os procedimentos devem ser efectuados de um BSC para manter a esterilidade. Transferir assepticamente o seguinte para o BSC:
- McIlwain Tissue Chopper (helicóptero). Limpe todas as superfícies com 70% IPA, especialmente o braço helicóptero (Figura 1B). Todo o helicóptero pode ser descontaminados utilizando óxido de etileno, se necessário.
- Uma autoclavado nut-driver ou noz-chave (incluído com o helicóptero, a Figura 1I), uma pinça de 18 centímetros, um conjunto de micropipetas de tamanho padrão (20 mL-1, 000 mL), uma pipetaid e racks tubo.
- Estéreis descartáveis pipetas sorológicas, pontas de pipeta barreira, 15 ml tubos cônicos, 60 mm placas de Petri, lâminas de preparação de ponta dupla e frascos T de tamanho adequado. ATENÇÃO: Só lidar com as lâminas afiadas com um fórceps.
- Reagentes
- Expandir hNPCs em Manutenção meios (MM) constituídos por Neural Stem meio de expansão celular, de EGF a 100 ng / ml e de Factor Inibidor da Leucemia (LIF), a 10 ng / ml. Transfira os reagentes e dispositivo (s) de filtragem necessários para preparar a mídia para o BSC.
- Re-suspender o EGF liofilizado usando Neural Stem Médio expansão celular e preparar alíquotas a 100 mg / ml para armazenar a -80 ° C por até 1 ano. LIF é armazenado como adquirido a 4 ° C durante até 6 meses ou a data de validade dada pelo fabricante.
- Transferir reagentes mm no BSC. Combine todos os reagentes em um dispositivo de filtração e filtro de tamanho apropriado utilizando um aparelho de vácuo. Armazenar a 4 ° C por até 3 semanas.
- hNPC Observações
- Os dois fatores mais importantes para resolver antes de cortar é diâmetro da esfera e da mídia condicionado ou cor. O meio condicionado (CM) é definida como o meio que foi metabolizado pelas hNPCs em cultura sob condições de incubadora (37 ° C, 5% de CO 2, 95% de humidade). Como as células metabolizam os meios de comunicação o componente vermelho de fenol mudará de uma rosa a cor amarela significa um ambiente mais ácido (Figura 5D).
- Segure o frasco (s) de hNPCs contra a luz para tratar a cor da mídia (ver discussão para mais detalhes).
- Examine o frasco com um microscópio para observar as células. Use um retículo para examinar o tamanho esfera. Se muitas esferas têm um diâmetro de 300 mm, ou superior, prosseguir com o processo de corte. Pique as células a cada 7-10 dias.
- Se um golpe não se justifica, a troca de 25-75% da CM com meios frescos a cada 3-4 dias, dependendo da rapidez com que as células são metabolizando a mídia. Contratinuar a troca de mídia até que as esferas são a grande o suficiente para a passagem.
- hNPCs são normalmente cortados com uma razão de 1:2, a partir de frascos pequenos para frascos maiores. Use a Tabela 1 como um guia de referência para as recomendações de tamanho e volume frasco.
| Frasco | Volume de mídia totais | Pré-Chop | → | Pós-Chop |
| 1 T12.5 | 5 ml | 1 T12.5 | → | 1 T25 |
| 1 T25 | 10 ml | 1 T25 | → | 1 T75 |
| 1 T75 | 20 ml | 1 T75 | → | 1 T175 |
| 1 T175 | 40 ml | 1 T175 | → | 2 T175s |
| 2 T175s | 80 ml | 2 T175s * | → | 4 T175s |
| * 2 T175s é o número máximo de garrafas que podem ser cortados de uma vez. Pique em conjuntos de 2 T175s e referem-se a etapa 7. | ||||
Tabela 1. HNPC paradigma expansão. Descrição de um esquema de expansão típico para hNPCs. É padrão para expandir de duas vezes volumetricamente a cada 7-10 dias.
3. Setup Chopper
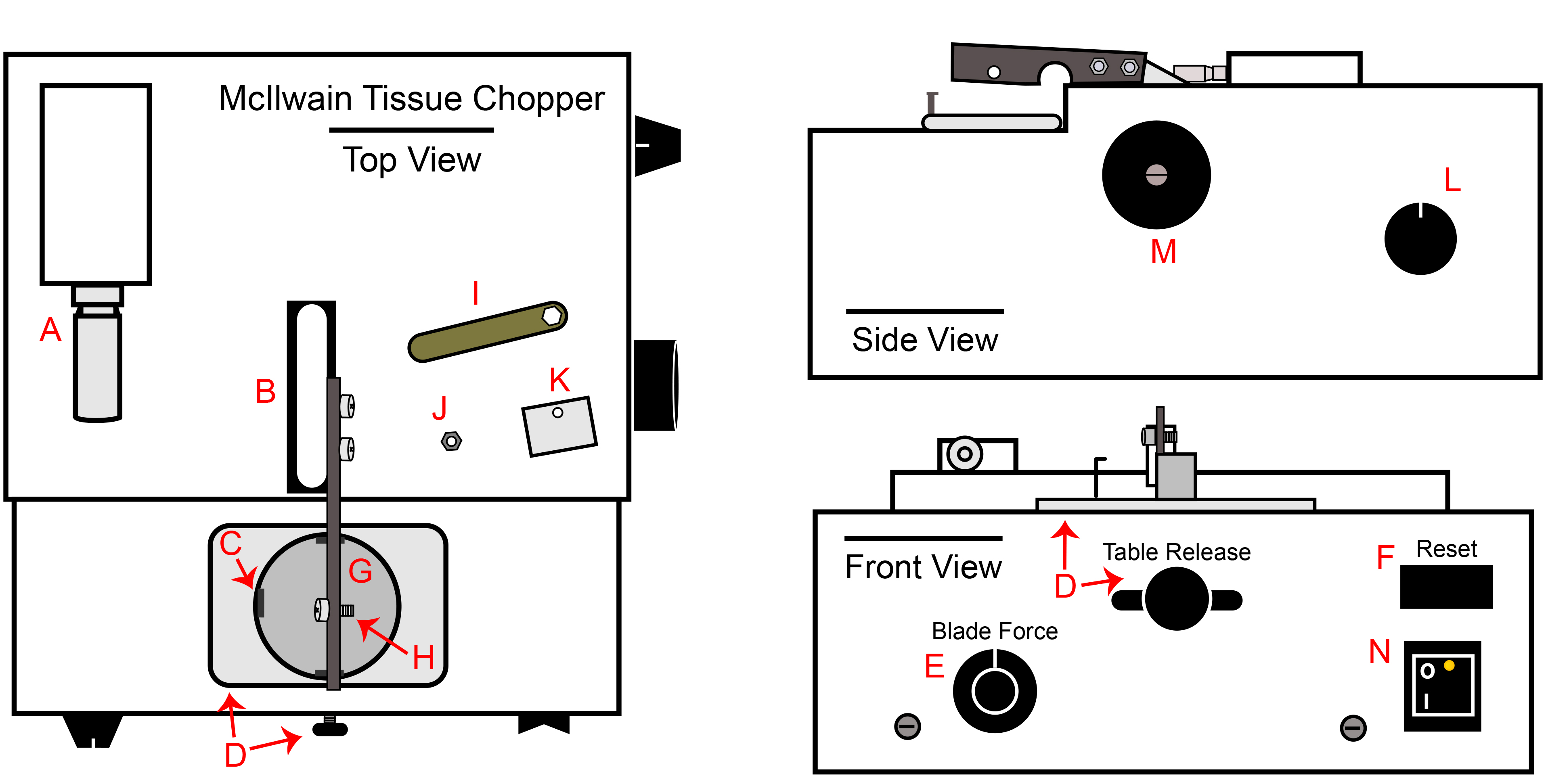
Figura 1. McIlwain Chopper Tissue. A) Pique micrômetro ajuste de espessura, B) Chopper base do braço eo braço ligado, C) Gancho em suporte da placa para placa de Petri, D) botão de liberação de mesa e tabuleiro, E) botão de controle de força Blade, F) Resetar switch, G) suporte da placa, H) Parafuso de fixação para lâmina, fecho e porca, I) Chave Porca incluído com helicóptero, J) porca Lâmina / fecho, K) Lâmina fecho, L ) botão de controle de velocidade de corte automático, M) botão de operação manual de cortar o braço, N) Interruptor de alimentação.
- Ligue o helicóptero a uma tomada no BSC e ligue o interruptor de alimentação (Figura 1 N). Defina a distância de cortar até 200 mM (Figura 1A). Defina a força da lâmina de 270 ° ou 09:00 se o botão foi um relógio (Figura 1E). Confirme se o botão de velocidades automática é girada tanto para a esquerda quanto possível. (Figura 1D).
- Mover a libertação tabela todo o caminho para a direita confirmar o suporte da placa é estável (Figura 1D).
- Gire a manual braço manipulador no sentido horário para levantar o braço ao seu nível máximo (Figura 1M). O braço manual do manipulador deve ser apenas no sentido horário rodado.
- Transferir assepticamente uma estéril, lâmina de corte de dois gumes para o helicóptero braço parafuso usando um par de fórceps (Figura 1H).
- Conclua esta etapa apenas para cGMP passaging, como a placa de Petri por si só é suficiente para o processamento de pesquisa de grau. Como observado no passo 2.1.4, discos calços colocados dentro da base de placa de Petri são necessários para a cGMP. O disco calço impede cacos de plástico a partir de incorporar as esferas durante o processo de corte. Para cada golpe planejado, transferir um disco de calços na base de cada placa de Petri e cobertura.
- Assepticamente colocar o fecho (Figura 1K) sobre a lâmina utilizando fórceps. A parte curva do gancho deve ser ao longo da borda superior do braço. O fecho não vai ficar no braço até que a porca foi firmemente formado. Use a pinça para segurar as clasp sobre o braço e segura a porca (Figura 1J) no parafuso com a porca estéril-driver. Deixe a porca de um ¼ de volta solto.
4. Pré-chop Procedimento
- Transferir o volume sugerido de MM para o novo frasco (s) de acordo com Tabela 2, coluna C.
- Transferir assepticamente as células da incubadora para o BSC. Incline o frasco (s) em um rack de tubo (Figura 2A) e permitir que as esferas se estabelecer no frasco (s).
- Uma vez instalado, aspirar-se para 12 ml de sobrenadante com 5 ml ou 10 ml de pipeta serológica e lavar todas as esferas fracamente aderentes a partir da superfície do recipiente de vidro (s). Repita conforme necessário e resolver as esferas entre lavagens.
- Transferir o volume sugerido de CM para o novo frasco (s) de acordo com a Tabela 2, Coluna D. Passaging Se dois ou mais frascos T175, veja o passo 7.1.
- Transfira todos os restantes CM e esferas em um novo tubo de 15 ml. Permitir que as esferas para settle e descartar o balão utilizado (s).
- Passo Crítico: Lentamente transferir as esferas do tubo de 15 ml para a placa de Petri 60 mm ou disco calço no volume viável menor; 0,1-0,5 ml é recomendada (Figura 2B). Manter o volume restante de MC, uma vez que irá ser usada para enxaguar as células do prato de pós-pique. Tente minimizar a área de superfície coberta pela mídia e esferas no prato (Figura 2C).

Figura 2. Preparação Sphere para cortar. A) Incline o frasco (s) contra um suporte de tubos ou item semelhante para liquidar as esferas no canto do balão. B) Transferir as esferas tão densamente quanto possível do tubo cônico ao Petri prato. C) Reunir as esferas do tubo cônico em tele meio da placa de Petri. D) Remover tanto sobrenadante quanto possível, a partir do topo das esferas reunidas. E) para espalhar as esferas para fora através do lado de uma ponta de micropipeta de plástico. F) mover suavemente as esferas para um lado da piscina esferas. G) Exemplo de esferas que foram movidos para um lado da piscina para facilitar a remoção da mídia. H) Condensado espalhar-se sobre a placa de Petri, pronto para cortar. Clique aqui para ver imagem ampliada.
- Em seguida, as esferas têm de ser condensado, removendo o sobrenadante transferido por no passo 4.6. Transferir o sobrenadante para trás para dentro do tubo cónico de 15 ml, com uma ponta de micropipeta de barreira de aerossol (Figura 2D), evitar a remoção de esferas. Comece por retirar o máximo de mídia como possível a partir do topo da piscina media / celular. Quando não é possívelpara remover a mídia sem esferas, passe para o passo seguinte.
| Coluna A | Coluna B | A coluna C | Coluna D | Coluna E | Coluna F | |
| Pré-Chop Flask Tamanho | → | Pós-Chop Flask (s) Tamanho | Volume sugerido de MM para transferir para novo frasco (s) pré-chop | Volume sugerido de CM transferir para novo frasco (s) pré-chop | Volume sugerido de esferas / mídia para transferir para novo frasco (s) pós-chop | Volume final semeado / Flask |
| T12.5 | → | T25 | 5 ml | 0 ml | 5 ml | 10 ml |
| T25 | → | T75 | 10 ml | 0 ml | 10 ml | 20 ml |
| T75 | → | T175 | 20 ml | 10 ml | 10 ml | 40 ml |
| 1 T175 | → | 2 T175s | 20 ml por frasco | 15 ml por frasco | 5 ml por frasco | 40 ml |
| 2 T75s | → | 4 T175s | 20 ml por frasco | 17,5 ml por frasco | 2,5 ml por frasco | 40 ml |
Guia de transferência Tabela 2. Mídia pré / pós-chop. Volumes sugeridos para usar durante o processo de corte.
- Espalhar a piscina utilizando o lado da ponta da pipeta para aumentar a área de superfície (Figura 2E).
- Passo Crítico: Sugestão a placa de Petri um pouco para você e use o lado da ponta da pipeta suavemente slide todas as esferas para um lado da piscina (figura 2F, L).
- Passo Crítico: Quando todas as células foram realocados, incline lentamente a placa de Petri na direção oposta. Durante o processo, os meios isolados fluirá longe das esferas. Transfira a mídia de volta para o tubo cônico de 15 ml. Remoção esfera mínima é aceitável.
- Usar o lado da ponta da pipeta a deslizar suavemente todas as esferas de volta para o centro da placa de Petri de modo a piscina tem um diâmetro de 0,5-2,4 cm (Figura 2H). É importante manter a profundidade da esfera piscina rasa. Se a piscina é muito profundo, as esferas vão simplesmente ser deixado de lado durante a cortar. NOTA: O diâmetro da esfera da piscina não pode ser maior do que 2,5 cm, ou a lâmina em contacto com as bordas da placa de Petri, ausente nas células.
5. Pique Procedimento
- Transfira a placa de Petri para o suporte da placa (Figura 1G) e garantir o pratoé fixada sob os ganchos suporte da placa (Figura 1C).
- O botão de liberação tabela tem entalhes onde vai se encaixar na engrenagem. Use o botão de liberação da tabela para deslizar o suporte da placa para a esquerda de modo que a lâmina é claro das esferas e trancado em marcha (Figura 1D).
- Passo Crítico: Abaixe o braço de helicóptero girando o botão manipulador manual (Figura 1M) no sentido horário até que a lâmina se encaixe para baixo flat na placa de Petri. Use uma mão para pressionar para baixo no monte braço (Figura 1B) enquanto aperta a porca com o nutdriver.
- Aperte o botão de reset uma vez (Figura 1F). Firme a placa de Petri com uma mão enquanto gira o botão braço manipulador automático (Figura 1L) no sentido horário para a posição 90 ° ou 12:00 se o botão foi um relógio. ATENÇÃO: Mantenha os dedos longe da lâmina em movimento em todos os momentos.
- Passe a lâmina totalmente através do pool de esferas. Gire o suporte da placa90 °.
- Solte o parafuso e repita o passo 5,3-5,5.
- Transferir assepticamente a placa de Petri de suporte da placa em um espaço de trabalho no BSC.
6. Pós-chop Procedimento
- Primeiro de 10 ml pipeta sorológica com o CM no tubo cônico do passo 4.6 e, em seguida, transferir 1 ml para as esferas picadas. Delicadamente, re-suspender e transferir para um novo tubo de 15 ml. Evite bolhas e repita quantas vezes for necessário para coletar as esferas picadas.
DICA: Minimizar raspar o prato como fragmentos de plástico podem decolar. Esta não é uma preocupação se usando os discos de calços de aço inoxidável. Cuidado com células inerentes ao interior da pipeta sorológica. Se isso ocorrer, bolhas aspirado intermitentemente através de meios de comunicação na pipeta para retirar as células. - Meça o volume de CM e esferas picadas. Adicionar o volume apropriado de MM para atingir o volume listados na Tabela 2, a coluna E.
- Tritura-se oEsferas 2-3x para quebrar quaisquer esferas vagamente fundidas.
- Passo Crítico: Alíquota da suspensão esfera em cada novo frasco. Só transferir a suspensão esfera em um frasco de cada vez, e re-suspender as esferas entre as transferências. Alíquotas vários frascos de cada vez resulta em um número desproporcionado de esferas em cada frasco. O volume final em cada frasco deve igualar os volumes na Tabela 2, Coluna F. Ver passo 7.2 semeando quando maior do que dois frascos T175.
- Remova a porca com o motorista-porca e depois o fecho com a pinça estéreis. Descontaminar adequadamente com 70% IPA ou equivalente. ATENÇÃO: Remova a lâmina cortando usado apenas com uma pinça e descarte em um recipiente para objectos cortantes bio-perigo.
- Descontaminar todas as superfícies do triturador com 70% de IPA.
. 7 variações do processo - diversos frascos
Existem várias diferenças quando Passaging mais de dois T175s. O passos abaixo são alterações da etapa referenciado.
- Referências para o passo 4.4:
- Quando passaging dois T175s, combinar todos os meios de comunicação e esferas em frascos T175. Permitir que as esferas para assentar e depois divida em alíquotas o volume apropriado de CM em cada um dos novos frascos tal como indicado na Tabela 2, coluna D. Prosseguir para o passo 4.5.
- Quando passaging maior do que dois T175s, obter um novo frasco T175 e rotular como o balão CM. Complete a etapa 7.1.1 mas transferir o CM para o balão CM. Armazenar o frasco do lado do BSC para ser usado para recolher o CM a partir de todos os frascos até que todos os frascos foram picados. Em seguida, o CM serão igualmente divididas em alíquotas para cada um dos novos frascos.
- Passo Referência 6.4 - Quando cortar a mesma linha celular várias vezes, transferir a suspensão esfera picado em um novo frasco T75 esferas rotulados de pós-pique e registrar o volume transferido. Continuar para combinar as células nestegarrafa depois de cada costeleta e armazenar o frasco na estufa a 37 ° C, 5% de CO 2, 95% de humidade. Depois de todas as costeletas de ter sido concluída, divida em alíquotas da suspensão esfera no volume para cada novo frasco. Avance para o passo 6.5.
8. Criopreservação
O protocolo a seguir é para preservar criogenicamente hNPCs.
- Descongelar meio de congelação de células em um banho de água potável a 37 ° C e, em seguida, armazenar em gelo. Célula congelação meio pode ser distribuído por alíquotas e guardado a -80 ˚ C durante até 6 meses.
- Fogo de vidro polonês pipetas Pasteur, girando a abertura da pipeta em uma chama. Preparar pelo menos dois grandes e dois polido ao fogo pipetas pequeno furo (Figura 3). As esferas serão dissociadas movendo de grandes para pequenas pipetas furo.
- Coloque TrypLE Select no banho de água a 37 ° C durante 5 min. Remover e manter à temperatura ambiente até que esteja pronto para uso.

Figura 3. Vidro Fire-polimento pipetas Pasteur. A) Segurar a pipeta na parte superior da chama e rotação, a fim de B) Exemplo de um grande furo-fogo polido pipeta de vidro uniformemente em volta das bordas da pipeta de vidro.. C) exemplo de um pequeno furo fogo-polido pipeta de vidro.
- Transferir assepticamente as neurospheres para o BSC. Permitir que as esferas se contentar, inclinando-se o frasco (s) contra um suporte de tubos e lavar o fundo do frasco para remover quaisquer esferas frouxamente aderentes. Permitir que as esferas para reinstalar-se.
- Transferir todo mas 5-10 ml de CM num frasco estéril e medir o volume total. Coloque as restantes esferas e mídia em um tubo cônico.
- Depois de todas as células se instalaram, transferir a totalidade, mas uma pequena menisco do CM para a garrafa e summate o volume.
- Transferência assepticamente 5-10 ml de aquecido TrypLE Select para o tubo cônico e re-suspender o pellet celular. Transfira o tubo cônico na C banho de água 37 ° para 15-20 min. Após 7,5-10 min, agitar suavemente o tubo cônico para misturar.
- Use o volume CM medido a partir do passo 8.5 e preparar um volume igual de MM. Combine e filtrar o CM 50% e solução MM 50% (solução de CM / MM).
- Transferir assepticamente uma peneira de 40 mM em um tubo de 50 ml.
- Quando a incubação é completa, girar os tubos de 15 ml cônico de 15 segundos a 100 x g.
- Aspirar cuidadosamente e descartar o TrypLE Select e qualquer substrato pegajoso. Deixe uma pequena menisco. Adicionar suavemente 2-4 ml de CM / MM para diluir o restante TrypLE Select enquanto não perturbar o sedimento. Deixe as células desalojadas re-assentar antes de descartar a lavagem.
- Adicionar 2-5 ml MC / MM solução para as esferas de tubo. Dissociar as esferas com uma pipeta de 5 ml por trituração de um máximo de 10x. Deixe a unesferas dissociadas contentar com 1-2 min. Transferir a suspensão de células dissociadas sobre o crivo de 40 mM para remover aglomerados totalmente não dissociada.
- Repita o passo 8,12 com um grande furo pipeta de vidro-fogo polido e, em seguida, uma pipeta de vidro de pequeno calibre.
- Lavar o filtro com 2-5 ml de solução de CM / MM.
- Misture a suspensão de células e retirar amostras para análise de viabilidade.
- Diluir as amostras com azul de tripan em um factor de diluição adequado e contar. Utilizar a equação padrão abaixo para calcular a concentração de células viáveis média e calcular o total de células viáveis.

- Calcular o volume total de meio de congelação de células necessária para re-suspender as células em 5,0 x 10 6 células / ml. 1 ml de células serão semeadas em cada frasco de congelação. Transferir os criotubos no BSC.
- Centrifugar a suspensão de células a 200 xg por 5 min a 4 ° C em 15 mtubos cônicos l para melhor rendimento. Se 50 ml tubos cónicos são usados para congelar um grande escala para baixo, aumenta a taxa e tempo de 400 xg durante 10 min.
- Re-suspender o sedimento de células utilizando o meio de congelação de células a 5,0 x 10 6 células / ml. Aliquota de 1 ml de suspensão celular em cada frasco de congelação. Para uma distribuição regular, aspirado 6 ml de suspensão e alíquotas 5 criotubos x 1 ml. Transfira os restantes 1 ml de suspensão de volta para o pool de células. Repetir até todos os frascos foram preenchidos.
- Assepticamente selar todos os criotubos sem sementes e transferi-los para gelo por 5-10 min.
- Use uma das seguintes opções para estratégias de criopreservação para preservar os hNPCs: Álcool isopropílico Câmara
- Encher o número necessário de câmara (s) com 100% de IPA, à temperatura ambiente.
- Transferir os criotubos semeados de gelo dentro da câmara (s) e transferir a câmara (s) em um congelador a -80 ° C durante a noite. As células são estáveis durante até uma semana à temperatura de -80 ° C, no entanto, sugere-se a transferir os frascos para armazenamento de azoto líquido a longo prazo, no dia seguinte.
Controlado Taxa Freezer
- Carregar um programa de congelamento apropriado para o software do congelador taxa controlada. Um programa de exemplo é apresentado na Tabela 3. Figura 4 mostra uma curva típica de congelação para hNPCs. No entanto, o programa exato vai variar para cada modelo de congelador. A taxa padrão da amostra total deve ser cerca de -1 ° C / min até atingir -40 ° C, onde a taxa de congelamento pode ser aumentada substancialmente a pelo menos -80 ° C.
| Passo | Taxa de (° C) | Temperatura final (° C) | Segure (min seg) | Gatilho |
| 1 | - | - | 5 min 0 sec | Câmara |
| 2 | - 1,3 | - 5 | - | Amostra |
| 3 | - | - | 1 min 0 sec | Câmara |
| 4 | - 45 | - 58 | - | Câmara |
| 5 | + 10 | - 26 | - | Câmara |
| 6 | + 3 | - 23 | - | Câmara |
| 7 | - 0,8 | - 40 | - | Amostra |
| 8 | - 10 | - 100 | - | Câmara |
| 9 | - 35 | - 160 | - | Câmara |
Tabela 3. Passos para congelamento hNPCs em um r controladocomeu congelador. Programa sugerido para hNPC criopreservação em um freezer taxa controlada.

Curva de congelação Amostra Figura 4.. Curva de congelação típica para hNPCs sobre um congelador de taxa controlada.
- Transfira os criotubos de gelo nos cestos associados ao congelador taxa de controle. Certifique-se de carregar um cryovial com apenas células congelamento mídia a ser usada para a sonda de temperatura da amostra. Transfira os cestos para a câmara de congelamento e colocar a sonda de amostra no frasco sonda. Inicie o programa.
- Quando o protocolo foi completado, transferir os frascos para armazenagem de azoto líquido a longo prazo.
9. Descongelamento Procedimento
O protocolo a seguir é para o descongelamento criogenicamente phNPCs reservados.
- Transfira os criotubos de armazenamento de nitrogênio líquido imediatamente em gelo seco. ATENÇÃO: Os frascos podem ter rachaduras ou tampas soltas permitindo nitrogênio líquido para entrar no frasco. Quando removido de condições de congelamento profundo, o líquido pode ferver, explodindo o frasco imediatamente. Use EPI adequado ao remover os frascos.
- Prepare a todos os reagentes e fornecimentos abaixo antes do tempo. Uma vez que o processo de descongelamento tenha começado, é crítico para seguir de forma eficiente.
- Transferir Neural Stem Expansão celular Médio, MM, um tubo de 15 ml, um 2 ml e 10 ml uma pipeta sorológica para cada cryovial no BSC.
- Um mínimo de 9 ml de Neural Stem meio de expansão celular e 5 ml de MM é necessário para cada frasco. Prepare mais de cada mídia, se necessário.
- Só descongelar um frasco de hNPCs de cada vez. Transfira as células congeladas de gelo seco em um 37 ° C banho de água limpa e agitar o frasco no banho de água continuamente. Monitorar o volume degelo que tenha derretido. Quando existe um pedaço de gelo de cerca de 0,5 cm à esquerda no recipiente, pulverizar e limpar com 70% de álcool isopropílico e transferir para o BSC.
- Transferir o conteúdo do criotubo para um tubo cónico de 15 ml com uma pipeta de 2 ml serológico. Adicionar 1 ml de Neural Stem Médio Expansão celular para o vazio cryovial e depois transferir 8 ml de Neural Stem Médio Expansão celular para as células descongeladas em um processo lento, queda forma sábia, agitando suavemente o tubo. Isto é feito para reduzir o risco de choque osmótico.
- Transferir a lavagem do criotubo para os 9 ml de suspensão de células. Transfira o tubo cônico em gelo e repita os passos de 9,4-9,5 para todos os frascos restantes.
- Centrifugar os tubos cónicos a 200 xg durante 5 min a 4 ° C. Durante a centrifugação, preparar um número adequado de recipientes para sementeira com base na Tabela 4.
| # De frascos | Volume Sementeira Total (ml) | Frasco |
| 1 | 5 | T12.5 |
| 2 | 10 | T25 |
| 3 | 15 | T75 |
| 4 | 20 | T75 |
| 5 | 25 | T75 |
| 6 | 30 | T175 |
| 7 | 35 | T175 |
| 8 | 40 | T175 |
| 8 + | - | Combinação de frascos |
Tabela 4. Tamanhos Garrafa com base no número de criotubos descongelados. Volume sugerido e tamanho frasco para semear hNPCs pós-descongelamento.
- Re-suspender e combinar todos os tubos em um volume apropriado de MM com base na Tabela 4. Misturar bem e remover uma amostra para contagem de viabilidade. Veja os passos 8,15-8,16 para contar detalhes. A gama de semeadura padrão é entre 160,000-320,000 células / cm 2.
- Misture as células bem e Alíquota da células em frascos. Transferir os frascos para um de CO 2/37 ° C/95% de humidade incubadora de 5%. Misture o frasco suavemente balançando frente e para trás para distribuir uniformemente as células.
- As células vão formar esferas dentro de 24-48 horas. Ocasionalmente, as células aderem à superfície do plástico e formar uma distribuição de colónias de favo de mel. Se isto ocorrer, deixar as células durante 3 dias antes de enxaguar as células solta, auxiliando na formação de esfera. Lavar a cada 1-3 dias até que não haja células aderentes. Se necessário, a transferência das células para um novo frasco.
- Taxas de 25-75% dos meios de comunicação com MM a cada 3-4 dias até que as células estão prontos para picar, geralmente 7-14 dias pós-descongelamento.
Access restricted. Please log in or start a trial to view this content.
Resultados
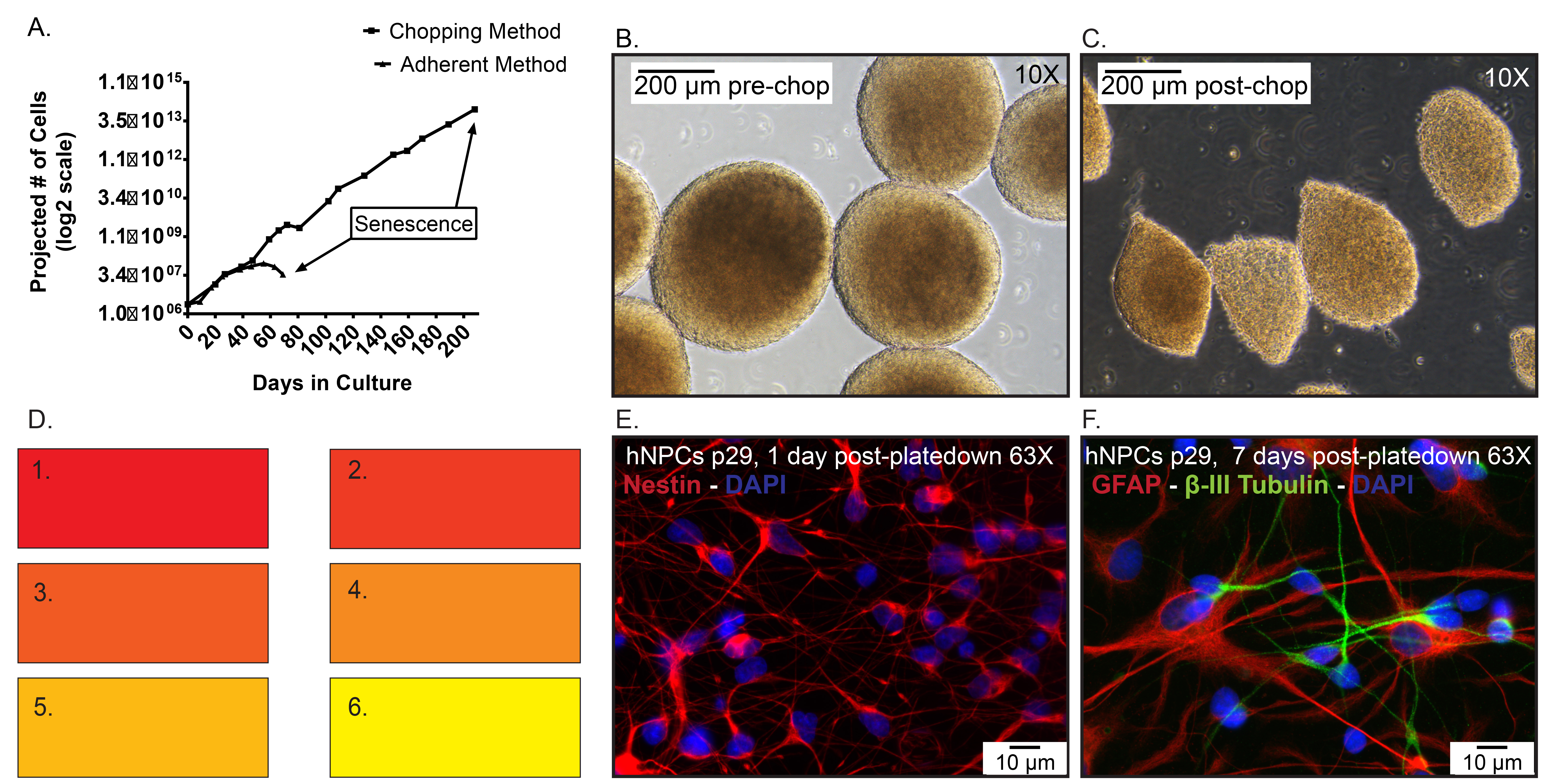
Número de células Figura 5. Dados representativos. A) Projeção de hNPCs congelados a p19, depois descongelado e expandida como uma monocamada aderente usando dissociação enzimática em comparação com neurospheres subculturas através do método de cortar. Dia 0 representa quando as células foram descongeladas a p20. B) Imagens r...
Access restricted. Please log in or start a trial to view this content.
Discussão
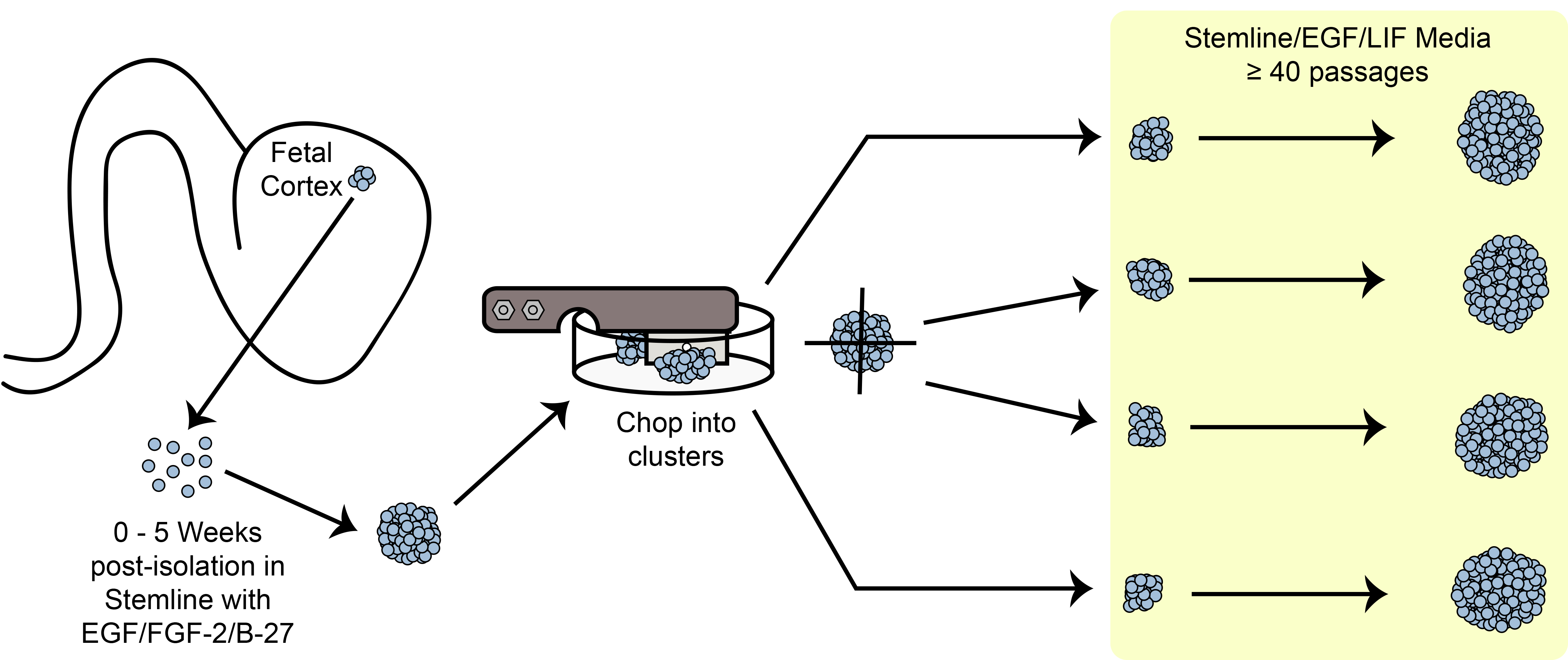
Figura 6. Chopping esquemática. Expansão de células-tronco esferóide / progenitoras em cultura utilizando o método de corte mecânico.
Etapas críticas
Uma visão geral sobre o paradigma expansão corte é mostrado na Figura 6. Tamanho esfera hNPC é um dos critérios importa...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Dr. Soshana Svendsen para análise crítica e edição deste relatório. Este trabalho foi contribuído para pelo NIH / NINDS 1U24NS078370-01 e CIRM Dr2a-05320.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Beaker, 50 ml | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 ml inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 ml | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 ml | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 ml | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 ml | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 ml | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 ml | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern - Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37 °C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1-10 μl | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100-1,000 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2-20 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20-200 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μl | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1,000 μl | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μl | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μl | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 ml | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 ml | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 ml | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 ml | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1x) | Life Technologies | 12563-011 |
Referências
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. - IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 Forthcoming.
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. iP. S. C. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue. The corresponding author was changed from:
Brandon C. Shelley
to:
Clive Svendsen
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados