È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo di espansione cGMP-applicabile per Aggregati di neurali umane staminali e cellule progenitrici derivate da cellule staminali pluripotenti o fetale tessuto cerebrale
In questo articolo
Erratum Notice
Riepilogo
Questo protocollo descrive un metodo tagliere meccanico romanzo che consente l'espansione di staminali e cellule progenitrici aggregati sferici neurali senza dissociazione di una sospensione di cellule singole. Mantenere il contatto cellula / cellula consente una crescita rapida e stabile per oltre 40 passaggi.
Abstract
Una tecnica di espansione delle cellule ad accumulare un gran numero di cellule da un singolo esemplare per esperimenti di ricerca e studi clinici sarebbe di grande beneficio alla comunità di cellule staminali. Molti metodi di espansione attuali sono laboriosi e costosi, e quelli che coinvolgono completa dissociazione possono causare diversi tipi di staminali e cellule progenitrici di sottoporsi a una differenziazione o all'inizio senescenza. Per superare questi problemi, abbiamo sviluppato un metodo passaging meccanico automatizzato denominato "taglio" che è semplice e poco costoso. Questa tecnica evita dissociazione chimica o enzimatica in cellule singole e invece consente l'espansione su larga scala di sospensione, culture sferoidali che mantengono il contatto cellula / cellula costante. Il metodo di taglio è stato utilizzato principalmente per fetali cellule progenitrici neurali del cervello-derivato o neurosfere, ed è stato recentemente pubblicato per l'utilizzo con le cellule staminali neurali derivate da cellule staminali pluripotenti embrionali e indotte. La procedura involves semina neurosfere su un piatto di coltura di tessuti Petri e in seguito una tagliente, la lama sterile attraverso le cellule automatizzare efficacemente il tedioso processo di manualmente dissociare meccanicamente ogni sfera. Sospendere cellule in coltura fornisce una superficie favorevole rapporto area-volume; come oltre 500.000 cellule possono essere coltivate in un singolo neurosfere inferiore a 0,5 mm di diametro. In un pallone T175, oltre 50 milioni di cellule possono crescere in colture in sospensione rispetto a solo 15 milioni nelle culture aderenti. È importante sottolineare che la procedura di taglio è stata utilizzata in corrente di buona fabbricazione (cGMP), permettendo la produzione di quantità di massa di prodotti di cellule clinico-grade.
Introduzione
C'è una lunga storia di espansione delle cellule staminali neurali roditori nella cultura sia come monostrato 1-3 o neurosfere di aggregazione 4-7. Inoltre, le cellule progenitrici neurali umane (hNPCs) isolati da varie regioni del sistema nervoso centrale sviluppo 8-17 sono state espanse in vitro. Queste cellule sono bi-potente, in grado di differenziarsi in entrambi astrociti e neuroni e sono stati uno strumento molto utile per lo studio dello sviluppo neurale 18,19 e la malattia meccanismo 20,21. hNPCs sono stati trapiantati in molti diversi modelli animali di malattia del sistema nervoso centrale con diversi livelli di integrazione, sopravvivenza e effetti funzionali 22-24.
Tradizionalmente, roditori o NPC fetali derivate umani sono esposti a fattori di crescita - spesso fattore di crescita epidermico (EGF) e / o il fattore di crescita dei fibroblasti-2 (FGF-2) 25-28 - e sia aderente 29 e treSistemi sferoidali-dimensionali sono in genere diversi passaggi utilizzando dissociazione enzimatica in una cella singola sospensione 30-34. Il metodo standard per espandere le cellule per la ricerca o l'uso clinico è come un monostrato aderente a causa di una facile manipolazione. Tuttavia, abbiamo dimostrato che passaging monostrato e neurosfere hNPCs con enzimatici o soluzioni chimiche portato nei primi mesi del senescenza 35. Inoltre, dissociazione enzimatica può provocare un aumento dei livelli di differenziazione e di anomalie del cariotipo sulla base di dati dimostrati con le cellule staminali embrionali 36-38. Anche se il metodo standard di hNPCs Passaging ha prodotto corrente di buona fabbricazione (cGMP) i prodotti di qualità che sono andati in fase 1 studi clinici (Stem Cells Inc., Neuralstem Inc.), il metodo consentito solo un paio di giri di amplificazione delle cellule, limitando l' potenziale bancario.
Chiaramente, i grandi esperimenti di ricerca e studi clinici futuri potrebbero beneficiare della capacità dipropagare cellule in massa e con senescenza ritardata per consentire la crescita su larga scala e banking di cellule. Per rispondere a questa esigenza, abbiamo sviluppato un modo nuovo e automatizzata di neurosfere intatte meccanicamente Passaging da "tagliare" li in piccoli gruppi per mantenere il contatto cellula-cellula. Questo metodo notevolmente aumentato la loro durata di vita 39 e la sospensione della cultura permette un uso più efficiente dello spazio incubatore rispetto a colture monostrato, come si è visto con 3D metodo di coltura del bioreattore alternativo 40. Il protocollo tagliere fornito permette la produzione di banche di grandi dimensioni da un campione fetale maggiore di passaggio 10, un'impresa improbabile utilizzando metodi passaging standard. Mentre questo metodo per hNPCs passaging è non convenzionale, sta crescendo in popolarità ed è stato recentemente, pubblicato con altri tipi di cellule come le cellule staminali neurali derivate da embrioni umani e cellule staminali pluripotenti indotte, consentendo l'espansione su larga scala per varie applicazioni, tra cui in vitro modellazione malattia 41-46. Soprattutto, una banca di cellule hNPC cGMP-grade è già stato prodotto con il metodo tagliere, dimostrando che la tecnica può essere applicata verso future applicazioni cliniche.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Dichiarazione etica e sicurezza
- Questa procedura prevede l'utilizzo di prodotti di coltura di cellule derivate da esseri umani o animali. Tutti i tessuti derivati devono essere approvati prima dell'uso appropriato Institutional Review Board (s) e / o la cura degli animali e del Comitato Usa (s) Istituzionale.
- Tutti i rifiuti bio-pericolosi devono essere smaltiti secondo le norme di sicurezza decise dal rispettivo ente. Conoscere e seguire tutte le norme di sicurezza e smaltimento apposite tutta la procedura.
2. Preparazione di attrezzature, forniture, reagenti, e Osservazioni
- Preparazione
- Ottenere una capsula di Petri di vetro, filtra 8,5 centimetri cerchi di carta e lame di preparazione a doppio taglio.
- Posizionare un pezzo di carta da filtro nella piastra di Petri e trasferire più lame sguainate sulla carta da filtro nella scatola di Petri.
- Ripetutamente filtro layer di carta e lame fino a quando la piastra di Petri è circa il 75% pieno, copertura spiritoh Petri dish coperchio e autoclave. Conservare in un ambiente sterile o chiuso per preservare la sterilità.
- Autoclave 18 centimetri pinze e un autoclavabile dado driver in un sacchetto di sterilizzazione. Per la produzione di cGMP, autoclave diversi dischi spessori in acciaio inox in buste di sterilizzazione. Per ulteriori informazioni relative al disco spessore, vedere il punto 3.5.
- Sterilizzare l'armadio bio-sicurezza (BSC) con il 70% di alcool isopropilico (IPA).
- Tutte le procedure devono essere eseguite in un BSC per mantenere la sterilità. Asetticamente trasferire la segue nel BSC:
- McIlwain Tissue Chopper (chopper). Pulire tutte le superfici con il 70% IPA, in particolare il braccio chopper (Figura 1B). L'intero chopper può essere decontaminato con ossido di etilene, se necessario.
- Un dado driver autoclavato o di noci-chiave (in dotazione con l'elicottero, Figura 1I), uno 18 centimetri pinza, una serie di Micropipettatrici di dimensioni standard (20 ml-1, 000 ml), una pipetaid e cremagliere del tubo.
- Sterili monouso pipette sierologiche, consigli barriera pipette, provette da 15 ml coniche, 60 mm piastre di Petri, lame di preparazione a doppio taglio e dimensioni appropriate fiaschi T. ATTENZIONE: maneggiare solo i taglienti lame con una pinza.
- Reagenti
- Espandere hNPCs in Manutenzione media (MM) costituiti da cellule staminali neurali Piano di espansione, FEG a 100 ng / ml e leucemia inibitorio Factor (LIF) a 10 ng / ml. Trasferire i reagenti e dispositivo di filtraggio (s) necessari per preparare supporti nel BSC.
- Re-sospendere il FEG liofilizzato utilizzando Neural Stem Cell media espansione e preparare aliquote a 100 pg / ml per conservare a -80 ° C per un massimo di 1 anno. LIF è memorizzata come acquistata a 4 ° C per 6 mesi o la data di scadenza indicata dal costruttore.
- Trasferire i reagenti mm nel BSC. Unire tutti i reagenti in un dispositivo di filtraggio di dimensioni adeguate e filtro con un apparato di vuoto. Conservare a 4 ° C per un massimo di 3 settimane.
- hNPC Osservazioni
- I due fattori più importanti da affrontare prima di tagliare è diametro della sfera e supporti di condizionamento o colore. Mezzi condizionati (CM) è definito come mezzo che è stato metabolizzato dal hNPCs in coltura in condizioni incubatore (37 ° C, 5% CO 2, 95% di umidità). Come le cellule metabolizzano i media della componente rosso fenolo si sposterà da una rosa di colore giallo significare un ambiente più acido (Figura 5D).
- Tenere il pallone (s) di hNPCs fino alla luce di affrontare il colore del supporto (vedi la discussione per i dettagli).
- Scansione tramite il pallone con un microscopio per osservare le cellule. Utilizzare un reticolo per esaminare dimensione della sfera. Se molte sfere hanno un diametro di 300 micron o superiore, procedere con il processo di triturazione. Tritare le cellule ogni 7-10 giorni.
- Se un chop non è giustificata, lo scambio 25-75% del CM con mezzi freschi ogni 3-4 giorni a seconda di quanto velocemente le cellule sono metabolizzando i media. Controcontinuare a scambiare media fino a quando le sfere sono abbastanza grandi da passaggio.
- hNPCs sono tipicamente tagliate con un rapporto di 1:2, palloni da piccole a grandi fiaschi. Utilizzare la Tabella 1 come guida di riferimento per dimensioni pallone e volume raccomandazioni.
| Pallone | Volume totale dei mezzi di comunicazione | Pre-Chop | → | Post-Chop |
| 1 T12.5 | 5 ml | 1 T12.5 | → | 1 T25 |
| 1 T25 | 10 ml | 1 T25 | → | 1 T75 |
| 1 T75 | 20 ml | 1 T75 | → | 1 T175 |
| 1 T175 | 40 ml | 1 T175 | → | 2 T175s |
| 2 T175s | 80 ml | 2 T175s * | → | 4 T175s |
| * 2 T175s è il numero massimo di flaconi che possono essere tagliate contemporaneamente. Tritare in gruppi di 2 T175s e si riferiscono al punto 7. | ||||
Tabella 1. Paradigma espansione hNPC. Descrizione di un sistema di espansione tipica per hNPCs. È standard per espandere due volte volumetricamente ogni 7-10 giorni.
3. Setup Chopper
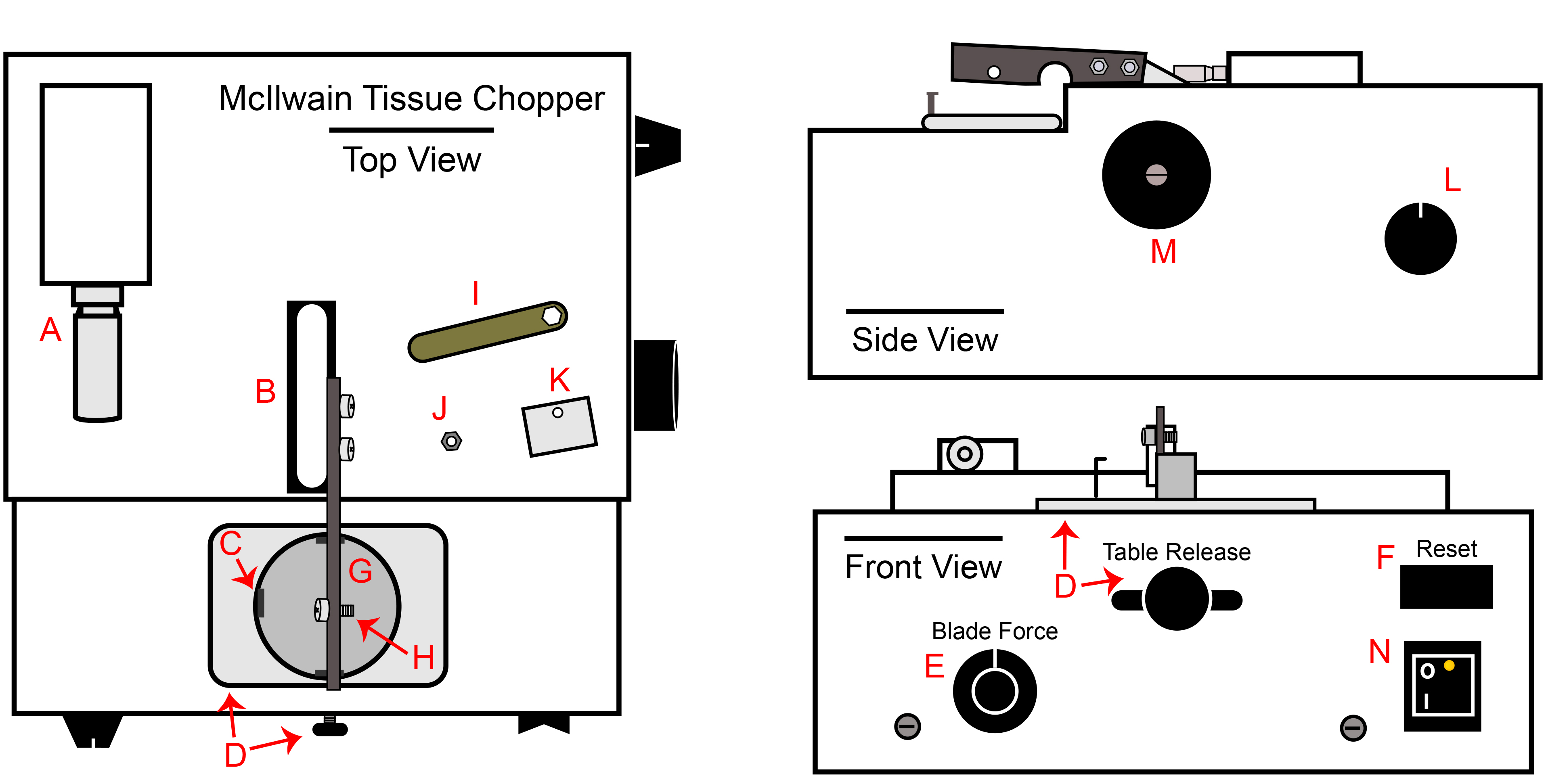
Figura 1. McIlwain Tissue Chopper. A) Tritare micrometro regolazione dello spessore, B) Chopper base del braccio e il braccio attaccato, C) Agganciare il portatarga per il piatto di Petri, D) manopola di sblocco tavolo e vassoio, E) manopola di regolazione forza di Blade, F) Reset switch, G) Porta targa, allegato H) Bullone della lama, fermaglio e il dado, I) chiave Dado incluso con chopper, J) dado Lama / catenaccio, K) Lama catenaccio, L ) manopola di controllo della velocità tagliere automatizzato, M) manopola operativo braccio tagliere manuale, N) interruttore di alimentazione.
- Collegare l'elicottero in una presa nel BSC e accendere l'interruttore di alimentazione (Figura 1N). Impostare la distanza tagliere a 200 micron (Figura 1A). Impostare la pressione della lama a 270 ° o 09:00 se la manopola era un orologio (Figura 1E). Verificare che la manopola automatico della velocità viene ruotata in senso antiorario, per quanto possibile. (Figura 1L).
- Spostare il rilascio tavola tutto il modo a destra confermare il portatarga è stabile (Figura 1D).
- Ruotare il manual braccio manipolatore senso orario per sollevare il braccio al suo livello massimo (Figura 1M). Il braccio manipolatore manuale deve solo essere ruotato in senso orario.
- Asetticamente trasferire una sterile, a doppio taglio lama taglio sul bullone braccio chopper con un paio di pinze (Figura 1H).
- Completare questa fase solo per cGMP passaging, come il piatto di Petri da sola è sufficiente per l'elaborazione della ricerca-grade. Come indicato nel passaggio 2.1.4, dischi spessoramento poste all'interno della base di piastra di Petri sono necessari per cGMP. Il disco spessore impedisce frammenti di plastica da incorporare nelle sfere durante la procedura tagliere. Per ogni chop prevista, trasferire un disco spessore alla base di ogni piatto di Petri e la copertura.
- Asetticamente posizionare la fibbia (Figura 1K) sopra la lama con le pinze. La porzione curva della fibbia deve essere sopra il bordo superiore del braccio. La chiusura non rimarrà sul braccio fino a quando il dado è stato modellato in modo sicuro. Utilizzare le pinze per tenere le clasp sul braccio e fissare il dado (Figura 1J) sul bullone con dado driver sterile. Lasciare il dado a ¼ di giro sciolto.
4. Procedura Pre-chop
- Trasferire il volume suggerito di MM nel nuovo pallone (s) come da Tabella 2, colonna C.
- Asetticamente trasferire le cellule dal termostato nel BSC. Appoggiare il pallone (s) su un portaprovette (Figura 2A) e permettono le sfere di stabilirsi nella beuta (s).
- Una volta sistemati, aspirare fino a 12 ml di surnatante con 5 ml o 10 ml pipetta sierologica e lavare tutte le sfere liberamente aderenti dalla superficie del pallone (s). Ripetere se necessario e risolvere le sfere tra risciacqui.
- Trasferire il volume consigliato di CM nel nuovo pallone (s) secondo la tabella 2, colonna D. Se passaging due o più flaconi T175, vedere il punto 7.1.
- Trasferire tutti i restanti CM e sfere in un nuovo tubo da 15 ml. Lasciare le sfere di séttle e gettare il pallone utilizzato (s).
- Punto Critico: trasferire lentamente le sfere dal tubo conico da 15 ml sul piatto 60 millimetri Petri o il disco spessore del volume più basso possibile; 0,1-0,5 ml è raccomandata (Figura 2B). Mantenere la rimanente quantità di CM come verrà utilizzato per lavare le cellule dal piatto post-chop. Cercare di ridurre al minimo la superficie coperta dai media e sfere sul piatto (Figura 2C).

Figura 2. Preparazione Sphere per tritare. A) Appoggiare il pallone (s) nei confronti di un rack tubo o un oggetto simile per saldare le sfere in un angolo del pallone. B) Trasferire le sfere così densamente possibile dal tubo conico alla Petri piatto. c) riserva di sfere dal tubo conico in tegli mezzo della piastra di Petri. D) rimuovere il più possibile supernatante dalla parte superiore delle sfere aggregati. E) Distribuire le sfere utilizzando il lato di una micropipetta punta in plastica. F) Spostare leggermente le sfere su un lato della piscina sfere. G) Esempio di sfere che sono stati spostati su un lato della piscina per facilitare la rimozione dei media. H) abbreviato sparsi sul piatto di Petri, pronto per tritare. Clicca qui per vedere l'immagine ingrandita.
- Successivamente, le sfere devono essere condensato rimuovendo il supernatante trasferito sopra al punto 4.6. Trasferire il surnatante indietro nel tubo da 15 ml con un aerosol barriera a punta micropipettatore (Figura 2D), evitare la rimozione delle sfere. Cominciare rimuovendo il più multimediale possibile dalla cima del pool di supporti / cell. Quando non è possibileper rimuovere il supporto, senza sfere, procedere al passo successivo.
| Colonna A | Colonna B | Colonna C | Colonna D | Colonna E | Colonna F | |
| Pre-Chop Flask Size | → | Post-Chop Flask (s) Dimensioni | Il volume consigliato di MM di trasferire al nuovo pallone (s) pre-chop | Il volume consigliato di CM di trasferire al nuovo pallone (s) pre-chop | Il volume consigliato di sfere / media per trasferire nel nuovo pallone (s) post-chop | Volume finale ad apporto / Flask |
| T12.5 | → | T25 | 5 ml | 0 ml | 5 ml | 10 ml |
| T25 | → | T75 | 10 ml | 0 ml | 10 ml | 20 ml |
| T75 | → | T175 | 20 ml | 10 ml | 10 ml | 40 ml |
| 1 T175 | → | 2 T175s | 20 ml per beuta | 15 ml per beuta | 5 ml per beuta | 40 ml |
| 2 T75s | → | 4 T175s | 20 ml per beuta | 17.5 ml per pallone | 2,5 ml per pallone | 40 ml |
Tabella 2. Guida di trasferimento media pre / post-chop. Volumi suggeriti da utilizzare durante il processo di triturazione.
- Distribuire la piscina utilizzando il lato della punta della pipetta per aumentare la superficie (Figura 2E).
- Punto Critico: Segnala il piatto di Petri leggermente verso di voi e utilizzare il lato della punta della pipetta di delicatezza slide tutte le sfere a un lato della piscina (Figura 2F, G).
- Fase critica: quando tutte le celle sono stati trasferiti, inclinare lentamente la piastra Petri direzione opposta. Durante il processo, solo i media defluire dalle sfere. Trasferire i media indietro nel tubo da 15 ml. Rimozione sfera Minimal è accettabile.
- Utilizzare il lato del puntale di scorrere dolcemente tutte le sfere di nuovo al centro del piatto Petri quindi la piscina ha un diametro di 0,5-2,4 cm (Figura 2H). È importante mantenere la profondità della piscina poco profonda sfera. Se la piscina è troppo profonda, le sfere saranno semplicemente messi da parte durante il taglio. NOTA: Il diametro della piscina sfera non può essere superiore a 2,5 cm o la lama in contatto con i bordi della piastra di Petri, mancando le cellule.
5. Chop Procedura
- Trasferire la capsula Petri sul supporto piastra (Figura 1G) e garantire il piattoè fissato sotto i ganci portatarga (Figura 1C).
- La manopola di sblocco tavolo ha tacche dove si adatta in marcia. Utilizzare la manopola di rilascio tavolo per far scorrere il portatarga a sinistra in modo che la lama è chiara delle sfere e bloccato in marcia (Figura 1D).
- Punto Critico: Abbassare il braccio chopper ruotando la manopola manipolatore manuale (Figura 1M) in senso orario fino a quando la lama scatta giù piatto sulla piastra di Petri. Con una mano premere verso il basso sul monte braccio (Figura 1B), mentre si stringe il dado con la NUTDRIVER.
- Premere il pulsante di reset una volta (Figura 1F). Stabilizzare il piatto di Petri con una mano mentre si ruota la manopola automatica braccio manipolatore (Figura 1L) in senso orario fino alla posizione di 90 ° o 12:00 se la manopola fosse un orologio. ATTENZIONE: Tenere le dita lontane dalla lama in movimento in ogni momento.
- Passare la lama completamente attraverso il pool di sfere. Ruotare il portatarga90 °.
- Allentare il bullone e ripetere il punto 5,3-5,5.
- Asetticamente trasferire la capsula di Petri dal supporto piastra su uno spazio di lavoro nel BSC.
6. Procedura Post-chop
- Prime a 10 ml pipetta sierologica con la CM nel tubo conico dal punto 4.6 e poi trasferire 1 ml sulle sfere tritate. Delicatamente risospendere e trasferire in un nuovo tubo da 15 ml. Evitare le bolle e ripetere tante volte quanto necessario per raccogliere le sfere tritate.
SUGGERIMENTO: Ridurre al minimo raschiando il piatto come frammenti di plastica possono sollevare. Questo non è un problema se si usano i dischi spessoramento acciaio inox. Attenzione alle cellule connessi con l'interno della pipetta sierologica plastica. In questo caso, le bolle aspirato intermittenza attraverso i media nella pipetta per staccare le cellule. - Misurare il volume di CM e sfere tritate. Aggiungere il volume appropriato di MM per raggiungere il volume elencati nella Tabella 2, colonna E.
- Triturare l'sfere 2-3x per rompere ogni sfere liberamente fusi.
- Punto Critico: Aliquota la sospensione sfera in ogni nuovo pallone. Solo trasferire la sospensione sfera in un pallone alla volta, e ri-sospende le sfere fra trasferimenti. Aliquotando flaconi multipli alla volta si traduce in un numero sproporzionato di sfere in ogni pallone. Il volume finale in ogni contenitore deve essere uguale volumi nella tabella 2, colonna F. Vedere il punto 7.2 quando semina maggiore di due palloni T175.
- Rimuovere il dado con il dado-driver e quindi la chiusura con le pinze sterili. Decontaminare adeguatamente con il 70% IPA o equivalente. ATTENZIONE: Rimuovere la lama taglio utilizzato solo con una pinza e gettare in un apposito contenitore bio-hazard.
- Decontaminare tutte le superfici del chopper con il 70% IPA.
. 7 variazioni di processo - flaconi multipli
Ci sono parecchie differenze quando Passaging più di due T175s. Il passos indicati sono alterazioni della fase di riferimento.
- I riferimenti al passo 4.4:
- Quando passaging due T175s, unire tutti i mezzi di comunicazione e sfere in matracci T175. Lasciare le sfere di stabilirsi e poi un'aliquota il volume appropriato di CM in ciascuno dei nuovi flaconi come indicato nella tabella 2, colonna D. Procedere alla fase 4.5.
- Quando passaging superiore a due T175s, ottenere un nuovo pallone T175 ed etichetta come il pallone CM. Passo Complete 7.1.1, ma trasferire la CM nel pallone CM. Conservare il matraccio sul lato del BSC essere utilizzato per raccogliere il CM da tutte le beute sono state fino tritato tutte le beute. Poi il CM verrà equamente frazionato in ciascuno dei nuovi flaconi.
- Riferimento passo 6.4 - Quando tritare la stessa linea cellulare più volte, trasferire la sospensione sfera tritato in un pallone nuovo T75 sfere etichettati post-chop e registrare il volume trasferito. Continua a combinare le cellule in questapallone dopo ogni taglio e memorizzare il pallone in incubatore a 37 ° C, 5% CO 2, 95% di umidità. Dopo che tutte le costolette sono state completate, Aliquota la sospensione sfera di volume in ogni nuovo pallone. Passare al punto 6.5.
8. Crioconservazione
Il protocollo che segue è per criogenicamente preservare hNPCs.
- Scongelare cella mezzo congelamento in un bagno di acqua pulita a 37 ° C e quindi memorizzare su ghiaccio. Cellulare medio congelamento può essere aliquotati e conservati a -80 ˚ C per 6 mesi.
- Fuoco di vetro smalto di Pasteur pipette ruotando l'apertura della pipetta in una fiamma. Preparare almeno due grandi e due al fuoco lucido pipette di piccolo calibro (Figura 3). Le sfere saranno dissociate passando da grandi a piccole pipette foro.
- Mettere TrypLE Selezionare nel bagno d'acqua a 37 ° C per 5 min. Rimuovere e conservare a temperatura ambiente fino al momento dell'uso.

Figura 3. Fuoco lucidatura di vetro Pasteur pipette. A) Tenere la pipetta nella parte superiore della fiamma e di spin per uniformemente intorno ai bordi della pipetta di vetro. B) Esempio di grosso calibro incendio lucidato pipetta di vetro. C) Esempio di un piccolo foro fuoco lucido vetro pipetta.
- Asetticamente trasferire i neurosfere nel BSC. Lasciare le sfere di stabilirsi appoggiandosi beuta (s) contro un portaprovette e risciacquare il fondo del pallone per rimuovere eventuali sfere liberamente aderenti. Lasciare le sfere a reinsediarsi.
- Trasferire tutto ma 5-10 ml di CM in una bottiglia sterile e misurare il volume totale. Mettere le restanti sfere e supporti in un tubo conico.
- Dopo che tutte le cellule si sono stabiliti, trasferire tutti ma una piccola menisco del CM nella bottiglia e sommare il volume.
- Trasferire asetticamente 5-10 ml di riscaldato TrypLE Select nel tubo conico e risospendere il pellet cellulare. Trasferire la provetta conica in bagno d'acqua a 37 ° C per 15-20 min. Dopo 7,5-10 min, scuotere delicatamente il tubo conico per mescolare.
- Utilizzare il volume CM misurata dal punto 8.5 e preparare un volume uguale di MM. Unire e filtrare la soluzione MM 50% (soluzione CM / MM) CM 50% e.
- Asetticamente trasferire un colino 40 micron in una provetta da 50 ml.
- Quando l'incubazione, centrifugare le provette da 15 ml coniche per 15 sec a 100 x g.
- Con attenzione aspirare e scartare il TrypLE Seleziona e qualsiasi substrato filante. Lascia un piccolo menisco. Aggiungere delicatamente 2-4 ml di CM / MM per diluire il restante TrypLE Seleziona pur non disturbare il pellet. Lasciate che tutte le cellule sloggiato ri-stabilirsi prima di eliminare il lavaggio.
- Aggiungere 2-5 ml CM / MM soluzione alle sfere del tubo. Dissociare le sfere con una pipetta da 5 ml triturando un massimo di 10x. Lasciate che l'ONUsfere dissociate accontentarsi di 1-2 min. Trasferire la sospensione cellulare dissociato sul filtro 40 micron per rimuovere i cluster pienamente indissociate.
- Ripetere passo 8.12 con un grosso calibro pipetta di vetro fuoco lucido e poi un bicchiere pipetta di piccolo calibro.
- Sciacquare il filtro con 2-5 ml di soluzione di CM / MM.
- Mescolare la sospensione cellulare e prelevare campioni per l'analisi della redditività.
- Diluire i campioni con trypan blu ad un fattore di diluizione e contare. Utilizzare l'equazione standard di seguito per calcolare la concentrazione media di cellule vitali e calcolare il totale delle cellule vitali.

- Calcolare il volume totale di cella di congelamento mezzi necessari per ri-sospendere le cellule in 5,0 x 10 6 cellule / ml. 1 ml di cellule saranno seminate in ogni esageratamente. Trasferire le cryovials nel BSC.
- Centrifugare la sospensione cellulare a 200 xg per 5 minuti a 4 ° C a 15 ml tubi conici per la migliore resa. Se 50 ml provette coniche sono utilizzate per congelamento larga scala giù, aumentare la frequenza e tempo a 400 xg per 10 min.
- Risospendere il pellet cellulare utilizzando il mezzo congelamento cella a 5,0 x 10 6 cellule / ml. Aliquotare 1 ml di sospensione cellulare in ciascun esageratamente. Per una distribuzione uniforme, aspirare 6 ml di sospensione e di aliquote cryovials 5 x 1 ml. Trasferire le rimanenti 1 ml di sospensione nel pool di cellule. Ripetere fino a quando tutti i flaconi sono stati riempiti.
- Asetticamente sigillare tutti cryovials teste di serie e trasferirli sul ghiaccio per 5-10 min.
- Utilizzare una delle seguenti strategie di crioconservazione per preservare i hNPCs: alcool isopropilico Camera
- Riempire il numero richiesto di camera (s) con 100% di IPA a temperatura ambiente.
- Trasferire i cryovials seminati dal ghiaccio nella camera (s) e trasferire la camera (s) in un freezer -80 ° C durante la notte. Le cellule sono stabili fino ad una settimana a -80 ° C, tuttaviasi suggerisce di trasferire le fiale di stoccaggio a lungo termine azoto liquido il giorno seguente.
Controllata Tasso Freezer
- Carica un programma di congelamento appropriato per il software del tasso del freezer controllata. Un esempio di programma è elencato nella tabella 3. Figura 4 mostra una curva di congelamento tipico per hNPCs. Tuttavia, il programma esatto varierà per ogni modello freezer. La frequenza di campionamento complessivo standard dovrebbe essere vicino a -1 ° C / min fino a raggiungere -40 ° C, dove il tasso di congelamento può essere notevolmente aumentato ad almeno -80 ° C.
| Passo | Rate (° C) | End temperatura (° C) | Hold (min sec) | Trigger |
| 1 | - | - | 5 min 0 sec | Camera |
| 2 | - 1.3 | - 5 | - | Campione |
| 3 | - | - | 1 min 0 sec | Camera |
| 4 | - 45 | - 58 | - | Camera |
| 5 | + 10 | - 26 | - | Camera |
| 6 | + 3 | - 23 | - | Camera |
| 7 | - 0.8 | - 40 | - | Campione |
| 8 | - 10 | - 100 | - | Camera |
| 9 | - 35 | - 160 | - | Camera |
Tabella 3. Passi per il congelamento hNPCs in un r controllatamangiato freezer. Programma consigliato per hNPC crioconservazione su un tasso freezer controllato.

Figura 4. Curva di congelamento del campione. Curva di congelamento tipico per hNPCs su un tasso freezer controllato.
- Trasferire i cryovials di ghiaccio nei cesti associati al tasso di controllo freezer. Accertarsi di caricare un esageratamente solo con cella di congelamento dei media da utilizzare per la sonda di temperatura del campione. Trasferire i cestelli nella camera di congelamento e posizionare la sonda campione nella fiala sonda. Avviare il programma.
- Quando il protocollo è completata, trasferire le fiale in azoto liquido stoccaggio a lungo termine.
9. Procedura di scongelamento
Il protocollo che segue è per lo scongelamento cryogenically phNPCs riservati.
- Trasferire i cryovials dal magazzino azoto liquido immediatamente sul ghiaccio secco. ATTENZIONE: I flaconi possono avere crepe o coperchi sfusi che consentono di azoto liquido per entrare nel flaconcino. Quando viene rimosso da condizioni di surgelati, il liquido può bollire, subito esplodere il flacone. Utilizzare il corretto DPI quando si rimuovono le fiale.
- Preparare tutti i reagenti e forniture sotto prima del tempo. Una volta che il processo di scongelamento è iniziato, è fondamentale seguire attraverso efficiente.
- Trasferimento Neural Stem Cell espansione Medium, MM, un tubo da 15 ml, uno di 2 ml e 10 ml una pipetta sierologica per ogni esageratamente nel BSC.
- Un minimo di 9 ml di Neural Stem Cell espansione a medio e 5 ml di MM è richiesto per ogni flacone. Preparare più di ogni supporto, se necessario.
- Scongelare un flaconcino di hNPCs solo alla volta. Trasferire le cellule congelate di ghiaccio secco in un ambiente pulito 37 ° C bagnomaria e mescolare il flacone nel bagno d'acqua continuo. Controllare il volume deglighiaccio che si è sciolto. Quando vi è un pezzo di ghiaccio circa 0,5 cm a sinistra nel flacone, spruzzare e pulire con il 70% di alcool isopropilico e trasferire nel BSC.
- Trasferire il contenuto del esageratamente in una provetta da 15 ml con 2 ml pipetta sierologica. Aggiungere 1 ml di Neural Stem Cell media espansione al esageratamente vuota e quindi trasferire 8 ml di Neural Stem Cell media espansione sulle celle scongelati in un lento, goccia maniera saggia mentre scuotendo delicatamente il tubo. Questo viene fatto per ridurre il rischio di shock osmotico.
- Trasferire il risciacquo dalla esageratamente ai 9 ml di sospensione cellulare. Trasferire il tubo conico su ghiaccio e ripetere i passaggi 9,4-9,5 per tutte le fiale rimanenti.
- Centrifugare le provette coniche a 200 xg per 5 minuti a 4 ° C. Durante la centrifugazione, preparare il numero appropriato di flaconi per semina base alla tabella 4.
| # Di flaconi | Volume totale Seeding (ml) | Pallone |
| 1 | 5 | T12.5 |
| 2 | 10 | T25 |
| 3 | 15 | T75 |
| 4 | 20 | T75 |
| 5 | 25 | T75 |
| 6 | 30 | T175 |
| 7 | 35 | T175 |
| 8 | 40 | T175 |
| 8 + | - | Combinazione di Boccette |
Tabella 4. Dimensioni Flask in base al numero di cryovials scongelati. Il volume consigliata e la dimensione pallone a seme hNPCs post-disgelo.
- Re-sospendere e unire tutti i tubi nel volume appropriato di MM in base alla Tabella 4. Mescolare bene e rispostare un campione per il conteggio vitalità. Vedere i passaggi 8,15-8,16 per il conteggio dei dettagli. La gamma di semina standard è tra 160,000-320,000 cellule / cm 2.
- Mescolare le cellule bene e un'aliquota le cellule in fiasche. Trasferire i palloni ad un 5% di CO 2/37 ° C/95% di umidità dell'incubatrice. Mescolare il pallone delicatamente agitando avanti e indietro per distribuire uniformemente le cellule.
- Le cellule formeranno sfere entro 24-48 ore. Occasionalmente le cellule aderiscono alla superficie plastica e forma una distribuzione colonia nido d'ape. In questo caso, lasciare le celle per tre giorni prima di risciacquare le cellule sciolto, aiutando nella formazione di sfera. Risciacquare ogni 1-3 giorni fino a quando non ci sono cellule aderenti. Se necessario trasferimento delle cellule in un matraccio.
- Scambio 25-75% dei mezzi di comunicazione con MM, ogni 3-4 giorni fino a quando le cellule sono pronte a tagliare, di solito 7-14 giorni post-disgelo.
Access restricted. Please log in or start a trial to view this content.
Risultati
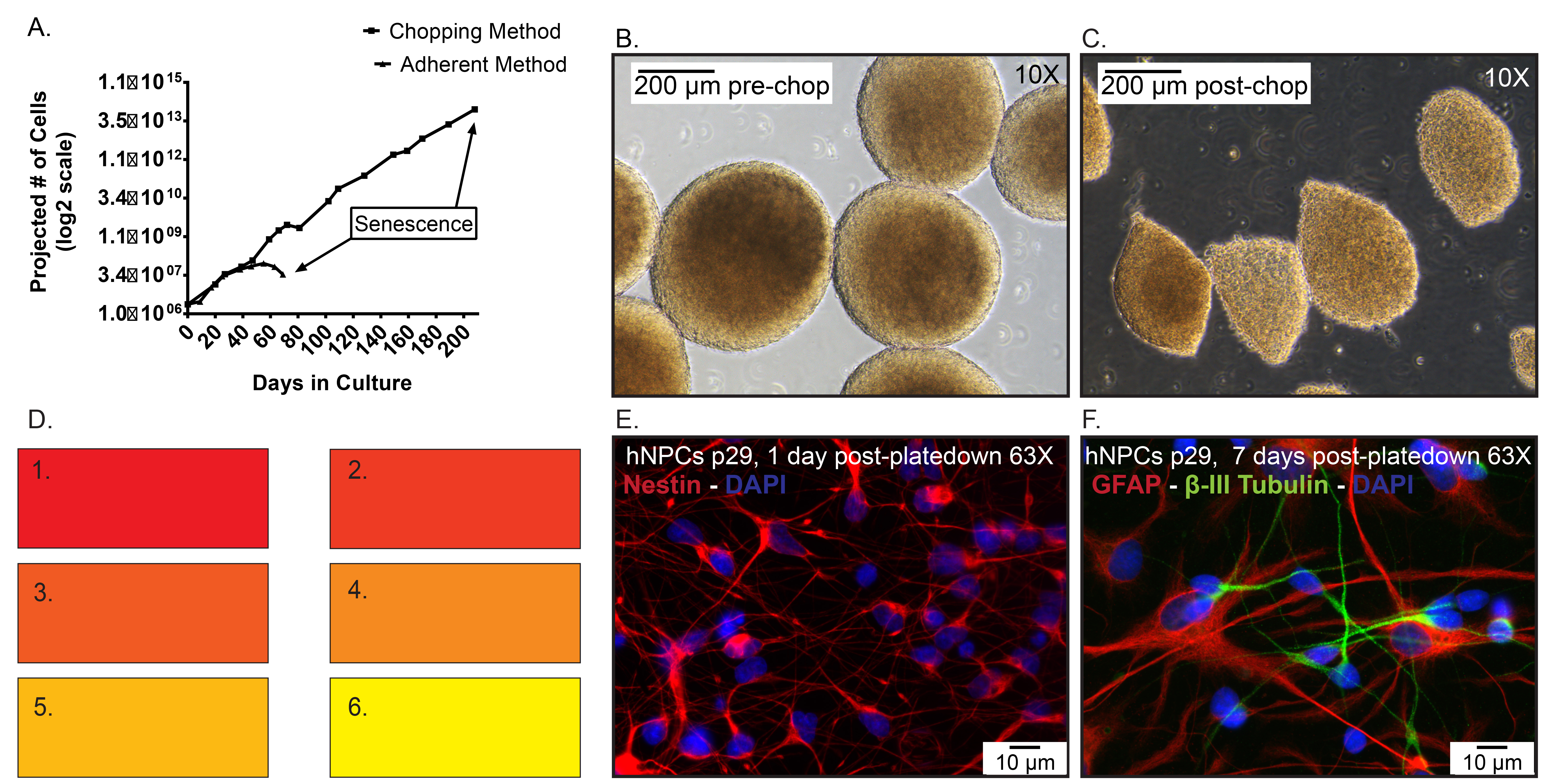
Il numero di cellule Figura 5. Dati rappresentativi. A) previsti delle hNPCs congelati a p19, poi scongelati e ampliato come un monostrato aderente con dissociazione enzimatica rispetto al neurosfere diversi passaggi tramite il metodo tagliere. Giorno 0 rappresenta quando le cellule sono state scongelati a p20. B) Immagini rappresentativ...
Access restricted. Please log in or start a trial to view this content.
Discussione
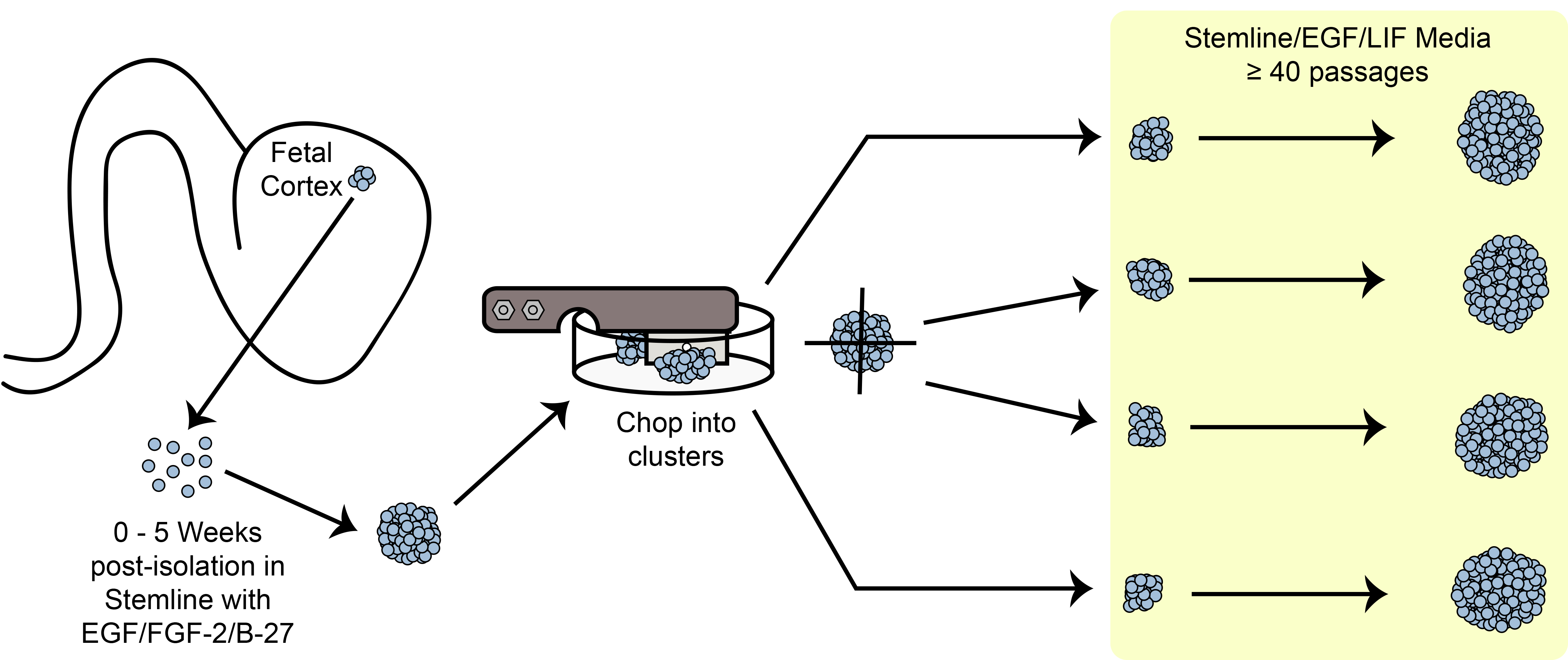
Figura 6. Tagliere schematica. Espansione cellule staminali sferoide / progenitrici nella cultura utilizzando il metodo di trinciatura meccanica.
Fasi critiche
Una panoramica del paradigma espansione tagliere è mostrato in Figura 6. HNPC dimensione della sfera è uno dei criteri ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dott. Soshana Svendsen per la revisione critica e la modifica di questa relazione. Questo lavoro è stato contribuito per il NIH / NINDS 1U24NS078370-01 e CIRM DR2A-05320.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Beaker, 50 ml | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 ml inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 ml | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 ml | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 ml | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 ml | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 ml | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 ml | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern - Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37 °C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1-10 μl | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100-1,000 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2-20 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20-200 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μl | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1,000 μl | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μl | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μl | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 ml | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 ml | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 ml | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 ml | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1x) | Life Technologies | 12563-011 |
Riferimenti
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. - IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 Forthcoming.
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. iP. S. C. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue. The corresponding author was changed from:
Brandon C. Shelley
to:
Clive Svendsen
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon