Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método de expansión de GMPc aplicable para agregados de Neural humano madre y células progenitoras derivadas de células madre pluripotentes o tejido cerebral fetal
En este artículo
Erratum Notice
Resumen
Este protocolo describe un nuevo método de cortar mecánico que permite la expansión de la madre y de células progenitoras neurales agregados esféricos sin disociación a una única suspensión de células. Mantener el contacto célula / célula permite un crecimiento rápido y estable durante más de 40 pasajes.
Resumen
Una técnica de expansión de células para acumular grandes cantidades de células a partir de una sola muestra para experimentos de investigación y ensayos clínicos se beneficiaría en gran medida a la comunidad de células madre. Muchos métodos actuales de expansión son laboriosos y costosos, y los que implican la disociación completa pueden causar varios tipos madre y células progenitoras a someterse a la diferenciación o la senescencia temprana. Para superar estos problemas, hemos desarrollado un método de pases mecánica automática que se refiere como "cortar" que es simple y de bajo costo. Esta técnica evita la disociación química o enzimática en células individuales y en su lugar permite la expansión a gran escala de suspensión, cultivos de esferoides que mantienen el contacto célula / célula constante. El método de cortar se ha usado principalmente para células derivadas de cerebro fetal neurales progenitoras o neuroesferas, y recientemente ha sido publicado para su uso con células madre neurales derivadas de células madre pluripotentes embrionarias e inducidos. El procedimiento involvES siembra neuroesferas en un cultivo de tejidos plato de Petri y posteriormente pasa a una, la cuchilla afilada estéril a través de las células de la automatización de manera efectiva el tedioso proceso de manualmente disociar mecánicamente cada esfera. La suspensión de células en cultivo proporciona una relación superficie-área-volumen favorable; como más de 500.000 células pueden ser cultivadas en una sola neuroesfera de menos de 0,5 mm de diámetro. En un matraz T175, más de 50 millones de células pueden crecer en cultivos en suspensión en comparación con sólo 15 millones en cultivos adherentes. Es importante señalar que el procedimiento de cortar ha sido utilizada bajo buenas prácticas de fabricación actuales (cGMP), que permite la producción de cantidades masivas de productos celulares de grado clínico.
Introducción
Hay una larga historia de la expansión de las células madre neurales de roedores en la cultura, ya sea como una monocapa 1-3 o 4-7 neuroesferas agregados. Además, las células progenitoras neurales humanas (hNPCs) aisladas a partir de diversas regiones del sistema nervioso central en desarrollo 8-17 han sido expandidas in vitro. Estas células son bi-potentes, capaces de diferenciarse en astrocitos y neuronas y han sido una herramienta muy útil en el estudio del desarrollo neural 18,19 y las enfermedades mecanismo de 20,21. hNPCs también se han trasplantado en muchos modelos animales diferentes de enfermedad del sistema nervioso central con diferentes niveles de integración, la supervivencia y efectos funcionales 22-24.
Tradicionalmente, roedor o NPC derivadas de fetos humanos están expuestos a factores de crecimiento - factor de frecuencia de crecimiento epidérmico (EGF) y / o factor de crecimiento de fibroblastos-2 (FGF-2) 25-28 - y tanto adherente 29 y tresSistemas de esferoide-dimensionales se pasan típicamente usando disociación enzimática en una suspensión de una sola célula 30-34. El método estándar para expandir las células para la investigación o el uso clínico es como una monocapa adherente debido a la fácil manipulación. Sin embargo, hemos demostrado que los pases en monocapa y de neuroesferas con hNPCs enzimática o soluciones químicas resultaron en la senescencia temprana 35. Además, la disociación enzimática puede dar lugar a mayores niveles de diferenciación y anomalías del cariotipo basados en datos demostrados con células madre embrionarias 36-38. Aunque el método estándar de hNPCs pases ha producido buenas prácticas de fabricación actuales (cGMP) productos de calidad que han pasado a la fase 1 de pruebas clínicas (Stem Cells Inc., Neuralstem Inc.), el método permite únicamente un par de rondas de amplificación de células, lo que limita la banca potencial.
Está claro que los grandes experimentos de investigación y ensayos clínicos futuros podrían beneficiarse de la capacidad depropagar células en grandes cantidades y con el retraso en la senescencia para permitir el crecimiento a gran escala y de bancos de células. Para satisfacer esta necesidad, hemos desarrollado una forma novedosa y automatizado de neuroesferas intactos mecánicamente pases por "picar" en pequeños grupos para mantener el contacto de célula a célula. Este método aumenta en gran medida su vida útil 39 y suspensión de cultivo permite un uso más eficiente del espacio de la incubadora en comparación con cultivos en monocapa, como se ve con un método de cultivo del biorreactor 3D alternativa 40. El protocolo de cortar proporcionado permite la producción de bancos a gran escala a partir de una muestra fetal mayor que el paso 10, una hazaña poco probable utilizando métodos estándar pases. Si bien este método para hNPCs pases es poco convencional, que está creciendo en popularidad y fue recientemente publicado con otros tipos de células, como las células madre neurales derivadas de células madre pluripotentes inducidas de embriones humanos y, lo que permite la expansión a gran escala para diversas aplicaciones incluyendo en vitro modelado enfermedad 41-46. Es importante destacar que un cGMP grado banco de células hNPC ya se ha producido con el método de cortar, lo que demuestra que la técnica se puede aplicar a futuras aplicaciones clínicas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Declaración de Seguridad y ética
- Este procedimiento implica el uso de productos de cultivo de células derivadas de seres humanos o animales. Todos los tejidos derivados deben ser aprobados antes de su uso por la Junta de Revisión Institucional apropiada (s) y / o el Cuidado de Animales y el empleo Comisión (s) Institucional.
- Todo biológicos peligrosos los residuos deben eliminarse de acuerdo con las normas de seguridad adoptada por la institución respectiva. Conocer y seguir todas las pautas de seguridad y eliminación apposite durante todo este procedimiento.
2. Preparación de Equipos, Suministros, reactivos y Observaciones
- Preparación
- Obtenga una caja de Petri de vidrio, 8,5 cm de filtro círculos de papel y hojas de preparación de doble filo.
- Coloque un pedazo de papel de filtro en la placa de Petri y transferir varias cuchillas sin funda sobre el papel de filtro en la placa de Petri.
- En repetidas ocasiones el papel de filtro de capas y hojas hasta que la placa de Petri es más o menos 75% de su capacidad, ingenio cubiertah Petri tapa de la placa y de autoclave. Almacene en un ambiente estéril o cerrada para conservar la esterilidad.
- Autoclave 18 cm fórceps y una tuerca-driver autoclavable en una bolsa de esterilización. Para la producción de cGMP, autoclave varios discos cuñas de acero inoxidable en bolsas de esterilización. Para obtener más información sobre el disco calza, consulte el paso 3.5.
- Desinfectar el gabinete de bioseguridad (BSC) con 70% de alcohol isopropílico (IPA).
- Todos los procedimientos se deben realizar en un BSC para mantener la esterilidad. Transferir asépticamente lo siguiente en el BSC:
- McIlwain tejido Chopper (chopper). Limpie todas las superficies con un 70% de IPA, especialmente el brazo de la picadora (fig. 1B). Todo el helicóptero puede ser descontaminado usando óxido de etileno si es necesario.
- Una tuerca-driver en autoclave o la tuerca-llave (incluida con el helicóptero, la Figura 1I), uno de 18 cm de fórceps, un conjunto de micropipetas de tamaño estándar (20 l-1, 000 l), uno pipetaid y bastidores de tubo.
- Pipetas estériles desechables serológicos, puntas de pipeta de barrera, 15 ml tubos cónicos, 60 mm placas de Petri, hojas de preparación de doble punta y frascos T de tamaño apropiado. PRECAUCIÓN: Sólo manejar las afiladas cuchillas con un fórceps.
- Reactivos
- Expandir hNPCs en el mantenimiento de los medios de comunicación (MM) que consisten de madre neurales medio de expansión de la célula, el EGF a 100 ng / ml y Factor Inhibidor de Leucemia (LIF) a 10 ng / ml. Transfiera los reactivos y el dispositivo (s) de filtración necesarios para preparar los medios de comunicación en el BSC.
- Vuelva a suspender el EGF liofilizado utilizando Neural expansión de células madre mediano y preparar alícuotas a 100 mg / ml para almacenar a -80 ° C durante un máximo de 1 año. LIF se almacena como comprar a 4 ° C durante un máximo de 6 meses o la fecha de caducidad indicada por el fabricante.
- Transfiera los reactivos MM en el BSC. Combine todos los reactivos en un dispositivo de filtración de tamaño adecuado y el filtro usando un aparato de vacío. Almacenar a 4 ° C durante un máximo de 3 semanas.
- hNPC Observaciones
- Los dos factores más importantes que tratar antes de cortar es diámetro de la esfera y los medios de comunicación acondicionado o color. El medio condicionado (CM) se define como medio que se ha metabolizado por los hNPCs en cultivo bajo condiciones de incubadora (37 ° C, 5% CO 2, 95% de humedad). A medida que las células metabolizan los medios de comunicación del componente rojo fenol se desplazará de un color de rosa a amarillo significa un ambiente más ácido (Figura 5D).
- Sostenga el frasco (s) de hNPCs a la luz para hacer frente al color del material (véase la discusión para más detalles).
- Escanear a través del frasco con un microscopio para observar las células. Utilice una retícula para examinar el tamaño de la esfera. Si muchas esferas tienen un diámetro de 300 micras o más, continuar con el proceso de cortar. Picar las células cada 7-10 días.
- Si una chuleta no está garantizado, cambio de 25 a 75% de la CM con medio fresco cada 3-4 días, dependiendo de la rapidez con que las células están metabolizando los medios de comunicación. Estafacontinuar el intercambio de medios de comunicación hasta que las esferas son lo suficientemente grandes como para pasaje.
- hNPCs son típicamente picado en una proporción de 1:02, de los matraces pequeños a matraces más grandes. Utilice la Tabla 1 como guía de referencia para las recomendaciones de tamaño de frasco y volumen.
| Frasco | Volumen de los medios de comunicación en total | Pre-Chop | → | Post-Chop |
| 1 T12.5 | 5 ml | 1 T12.5 | → | 1 T25 |
| 1 T25 | 10 ml | 1 T25 | → | 1 T75 |
| 1 T75 | 20 ml | 1 T75 | → | 1 T175 |
| 1 T175 | 40 ml | 1 T175 | → | 2 T175s |
| 2 T175s | 80 ml | 2 T175s * | → | 4 T175s |
| * 2 T175s es el número máximo de frascos que se pueden cortar a la vez. Picar en grupos de 2 T175s y consulte el paso 7. | ||||
Tabla 1. Paradigma expansión hNPC. Descripción de un plan de expansión típico para hNPCs. Es norma de ampliar de dos veces volumétricamente cada 7-10 días.
3. Configuración Chopper
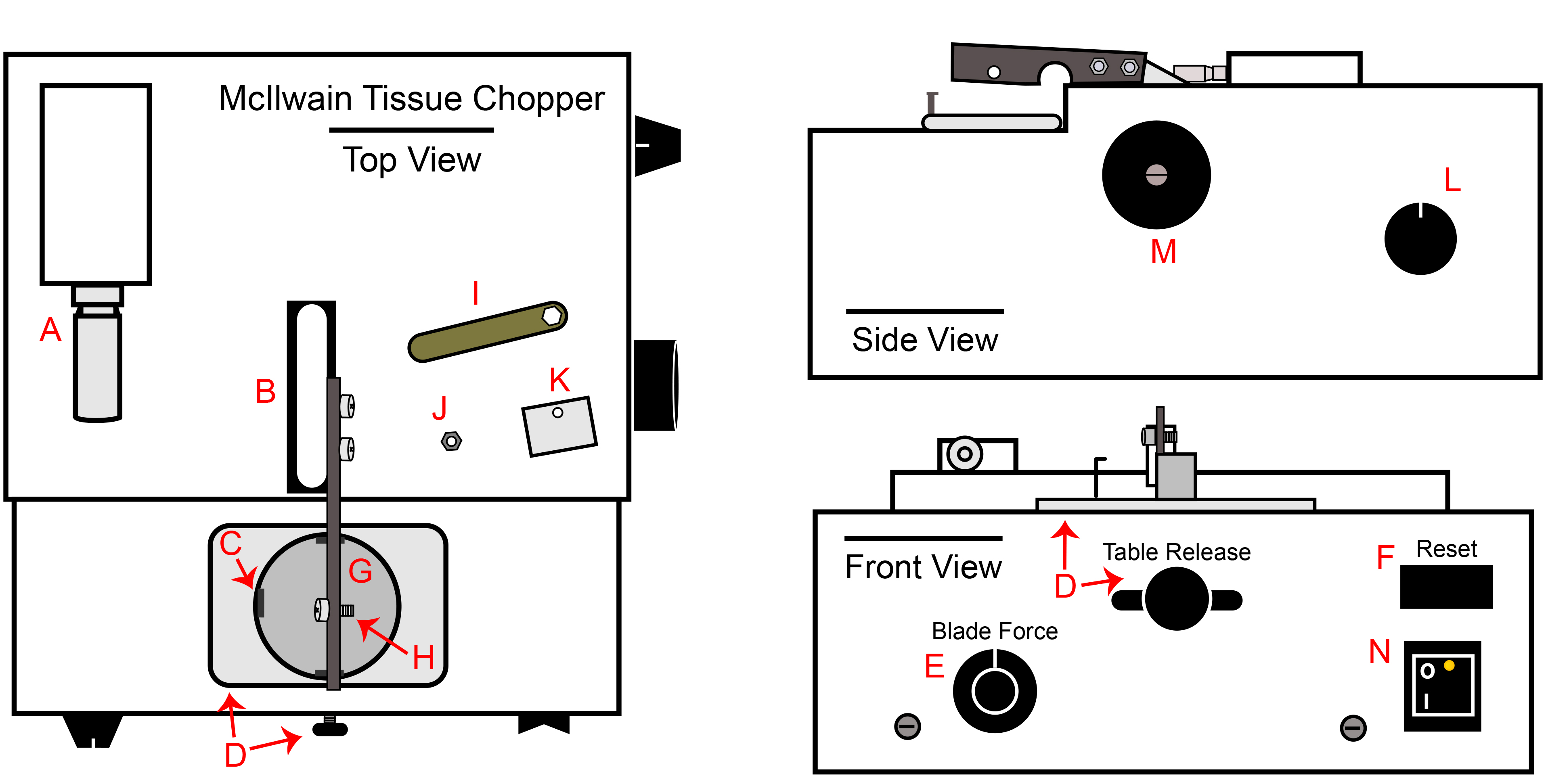
Figura 1. Cortador de tejidos McIlwain. A) Picar micrómetro ajuste de grosor, base del brazo B) Chopper y brazo unido, C) Enganche el soporte de la placa para la placa de Petri, D) perilla de liberación tabla y la bandeja, E) Mando de control de la fuerza de la hoja, F) interruptor RESET, G Soporte de matrícula), H) Tornillo de fijación de la hoja, cierre y tuerca, I) Llave Tuerca incluido con picador, J) tuerca de la hoja / broche, broche de la hoja K), L ) Mando automatizado de control de velocidad de picar, M) Mando operativo brazo cortar Manual, N) Interruptor de encendido.
- Conecte el helicóptero a una toma en el BSC y encienda el interruptor de alimentación (Figura 1 N). Establezca la distancia de picar a 200 micras (Figura 1A). Ajuste la fuerza de la cuchilla a 270 ° o 09:00 si el mando era un reloj (Figura 1E). Confirme que la perilla de velocidades automática se gira en sentido contrario en la medida de lo posible. (Figura 1L).
- Mueva la liberación mesa todo el camino a la derecha confirmar el soporte de la placa es estable (Figura 1D).
- Gire el manumanipulador al brazo hacia la derecha para levantar el brazo a su nivel máximo (Figura 1M). El brazo manipulador manual sólo debe ser girado en sentido horario.
- Transferir asépticamente un, cuchilla de picar de doble filo estéril sobre el perno de brazo helicóptero usando un par de pinzas (Figura 1H).
- Llene esta sección sólo para cGMP pases, como el plato de Petri por sí sola es suficiente para el procesamiento de grado de investigación. Como se ha indicado en el paso 2.1.4, se requieren discos shim colocados en el interior de la base de placa de Petri para GMPc. El disco cuña impide fragmentos de plástico de la incorporación a las esferas durante el procedimiento de cortar. Para cada chuleta planeado, transferir un disco cuña en la base de cada placa de Petri y la cubierta.
- Asépticamente colocar el broche (Figura 1K) sobre la hoja utilizando las pinzas. La porción curvada del gancho debe ser sobre el borde superior del brazo. El cierre no se quedará en el brazo hasta que la tuerca se ha formado de manera segura. Utilice las pinzas para sujetar las clasp en el brazo y asegurar la tuerca (Figura 1J) en el perno con la tuerca-driver estéril. Deje la tuerca de ¼ de vuelta floja.
4. Procedimiento Pre-chop
- Transferir el volumen recomendado de MM en el nuevo frasco (s) de acuerdo con la Tabla 2, columna C.
- Transferir asépticamente las células de la incubadora en el BSC. Incline el frasco (s) en un bastidor de tubo (Figura 2A) y dejando que las esferas se asienten en el matraz (s).
- Una vez instalados, aspirar hasta 12 ml de sobrenadante con 5 ml o 10 ml de pipeta serológica y enjuague todas las esferas de baja adherencia de la superficie del matraz (s). Repita según sea necesario y resolver las esferas entre enjuagues.
- Transferir el volumen recomendado de CM en el nuevo frasco (s) de acuerdo con la Tabla 2, columna D. Si pases dos o más matraces T175, consulte el paso 7.1.
- Transferir todo CM restante y las esferas en un nuevo tubo cónico de 15 ml. Permitir que las esferas en síttle y deseche el frasco utilizado (s).
- Paso Crítico: transferir lentamente las esferas del tubo cónico de 15 ml en el 60 mm placa de Petri o disco cuña en el volumen más bajo posible; 0,1 a 0,5 ml se recomienda (Figura 2B). Mantenga el volumen restante de CM, ya que se utiliza para aclarar las células de la placa posterior a la chuleta. Trate de minimizar la superficie cubierta por los medios de comunicación y las esferas en el plato (Figura 2C).

Figura 2. Preparación Esfera para picar. A) Incline el frasco (s) en contra de un bastidor de tubo o un elemento similar para resolver las esferas en la esquina del matraz. B) Transferir las esferas tan densamente posible del tubo cónico al Petri plato. C) Reunir las esferas del tubo cónico en tél medio de la placa de Petri. D) Remover tanto sobrenadante como sea posible de la parte superior de las esferas agrupadas. E) Difundir las esferas a cabo utilizando el lado de una punta de la micropipeta de plástico. F) Mueva suavemente las esferas a un lado de la piscina esferas. G) Ejemplo de esferas que se han movido a un lado de la piscina para facilitar la eliminación de medios. H) Condensed extienden sobre la placa de Petri, listo para picar. Haga clic aquí para ver la imagen más grande.
- A continuación, las esferas deben ser condensado por eliminar el sobrenadante transferido sobre en el paso 4.6. Transferir el sobrenadante de nuevo en el tubo cónico de 15 ml con un aerosol barrera de punta de micropipeta (figura 2D), evitar la eliminación de las esferas. Comienza por eliminar la mayor cantidad de medios de comunicación como sea posible de la parte superior del grupo de medios / célula. Cuando no es posiblepara eliminar los medios de comunicación sin esferas, continúe con el siguiente paso.
| Columna A | Columna B | Columna C | Columna D | Columna E | Columna F | |
| Pre-Chop Frasco Tamaño | → | Post-Chop Frasco (s) Tamaño | Volumen sugerido de MM para transferir al nuevo frasco (s) antes de la chuleta | Volumen sugerido de CM para transferir al nuevo frasco (s) antes de la chuleta | Volumen sugerido de esferas / medios para transferir a un nuevo frasco (s) post-chop | Volumen final Sembrado / frasco |
| T12.5 | → | T25 | 5 ml | 0 ml | 5 ml | 10 ml |
| T25 | → | T75 | 10 ml | 0 ml | 10 ml | 20 ml |
| T75 | → | T175 | 20 ml | 10 ml | 10 ml | 40 ml |
| 1 T175 | → | 2 T175s | 20 ml por matraz | 15 ml por matraz | 5 ml por matraz | 40 ml |
| 2 T75s | → | 4 T175s | 20 ml por matraz | 17,5 ml por matraz | 2,5 ml por matraz | 40 ml |
Tabla 2. Guía de transferencia de medios pre / post-chop. Volúmenes sugeridos para utilizar durante el proceso de cortar.
- Corre la piscina a cabo utilizando el lado de la punta de la pipeta para aumentar el área de superficie (Figura 2E).
- Paso Crítico: Recomienda a la placa de Petri ligeramente hacia usted y utilizar el lado de la punta de la pipeta para suavemente slide todas las esferas a un lado de la piscina (figura 2F, G).
- Paso crítico: Cuando todas las células han sido reubicadas, inclinar lentamente la placa de Petri la dirección opuesta. Durante el proceso, los medios de comunicación por sí solos fluirán fuera de las esferas. La transferencia de los medios de comunicación de nuevo en el tubo cónico de 15 ml. Eliminación Minimal esfera es aceptable.
- Utilice el lado de la punta de la pipeta para deslizar suavemente todas las esferas de vuelta al centro de la placa de Petri así que la piscina tiene un diámetro de 0,5-2,4 cm (Figura 2H). Es importante mantener la profundidad de la esfera poco profunda de la piscina. Si la piscina es muy profunda, las esferas simplemente serán dejados de lado durante el troceado. NOTA: El diámetro de la esfera de la piscina no puede ser mayor que 2,5 cm o la hoja pondrá en contacto con los bordes de la placa de Petri, la falta de las células.
5. Procedimiento Chop
- Transfiera la cápsula de Petri en el soporte de la placa (Figura 1G) y garantizar el platose fija debajo de los ganchos porta placa (Figura 1C).
- La perilla de liberación tabla tiene muescas donde caben en el engranaje. Utilice la perilla de liberación tabla de deslizar el soporte de la placa a la izquierda para que la hoja está claro de las esferas y bloqueado en el engranaje (Figura 1D).
- Paso Crítico: Baje el brazo de helicóptero girando el mando manipulador manual (Figura 1M) en sentido horario hasta que la hoja quede en forma plana sobre la placa de Petri. Utilice una mano para presionar hacia abajo en la montaña brazo (Figura 1B) mientras aprieta la tuerca con la llave para tuercas.
- Pulse el botón de reinicio una vez (Figura 1F). Estabilizar la placa de Petri con una mano mientras gira el mando brazo manipulador automático (Figura 1 L) en sentido horario hasta la posición de 90 ° ó 12:00 si el mando era un reloj. ATENCIÓN: Mantenga los dedos alejados de la hoja en movimiento en todo momento.
- Pase la hoja totalmente a través de la piscina de esferas. Gire el soporte de la placa90 °.
- Afloje el tornillo y repita el paso 5.3 a 5.5.
- Transferir asépticamente la placa de Petri del soporte de la placa en un espacio de trabajo en el BSC.
6. Procedimiento post-chop
- Primer 10 ml de una pipeta serológica con el CM en el tubo cónico desde el paso 4.6 y luego transferir 1 ml sobre las esferas picadas. Suavemente volver a suspender y transferir a un nuevo tubo cónico de 15 ml. Evite las burbujas y repetir tantas veces como sea necesario para recoger las esferas picadas.
TIP: Minimizar el raspado de la placa en forma de fragmentos de plástico pueden despegar. Esto no es un problema si utiliza los discos de cuñas de acero inoxidable. Tenga cuidado con las células correspondientes a la parte interior de la pipeta serológica de plástico. Si esto ocurre, las burbujas de aspirado de forma intermitente a través de medios de comunicación en la pipeta para separar las células. - Mida el volumen de CM y esferas picadas. Añadir el volumen adecuado de MM para alcanzar el volumen que figuran en el Cuadro 2, columna E.
- Se tritura elesferas 2-3x para romper los ámbitos vagamente fusionados.
- Paso Crítico: Alícuota de la suspensión esfera en cada nuevo frasco. Sólo transferir la suspensión esfera en un frasco a la vez, y volver a suspender las esferas entre las transferencias. Alícuotas de frascos múltiples a la vez se traduce en un número desproporcionado de esferas en cada frasco. El volumen final de cada frasco debe ser igual a los volúmenes en la Tabla 2, columna F. Ver el punto 7.2, cuando la siembra de más de dos matraces T175.
- Retire la tuerca con la tuerca-driver y luego el cierre con las pinzas estériles. Descontaminar apropiadamente con 70% de IPA o equivalente. PRECAUCIÓN: Extraiga la cuchilla de picar sólo se utiliza con un fórceps y deseche en un contenedor de objetos punzantes riesgo biológico.
- Descontaminar todas las superficies del helicóptero con 70% de IPA.
. 7 Variaciones de proceso - Múltiples Frascos
Hay varias diferencias cuando pases más de dos T175s. El pasos siguientes son alteraciones de la etapa de referencia.
- Las referencias a la etapa 4.4:
- Cuando pases dos T175s, combinar todos los medios de comunicación y las esferas en matraces T175. Permita que las esferas se asiente y luego alícuota del volumen adecuado de CM en cada uno de los nuevos frascos como se indica en la Tabla 2, columna D. Proceda al paso 4.5.
- Cuando pases más de dos T175s, obtener un nuevo matraz T175 y la etiqueta como el frasco CM. Paso completo 7.1.1 pero transferir el CM en el matraz CM. Almacenar el matraz en el lado del BSC para ser utilizado para recoger el CM de todos los matraces hasta que todos los frascos han sido picado. A continuación, el CM será igualmente dividió en alícuotas en cada uno de los nuevos matraces.
- Incremento de referencia 6.4 - Cuando cortar la misma línea celular varias veces, transferir la suspensión esfera cortada en un nuevo matraz T75 esferas marcadas posterior a la chuleta y registrar el volumen transferido. Continuar para combinar las células en estematraz después de cada chuleta y almacenar el matraz en la incubadora a 37 ° C, 5% de CO 2, 95% de humedad. Después de todas las chuletas se han completado, alícuotas de la suspensión esfera en volumen en cada nuevo matraz. Continúe en el paso 6.5.
8. Criopreservación
El siguiente protocolo es para preservar criogénicamente hNPCs.
- Descongele medio de congelación de células en un baño de agua limpia a 37 ° C y luego almacenar en hielo. Celular medio de congelación se puede alícuotas y se almacenó a -80 ˚ C durante un máximo de 6 meses.
- Fuego de vidrio esmalte de pipetas Pasteur mediante la rotación de la abertura de la pipeta en una llama. Preparar al menos dos grandes y dos pipetas pulido a fuego pequeño calibre (Figura 3). Las esferas se pueden disociar moviendo desde grandes a pequeñas pipetas calibre.
- Coloque TrypLE Seleccione en el baño de agua a 37 ° C durante 5 min. Retire y mantenga a temperatura ambiente hasta que esté listo para su uso.

Figura 3. Vidrio fuego pulido Pasteur pipetas. A) Sostenga la pipeta en la parte superior de la llama y el giro con el fin de manera uniforme alrededor de los bordes de la pipeta de vidrio. B) Ejemplo de una pipeta de vidrio pulido al fuego de gran calibre. C) Ejemplo de una pipeta de vidrio pulido al fuego de pequeño calibre.
- Transferir asépticamente las neuroesferas en el BSC. Permita que las esferas se asienten inclinando el frasco (s) en contra de un bastidor de tubo y enjuagar el fondo del frasco para eliminar las esferas de baja adherencia. Permitir que las esferas se reasentarse.
- Transfiera todos menos 5-10 ml de CM en un frasco estéril y medir el volumen total. Coloque las esferas restantes y medios de comunicación en un tubo cónico.
- Después de que todas las células se han asentado, transferir todos menos una pequeña menisco del CM en la botella y sumar los volume.
- Transfiera asépticamente 5-10 ml de calentado TrypLE Seleccione en el tubo cónico y volver a suspender el sedimento celular. Transferir el tubo cónico en el 37 ° C baño de agua durante 15 a 20 min. Después de 7,5 a 10 min, agitar suavemente el tubo cónico para mezclar.
- Utilice el volumen cm medida desde el paso 8.5 y preparar un volumen igual de MM. Combine y filtre la CM el 50% y solución MM 50% (solución CM / MM).
- Transferir asépticamente un colador de 40 micras en un tubo cónico de 50 ml.
- Cuando la incubación se completa, girar los tubos de 15 ml cónicos para 15 seg a 100 x g.
- Aspirar con cuidado y deseche el TrypLE Seleccionar y cualquier sustrato fibroso. Deja un pequeño menisco. Añadir suavemente 2-4 ml de CM / MM para diluir el restante TrypLE Select mientras no perturbar el sedimento. Que la presencia de células desprendidas volver a instalarse antes de desechar el lavado.
- Añadir 2-5 ml CM / MM solución a las esferas de tubo. Disociar las esferas con una pipeta de 5 ml por trituración un máximo de 10 veces. Deje que la ONUesferas disociadas se conforman con 1-2 min. Transferir la suspensión celular disociada en el colador de 40 micras para eliminar racimos totalmente disociadas.
- Repita el paso 8.12 con un calibre grande pipeta de vidrio pulido al fuego y luego una pipeta de vidrio de pequeño calibre.
- Enjuague el filtro con 2-5 ml de solución CM / MM.
- Mezclar la suspensión celular y retirar muestras para el análisis de la viabilidad.
- Diluir las muestras con azul de tripano en un factor de dilución apropiado y contar. Usar la ecuación estándar a continuación para calcular la concentración media de células viables y calcular las células viables totales.

- Calcular el volumen total de los medios de comunicación celular de congelación necesario para volver a suspender las células en 5,0 x 10 6 células / ml. 1 ml de las células se sembraron en cada criovial. Transfiera los crioviales en el BSC.
- Centrifugar la suspensión de células a 200 xg durante 5 min a 4 ° C en 15 mtubos l cónicos para mejor rendimiento. Si 50 ml tubos cónicos se utilizan para una congelación a gran escala hacia abajo, aumentar la velocidad y el tiempo a 400 g durante 10 min.
- Vuelva a suspender el sedimento celular utilizando el medio de congelación de células en 5,0 x 10 6 células / ml. Alícuota 1 ml de suspensión celular en cada criovial. Por Una distribución uniforme, aspirado 6 ml de suspensión y alícuotas 5 crioviales x 1 ml. La transferencia de los restantes 1 ml de suspensión en la agrupación de las células. Repita hasta que todas las ampollas se han llenado.
- Asépticamente sellar todas crioviales sin semillas y transferirlos en hielo durante 5-10 min.
- Utilice una de las siguientes estrategias de crioconservación para conservar los hNPCs: Alcohol isopropílico Cámara
- Llenar el número requerido de cámara (s) con 100% de IPA a temperatura ambiente.
- Transferir los crioviales cabezas de serie de hielo en la cámara (s) y transferir la cámara (s) en un -80 ° C congelador durante la noche. Las células son estables durante hasta una semana a -80 ° C, sin embargo,se sugiere transferir los viales para almacenamiento de nitrógeno líquido a largo plazo al día siguiente.
Controlado Congelador Cambio
- Subir un programa de congelación apropiado para el software del congelador de velocidad controlada. Un programa de ejemplo se muestra en la Tabla 3. Figura 4 muestra una curva de congelación típica para hNPCs. Sin embargo, el programa exacto variará para cada modelo de congelador. La tarifa de la muestra global estándar debe estar cerca de -1 ° C / min hasta alcanzar -40 ° C, donde la velocidad de congelación puede ser aumentado sustancialmente a lo menos -80 º C.
| Paso | Tarifa (° C) | Fin de temperatura (° C) | Retención (min seg) | Gatillo |
| 1 | - | - | 5 min 0 seg | Cámara |
| 2 | - 1.3 | - 5 | - | Muestra |
| 3 | - | - | 1 min 0 seg | Cámara |
| 4 | - 45 | - 58 | - | Cámara |
| 5 | + 10 | - 26 | - | Cámara |
| 6 | + 3 | - 23 | - | Cámara |
| 7 | - 0,8 | - 40 | - | Muestra |
| 8 | - 10 | - 100 | - | Cámara |
| 9 | - 35 | - 160 | - | Cámara |
Tabla 3. Pasos para la congelación hNPCs en un r controladacomió congelador. Programa sugerido para hNPC criopreservación en un congelador de velocidad controlada.

Figura 4. Curva de congelación de la muestra. Curva de congelación típica para hNPCs en un congelador de velocidad controlada.
- Transfiera los crioviales de hielo en los cestos asociados con el congelador de velocidad controlada. Asegúrese de cargar un criovial sólo con medio de congelación de células a utilizar para la sonda de temperatura de la muestra. Transfiera las cestas en la cámara de congelación y colocar la sonda de muestreo en el vial de la sonda. Inicie el programa.
- Cuando el protocolo ha completado, la transferencia de los viales en nitrógeno líquido de almacenamiento a largo plazo.
9. Procedimiento de descongelación
El siguiente protocolo es para criogénicamente descongelación phNPCs reservados.
- Transfiera los crioviales del almacenamiento en nitrógeno líquido inmediatamente en hielo seco. PRECAUCIÓN: Los viales pueden tener grietas o tapas sueltas que permiten nitrógeno líquido para entrar en el vial. Cuando se retira de las condiciones de ultracongelación, el líquido puede hervir, de inmediato la explosión del vial. Use EPP apropiado al retirar los viales.
- Preparar todos los reactivos y materiales de construcción por debajo antes de tiempo. Una vez que el proceso de descongelación ha comenzado, es crítico para seguir a través de manera eficiente.
- Transferencia Neural expansión de células madre Medium, MM, un tubo cónico de 15 ml, 2 ml de uno y uno 10 ml de pipeta serológica para cada criovial en el BSC.
- Un mínimo de 9 ml de expansión de células madre neuronales medio y se requiere 5 ml de MM para cada vial. Preparar más de cada medio de comunicación si es necesario.
- Sólo descongelar un vial de hNPCs a la vez. Transferir las células congeladas de hielo seco en un lugar limpio 37 ° C baño de agua y agitar el vial en el baño de agua continuamente. Monitorear el volumen dehielo que se ha derretido. Cuando hay un pedazo de hielo de aproximadamente 0,5 cm a la izquierda en el vial, rocíe y limpie con un 70% de alcohol isopropílico y transferir en el BSC.
- Transferir el contenido del criovial a un tubo cónico de 15 ml con una pipeta serológica de 2 ml. Añadir 1 ml de Neural expansión de células madre Medio a la criovial vacío y luego transferir 8 ml de Neural expansión de células madre en medio de las células descongeladas en una lenta, gota a gota, mientras agitando suavemente el tubo. Esto se hace para reducir el riesgo de choque osmótico.
- Transferir el enjuague de la criovial a los 9 ml de suspensión de células. Transferir el tubo cónico sobre hielo y repita los pasos 9.4 a 9.5 para todos los viales restantes.
- Centrifugar los tubos cónicos a 200 xg durante 5 min a 4 ° C. Durante la centrifugación, preparar el número apropiado de frascos para la siembra basados en la Tabla 4.
| N º de viales | Volumen Siembra total (ml) | Frasco |
| 1 | 5 | T12.5 |
| 2 | 10 | T25 |
| 3 | 15 | T75 |
| 4 | 20 | T75 |
| 5 | 25 | T75 |
| 6 | 30 | T175 |
| 7 | 35 | T175 |
| 8 | 40 | T175 |
| 8 + | - | Combinación de Frascos |
Tabla 4. Tamaños Frasco basado en el número de crioviales descongelados. Volumen sugerido y tamaño matraz para sembrar hNPCs después de la descongelación.
- Vuelva a suspender y combinar todos los tubos en el volumen apropiado de MM basado en la Tabla 4. Mezclar bien y volvermover una muestra para el conteo de viabilidad. Consulte los pasos 8.15 a 8.16 para el recuento de los detalles. El rango de siembra estándar es entre 160,000-320,000 células / cm 2.
- Mezclar las células bien y alícuotas de las células en frascos. Transfiera los frascos a un 5% de CO 2/37 ° C/95% de humedad incubadora. Mezcle el frasco agitando suavemente hacia adelante y hacia atrás para distribuir uniformemente las células.
- Las células se forman esferas dentro de las 24-48 horas. De vez en cuando las células se adhieren a la superficie de plástico y formar una distribución de colonia en forma de panal. Si esto ocurre, deje las células durante 3 días antes de enjuagar las células sueltas, ayudando en la formación de esferas. Enjuague cada 1-3 días hasta que no queden células adherentes. Si la transferencia necesaria de las células a un nuevo matraz.
- Cambio de 25-75% de los medios con MM cada 3-4 días hasta que las células están listas para cortar, generalmente 7-14 días después de la descongelación.
Access restricted. Please log in or start a trial to view this content.
Resultados
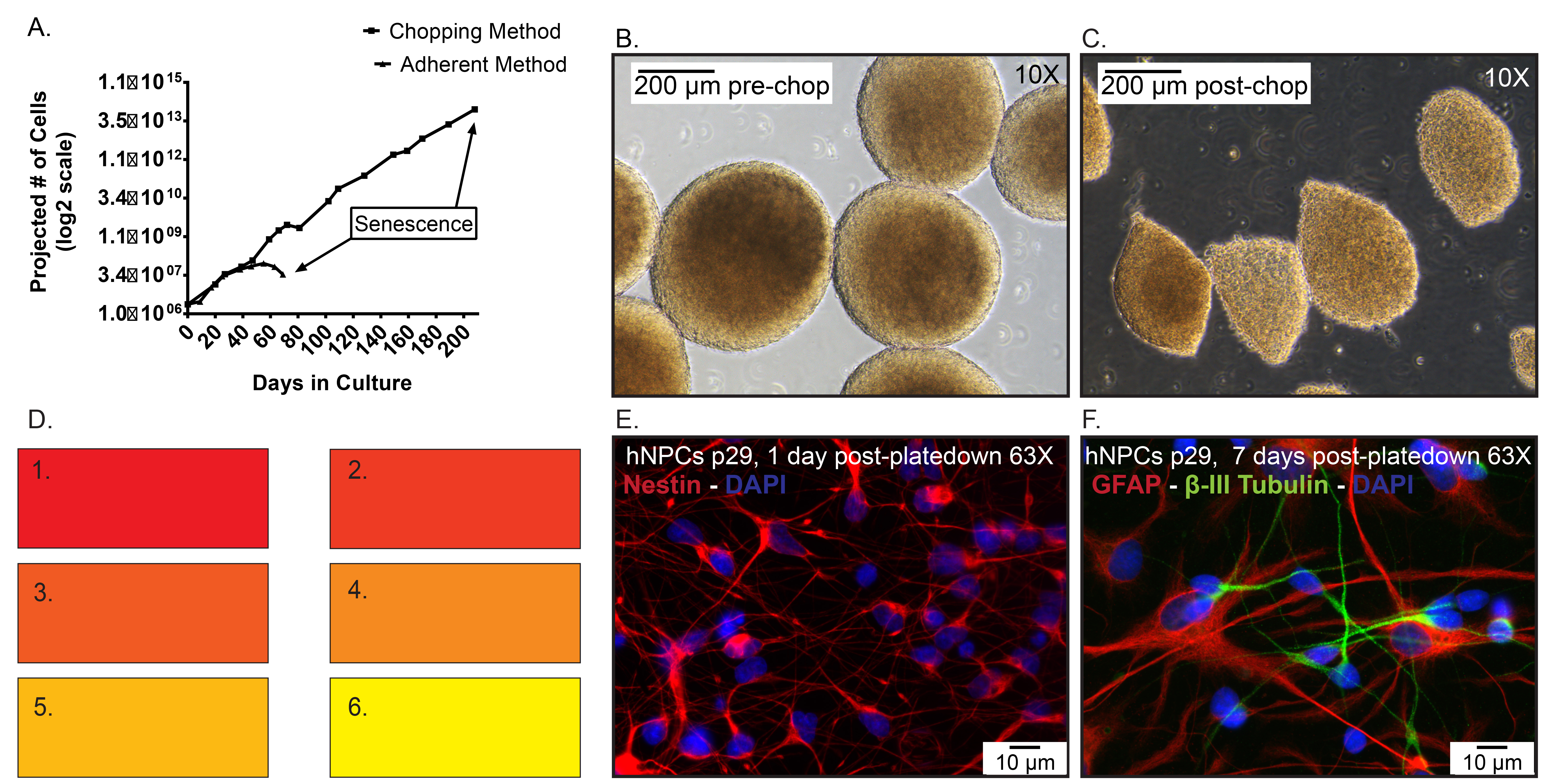
El número de células Figura 5. Los datos representativos. A) proyectados de hNPCs congelados en p19, luego descongelados y se expandieron como una monocapa adherente mediante disociación enzimática en comparación con neuroesferas con pases a través del método de cortar. Día 0 representa cuando las células se descongelaron a p20. B)
Access restricted. Please log in or start a trial to view this content.
Discusión
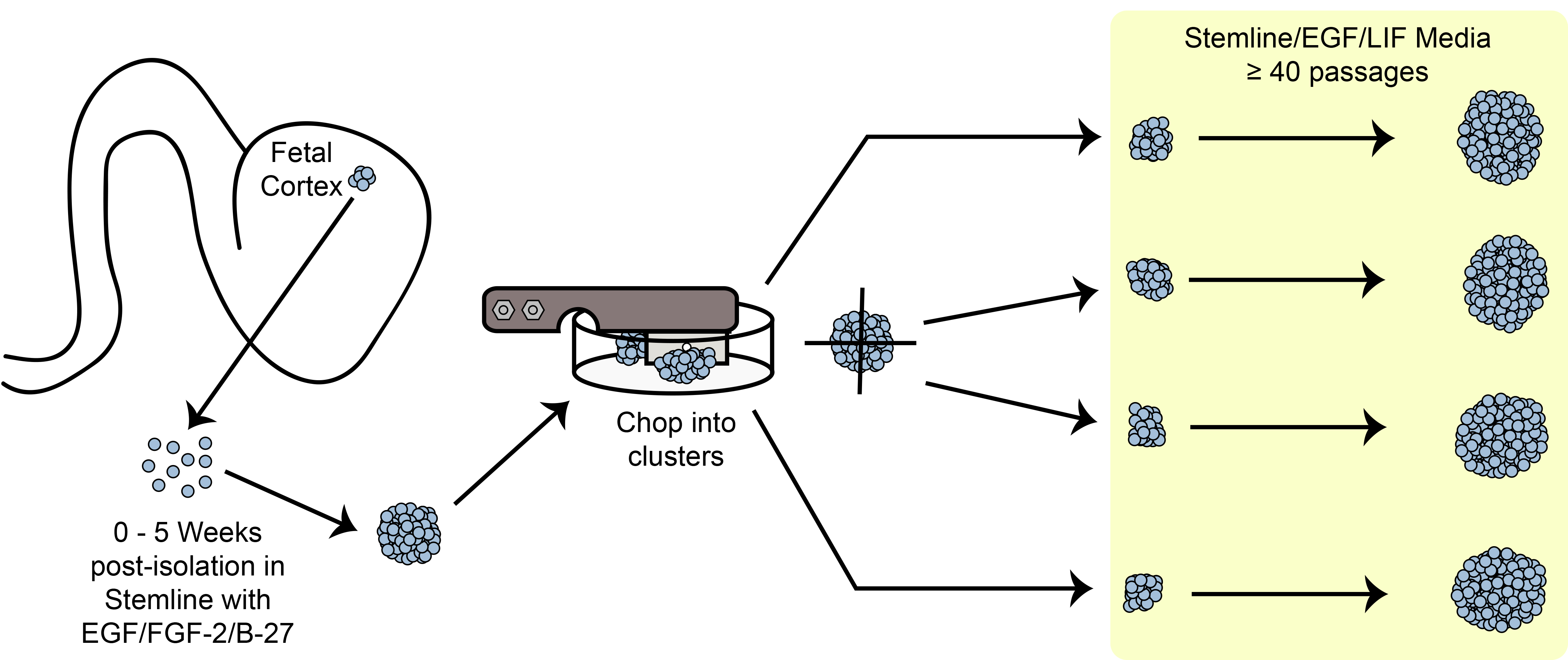
Figura 6. Esquema de cortar. Expandiendo las células madre esferoide / progenitoras en la cultura con el método de cortar mecánica.
Pasos críticos
Una visión general del paradigma de la expansión de picar se muestra en la Figura 6. HNPC tamaño de la esfera es uno de los ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Soshana Svendsen para la revisión y edición de este informe crítico. Este trabajo ha sido aportada por el NIH / NINDS 1U24NS078370-01 y el CIRM Dr2a-05320.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Beaker, 50 ml | Fisherbrand | FB-100-50 | multiple manufacturers/suppliers |
| Bio-Safety Cabinet, class II | Baker | SG-603A | 4 ft. or 6 ft. model. 6 ft. model recommended; multiple manufacturers/suppliers |
| Blades, Double-edge Prep | Personna | 74-0002 | multiple manufacturers/suppliers. CAUTION: Sharp |
| Cell Freezing Media | Sigma-Aldrich | C6295-50ML | DMSO, serum-free |
| Centrifuge, swing-bucket with 15 ml inserts | Eppendorf | 5810 R | multiple manufacturers/suppliers |
| Conical Tubes, 15 ml | Fisherbrand | S50712 | multiple manufacturers/suppliers |
| Conical Tubes, 50 ml | BD Falcon | 352074 | multiple manufacturers/suppliers |
| Controlled Rate Freezer | Planer | Kryo 750 | multiple manufacturers/suppliers |
| Cryovials, 2 ml | Corning | 430488 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T12.5 | BD Falcon | 353107 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T25 | BD Falcon | 353081 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T175 | BD Falcon | 353045 | multiple manufacturers/suppliers |
| Culture Flask, Vented, T75 | BD Falcon | 353110 | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 1 L | Millipore | SCGPU11RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 150 ml | Millipore | SCGVU01RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 500 ml | Millipore | SCGPU05RE | multiple manufacturers/suppliers |
| Filter, 0.22 µm, attached cup, 50 ml | Millipore | SCGP00525 | multiple manufacturers/suppliers |
| Filter Paper, 8.5 cm circles | Whatman/GE | 1001-085 | |
| Forceps, Standard Pattern - Serrated/Curved/18 cm | Fine Science Tools | 11001-18 | |
| Freezing Chamber, Isopropyl Alcohol | Nalgene | 5100-0001 | "Mr. Frosty" |
| Incubator, 37 °C/5% CO2 | Forma | 370 series | multiple manufacturers/suppliers |
| Hemacytometer, Phase | Hausser Scientific | 1475 | multiple manufacturers/suppliers |
| McIlwain Tissue Chopper | Lafayette Instruments | TC752-PD | Petri dish modification required. CAUTION: Moving, sharp blade. |
| Micropipettor, 1-10 μl | Gilson | F144562 | multiple manufacturers/suppliers |
| Micropipettor, 100-1,000 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 2-20 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Micropipettor, 20-200 μl (starter kit) | Gilson | F167700 | multiple manufacturers/suppliers |
| Nutdriver, Autoclavable, 5/16" | Steritool | 10302 | |
| Pasteur Pipets, cotton-plugged | Fisherbrand | 13-678-8B | multiple manufacturers/suppliers |
| Petri Dish, Glass, Autoclavable | Corning | 3160-100 | |
| Pipet Aid | Drummond | 4-000-101 | multiple manufacturers/suppliers |
| Shim disc | McMaster-Carr | VARIABLE | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 10 μl | AvantGuard | AV10R-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 1,000 μl | AvantGuard | AV1000 | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 20 μl | AvantGuard | AV20-H | multiple manufacturers/suppliers |
| Sterile barrier pipet tips, 200 μl | AvantGuard | AV200-H | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 10 ml | Fisherbrand | 13-676-10J | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 2 ml | Fisherbrand | 13-675-3C | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 25 ml | Fisherbrand | 13-676-10K | multiple manufacturers/suppliers |
| Sterile Disposable pipettes, all-plastic wrap, 5 ml | Fisherbrand | 13-676-10H | multiple manufacturers/suppliers |
| Sterilization Pouches, 19 x 33 cm | Crosstex | SCL | multiple manufacturers/suppliers |
| Strainer, 40 µm | BD Falcon | 352340 | |
| Tissue Culture Dishes, 60 mm | BD Falcon | 351007 | |
| Tube Racks, Interlocking Four-Way | Fisherbrand | 03-448-17 | |
| Water Bath | Fisherbrand | S52602Q | multiple manufacturers/suppliers |
| Neural Progenitor Cell-Specific Processing Reagents | |||
| Neural Stem Cell Expansion Medium (Stemline) | Sigma-Aldrich | S3194-500ML | Important to use the Stemline brand |
| Recombinant Human Epidermal Growth Factor (EGF) | Millipore | GF316 | multiple manufacturers/suppliers |
| Recombinant Human Leukemia Inhibitory Factor (LIF) | Millipore | LIF1010 | multiple manufacturers/suppliers |
| Trypan Blue (0.4%) | Sigma-Aldrich | T8154-100ML | multiple manufacturers/suppliers |
| TrypLE Select (1x) | Life Technologies | 12563-011 |
Referencias
- Cattaneo, E., McKay, R. Proliferation and differentiation of neuronal stem cells regulated by nerve growth factor. Nature. 347, 762-765 (1990).
- Palmer, T. D., Takahashi, J., Gage, F. H. The adult rat hippocampus contains primordial neural stem cells. Molecular and cellular neurosciences. 8, 389-404 (1997).
- Wu, Y., Liu, Y., Chesnut, J. D., Rao, M. S. Isolation of neural stem and precursor cells from rodent tissue. Methods in molecular biology. , 438-4339 (2008).
- Reynolds, B. A., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255, 1707-1710 (1992).
- Svendsen, C. N., Fawcett, J. W., Bentlage, C., Dunnett, S. B. Increased survival of rat EGF-generated CNS precursor cells using B27 supplemented medium. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. , 102-407 (1995).
- Laywell, E. D., Kukekov, V. G., Steindler, D. A. Multipotent neurospheres can be derived from forebrain subependymal zone and spinal cord of adult mice after protracted postmortem intervals. Experimental neurology. , 156-430 (1999).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. J Vis Exp. 45 (45), (2010).
- Temple, S. Division and differentiation of isolated CNS blast cells in microculture. Nature. 340, 471-473 (1989).
- Chalmers-Redman, R. M., Priestley, T., Kemp, J. A., Fine, A. In vitro propagation and inducible differentiation of multipotential progenitor cells from human fetal brain. Neuroscience. 76, 1121-1128 (1997).
- Ostenfeld, T., et al. Regional specification of rodent and human neurospheres. Brain research. Developmental brain research. 134, 43-55 (2002).
- Carpenter, M. K., et al. et al. In vitro expansion of a multipotent population of human neural progenitor cells. Experimental neurology. 158, 265-278 (1999).
- Nunes, M. C., et al. Identification and isolation of multipotential neural progenitor cells from the subcortical white matter of the adult human brain. Nature. 9, 439-447 (2003).
- Piao, J. H., et al. Cellular composition of long-term human spinal cord- and forebrain-derived neurosphere cultures. Journal of neuroscience research. 84, 471-482 (2006).
- Barami, K., Zhao, J., Diaz, F. G., Lyman, W. D. Comparison of neural precursor cell fate in second trimester human brain and spinal cord. Neurological research. 23, 260-266 (2001).
- Walder, S., Ferretti, P. Distinct neural precursors in the developing human spinal cord. The International journal of developmental biology. 48, 671-674 (2004).
- Buc-Caron, M. H. Neuroepithelial progenitor cells explanted from human fetal brain proliferate and differentiate in vitro. Neurobiology of. 2, 37-47 (1995).
- Becq, H., Jorquera, I., Ben-Ari, Y., Weiss, S., Represa, A. Differential properties of dentate gyrus and CA1 neural precursors. Journal of. 62, 243-261 (2005).
- Keenan, T. M., Nelson, A. D., Grinager, J. R., Thelen, J. C., Svendsen, C. N. Real time imaging of human progenitor neurogenesis. PloS one. 5, (2010).
- Kim, H. J., McMillan, E., Han, F., Svendsen, C. N. Regionally specified human neural progenitor cells derived from the mesencephalon and forebrain undergo increased neurogenesis following overexpression of ASCL1. Stem cells. 27, 390-398 (2009).
- Windrem, M. S., et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse. Cell stem cell. 2, 553-565 (2008).
- Kitiyanant, N., Kitiyanant, Y., Svendsen, C. N., Thangnipon, W. B. D. N. F. - IGF-1- and GDNF-secreting human neural progenitor cells rescue amyloid beta-induced toxicity in cultured rat septal neurons. Neurochemical research. 37, 143-152 (2012).
- Dutta, S., et al. Cell therapy: the final frontier for treatment of neurological diseases. CNS neuroscience & therapeutics. 19, 5-11 (2013).
- Lindvall, O., Barker, R. A., Brustle, O., Isacson, O., Svendsen, C. N. Clinical translation of stem cells in neurodegenerative disorders. Cell stem cell. 10, 151-155 (2012).
- Wang, S., et al. Long-term vision rescue by human neural progenitors in a rat model of photoreceptor degeneration. Investigative ophthalmology & visual science. 49, 3201-3206 (2008).
- Kitchens, D. L., Snyder, E. Y., Gottlieb, D. I. FGF and EGF are mitogens for immortalized neural progenitors. Journal of. 25, 797-807 (1994).
- Craig, C. G., et al. In vivo growth factor expansion of endogenous subependymal neural precursor cell populations in the adult mouse brain. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 2649-2658 (1996).
- Ciccolini, F., Svendsen, C. N. Fibroblast growth factor 2 (FGF-2) promotes acquisition of epidermal growth factor (EGF) responsiveness in mouse striatal precursor cells: identification of neural precursors responding to both EGF and FGF-2. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 7869-7880 (1998).
- Kelly, C. M., et al. EGF and FGF-2 responsiveness of rat and mouse neural precursors derived from the embryonic CNS. Brain research bulletin. 68, 83-94 (2005).
- Sun, Y., et al. Long-term tripotent differentiation capacity of human neural stem (NS) cells in adherent culture. Molecular and cellular neurosciences. 38, 245-258 (2008).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11, 951-966 (1993).
- Gritti, A., et al. Multipotential stem cells from the adult mouse brain proliferate and self-renew in response to basic fibroblast growth factor. The Journal of neuroscience : the official journal of the Society for Neuroscience. 16, 1091-1100 (1996).
- Chojnacki, A., Weiss, S. Production of neurons, astrocytes and oligodendrocytes from mammalian CNS stem cells. Nature. 3, 935-940 (2008).
- Ferrari, D., Binda, E., De Filippis, L., Vescovi, A. L. Isolation of neural stem cells from neural tissues using the neurosphere technique. Current protocols in stem cell biology. Chapter. 2, 10-1002 (2010).
- Ebert, A. D., McMillan, E. L., Svendsen, C. N. Isolating, expanding, and infecting human and rodent fetal neural progenitor cells. Current protocols in stem cell biology. Chapter 2, Unit 2D 2, doi:10.1002/9780470151808.sc02d02s6. , (2008).
- Svendsen, C. N., et al. Long-term survival of human central nervous system progenitor cells transplanted into a rat model of Parkinson's disease. Experimental neurology. 148, 135-146 (1997).
- Draper, J. S., et al. Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nature. 22, 53-54 (2004).
- Buzzard, J. J., Gough, N. M., Crook, J. M., Colman, A. Karyotype of human ES cells during extended culture. Nature biotechnology. 22, 381-382; author reply 382. , 10-1038 (2004).
- Mitalipova, M. M., et al. Preserving the genetic integrity of human embryonic stem cells. Nature. 23, 10-1038 Forthcoming.
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of neuroscience. 85, 141-152 (1998).
- Baghbaderani, B. A., Mukhida, K., Hong, M., Mendez, I., Behie, L. A. A review of bioreactor protocols for human neural precursor cell expansion in preparation for clinical trials. Current stem cell research & therapy. 6, 229-254 (2011).
- Ebert, A. D., et al. EZ spheres: A stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem cell research. 10, 417-427 (2013).
- Ebert, A. D., et al. Induced pluripotent stem cells from a spinal muscular atrophy patient. Nature. 457, 277-280 (2009).
- Consortium, H. D. iP. S. C. Induced pluripotent stem cells from patients with Huntington's disease show CAG-repeat-expansion-associated phenotypes. Cell stem cell. 11, 264-278 (2012).
- Gamm, D. M., Nelson, A. D., Svendsen, C. N. Human retinal progenitor cells grown as neurospheres demonstrate time-dependent changes in neuronal and glial cell fate potential. Annals of the New York Academy of Sciences. , 1049-10107 (2005).
- Hosoyama, T., Meyer, M. G., Krakora, D., Suzuki, M. Isolation and in vitro propagation of human skeletal muscle progenitor cells from fetal muscle. Cell biology international. 37, 191-196 (2013).
- Sareen, D., et al. Inhibition of apoptosis blocks human motor neuron cell death in a stem cell model of spinal muscular atrophy. PloS one. 7, (2012).
- Chang, M. Y., Park, C. H., Lee, S. H. Embryonic cortical stem cells secrete diffusible factors to enhance their survival. Neuroreport. 14, 1191-1195 (2003).
- Sareen, D., et al. Chromosome 7 and 19 trisomy in cultured human neural progenitor cells. PloS one. 4, (2009).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue
Posted by JoVE Editors on 9/01/2014. Citeable Link.
A correction was made to A cGMP-applicable Expansion Method for Aggregates of Human Neural Stem and Progenitor Cells Derived From Pluripotent Stem Cells or Fetal Brain Tissue. The corresponding author was changed from:
Brandon C. Shelley
to:
Clive Svendsen
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados