A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
والقرنية Micropocket الفحص: نموذج من الأوعية الدموية في العين ماوس
In This Article
Summary
يصف بروتوكول الفحص micropocket القرنية كما وضعت في الفئران.
Abstract
الماوس القرنية micropocket الفحص هو فحص قوي والكمي في الجسم الحي لتقييم الأوعية الدموية. باستخدام الكريات بطء الإفراج موحدة تحتوي على عوامل النمو المحددة التي تؤدي إلى نمو الأوعية الدموية في جميع أنحاء القرنية اوعائي بشكل طبيعي، الأوعية الدموية يمكن قياسها كميا و. في هذا الاختبار يتم إنشاء استجابة عائية على مدار عدة أيام، وهذا يتوقف على نوع وجرعة من عامل النمو المستخدمة. يتم تشغيل تحريض اتساع الأوعية الدموية عادة إما عاملا أساسيا نمو الخلايا الليفية (bFGF) أو عامل نمو بطانة الأوعية الدموية (VEGF). من خلال الجمع بين هذه العوامل النمو مع sucralfate وhydron (بولي HEMA (بولي (ميتاكريليت 2 هيدروكسي))) وصب الخليط في الكريات، ويمكن زرعها جراحيا في العين الماوس. هذه الكريات موحدة ببطء الافراج عن عوامل النمو أكثر من خمسة أو ستة أيام (bFGF أو VEGF على التوالي) مما يتيح استجابة عائية الكافية اللازمة لف منطقة السفينةuantification باستخدام المصباح الشقي. هذا الاختبار يمكن استخدامها لمختلف التطبيقات، بما في ذلك تقييم المخدرات المغير عائية أو العلاجات وكذلك المقارنة بين خلفيات وراثية مختلفة تؤثر على الأوعية الدموية. محقق المهرة بعد ممارسة هذا الاختبار يمكن زرع بيليه في أقل من 5 دقائق لكل عين.
Introduction
عملية تكوين الأوعية الدموية، وتشكيل الأوعية الدموية الجديدة تشكل تلك الموجودة مسبقا، معقد للغاية وينظم من قبل العديد من العوامل الداخلية التي تتحكم في الخطوات المختلفة لتنتشر السفن والتشكل. يتم تشغيل الأوعية الدموية بسبب حدوث تحول في التوازن بين العوامل المؤيدة والمضادة للعائية، وهو التوازن الذي يحافظ عادة على الأوعية الدموية في حالة سكون. الأوعية الدموية في البالغين يحدث في بعض الظروف الفسيولوجية مثل أثناء دورة المبيض الأنثوية أو في عمليات إصلاح مثل التئام الجروح وتجديد الأنسجة. ومع ذلك، فإنه هو أيضا السمة المميزة للعديد من الأمراض بما في ذلك الأورام الخبيثة، وظروف المناعة الذاتية والأمراض الالتهابية. اشتراك الأوعية الدموية في هذه الظروف الفسيولوجية والمرضية يجعل من موضوع هام للبحث وهدفا جذابا للعلاج.
نظرا لتعقيد الأوعية الدموية وإشراك العديد مLLS والعوامل في هذه العملية، بما في ذلك الخلايا البطانية، pericytes، تعميم خلايا والخلايا اللحمية، في المختبر تظل نماذج محدودة ولا يمكن أن ألخص فريدة من نوعها المكروية في الجسم الحي. الرئيسية في فحوصات المختبر من الأوعية الدموية وتركز بشكل كبير على مراقبة الآثار المباشرة على الخلايا البطانية وقياس خطوات معينة في عملية عائية تحت ظروف خاضعة للرقابة. وتشمل هذه المقايسات الكمي من الخلايا البطانية انتشار 1، 2 الهجرة، وتشكيل شبكة 3، تشكيل أنبوب 4 و 5 تنبت من الكروية. خارج الحي النماذج، على عكس تلك الموجودة في المختبر، هي أكثر تعقيدا ودمج أنواع الخلايا الأنسجة المتعددة، على سبيل المثال الراهن حلقة الأبهر فحص 6. ومع ذلك، مثل أنظمة أخرى، فإنه لا يمكن التقاط مساهمة خلايا تعميم وسدى الطبيعي للخلايا البطانية كما موجود في الجسم الحي. محاولاتلدراسة الأوعية الدموية تحت تدفق لتقليد تتم باستخدام أنظمة ميكروفلويديك 7 الإعداد في الجسم الحي، ولكن حتى هذه المقايسات، وإن تحسنت كثيرا، لا تزال غير قادرة على حساب لجميع المقصورات الموجودة في الجسم الحي.
بسبب القيود المفروضة على في المختبر، وبحكم نماذج الأوعية الدموية الجسم الحي، في الجسم الحي نماذج تبقى الخيارات أكثر موثوقية للدراسات الأوعية الدموية. أمثلة على هذه النماذج تشمل غرس غرف شفافة، "ويندوز"، التي تسمح التصور من تزايد الأوعية الدموية تحت المجهر 8، يزرع تحت الجلد عن طريق الحقن مثل تشكيل matrigel والسفينة في الأنسجة الطبيعية مثل الماوس الأذن وغشاء مشيمائي الدجاج (CAM ). ومع ذلك، واحد من النماذج الأكثر قبولا الأوعية الدموية والكمية في الجسم الحي هو فحص القرنية micropocket اتساع الأوعية الدموية وصفها هنا، التي تستغل بشكل طبيعي اوعائيالقرنية بمثابة "شاشة" لتصور وتقييم النمو عائية جديد 9.
نحن هنا وصف micropocket فحص القرنية وتطويرها في الفئران. في البداية تم استخدام نموذج لقياس المحفزات عائية غير محددة في القرنيات أرنب. وقد تم ذلك عن طريق إدخال قطع الورم في الخلط المائي في الغرفة الأمامية للعين الأرنب ويقاس اتساع الأوعية الدموية التي يسببها الورم 11.
ومع ذلك، فقد تطورت الفحص في وقت لاحق لدراسة آثار النمو محدد 10 العوامل لتحديد وتوحيد تأثير عائية أفضل. من أجل الافراج عن عامل النمو في العين، استخدمت الكريات بطء الإفراج تحتوي على كميات معروفة من عوامل النمو عائية بدلا من الأنسجة. توفر تنقية البروتينات المؤتلف عائية مثل bFGF أو VEGF تمكين استخدامها كأهداف محددة من modulaters الأوعية الدموية 12. في البداية، كان الفحصتستخدم إلى حد كبير في الأرانب، والتي هي أسهل للعمل مع نظرا لحجمها ولكن في وقت لاحق وقد ترجم هذا النموذج في الفئران. نموذج حيواني أصغر حجما وأقل تكلفة. التحول من أرنب على الفئران تقدم ميزة هامة لتكون قادرة على استخدام الحيوانات التلاعب وراثيا، مما يخلق مجالا جديدا للبحث في المكونات الوراثية التي تؤثر على الأوعية الدموية 13. بالإضافة إلى استخدام أكثر قبولا من القرنية الفحص في دراسة الأوعية الدموية، ويمكن أيضا عمليات بيولوجية أخرى يجري التحقيق باستخدام فحوصات تعديل. على سبيل المثال، قدمت دراسات lymphangiogenesis ممكن من خلال غرس انخفاض الكريات جرعة bFGF الذي يسمح التصور من الأوعية اللمفاوية من خلال الواسمات الجزيئية محددة 14. وبالإضافة إلى ذلك، قدمت هذا الاختبار وسيلة لتقييم آثار الإشعاع على الأوعية الدموية 15.
في الجمع، والقرنية micropocket فحص الأوعية الدموية هو كمي، مندوبroducible، وتقييم مرونة الأوعية الدموية في الجسم الحي. والميزة الرئيسية لهذا الاختبار هي أن قياس السفن الخلفية غير ضروري لأن الأوعية تنمو في الأنسجة اوعائي بشكل طبيعي. نحن هنا وصف بروتوكول من هذا الاختبار في التفاصيل ومناقشة السيناريوهات المختلفة التي يمكن أن تحدث. يتكون الاختبار من 3 قطاعات منفصلة. هنا فإننا سوف تصف إعداد عامل نمو شامل الكريات، وغرس الجراحية لاحقا، وأخيرا الطريقة المستخدمة لقياس النمو التوعية المستحدثة الناتجة عن ذلك.
Protocol
وتعرض جميع البروتوكولات التي تنطوي على الحيوانات إلى وأقرته اللجنة رعاية واستخدام الحيوان المؤسسي في مستشفى بوسطن للأطفال وتتم وفقا لتوصيات الاتحاد للتقويم والاعتماد من رعاية الحيوان المعملية (AAALAC). تأكد من استخدام أدوات معقمة وtechniqure العقيم أثناء تنفيذ الإجراء.
1. إعداد الكريات
- تزن من 10 ملغ من sucralfate و 60 ملغ من hydron مع ملعقة unbent معقمة. وضع في أنابيب microcentrifuge منفصلة.
- وضع قطعة 1 سم مربع من شبكة إلى العقيمة 10 سم الطبق. عكس ذلك شبكة ترتكز على غطاء الضحلة. توضع جانبا.
- إضافة 500 ميكرولتر من الإيثانول إلى hydron ودوامة لمدة 10 دقيقة على الأقل.
- إضافة كمية مناسبة من عامل النمو (القياسية: 20 ميكروغرام للbFGF، 50 ميكروغرام للVEGF) إلى sucralfate ودوامة لفترة وجيزة. عامل النمو تخزينها في-80 ° C الفريزر بتركيز 1 ملغ / مل. يجب أن حجم السائل أضاف أن ما لا يقل عن 20 ميكرولتر لضمان sucralfate هو مبلل تماما ولكن يجب أن لا تتجاوز 50 ميكرولتر. أكبر حجم يجعل تبخر السائل في الخطوة التالية صعوبة.
- ضع الخليط sucralfate في المبخر الطرد المركزي تعيين على الأقل حتى يصبح الخليط الجاف تماما، وعادة 30-50 دقيقة اعتمادا على حجم السائل المستخدم.
- تحقق الخليط لمدة الرطوبة المتبقية مع نهاية مدبب من ملعقة معقمة. الخليط يجب أن يشعر "مقدد".
- استخدام نهاية مدبب من ملعقة لتفريق خليط sucralfate داخل الأنبوب.
- إضافة 10 ميكرولتر من hydron إلى sucralfate.
- نظرا لطبيعة لزجة من hydron، وقطع من نهاية الماصة غيض 200 ميكرولتر ومن ثم رسم والافراج عن 10 ميكرولتر قبل pipetting صعودا مرة أخرى وإضافة إلى sucralfate.
- استخدام بسرعة خلاف عازمةالعلا لخلط hydron وsucralfate وإزالتها من الأنبوب.
- جمع الخليط على طول الجانب السفلي من غيض من ملعقة عازمة ثم تدوير أنبوب أثناء الرسم ملعقة على طول جدار الأنبوب. سوف الخليط يجف بسرعة لذلك يجب أن يتم ذلك خطوة بكفاءة.
- نشر الخليط على شبكة مستعدة باستخدام ملقط ليثبت في مكانه. يجب أن يكون الخليط حتى طبقة وملء في الثقوب للشبكة.
- تزج ملعقة عازمة في أنبوب يحتوي على hydron واستخدامه معطف كلا الجانبين للشبكة.
- وضع شبكة المغلفة متوكئا على الجانب ضد حافة الطبق والسماح للتجفيف في RT لمدة 30-45 دقيقة.
- وضع شبكة في الثلاجة -20 درجة مئوية أو الشروع فورا في الخطوة التالية. إبقاء شبكة داخل الطبق.
- وضع 35 مم طبق داخل طبق بتري أكبر، الغطاء. استخدام زوج من ملقط لسحب بعناية الألياف للشبكة بغض النظر على مدى 35 مم طبق. الكريات الضالة جويتم جمعها من الطبق أكبر في نهاية المطاف.
- تحقق الكريات عن التوحيد تحت النطاق. عملية ينتج حوالي 250 الكريات بالتالي الجرعة القياسية في بيليه لbFGF وVEGF هو 80 نانوغرام و 200 نانوغرام، على التوالي.
- متجر الكريات في 35 مم طبق في الثلاجة -20 درجة مئوية لمدة تصل إلى 3 أشهر.
2. زرع الجراحي من الكريات
- انشاء منطقة الجراحية تحت المجهر التشغيل.
- تخدير الفأر مع AVERTIN (400-500 مغ / كغ، داخل الصفاق) ووضع مؤشر الماوس تحت المجهر حتى العين مرئيا. أداء قرصة أخمص قدميه لضمان مستوى كاف من التخدير.
- تخدير العين الماوس عن طريق وضع 1 قطرة من حل بروباراكايين فوق مقلة العين. انتظر 20-30 ثانية وربت مع الشاش.
- Proptose العين الفأر مع # 1 مبلد المجوهرات ملقط يجري المؤكد أن ترك الجلد بين ملقط والعين. من المهم أن نحكم على الضغوط التي مورست بشكل صحيح.60. وعقد العين بقوة أيضا يؤدي إلى أن تصبح حمراء وغضب، بينما تفقد أيضا على عقد سيسمح للتحرك العين أثناء الجراحة.
- استخدام microknife 30 درجة إلى إجراء شق في القرنية حوالي 1 ملم من حوف. يجب أن يكون الشق 1-2 ملم في الطول. يجب أن تكون شق عميق بما يكفي لاختراق ما وراء الطبقة الظهارية في midstroma لكن ليس عميق جدا للتمزق العين.
- استخدام سكين فون Graef لجعل جيب عمودي على شق.
- حرك السكين تحت طبقة القرنية في موقع شق والعمل بلطف سكين في وتحريكه على طول شق لتوسيع الفضاء، وبالتالي تشكيل الجيب. فإنه يساعد على تحريك الماوس وكذلك لتكون قادرة على العمل مع انحناء العين. يجب الحرص على عدم دفع نحو الانخفاض مع طرف لتجنب تمزق العين.
- الرطب ملقط صائغ رقم 5 مع بروباراكايين واختيار بيليه للخروج من الطبق. وضع بيليه على العين.
- ترطيب سكين فون Graef مع بروباراكايين ونقل بعض من السائل على بيليه لجعله مطاطي ولين العريكة. إزالة الرطوبة الزائدة مع الشاش أو القطن المسحة.
- إدراج بيليه في الجيب باستخدام سكين فون Graef لدفعها داخل تحت طبقة القرنية. مرة واحدة بيليه كله في الداخل، تشغيل الجانب المسطح من سكين فون Graef على الموقع للتأكد من أن بيليه هو آمن.
- معطف العين مع مرهم مضاد حيوي الثلاثي.
- تحويل الماوس مرارا وتكرار لعملية جراحية في العين المعاكس.
3. الكمي من القرنية اتساع الأوعية الدموية.
ترك الحيوانات لتطوير السفن على مدى فترة محددة من الوقت. اليوم سفينة الدرجات يعتمد على عامل النمو المستخدمة. الصف bFGF في يوم 5 وVEGF الأضعف في يوم 6. يوم هو يوم غرس 0.
- تخدير الفأر مع AVERTIN (400-500 مغ / كغ، داخل الصفاق).
- استخدام مجهر المصباح الشقي لجرادينغ. بصري واحد لديه شبيكة الشعر، وخطوط داخل العدسة المستخدمة كوسيلة مساعدة لتحديد قياس طول السفينة والمسافة حول محيط العين أن السفن قد ظهرت.
- عقد الماوس أمام نطاقها، وتحديد المواقع الماوس بحيث ينظر إلى العين في العين مع بيليه مباشرة إلى الأمام. استقرار الرأس بين الإبهام والسبابة بحيث يتم تشديد الجلد على الوجه وproptosed العين قليلا.
- ضع ذ محور للشبيكة الشعر على طول سفينة الحوفي مباشرة تحت بيليه. قياس طول الأوعية المتفرعة في اتجاه تصاعدي الكريات. يسجل هذا القياس في أعشار من ملليمتر وتعيين طول السفينة (VL) (الشكل 1A).
- تحويل الماوس أو شبيكة الشعر بحيث تكون المسافة حول العين أن هذه السفن قد ظهرت تصبح واضحة. فمن الأسهل أن نفكر في العين والوجه على مدار الساعة مع فترات من 1 إلى 12. المعين هذه الساعة ساعة عدد (CH) (الشكل 1B). يمكن أن يكون رقما صحيحا أو كسور 0.25 (على سبيل المثال، 2، 2.25، 2.5 أو 2.75). ملاحظة: CH هو ذاتي. على سبيل المثال، البعض قد قياس المسافة حول العين لتشمل جميع السفن ظهرت من حوف حين أن البعض الآخر قد يتوقف قياس عند نقطة حيث طول السفينة هو نصف القصوى. العامل المهم هو أن تكون متسقة مع واحد كيف يختار الصف.
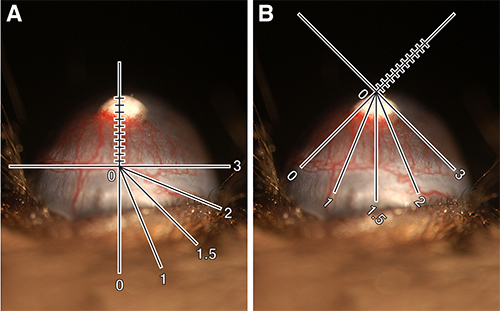
الرقم 1. الكمي لاتساع الأوعية الدموية القرنية. (A) 80 نانوغرام bFGF بيليه مزروع في C57BL / 6J الماوس يظهر المصباح الشقي شبيكة الشعر موجهة لقياس طول السفينة. VL = 0.9 مم. (B) نفس الاداء العين المصباح الشقي شبيكة الشعر استدارة لقياس ساعة على مدار الساعة. CH = 3.25. حساب مساحة سفينة = 1.84 مم 2. هذه الصور تم تعزيز رقميا للسماح لإضافة التخطيطي شبيكة الشعر. انقر هنا لمشاهدة صورة أكبر.
- حساب مساحة سفينة (VA) باستخدام الصيغة أدناه، والتي تقوم على مساحة بيضاوي (ملاحظة، فإنه من المفيد أن تضع ذلك في الاعتبار عند الدرجات.) اكسبريس VA في ملليمتر مربع. الصيغة هي كما يلي:
سفينة طول × مدار الساعة ساعة X 0.2 = π منطقة السفينة
النتائج
وتظهر نتائج نموذجية لbFGF وVEGF في الكريات العادية منخفضة عائية C57BL / 6J الفئران في الشكل 2A و B على التوالي. يبين الشكل 2E التوزيع الطبيعي من منطقة السفينة (VA) في C57BL / سلالة 6J بجرعات متفاوتة من هذه نمو العوامل. 80 الكريات bFGF نانوغرام يؤدي عادة في VA حوا...
Discussion
هناك العديد من الخطوات الهامة في إجراء فحص القرنية ناجحة. أول من صنع كريات موحدة قادرة على أن تزرع وتحفيز الأوعية. أهم أجزاء من إعداد بيليه هي 1) باستخدام عامل النمو خالية من الناقل. 2) ضمان وجود مزيج جيد من عامل النمو مع sucralfate وhydron و3) تحريك الخليط النهائي بسرعة ولكن بعن?...
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
نشكر كريستين جونسون لعمل الرسوم البيانية.
Materials
| Name | Company | Catalog Number | Comments |
| Section 1: Pellet preparation | |||
| Sucralfate | Sigma | #S0652 | |
| Hydron (aka Poly(2-Hema)) | Sigma | #P3932-10G | |
| Ethanol | Pharmco Products Inc | #111000200CSGL | |
| Growth factors: | Must be carrier-free (no bovine serum albumin(BSA)) | ||
| Fibroblast growth factor (FGF) | PeproTech | #AF-100-18B | |
| Vascular endothelial growth factor (VEGF) | R & D Systems | #293-VE-050/CF | |
| 35 mm dish | Becton-Dickson | #353001 | Used for storage of pellets |
| 10 cm petri dish | VWR | #25384-342 | Used as work surface for preparing pellets |
| Mesh | Sefar America | #03--300/51 | 300 um nitex nylon, cut into cm square pieces and sterilzed in autoclave |
| Spatulas | Fisher Scientific | #21-401-10 | Use tapered end of one to break up pellet mixture. Bend tapered end of other to help remove mixture from microcentrifuge tube. |
| Microcentrifuge tubes | Fisher Scientific | #05-408-146 | One for hydron, one for sucralfate |
| Jewelers forceps, #5 | Ambler Surgical | #2315E | Need 2 for pulling mesh apart |
| Centrifugal evaporator | ThermoSavant | DNA110 SpeedVac | |
| Section 2: Surgical implantation of pellets | |||
| Operating microscope | Zeiss | ||
| 2.5% Avertin | General anesthetic | ||
| Proparacaine hydrochloride ophthalmic solution 0.5% | Falcon | NDC# 6131401601 | Eye anesthetic |
| Triple Antibiotic Ophthalmic Ointment | Bausch & Lomb | NDC# 2420878055 | Contains neomycin, polymixin and bacitracin |
| Ophthalmic microknife, 5 mm | Surgistar | #924501 | 30 degree angle |
| von Graef knife | Ambler Surgical | #3401E | |
| Jewelers forceps, #1 | Ambler Surgical | #2301E | Must be blunted with sharpening stone for proptosing eye |
| Jewelers forceps, #5 | Ambler Surgical | #2305E | For picking up pellets and placing on eye |
| Small curved scissors | Ambler Surgical | #5636E | For trimming whiskers |
| Gauze | For blotting eye after proparacaine | ||
| Section 3: Grading of Corneal Neovascularization | |||
| 2.5% Avertin | General anesthetic | ||
| Slit lamp | Nikon | FS-2 | Needs an ocular with a reticule to assist in measuring |
References
- Gospodarowicz, D., Moran, J., Braun, D., Birdwell, C. Clonal growth of bovine vascular endothelial cells: fibroblast growth factor as a survival agent. Proc. Natl. Acad. Sci. USA. 73, 4120-4124 (1976).
- Glaser, B. M., D'Amore, P. A., Seppa, H., Seppa, S., Schiffmann, E. Adult tissues contain chemoattractants for vascular endothelial cells. Nature. 288, 483-484 (1980).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures. J. Cell Biol. 107, 1589-1598 (1988).
- Montesano, R., Orci, L. Tumor-promoting phorbol esters induce angiogenesis in vitro. Cell. 42, 469-477 (1985).
- Korff, T., Augustin, H. G. Integration of endothelial cells in multicellular spheroids prevents apoptosis and induces differentiation. J. Cell Biol. 143, 1341-1352 (1998).
- Nicosia, R. F., Tchao, R., Leighton, J. Histotypic angiogenesis in vitro: light microscopic, ultrastructural, and radioautographic studies. In Vitro. 18, 538-549 (1982).
- Wong, K. H., Chan, J. M., Kamm, R. D., Tien, J. Microfluidic models of vascular functions. Annu Rev Biomed Eng. 14, 205-230 (2012).
- Sandison, J. C. A new method for the microscopic study of living growing tissues by the introduction of a transparent chamber in the rabbit's ear. Anat. Rec. 28, 281-287 (1924).
- Jain, R. K., Schlenger, K., Hockel, M., Yuan, F. Quantitative angiogenesis assays: progress and problems. Nat. Med. 3, 1203-1208 (1997).
- Rogers, M. S., Birsner, A. E., D'Amato, R. J. The mouse cornea micropocket angiogenesis assay. Nat. Protoc. 2 (10), 2545-2550 (2007).
- Gimbrone, M. A., Leapman, S. B., Cotran, R. S., Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261-276 (1972).
- Gimbrone, M. A., Cotran, R. S., Leapman, S. B., Folkman, J. Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst. 52, 413-427 (1974).
- Rohan, R. M., Fernandez, A., Udagawa, T., Yuan, J., D'Amato, R. J. Genetic heterogeneity of angiogenesis in mice. FASEB J. 14 (7), 871-876 (2000).
- Chang, L. K., et al. Dose-dependent response of FGF-2 for lymphangiogenesis. Proc Natl Acad Sci U S A. 101 (32), 11658-11663 (2004).
- Udagawa, T., Birsner, A. E., Wood, M., D'Amato, R. J. Chronic suppression of angiogenesis following radiation exposure is independent of hematopoietic reconstitution. Cancer Res. 67 (5), 2040-2045 (2007).
- Turner, P. V., Albassam, M. A. Susceptibility of rats to corneal lesions after injectable anesthesia. Med Comp. 55 (2), 175-182 (2005).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Exp. Eye Res. 42, 331-337 (1986).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved