このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
角膜マイクロアッセイ:マウス眼における血管新生のモデル
要約
プロトコルは、マウスにおいて開発された角膜マイクロポケットアッセイを説明しています。
要約
マウス角膜マイクロポケットアッセイは、血管形成を評価するための堅牢かつ定量的なin vivoアッセイである。自然に無血管の角膜を通して血管増殖を誘発特定の成長因子を含む標準化された徐放性ペレットを使用することにより、血管新生を測定し、定量することができる。このアッセイにおいて血管新生反応は、使用される成長因子の種類と用量に応じて、数日間にわたって生成される。血管新生の誘導は、一般的に塩基性線維芽細胞増殖因子(bFGF)または血管内皮増殖因子(VEGF)のいずれかによってトリガされる。スクラルファートとヒドロン(ポリ-HEMA(ポリ(2 - ヒドロキシエチルメタクリレート)))これらの成長因子を組み合わせて、ペレットに混合物をキャストすることによって、それらは外科的にマウスの眼に埋め込むことができる。これらの均一なペレットは、血管領域Qに必要な十分な血管新生応答を可能にする(それぞれ、bFGFまたはVEGF)五、六日間の成長因子をゆっくりと放しスリットランプを用いてuantification。このアッセイは、血管形成モジュレーター薬または治療、ならびに血管新生に影響を及ぼす異なる遺伝的背景との比較評価を含む異なる用途に使用することができる。この検定の練習後に熟練した研究者は、眼あたり5分未満でペレットを移植することができます。
概要
血管新生のプロセスは、新たな血管の形成は、既存のものを形成し、非常に複雑であり、血管の出芽および形態の異なるステップを制御するいくつかの内因性因子によって調節される。血管新生に起因プロと抗血管新生因子のバランスのずれ、通常は休止状態にある血管系を維持してバランスをトリガされます。成人における血管新生は、そのような女性の卵巣周期中のように、あるいは創傷治癒および組織再生などの修復過程における特定の生理学的条件で発生します。しかし、それはまた、悪性腫瘍、自己免疫状態および炎症性疾患を含むいくつかの病態の特徴である。これらの生理学的および病理学的状態における血管新生の関与は、それの研究と治療のための魅力的な標的のための重要な課題となります。
血管新生の複雑さと、いくつかのCEの関与のために細胞および間質細胞の循環内皮細胞、周皮細胞、を含むプロセスでLLSおよび因子は、in vitroモデルは、限定されるもので残り、 生体内微小環境に固有のを再現することはできません。血管新生の主要なインビトロアッセイは、主に内皮細胞に直接影響を観察し、制御された条件下で血管新生過程の特定のステップを測定することに焦点を当てている。これらのアッセイは、in vitroでのものとは異なり、 エクスビボモデル。内皮細胞増殖1の定量化、遊走2、ネットワーク形成3、管形成4及びスフェロイド5からの発芽を含む、より複雑であり、多数の組織の細胞型を組み込んで、例がある大動脈輪アッセイ6。それにもかかわらず、他のシステムと同様に、循環細胞の寄与およびin vivoで存在する内皮細胞の自然な間質をキャプチャすることはできません。試みずっと改善したものの、マイクロ流体システム7、しかしでもこれらのアッセイを使用して実行されるin vivoでの設定を模倣する流れの下の血管形成を研究するために、まだ、生体内に存在するすべての区画を占めることができない。
ためのin vitroおよび ex vivo血管新生モデルの制限のためのin vivoモデルは、血管新生研究のためのより信頼性の高い選択肢を残る。これらのモデルの例としては、顕微鏡8下で成長する血管の可視化を可能にする透明なチャンバー、「窓」の移植、例えばマウス耳およびニワトリ漿尿膜(CAMなどの正常組織におけるマトリゲル及び血管形成のような注射可能な皮下移植を含む)。しかし、最も許容され、定量的なin vivoでの血管新生モデルの一つは、当然無血管悪用ここで説明した角膜マイクロポケット血管新生アッセイは、ある新しい血管新生増殖9を視覚化し、評価するための「スクリーン」として角膜。
マウスで開発されたようにここでは、角膜マイクロポケットアッセイを記述する。最初に、モデルは、ウサギ角膜における非特異的な血管新生刺激を測定した。これは、ウサギの眼の前房の房水に腫瘍断片を導入することによって行われ、腫瘍誘導性新生血管11を測定した。
しかし、このアッセイは、後でより良い指定血管新生効果を標準化するために、特定の成長の影響を研究するために10因子発生した。目に増殖因子を放出するために、血管新生増殖因子の既知量を含有する徐放性ペレットは、代わりに組織を使用した。そのようなbFGFまたはVEGFなどの精製された組換え血管新生タンパク質の利用可能性は、血管新生modulaters 12の具体的な目標としてのそれらの使用を可能にした。最初に、このアッセイであった主にそのサイズのためにで動作するように容易になりますが、後でモデルをマウスに翻訳されたウサギ、で使用される;小型で安価な動物モデル。マウスにウサギからシフトすることにより、血管新生13に影響を与える遺伝的構成要素の研究の新たな領域を作成し、遺伝子操作した動物を使用することができるという重要な利点を提供した。血管新生の研究に角膜アッセイのより許容使用量に加えて、他の生物学的プロセスはまた、改変されたアッセイを用いて研究されてことができる。例えば、リンパ管新生の研究は、特定の分子マーカー14を通ってリンパ管の可視化を可能にした低用量のbFGFペレットの注入により可能となった。さらに、このアッセイは、血管形成15に対する放射線の影響を評価する手段を提供している。
要約すると、角膜マイクロ血管新生アッセイは、定量的、担当者であるin vivoでの血管新生のroducible、柔軟な評価。このアッセイの主な利点は、血管が自然に無血管組織に成長するので、背景血管の測定が不要であることである。私たちは詳細に、ここでこのアッセイのプロトコルを説明し、発生する可能性がありますさまざまなシナリオについて説明します。アッセイは3別個のセグメントで構成されています。ここでは、成長因子の包括的なペレットの調製、その後の外科的移植、最終的に得られた新生血管の成長を定量化するために使用される方法について説明する。
プロトコル
動物に関わるすべてのプロトコルはに提示され、承認施設内動物管理使用委員会によって小児病院ボストンで、かつ実験動物管理の評価と認定協会(AAALAC)の勧告に従って行われているされている。手順の実行中、滅菌機器および無菌techniqureを使用してください。
ペレットの調製
- スクラルファート10mgのおよび滅菌曲がっていないスパチュラでハイドロン60mgの秤量。個別の微小遠心管に入れます。
- 無菌10cmの皿にメッシュ1cmの正方形のピースを置きます。そう浅い蓋の上に載っているメッシュ反転。脇に置きます。
- 少なくとも10分間ハイドロンと渦にエタノールを500μl添加する。
- 簡潔にスクラルファートと渦に:増殖因子(bFGF用20μgの、VEGFに対する50μgの標準)の適切な量を追加します。に保管して成長因子1 mg / mlの濃度で-80°Cの冷凍庫。追加された液体のボリュームが完全に湿らせたスクラルファートを確保するために20μlの最小であるべきであるが、50μLを超えてはならない。より大きな体積は、次工程での液体の蒸発が困難になる。
- 混合物が完全に乾くまで使用される液体の量に応じて、通常は30〜50分で、低に設定された遠心エバポレーターにスクラルファート混合物を配置します。
- 無菌へらのテーパー端部と残留水分のため、混合物を確認してください。混合物は「歯ごたえ」を感じるはずです。
- チューブ内にスクラルファート混合物を分割するへらの先細端部を使用してください。
- スクラルファートにハイドロンの10を添加する。
- 原因ヒドロンの粘性に、200μlのピペットチップから端を切ってから、再度ピペッティングスクラルファートに添加する前に10μLを描くとリリース。
- すぐに曲がったスパッツを使用ULAはハイドロンとスクラルファートを混合し、チューブから削除する。
- 曲がったへらの先端部の下側に沿って混合物を収集した後、チューブの壁に沿ってへらを引き出しながら、チューブを回転させます。この手順が効率的に行われなければならないので、混合物は急速に乾燥します。
- 所定の位置に保持するために鉗子を使用して準備されたメッシュ上の混合物を広げる。混合物が均一な層であることと、メッシュの穴に埋める必要があります。
- ハイドロンを含むチューブに曲がったへらを浸し、コートのメッシュの両面を、それを使用しています。
- 皿の縁に側に傾いてコーティングされたメッシュを置き、30〜45分間、室温での乾燥を可能にする。
- -20℃の冷凍庫でメッシュを配置するか、次のステップにすぐに進みます。皿の内側にメッシュを保管してください。
- 大きなペトリ皿、蓋オフの内側に35mm皿を置きます。慎重に35mm皿の上に離れて、メッシュの繊維を引っ張って一対の鉗子を使用してください。ストレイペレットC最後に大きな皿から収集することができる。
- スコープの下での均一性のために、ペレットを確認してください。プロセスは、このようにbFGFおよびVEGFに対するペレット当たりの標準投与量はそれぞれ80 ngの200 ngの、ある約250のペレットが得られます。
- 最大3ヶ月間-20℃の冷凍庫で35mmディッシュに保管してペレット。
ペレットの2。外科的移植
- 手術用顕微鏡下の手術領域を設定します。
- アベルチン(400-500ミリグラム/ kgを、腹腔内)でマウスを麻酔し、目が見えるように、顕微鏡下でマウスを置きます。麻酔の十分なレベルを確保するために、つま先のピンチを実行します。
- 眼球の上プロパラカイン液の1滴を配置することによって、マウスの眼を麻酔。 20〜30秒待ってから、ガーゼパッドで軽くたたく。
- 鈍く#1宝石商鉗子は鉗子と目の間の皮膚を残すことが確実であることをマウスの眼をProptose。正しく適用される圧力を判断することが重要である。60;緩すぎるホールド目が手術中に移動することを可能にする一方あまりにもしっかりと目を保持することは、それが赤やイライラになることになります。
- 角膜に角膜輪部から約1mmの切開を作るために30°マイクロナイフを使用してください。切開は、長さ1〜2 mmでなければなりません。切開はmidstromaに上皮層を超えて浸透するのに十分な深しかし目を破裂しそう深くはないでなければなりません。
- 切開に垂直にポケットを作るためにフォン·グレーフナイフを使用してください。
- 切開部位での角質層の下にナイフをスライドさせ、ゆっくりとナイフを働くので、ポケットを形成し、スペースを拡大するために切開に沿って移動します。それは、目の曲で作業できるようにするだけでなく、マウスを移動するのに役立ちます。目を破裂を避けるために先端を下方へ押すことがないように注意してください。
- プロパラカインで第5位宝石商の鉗子を湿らせ、皿の外にペレットを拾う。目の上にペレットを配置します。
- プロパラカインとフォン·グレーフナイフを湿らせ、それがゴム状と柔軟にするペレット上に液体の一部を移す。ガーゼパッドまたは綿棒で余分な水分を取り除きます。
- 角膜層の下の内側にそれをプッシュするフォン·グレーフナイフを使用してポケットにペレットを挿入します。ペレット全体が内側になると、ペレットが安全であることを確認するために、サイト上でフォン·グレーフナイフの平らな面を実行します。
- コートトリプル抗生物質軟膏眼。
- マウスを裏返し、反対側の目の中に手術を繰り返します。
角膜血管新生の3定量。
一定期間にわたって血管を開発するために、動物にしておきます。容器グレーディングの日は使用される成長因子に依存する。 5日目と6日目での弱いVEGF上のグレードのbFGF注入の日は0日です。
- アベルチン(400-500ミリグラム/ kgを、腹腔内)でマウスを麻酔。
- GRAための細隙灯顕微鏡を使用鼎。一方の眼は、血管が発芽している眼の周囲に血管長と距離を定量化するために、測定の補助として使用される接眼レンズ内のレチクルラインを有している。
- そう、目に直接進んペレットと、眼で見られるマウスを配置する、スコープの前でマウスを押したままにします。皮膚は顔に締め付けられると、目を少しproptosedされるように、親指と人差し指の間に頭部を安定させます。
- ペレットの真下に輪部血管に沿ってレチクルのy軸を置きます。ペレットに向かって上向きに分岐する血管の長さを測定します。ミリの十分のこの測定値を記録し、血管長(VL)( 図1A)を指定。
- これらの血管が発芽していることを目の周りの距離が明確になるように、マウスまたはレチクルのどちらかの電源を入れます。それは12の指定この数クロック時間(CH)( 図1を介して1の間隔で時計の文字盤などの眼と考えるのが最も簡単ですB)。それは、0.25( 例えば、2、2.25、2.5または2.75)の整数または分画することができます。注:CHが主観的である。例えば、いくつかの他は、容器の長さが最大半量ある時点で測定を停止することがありながら、角膜輪部から発芽したすべての血管を含むように目の周りの距離を測定することができる。重要な要因は、一つは学年に選択する方法と一致していることです。
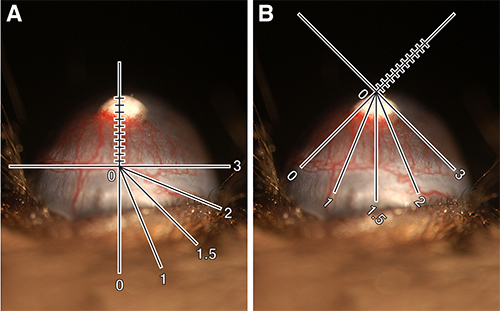
角膜血管新生の図1の定量。血管の長さを測定するように配向細隙灯レティクルを示すC57BL / 6Jマウスに移植された(A)80ngのbFGFをペレット。 VL = 0.9ミリメートル。 (B)同じ眼を示す細隙灯レチクルは、クロック時間を測定するために回転される。 CH = 3.25。計算された血管領域= 1.84ミリメートル2。これらの画像は、デジタルレチクル回路図の追加を可能にするために強化されています。 大きな画像を見るにはここをクリックしてください。
- 平方ミリメートルで、下記の式を用いて血管領域(VA)を計算し、楕円形の面積に基づいている(注、それはグレーディングときこれを覚えておくと便利です。)エクスプレスVA。次のように式は次のとおりです。
Vessel全長xクロック時のx 0.2π=血管面積
結果
通常の低血管新生C57BL / 6JマウスにおけるbFGFおよびVEGFペレットのための典型的な結果は、それぞれ、 図2A及びBに示されている。 図2Eは、これらの成長の変化用量のC57BL / 6J株における血管面積(VA)の正規分布を示して要因。 1.8〜2.4ミリメートル2の範囲内の値が許容されるものの80 ngのbFGFをペレットは、通常、約2.0ミリメートル2のVAにな...
ディスカッション
成功した角膜アッセイを行うにはいくつかの重要なステップがあります。最初は、移植することが可能な均一なペレットを製造し、血管を刺激している。ペレット製剤の最も重要な部分は、1)無担体増殖因子を使用している。 2)エッペンドルフチューブからのペレットがキャストされたメッシュに迅速にしかし慎重に最終混合物を移動する)スクラルファートとハイドロンと3で、成長...
開示事項
著者らは、開示することは何もない。
謝辞
私たちは、グラフィックの仕事のためにクリスティン·ジョンソンに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Section 1: Pellet preparation | |||
| Sucralfate | Sigma | #S0652 | |
| Hydron (aka Poly(2-Hema)) | Sigma | #P3932-10G | |
| Ethanol | Pharmco Products Inc | #111000200CSGL | |
| Growth factors: | Must be carrier-free (no bovine serum albumin(BSA)) | ||
| Fibroblast growth factor (FGF) | PeproTech | #AF-100-18B | |
| Vascular endothelial growth factor (VEGF) | R & D Systems | #293-VE-050/CF | |
| 35 mm dish | Becton-Dickson | #353001 | Used for storage of pellets |
| 10 cm petri dish | VWR | #25384-342 | Used as work surface for preparing pellets |
| Mesh | Sefar America | #03--300/51 | 300 um nitex nylon, cut into cm square pieces and sterilzed in autoclave |
| Spatulas | Fisher Scientific | #21-401-10 | Use tapered end of one to break up pellet mixture. Bend tapered end of other to help remove mixture from microcentrifuge tube. |
| Microcentrifuge tubes | Fisher Scientific | #05-408-146 | One for hydron, one for sucralfate |
| Jewelers forceps, #5 | Ambler Surgical | #2315E | Need 2 for pulling mesh apart |
| Centrifugal evaporator | ThermoSavant | DNA110 SpeedVac | |
| Section 2: Surgical implantation of pellets | |||
| Operating microscope | Zeiss | ||
| 2.5% Avertin | General anesthetic | ||
| Proparacaine hydrochloride ophthalmic solution 0.5% | Falcon | NDC# 6131401601 | Eye anesthetic |
| Triple Antibiotic Ophthalmic Ointment | Bausch & Lomb | NDC# 2420878055 | Contains neomycin, polymixin and bacitracin |
| Ophthalmic microknife, 5 mm | Surgistar | #924501 | 30 degree angle |
| von Graef knife | Ambler Surgical | #3401E | |
| Jewelers forceps, #1 | Ambler Surgical | #2301E | Must be blunted with sharpening stone for proptosing eye |
| Jewelers forceps, #5 | Ambler Surgical | #2305E | For picking up pellets and placing on eye |
| Small curved scissors | Ambler Surgical | #5636E | For trimming whiskers |
| Gauze | For blotting eye after proparacaine | ||
| Section 3: Grading of Corneal Neovascularization | |||
| 2.5% Avertin | General anesthetic | ||
| Slit lamp | Nikon | FS-2 | Needs an ocular with a reticule to assist in measuring |
参考文献
- Gospodarowicz, D., Moran, J., Braun, D., Birdwell, C. Clonal growth of bovine vascular endothelial cells: fibroblast growth factor as a survival agent. Proc. Natl. Acad. Sci. USA. 73, 4120-4124 (1976).
- Glaser, B. M., D'Amore, P. A., Seppa, H., Seppa, S., Schiffmann, E. Adult tissues contain chemoattractants for vascular endothelial cells. Nature. 288, 483-484 (1980).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures. J. Cell Biol. 107, 1589-1598 (1988).
- Montesano, R., Orci, L. Tumor-promoting phorbol esters induce angiogenesis in vitro. Cell. 42, 469-477 (1985).
- Korff, T., Augustin, H. G. Integration of endothelial cells in multicellular spheroids prevents apoptosis and induces differentiation. J. Cell Biol. 143, 1341-1352 (1998).
- Nicosia, R. F., Tchao, R., Leighton, J. Histotypic angiogenesis in vitro: light microscopic, ultrastructural, and radioautographic studies. In Vitro. 18, 538-549 (1982).
- Wong, K. H., Chan, J. M., Kamm, R. D., Tien, J. Microfluidic models of vascular functions. Annu Rev Biomed Eng. 14, 205-230 (2012).
- Sandison, J. C. A new method for the microscopic study of living growing tissues by the introduction of a transparent chamber in the rabbit's ear. Anat. Rec. 28, 281-287 (1924).
- Jain, R. K., Schlenger, K., Hockel, M., Yuan, F. Quantitative angiogenesis assays: progress and problems. Nat. Med. 3, 1203-1208 (1997).
- Rogers, M. S., Birsner, A. E., D'Amato, R. J. The mouse cornea micropocket angiogenesis assay. Nat. Protoc. 2 (10), 2545-2550 (2007).
- Gimbrone, M. A., Leapman, S. B., Cotran, R. S., Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261-276 (1972).
- Gimbrone, M. A., Cotran, R. S., Leapman, S. B., Folkman, J. Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst. 52, 413-427 (1974).
- Rohan, R. M., Fernandez, A., Udagawa, T., Yuan, J., D'Amato, R. J. Genetic heterogeneity of angiogenesis in mice. FASEB J. 14 (7), 871-876 (2000).
- Chang, L. K., et al. Dose-dependent response of FGF-2 for lymphangiogenesis. Proc Natl Acad Sci U S A. 101 (32), 11658-11663 (2004).
- Udagawa, T., Birsner, A. E., Wood, M., D'Amato, R. J. Chronic suppression of angiogenesis following radiation exposure is independent of hematopoietic reconstitution. Cancer Res. 67 (5), 2040-2045 (2007).
- Turner, P. V., Albassam, M. A. Susceptibility of rats to corneal lesions after injectable anesthesia. Med Comp. 55 (2), 175-182 (2005).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Exp. Eye Res. 42, 331-337 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved