Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Роговицы Micropocket Анализ: Модель ангиогенеза в Mouse глаз
В этой статье
Резюме
Протокол описывает роговицы micropocket определение, как разработанный на мышах.
Аннотация
Мышь роговицы micropocket анализ является надежным и количественный анализ в естественных условиях для оценки ангиогенеза. С помощью стандартных медленным высвобождением гранулы, содержащие специфические факторы роста, которые вызывают рост кровеносных сосудов в течение всего естественно, лишенной сосудов роговицы, ангиогенез может быть измерено и количественно. В этом анализе ангиогенный ответ генерируется в течение нескольких дней, в зависимости от типа и дозы фактора роста используется. Индукция неоваскуляризации обычно вызваны либо основного фактора роста фибробластов (bFGF) или фактора роста эндотелия сосудов (VEGF). Комбинируя эти факторы роста с сукральфат и Hydron (поли-НЕМА (поли (2-гидроксиэтил метакрилат))) и отливки смеси в гранулы, они могут быть хирургически имплантированы в глаз мыши. Эти единые гранулы медленно-релиз факторы роста в течение пяти или шести дней (bFGF или VEGF соответственно) позволяет достаточно ангиогенную реакцию, необходимую для области судно дuantification помощью щелевой лампы. Этот анализ может быть использован для различных применений, в том числе оценки ангиогенных модулятора лекарств или лечения, а также сравнения разных генетических фонов, влияющих на ангиогенез. Квалифицированный следователь после практики этого анализа можно имплантировать гранул менее чем 5 мин на глаза.
Введение
Процесс ангиогенеза, образование новых кровеносных сосудов образуют уже существующие те, в высшей степени сложным и регулируется с помощью нескольких эндогенных факторов, которые контролируют различные этапы прорастания сосудов и морфогенеза. Ангиогенез срабатывает за счет смещения в балансе между про-и анти-ангиогенеза факторов, баланса, что обычно ведет сосудистую в состоянии покоя. Ангиогенез у взрослых происходит в определенных физиологических условиях, таких как в женской яичников цикла или в репаративных процессов, таких как заживление ран и регенерации тканей. Тем не менее, это также отличительным признаком нескольких патологий в том числе злокачественных опухолей, аутоиммунных состояний и воспалительных заболеваний. Участие ангиогенеза в этих физиологических и патологических условиях делает его важным объектом для исследований и привлекательной мишенью для терапии.
В связи со сложностью ангиогенеза и привлечением нескольких сезаполняет и факторы в процессе, в том числе эндотелиальных клеток, перицитами, циркулирующих клеток и стромальных клеток, в пробирке модели остаются ограниченными и не могут резюмировать уникальную микросреду в естественных условиях. Основной в анализах пробирке ангиогенеза в значительной степени сосредоточены на наблюдении прямое воздействие на эндотелиальные клетки и измерение определенные шаги в процессе ангиогенеза в контролируемых условиях. Эти анализы включают количественную оценку пролиферации эндотелиальных клеток 1, миграции 2, формирование сети 3, формирование трубки 4 и прорастания от сфероидов 5. Экс естественных моделей, в отличие от тех в пробирке, являются более сложными и включать различные типы ткани клеток, примером чему кольца аорты анализ 6. Тем не менее, как и в других системах, он не может захватывать вклад циркулирующих клеток и естественную стромы эндотелиальных клеток, как существует в естественных условиях. Попыткиизучать ангиогенез в потоке, чтобы имитировать настройку в естественных условиях выполняются с помощью микрофлюидных системы 7, однако даже эти анализы, хотя значительно улучшилось, по-прежнему не в состоянии учесть все отсеки, существующих в естественных условиях.
В связи с ограничениями в пробирке и бывших естественных условиях моделей ангиогенеза, в естественных условиях модели остаются более надежные варианты для ангиогенеза исследований. Примерами таких моделей включают имплантацию прозрачных камер, "Windows", которые позволяют визуализировать растущих кровеносных сосудов под микроскопом 8, инъекционные подкожные имплантаты, такие как Матригель и сосудов образования в нормальных тканях, таких как уха мыши и курицы хориоаллантоисной мембране (CAM ). Тем не менее, одним из наиболее приемлемых и количественных моделей ангиогенеза в естественных условиях является роговицы micropocket неоваскуляризация анализ, описанный здесь, в которой использована, естественно, аваскулярныйРоговица как «экран», чтобы отследить и проанализировать новый ангиогенную рост 9.
Здесь мы опишем роговицы micropocket анализа, разработанные на мышах. Изначально модель была использована для измерения неспецифические ангиогенные стимулы в кролика роговицы. Это было сделано путем введения опухолевых части в водянистой влаги из передней камеры глаза кролика и измеряется индуцированного опухолью неоваскуляризацию 11.
Тем не менее, анализ был впоследствии превратилась для изучения последствий конкретного факторов роста 10 для лучшего определения и стандартизации ангиогенную эффект. Для того, чтобы освободить фактор роста в глаза, с медленным высвобождением гранулы, содержащие известные количества ангиогенных факторов роста были использованы вместо тканей. Наличие очищенных рекомбинантных ангиогенными белков, таких как bFGF или VEGF включен их использование в качестве конкретных задач ангиогенеза modulaters 12. Первоначально анализа былашироко используется в кроликов, которые легче работать с в силу своего размера, но позже модель была переведена на мышах; меньше и менее дорогой модели на животных. Переход от кролика мышам условии важное преимущество, которое позволяет использовать генетически манипулировать животных, создавая тем самым новую область исследований в генетических компонентов, влияющих ангиогенез 13. В дополнение к более приемлемым использование роговицы анализа в изучении ангиогенеза, другие биологические процессы также могут быть исследованы с использованием модифицированных анализов. Например, исследования лимфангиогенеза стали возможными благодаря имплантации гранулы с низким доза bFGF, которые позволили визуализацию лимфатических сосудов с помощью специальных молекулярных маркеров 14. Кроме того, это исследование служит средством для оценки воздействия радиации на ангиогенез 15.
В суммирования, роговицы micropocket ангиогенез анализ является количественная, представительroducible, гибкая оценка ангиогенеза в естественных условиях. Основным преимуществом этого анализа является то, что измерение фона сосудов является необходимым, так как сосуды растут на, естественно, лишенной сосудов ткани. Мы описываем здесь протокол этом анализе в деталях и обсудить различные сценарии, которые могут возникнуть. Анализ состоит из 3 отдельных сегментов. Здесь мы опишем приготовление фактор роста включено гранул, последующее хирургическую имплантацию и, наконец, метод, используемый для количественного определения результате неоваскулярную рост.
протокол
Все протоколы с участием животных представлены и одобрены Комитетом по уходу и использованию Институциональная животных, по крайней Детской больнице Бостона и проводятся в соответствии с рекомендациями ассоциации по оценке и аккредитации лабораторных животных (AAALAC). Обязательно используйте стерильную приборов и асептический techniqure при выполнении процедуры.
1 Получение гранул
- Взвесить 10 мг сукральфат и 60 мг Hydron с отогнутым стерильной шпателем. Поместите в отдельных микропробирок.
- Поместите 1 см квадратный кусок сетки в стерильный 10 см блюдо. INVERT так сетка лежит на мелкой крышкой. Отложите.
- Добавить 500 мкл этанола в Hydron и вихря в течение по крайней мере 10 мин.
- Добавить соответствующее количество фактора роста (стандарт: 20 мкг bFGF в течение 50 мкг для VEGF) в сукральфат и вихря кратко. Фактор роста Хранить в-80 ° C морозильник при концентрации 1 мг / мл. Объемы жидких добавленные должны быть не менее 20 мкл для обеспечения сукралфат полностью смоченной но не должна превышать 50 мкл. Большой объем составляет испарение жидкости на следующем этапе трудно.
- Поместите сукралфат смесь в центробежной испаритель, установленный на низкой, пока смесь полностью не высохнет, обычно 30-50 мин в зависимости от объема жидкости, используемой.
- Проверьте смесь для остаточной влажности с коническим концом стерильного шпателя. Смесь должна чувствовать себя "хрустящие".
- Используйте конический конец лопаточки, чтобы разбить сукралфат смесь внутри трубки.
- Добавить 10 мкл Hydron к сукральфат.
- Благодаря вязкой природы Hydron, обрежьте от пипетки наконечник 200 мкл, а затем рисовать и освободить 10 мкл до пипетки вверх снова и добавив к сукральфата.
- Быстро использовать согнутую плюнулула смешать Hydron и сукральфат и удалить из трубы.
- Собирают смесь вдоль нижней стороне наконечника изогнутой шпателем и затем вращать трубки во время рисования шпателем вдоль стенки трубы. Смесь быстро высушить так что этот шаг необходимо сделать эффективно.
- Распределите смесь на подготовленную сетку с помощью щипцов, чтобы держать это в месте. Смесь должна быть равномерным слоем и заполнить в отверстия сетки.
- Погрузите изогнутый шпатель в пробирку, содержащую Hydron и использовать его пальто обе стороны сетки.
- Поместите покрытием сетки, опираясь на стороне против краю тарелки и позволяют сушки при комнатной температуре в течение 30-45 мин.
- Поместите сетку в -20 ° C морозильник или немедленно приступить к следующему шагу. Держите сетку внутри блюдо.
- Поместите 35 мм чашку внутри большую чашку Петри, крышку. Используйте пару щипцов осторожно вытяните волокна сетки помимо над 35 мм блюдо. Бродячие гранулы ссобираться из большего блюдо в конце.
- Проверьте гранулы для единообразия в области. Процесс производится около 250 гранул, таким образом, стандартную дозу на гранулу для bFGF и VEGF составляет 80 нг и 200 нг, соответственно.
- Храните гранулы в 35 мм блюдо в -20 ° C морозильник на срок до 3 месяцев.
2 Хирургическая имплантация пеллет
- Настройка хирургическое площадь под операционным микроскопом.
- Обезболить мышь авертином (400-500 мг / кг, внутрибрюшинно) и поместите курсор мыши под микроскопом так глаз видна. Выполните ног щепотку, чтобы обеспечить достаточный уровень анестезии.
- Обезболить глаз мыши, поместив 1 каплю пропаракаина решения на вершине глазного яблока. Подождите 20-30 сек и промокните марлевым тампоном.
- Proptose глаз мыши с заглушается # 1 ювелиров щипцы будучи уверенным, чтобы оставить кожу между щипцами и глаза. Важно, чтобы судить давление, приложенное правильно.60; Держа глаза слишком сильно будет приводить к его красной и раздраженной, а слишком свободно овладеть позволит глаз двигаться во время операции.
- Используйте 30 ° microknife надрезать в роговицу около 1 мм от лимба. Разрез должен быть 1-2 мм в длину. Разрез должен быть достаточно глубоким, чтобы проникнуть за эпителиального слоя в midstroma но не настолько глубоко, чтобы разорвать глаз.
- Используйте нож фон GRAEF сделать карман перпендикулярно разреза.
- Наденьте нож под рогового слоя в месте разреза и осторожно работать нож в и переместить его вдоль разреза, чтобы увеличить пространство, образуя карман. Это помогает перемещать мышь, а чтобы иметь возможность работать с кривизной глаза. Будьте осторожны, чтобы не нажать вниз кончиком, чтобы избежать разрыва глаз.
- Намочите щипцов в # 5 ювелирные с пропаракаина и выбрать шарик до из тарелки. Поместите шарик на глаз.
- Смочите нож фон GRAEF с пропаракаина и передать часть жидкости на гранулы, чтобы сделать его эластичным и податливым. Удалите излишки влаги с марлевым тампоном или ватным тампоном.
- Вставьте пулю в кармане, используя нож фон GRAEF чтобы задвинуть внутрь под роговицы слоя. После того, как весь осадок внутри, запустить ее плоской стороной фон Граеф ножом над сайта, чтобы проверить, что осадок является безопасным.
- Пальто глаз с тройным мазь с антибиотиком.
- Переверните мышь и повторить операцию в обратном глаза.
3 Количественное роговицы неоваскуляризации.
Оставьте животных развивать сосуды в течение установленного периода времени. День классификации судна зависит от фактора роста используемого. Оценка bFGF на 5 день и слабого VEGF на 6 день День имплантации день 0.
- Обезболить мышь авертином (400-500 мг / кг, внутрибрюшинно).
- Используйте щелевой лампы микроскоп для градинь. Один глазной имеет ридикюль, линий внутри окуляра, используемого в качестве измерительного помощи количественно длину судна и расстояние вокруг окружности глаза, что эти суда проросли.
- Держите мышь перед рамки, позиционирование мыши так глаз видел в окуляр с таблеткой прямо вперед. Стабилизировать голову между большим и указательным пальцами так кожа подтягивается на лице и глаза слегка proptosed.
- Поместите по оси Y. ридикюль вдоль лимба судна непосредственно под осадку. Измерьте длину сосудов ветвящихся вверх к гранул. Запишите это измерение в десятых долях миллиметра и назначить длина судна (VL) (Рисунок 1А).
- Включите мышь или ридикюль так, чтобы расстояние вокруг глаз, что эти суда проросли становится ясно. Легче всего думать глаза как циферблат с интервалом в 1 через 12 назначенным это число часы часовой (CH) (рис 1Б). Это может быть целый ряд или доли 0,25 (например, 2, 2,25, 2,5 или 2,75). Примечание: CH является субъективным. Например, некоторые из них могут измерять расстояние вокруг глаз, чтобы включать в себя все сосуды проросшие от лимба в то время как другие могут остановить измерение в точке, где длина судна составляет половину максимальной. Важным фактором должна быть последовательной с тем, как каждый хочет класса.
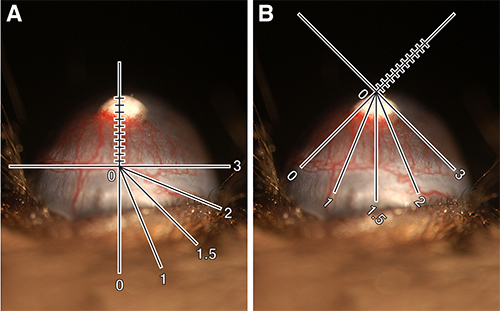
Рисунок 1 Количественная оценка роговицы неоваскуляризации. (А) 80 нг bFGF осадок имплантированы в C57BL / 6J мыши показывая щелевой лампы ридикюль ориентированный для измерения длины судна. В.Л. = 0,9 мм. (B) То же, глаза, показаны щелевой лампы ридикюль поворачивается измерить тактовую час. CH = 3.25. Рассчитано площадь судно = 1.84 мм 2. Эти изображения были цифровой обработке для обеспечения добавлением ридикюль схеме. Кликните здесь, чтобы посмотреть увеличенное изображение.
- Вычислить площадь сосудов (VA), используя формулу, приведенную ниже, который основан на площади овала (Примечание, полезно иметь это в виду, оценивая.) Экспресс VA в миллиметрах в квадрате. Формула выглядит следующим образом:
Судно длина х часов час х 0,2 π = площадь судно
Результаты
Типичные результаты для bFGF и VEGF гранул в нормальных низких ангиогенными C57BL / 6J показаны на рисунке 2А и В, соответственно. Фиг.2Е показывает нормальное распределение площади сосуда (VA) в / 6J штамма C57BL с различными дозами этих роста факторы. 80 нг bFGF гранулы обычн?...
Обсуждение
Есть несколько важных шагов в выполнении успешную роговицы анализа. Первый заключается в создании единых гранулы, способные быть имплантированы и стимулирования сосуды. Наиболее важные части подготовки гранул являются 1) с помощью носителя без фактора роста; 2) обеспечение хорошую сме...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Мы благодарим Кристин Джонсон для графических работ.
Материалы
| Name | Company | Catalog Number | Comments |
| Section 1: Pellet preparation | |||
| Sucralfate | Sigma | #S0652 | |
| Hydron (aka Poly(2-Hema)) | Sigma | #P3932-10G | |
| Ethanol | Pharmco Products Inc | #111000200CSGL | |
| Growth factors: | Must be carrier-free (no bovine serum albumin(BSA)) | ||
| Fibroblast growth factor (FGF) | PeproTech | #AF-100-18B | |
| Vascular endothelial growth factor (VEGF) | R & D Systems | #293-VE-050/CF | |
| 35 mm dish | Becton-Dickson | #353001 | Used for storage of pellets |
| 10 cm petri dish | VWR | #25384-342 | Used as work surface for preparing pellets |
| Mesh | Sefar America | #03--300/51 | 300 um nitex nylon, cut into cm square pieces and sterilzed in autoclave |
| Spatulas | Fisher Scientific | #21-401-10 | Use tapered end of one to break up pellet mixture. Bend tapered end of other to help remove mixture from microcentrifuge tube. |
| Microcentrifuge tubes | Fisher Scientific | #05-408-146 | One for hydron, one for sucralfate |
| Jewelers forceps, #5 | Ambler Surgical | #2315E | Need 2 for pulling mesh apart |
| Centrifugal evaporator | ThermoSavant | DNA110 SpeedVac | |
| Section 2: Surgical implantation of pellets | |||
| Operating microscope | Zeiss | ||
| 2.5% Avertin | General anesthetic | ||
| Proparacaine hydrochloride ophthalmic solution 0.5% | Falcon | NDC# 6131401601 | Eye anesthetic |
| Triple Antibiotic Ophthalmic Ointment | Bausch & Lomb | NDC# 2420878055 | Contains neomycin, polymixin and bacitracin |
| Ophthalmic microknife, 5 mm | Surgistar | #924501 | 30 degree angle |
| von Graef knife | Ambler Surgical | #3401E | |
| Jewelers forceps, #1 | Ambler Surgical | #2301E | Must be blunted with sharpening stone for proptosing eye |
| Jewelers forceps, #5 | Ambler Surgical | #2305E | For picking up pellets and placing on eye |
| Small curved scissors | Ambler Surgical | #5636E | For trimming whiskers |
| Gauze | For blotting eye after proparacaine | ||
| Section 3: Grading of Corneal Neovascularization | |||
| 2.5% Avertin | General anesthetic | ||
| Slit lamp | Nikon | FS-2 | Needs an ocular with a reticule to assist in measuring |
Ссылки
- Gospodarowicz, D., Moran, J., Braun, D., Birdwell, C. Clonal growth of bovine vascular endothelial cells: fibroblast growth factor as a survival agent. Proc. Natl. Acad. Sci. USA. 73, 4120-4124 (1976).
- Glaser, B. M., D'Amore, P. A., Seppa, H., Seppa, S., Schiffmann, E. Adult tissues contain chemoattractants for vascular endothelial cells. Nature. 288, 483-484 (1980).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures. J. Cell Biol. 107, 1589-1598 (1988).
- Montesano, R., Orci, L. Tumor-promoting phorbol esters induce angiogenesis in vitro. Cell. 42, 469-477 (1985).
- Korff, T., Augustin, H. G. Integration of endothelial cells in multicellular spheroids prevents apoptosis and induces differentiation. J. Cell Biol. 143, 1341-1352 (1998).
- Nicosia, R. F., Tchao, R., Leighton, J. Histotypic angiogenesis in vitro: light microscopic, ultrastructural, and radioautographic studies. In Vitro. 18, 538-549 (1982).
- Wong, K. H., Chan, J. M., Kamm, R. D., Tien, J. Microfluidic models of vascular functions. Annu Rev Biomed Eng. 14, 205-230 (2012).
- Sandison, J. C. A new method for the microscopic study of living growing tissues by the introduction of a transparent chamber in the rabbit's ear. Anat. Rec. 28, 281-287 (1924).
- Jain, R. K., Schlenger, K., Hockel, M., Yuan, F. Quantitative angiogenesis assays: progress and problems. Nat. Med. 3, 1203-1208 (1997).
- Rogers, M. S., Birsner, A. E., D'Amato, R. J. The mouse cornea micropocket angiogenesis assay. Nat. Protoc. 2 (10), 2545-2550 (2007).
- Gimbrone, M. A., Leapman, S. B., Cotran, R. S., Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261-276 (1972).
- Gimbrone, M. A., Cotran, R. S., Leapman, S. B., Folkman, J. Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst. 52, 413-427 (1974).
- Rohan, R. M., Fernandez, A., Udagawa, T., Yuan, J., D'Amato, R. J. Genetic heterogeneity of angiogenesis in mice. FASEB J. 14 (7), 871-876 (2000).
- Chang, L. K., et al. Dose-dependent response of FGF-2 for lymphangiogenesis. Proc Natl Acad Sci U S A. 101 (32), 11658-11663 (2004).
- Udagawa, T., Birsner, A. E., Wood, M., D'Amato, R. J. Chronic suppression of angiogenesis following radiation exposure is independent of hematopoietic reconstitution. Cancer Res. 67 (5), 2040-2045 (2007).
- Turner, P. V., Albassam, M. A. Susceptibility of rats to corneal lesions after injectable anesthesia. Med Comp. 55 (2), 175-182 (2005).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Exp. Eye Res. 42, 331-337 (1986).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены