Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kornea mikrocep Testi: Fare Eye Angiogenezis Bir Model
Bu Makalede
Özet
Protokol farelerde geliştirilen komea mikro-tahlili tarif eder.
Özet
Fare korneal mikrocep denemesi angiogenesisi değerlendirilmesi için sağlam ve kantitatif in vivo deneydir. Doğal olarak kornea avasküler boyunca kan damarı büyümesi tetiklemek belirli büyüme faktörlerini içeren standart yavaş salimli peletleri kullanarak, anjiyojenez ölçülebilir ve hesaplanabilir. Bu deneyde, bir anjiyojenik tepki kullanılan büyüme faktörü türüne ve miktarına bağlı olarak, birkaç gün boyunca oluşturulur. Neovaskularizasyon indüksiyonu ya da genel olarak temel fıbroblast büyüme faktörü (bFGF) veya vaskular endotelyal büyüme faktörü (VEGF) tarafından tetiklenir. Sukralfat ve Hydron (poli-HEMA (poli (2-hidroksietil metakrilat))) ve peletler halinde karışımın döküm bu büyüme faktörleri birleştirerek, bu cerrahi fare gözüne implante edilebilir. Bu üniforma topaklar damar alanı q için gerekli yeterli anjiyojenik yanıt sağlayan (sırasıyla bFGF veya VEGF) beş veya altı gün boyunca büyüme faktörleri, yavaş serbest bırakınyarıklı bir lamba kullanılarak uantification. Bu deney, anjiyojenik modülatörü ilaç ya da tedavi yanı sıra, anjiyojenezi etkilemeye, farklı genetik geçmişlerde arasında karşılaştırma değerlendirme dahil olmak üzere çeşitli uygulamalar için kullanılabilir. Bu testte uyguladıktan sonra bir uzman araştırmacı göz başına en az 5 dakika bir pelet naklediyorlar.
Giriş
Anjiyogenez süreci, yeni kan damarlarının oluşumu olan önceden varolan de kurulabilir, oldukça karmaşıktır ve damar filizlenme ve morfojenezinin farklı aşamaları kontrol eden endojen faktörler ile düzenlenir. Anjiyogenesis nedeniyle yanlısı ve anti-anjiyogenik faktörler arasındaki dengenin bir vardiya, normalde hareketsiz bir durumda damarsal koruyan bir denge için tetiklenir. Yetişkinlerde Anjiyogenez, kadın yumurtalık döngüsü sırasında veya yara iyileşmesi ve doku rejenerasyonu gibi tamir yöntemleriyle bazı fizyolojik koşullar altında meydana gelir. Ancak, aynı zamanda maligniteler, otoimmün hastalık ve enflamatuar hastalıklar da dahil olmak üzere birkaç patolojiden bir özelliğidir. Bu fizyolojik ve patolojik durumlarda angiogenesisin katılımı araştırma ve terapisi için çekici bir hedef yapan önemli bir konudur.
Nedeniyle anjiyogenez karmaşıklığı ve çeşitli ce tutulumunamodelleri sınırlı kalması ve eşsiz bir mikro-ortam, in vivo özetlemek olamaz in vitro endotel hücreleri, perisitler, destek hücreler ve stromal dolaşımdaki hücreleri de dahil olmak üzere bu süreçte ve LLS etkenler. Angiogenesis in vitro tahlilleri ana ölçüde endotel hücreleri üzerinde doğrudan etkilerinin gözlenmesi ve kontrollü koşullar altında anjiyojenik işleminde bazı adımlar ölçme üzerine odaklanmıştır. Bu deneyler 1, endotel hücre çoğalmasının, göç 2, 3 ağı oluşumu, tüp oluşumu 4 ölçülmesini ve parçacıklarının 5 çimlenme bulunmaktadır. Ex vivo modelleri, in vitro olanlardan farklı olarak, daha karmaşık ve çoğul doku hücre tipleri dahil, bir örnek olmak aort halkası deney 6. In vivo var Yine de, diğer sistemler gibi, dolaşımdaki hücrelerin katkısını ve endotel hücrelerinin doğal dokudan yakalayamazsınız. Girişimleriçok gelişmiş olmasına rağmen, mikroakışkan sistemleri 7 kullanılarak yapılmaktadır in vivo ayarı, ancak hatta bu deneyleri taklit akış altında anjiogenezisi çalışma, halen in vivo mevcut tüm bölmelere için açıklayamazlar.
Nedeniyle, in vitro ve ex vivo anjiyogenez modellerinin sınırlamalara in vivo modeller anjiyogenez çalışmaları için daha güvenilir seçimler kalır. Bu modelleri örnekleri mikroskop 8 altında büyüyen kan damarlarının görselleştirme izin şeffaf odaları, "pencere", implantasyon dahil, örneğin fare kulağı ve tavuk koryoallantoik zarı gibi normal dokularda matrigel ve damar oluşumu gibi enjekte cilt altı implantları (CAM ). Bununla birlikte, en kabul edilebilir ve kantitatif in vivo anjiyogenez modellerden biri doğal avasküler kullanan burada tarif edilen korneal mikrocep neovaskularizasyon tahlili, birBir "ekran" olarak kornea görselleştirmek ve yeni anjiyojenik büyüme 9 değerlendirmek için.
Farelerde geliştirilen Burada komea mikro-tahlili tarif eder. İlk model tavşan kornealarından spesifik olmayan anjiyojenik uyaranlara ölçmek için kullanılmıştır. Bu, tavşan gözün ön odasının sulu cismi; tümör parçaları sokulması ile yapılabilir ve tümörle tetiklenmiş neovaskülarizasyon 11 ölçülmüştür.
Ancak, deney sonra daha iyi belirlemek ve anjiyojenik etkisini standardize spesifik büyüme etkilerini incelemek için 10 faktörleri gelişti. Gözdeki büyüme faktörü serbest bırakmak amacıyla, anjiogenik büyüme faktörleri, bilinen miktarlarda ihtiva eden yavaş salımlı peletler yerine dokuların kullanılmıştır. Örneğin bFGF ve VEGF gibi saflaştırılmış rekombinant anjiyojenik proteinlerin mevcudiyeti anjiyojenez module 12 belirli hedeflere olarak kullanımı gerekmektedir. Başlangıçta, tahlilidirbüyük ölçüde onların büyüklüğü nedeniyle ancak daha sonra model fareler çevrilmiş ile çalışmak daha kolay tavşanlarda, kullanılan; Bir daha küçük ve daha az pahalı hayvan modeli. Farelere tavşan kayıyor böylece anjio 13 etkileyen genetik bileşenleri içine yeni bir araştırma alanı oluşturarak, genetik manipüle hayvanları kullanmak için güçlü olmak önemli bir avantaj sağladı. Anjiyojenez okuyan kornea deneyinin daha kabul edilebilir kullanımına ek olarak, diğer biyolojik prosesler için de değiştirilebilir deneyler kullanılarak araştırılmaktadır olabilir. Örneğin, lenfanjiyogenezin çalışmalar spesifik moleküler belirteçlerin 14 ile lenfatik damarların görselleştirme izin düşük doz bFGF'dir pelet implantasyonu ile mümkün yapılmıştır. Buna ek olarak, bu tahlili, angiogenesisin 15 radyasyonun etkilerini değerlendirmek için bir araç sağlamaktadır.
Toplamı, korneal mikrocep denemesi anjiyojenez niceliksel, temsilcisi olduğunuroducible, in vivo anjiyogenezin esnek bir değerlendirme. Bu tahlilde önemli bir avantajı, gemilerin, doğal olarak avasküler doku üzerinde büyür, çünkü arka plan kapların ölçüm gereksiz olmasıdır. Burada ayrıntılı olarak, bu testin protokolü tarif oluşabilir ve farklı senaryolar tartışır. Deney, 3 'farklı parçadan oluşur. Burada elde edilen nörovasküler büyüme ölçmek için kullanılan bir gelişme faktörü dahil topakların hazırlanmasını izleyen cerrahi implantasyon metodu ve son olarak anlatacağız.
Protokol
Hayvanları ile ilgili tüm protokoller sunulan ve onaylanan Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından Boston Çocuk Hastanesi de ve Laboratuvar Hayvanları Bakımı Değerlendirme ve Akreditasyon Derneği (AAALAC) tavsiyelerine uygun olarak yürütülmektedir edilir. Prosedürü gerçekleştirirken, steril aletleri ve aseptik techniqure kullandığınızdan emin olun.
Topakların hazırlanması 1.
- Sukralfat, 10 mg ve steril bir spatula ile bükülmemiş Hydron, 60 mg tartılır. Ayrı mikrosantrifüj tüpler yerleştirin.
- Steril bir 10 cm'lik bir tabak içine örgü bir 1 cm kare parça yerleştirin. Çok sığ kapağındaki artıklarını örgü ters. Kenara koyun.
- En az 10 dakika boyunca Hydron ve vorteks etanol 500 ul ilave edin.
- Kısaca, sukralfat ve vorteks: büyüme faktörü (bFGF için 20 ug, 50 ug, VEGF için standart) uygun miktarda ekleyin. Bir saklayın büyüme faktörü1 mg / ml bir konsantrasyonda, -80 ° C dondurucu. Eklenen sıvı hacmi tam olarak nemlendirilir sukralfat sağlamak için 20 ul bir en az 50 olmalıdır, ancak ul geçmemelidir. Daha büyük bir hacim, bir sonraki aşamada sıvının buharlaşma zorlaştırır.
- Karışım tamamen kuruyana kadar kullanılan sıvı hacmine bağlı olarak, normalde 30-50 dakika, düşük ayarlı santrifüj evaporatör içine sükralfat karışımı yerleştirin.
- Steril bir spatula ucu ile konik bakiye nem için karışımın edin. Karışım "gevrek" hissetmeniz gerekir.
- Tüp içindeki sükralfat karışımı parçalamak için bir spatula konik ucu kullanın.
- Sukralfata Hydron 10 ul.
- Nedeniyle Hydron viskoz olması nedeniyle, 200 ul, pipet ucu ucu kesin ve çekip tekrar pipetleme sukralfata eklemeden önce 10 ul bırakın.
- Çabuk bükülmüş tükürdü kullanınula Hydron ve sakralfatın karıştırın ve tüp kaldırmak.
- Bükülmüş spatula ucu alt tarafı boyunca karışımın toplanması ve tüpün duvarı boyunca spatula dışarı çekilmesi, sonra, tüp döndürün. Bu adımı verimli yapılmalıdır böylece karışım hızlı bir şekilde kurur.
- Yerinde tutmak için forseps kullanarak hazırlanan örgü üzerine karışımı sürün. Karışım, düz bir katman olabilir ve örgü deliklere doldurmalıdır.
- Tüp içeren Hydron içine bükülmüş spatula daldırın ve mesh o kaplamaz her iki tarafını kullanın.
- Çanak tarafındaki kenarına doğru eğilerek kaplanmış örgü yerleştirilir ve 30-45 dakika boyunca oda sıcaklığında kurumaya bırakılır.
- -20 ° C derin dondurucuda örgü yerleştirin veya bir sonraki adıma hemen devam. Çanak içinde örgü tutun.
- Daha büyük bir petri, kapak kapalı içinde 35 mm tabak yerleştirin. Dikkatli dışında 35 mm çanak üzerinde mesh lifleri çekmek için forseps çifti kullanın. Kaçak topakları cbir ucunda daha büyük bir çanak toplanabilir.
- Kapsamında düzgünlüğü için pelet edin. Böylece yöntem, bFGF için pelet başına standart bir doz yaklaşık 250 pelet elde edilir ve VEGF, sırasıyla 80 ng ve 200 ng vardır.
- En fazla 3 ay boyunca -20 ° C dondurucu içinde 35 mm çanak saklayın peletler.
PELETİ 2. Cerrahi implantasyonu
- Işletim mikroskop altında ameliyat alanını ayarlayın.
- Avertin (400-500 mg / kg, karın içinden) ile anestezi fare ve benzeri gözünün mikroskop altında fare yerleştirin. Anestezi yeterli düzeyde sağlamak için parmak tutam gerçekleştirin.
- Küresi üstüne proparakain çözeltisi 1 damla yerleştirerek fare göz anestezisi. 20-30 saniye bekleyin ve bir gazlı bezle hafifçe sürün.
- Körleşmiş # ile forseps ve göz arasındaki cildinizi belli olan 1 kuyumcular forseps fare göz Proptose. Bu doğru uygulanan basıncın hüküm önemlidir.60; Çok sıkı bir şekilde göz Holding de göz ameliyatı sırasında hareket sağlayacak bir tutuş gevşek ederken, kırmızı ve tahriş olmasına neden olacaktır.
- Kornea içine limbustan yaklaşık 1 mm bir kesi yapmak için 30 ° microknife kullanın. Kesi uzunluğu 1-2 mm olmalıdır. İnsizyon midstroma epitel tabakasının içine penetre kadar derin ama göz yırtmak için derin olmayan olmalıdır.
- Kesi dik bir cebi yapmak için von Graef bıçak kullanın.
- Kesi yerinde kornea tabakasının altında bıçak kaydırın ve hafifçe bıçak çalışmak ve böylece cebi oluşturan, boşluk büyütmek için kesi boyunca hareket ettirin. Bu gözün kavis çalışmak mümkün de fare taşımak için yardımcı olur. Göz rupturing önlemek için ucu ile aşağı itmek için değil dikkatli olun.
- Proparakain ile # 5 kuyumcuya forseps ıslatın ve yemeğin dışında bir pelet pick up. Göze bir pelet yerleştirin.
- Proparakain ile von Graef bıçağı ıslatın ve lastik ve esnek yapmak için pelet üzerine sıvı bazı aktarın. Gazlı bez ya da pamuklu bir bez ile fazla nemi alınız.
- Kornea tabakası altında içine itmeye von Graef bıçak kullanarak cebine pelet yerleştirin. Pelet içindeki sonra, topak güvenli olduğunu kontrol etmek için site üzerinde von Graef bıçağın düz tarafı çalıştırın.
- Coat üçlü antibiyotik merhem ile göz.
- Üzerinde fareyi ters çevirin ve zıt göz ameliyatı tekrarlayın.
Korneal neovaskularizasyon 3. miktarının belirlenmesi.
Zaman belirli bir süre boyunca gemileri geliştirmek için hayvanları bırakın. Damar derecelendirilmesi gün kullanılan büyüme faktörüne bağlıdır. Sınıf bFGF 6. günde 5 gün ve daha zayıf VEGF implantasyonu günü günde 0'dır.
- Avertin ile fare (400-500 mg / kg, karın içinden) anestezisi.
- Gra için yarık lamba mikroskop kullanımıding. Bir göz damarları filizlenmiş var gözün çevresine damar uzunluğu ve mesafe ölçmek için bir ölçüm aygıtı olarak kullanılan mercek içinde bir el çantası, çizgiler vardır.
- Çok göz doğrudan öncesinde pelet ile göz görülür fare konumlandırma, kapsam önünde fareyi tutun. Cilt yüzünde sıkılır ve göz hafifçe proptosed böylece başparmak ve işaret parmağı arasında başını stabilize.
- Limbal damar boyunca doğrudan pelet altında çantası y-eksenini yerleştirin. Pellet doğru yukarıya damarların dallanma uzunluğunu ölçer. Milimetrenin onda bu ölçümü kaydedin ve damar uzunluğu (VL) (Şekil 1A) belirler.
- Bu gemiler filizlenmiş olduğunu göz çevresinde mesafenin açık olur, böylece fareyi veya retiküle ya çevirin. Bu 12. Belirlediğiniz bu sayı saat saat (CH) (Şekil 1 ile 1 aralıklarla bir saat yüz olarak göze düşünmek en kolayB). Bu bir tam sayı veya 0.25 (örn, 2, 2.25, 2.5 veya 2.75) fraksiyonları olabilir. Not: CH özneldir. Örneğin, bazıları damar uzunluğu yarım maksimal olduğu noktada ölçüm durabilir limbustan filizlenmiş tüm damarlarını içerdiği göz çevresinde mesafeyi ölçmek olabilir. Önemli faktör, bir sınıf seçer nasıl tutarlı olmaktır.
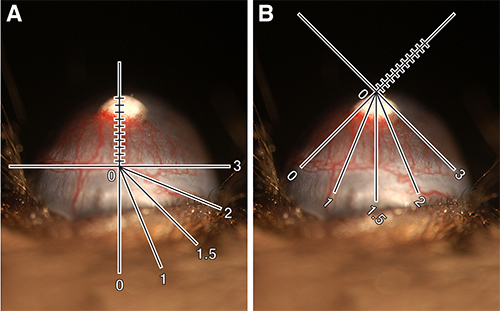
Neovaskularizasyonu Şekil 1. Kantitasyonu. (A) 80 ng bFGF'dir pelet C57BL / 6J fare damar uzunluğunu ölçmek odaklı biomikroskop retiküle gösteren takılmıştı. VL = 0.9 mm. (B) Aynı göz gösteren biomikroskop reticule saat saat ölçmek için döndürülebilir. CH = 3.25. Hesaplanan damar alan = 1.84 mm2. Bu görüntüler dijital çantası şematik eklenmesi için izin vermek için geliştirilmiştir. resmi büyütmek için buraya tıklayın.
- Bir oval alanda dayanmaktadır aşağıdaki formül kullanılarak damar alanını (VA), hesaplayın Express VA kare milimetre (Not, bu notlandırma zaman akılda tutmak için. Yararlı). Aşağıda formülü aşağıdaki gibidir:
Gemi uzunluk x Saat saat x 0,2 π = Gemi alanı
Sonuçlar
Normal düşük anjiyojenik C57BL / 6J fareler bFGF ve VEGF peletler için tipik sonuçlar, Şekil 2A ve B de gösterildiği gibi, sırasıyla. Şekil 2E, bu büyüme değişen dozları ile C57BL / 6J suş içerisinde damar alanının normal dağılımı (VA) görülmektedir faktörler. 1,8-2,4 mm2 aralığında değerler kabul edilebilir olsa da 80 ng bFGF topaklar normal olarak yaklaşık 2.0 mm2 bir VA neden olur. 200 ng VEGF k?...
Tartışmalar
Başarılı bir kornea tahlilini yapmak, bazı kritik adımlar vardır. İlk implante olması ve damarların uyarabiten üniforma peletlerini yapıyor. Pelet hazırlık en önemli parçaları) taşıyıcı-serbest büyüme faktörü kullanılarak 1; 2) peletler döküm örgüye eppendorf tüpüne dikkatli bir şekilde, ancak ikinci hızla hareket eden nihai karışımı), sukralfat ve Hydron ve 3 büyüme faktörü iyi bir karışım sağlamak. O "kukla" topaklar tekniği uygulamak için büyüme faktörü olm...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz grafik çalışması için Kristin Johnson teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Section 1: Pellet preparation | |||
| Sucralfate | Sigma | #S0652 | |
| Hydron (aka Poly(2-Hema)) | Sigma | #P3932-10G | |
| Ethanol | Pharmco Products Inc | #111000200CSGL | |
| Growth factors: | Must be carrier-free (no bovine serum albumin(BSA)) | ||
| Fibroblast growth factor (FGF) | PeproTech | #AF-100-18B | |
| Vascular endothelial growth factor (VEGF) | R & D Systems | #293-VE-050/CF | |
| 35 mm dish | Becton-Dickson | #353001 | Used for storage of pellets |
| 10 cm petri dish | VWR | #25384-342 | Used as work surface for preparing pellets |
| Mesh | Sefar America | #03--300/51 | 300 um nitex nylon, cut into cm square pieces and sterilzed in autoclave |
| Spatulas | Fisher Scientific | #21-401-10 | Use tapered end of one to break up pellet mixture. Bend tapered end of other to help remove mixture from microcentrifuge tube. |
| Microcentrifuge tubes | Fisher Scientific | #05-408-146 | One for hydron, one for sucralfate |
| Jewelers forceps, #5 | Ambler Surgical | #2315E | Need 2 for pulling mesh apart |
| Centrifugal evaporator | ThermoSavant | DNA110 SpeedVac | |
| Section 2: Surgical implantation of pellets | |||
| Operating microscope | Zeiss | ||
| 2.5% Avertin | General anesthetic | ||
| Proparacaine hydrochloride ophthalmic solution 0.5% | Falcon | NDC# 6131401601 | Eye anesthetic |
| Triple Antibiotic Ophthalmic Ointment | Bausch & Lomb | NDC# 2420878055 | Contains neomycin, polymixin and bacitracin |
| Ophthalmic microknife, 5 mm | Surgistar | #924501 | 30 degree angle |
| von Graef knife | Ambler Surgical | #3401E | |
| Jewelers forceps, #1 | Ambler Surgical | #2301E | Must be blunted with sharpening stone for proptosing eye |
| Jewelers forceps, #5 | Ambler Surgical | #2305E | For picking up pellets and placing on eye |
| Small curved scissors | Ambler Surgical | #5636E | For trimming whiskers |
| Gauze | For blotting eye after proparacaine | ||
| Section 3: Grading of Corneal Neovascularization | |||
| 2.5% Avertin | General anesthetic | ||
| Slit lamp | Nikon | FS-2 | Needs an ocular with a reticule to assist in measuring |
Referanslar
- Gospodarowicz, D., Moran, J., Braun, D., Birdwell, C. Clonal growth of bovine vascular endothelial cells: fibroblast growth factor as a survival agent. Proc. Natl. Acad. Sci. USA. 73, 4120-4124 (1976).
- Glaser, B. M., D'Amore, P. A., Seppa, H., Seppa, S., Schiffmann, E. Adult tissues contain chemoattractants for vascular endothelial cells. Nature. 288, 483-484 (1980).
- Kubota, Y., Kleinman, H. K., Martin, G. R., Lawley, T. J. Role of laminin and basement membrane in the morphological differentiation of human endothelial cells into capillary-like structures. J. Cell Biol. 107, 1589-1598 (1988).
- Montesano, R., Orci, L. Tumor-promoting phorbol esters induce angiogenesis in vitro. Cell. 42, 469-477 (1985).
- Korff, T., Augustin, H. G. Integration of endothelial cells in multicellular spheroids prevents apoptosis and induces differentiation. J. Cell Biol. 143, 1341-1352 (1998).
- Nicosia, R. F., Tchao, R., Leighton, J. Histotypic angiogenesis in vitro: light microscopic, ultrastructural, and radioautographic studies. In Vitro. 18, 538-549 (1982).
- Wong, K. H., Chan, J. M., Kamm, R. D., Tien, J. Microfluidic models of vascular functions. Annu Rev Biomed Eng. 14, 205-230 (2012).
- Sandison, J. C. A new method for the microscopic study of living growing tissues by the introduction of a transparent chamber in the rabbit's ear. Anat. Rec. 28, 281-287 (1924).
- Jain, R. K., Schlenger, K., Hockel, M., Yuan, F. Quantitative angiogenesis assays: progress and problems. Nat. Med. 3, 1203-1208 (1997).
- Rogers, M. S., Birsner, A. E., D'Amato, R. J. The mouse cornea micropocket angiogenesis assay. Nat. Protoc. 2 (10), 2545-2550 (2007).
- Gimbrone, M. A., Leapman, S. B., Cotran, R. S., Folkman, J. Tumor dormancy in vivo by prevention of neovascularization. J. Exp. Med. 136, 261-276 (1972).
- Gimbrone, M. A., Cotran, R. S., Leapman, S. B., Folkman, J. Tumor growth and neovascularization: an experimental model using the rabbit cornea. J. Natl. Cancer Inst. 52, 413-427 (1974).
- Rohan, R. M., Fernandez, A., Udagawa, T., Yuan, J., D'Amato, R. J. Genetic heterogeneity of angiogenesis in mice. FASEB J. 14 (7), 871-876 (2000).
- Chang, L. K., et al. Dose-dependent response of FGF-2 for lymphangiogenesis. Proc Natl Acad Sci U S A. 101 (32), 11658-11663 (2004).
- Udagawa, T., Birsner, A. E., Wood, M., D'Amato, R. J. Chronic suppression of angiogenesis following radiation exposure is independent of hematopoietic reconstitution. Cancer Res. 67 (5), 2040-2045 (2007).
- Turner, P. V., Albassam, M. A. Susceptibility of rats to corneal lesions after injectable anesthesia. Med Comp. 55 (2), 175-182 (2005).
- Calderone, L., Grimes, P., Shalev, M. Acute reversible cataract induced by xylazine and by ketamine-xylazine anesthesia in rats and mice. Exp. Eye Res. 42, 331-337 (1986).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır